乌司他丁对肠道上皮细胞屏障损伤的保护作用分析
李永胜,马晓峰
(1.甘肃省人民医院 急诊科,甘肃 兰州 730000; 2.国营长风机器厂职工医院 内科,甘肃 兰州 730000)
·论著·
乌司他丁对肠道上皮细胞屏障损伤的保护作用分析
李永胜1,马晓峰2
(1.甘肃省人民医院 急诊科,甘肃 兰州 730000; 2.国营长风机器厂职工医院 内科,甘肃 兰州 730000)
目的探讨乌司他丁(UTI)对肠道上皮细胞屏障损伤的保护作用及其机制。方法培养Caco-2细胞,并建立肿瘤坏死因子α(TNF-α)诱导的单层上皮细胞模型,随机分为空白对照组、TNF-α模型组、UTI低剂量组(5万U/kg)、UTI中剂量组(10万U/kg)、UTI高剂量组(20万U/kg)。采用Millicell电阻仪和多功能读板仪分别测定各组上皮细胞电阻(TER)和异硫氰酸荧光素标记的葡聚糖(FITC-dextran),酶联免疫吸附测定法(ELISA)测定白细胞介素6(IL-6)、IL-10水平,流式细胞仪测定细胞凋亡率,免疫蛋白质印记(Western blot)技术测定紧密连接蛋白闭合蛋白(occludin)和紧密黏连蛋白1(ZO-1)表达水平。结果与空白对照组相比,TNF-α模型组TER、FITC-dextran、occludin和ZO-1表达水平均明显下降,IL-6、IL-10、细胞凋亡率明显升高(P<0.05);与TNF-α模型组比较,经UTI处理后,TER、FITC-dextran、occludin和ZO-1表达水平升高,IL-6、IL-10、细胞凋亡率降低(P<0.05),其中以UTI高剂量组变化最显著(P<0.05)。结论UTI可能通过抑制炎性介质释放,调节紧密连接相关蛋白表达,抑制TNF-α诱导的肠道上皮细胞屏障功能损伤。
肠;细胞屏障;肿瘤坏死因子α;乌司他丁;紧密连接蛋白
肠道上皮细胞屏障是维持肠道屏障功能的关键[1],肿瘤坏死因子α(TNF-α)是重要的致炎因子,可损害肠上皮细胞及其细胞间紧密结构,影响肠道屏障功能。乌司他丁(UTI)是一种广谱酶抑制剂,可抑制中性粒细胞、内皮细胞等释放的丝氨酸蛋白酶,具有抑制炎症、清除氧自由基等作用[2]。最近研究表明,UTI抗炎效果确切,对小鼠肠道黏膜损伤有保护作用[3-4],但具体作用机制尚不明确。本研究通过建立TNF-α诱导的单层肠上皮细胞(IECs)屏障模型,从细胞功能、分子水平方面综合评价UTI对模型细胞的保护作用,并探讨作用机制,为UTI治疗肠黏膜屏障损伤提供依据,现报告如下。
1 材料和方法
1.1试剂与设备 UTI由广东天普生化医药股份有限公司提供;DMEM高糖培养基由美国GIBCO BRl公司提供;人肠上皮细胞注射株Caco-2细胞由美国ATCC公司提供;磷酸缓冲盐溶液(PBS)由北京中杉金桥生物技术有限公司提供;兔抗occludin抗体由美国Abcam公司提供;兔抗ZO-1抗体由美国Santa Cruz公司提供;TNF-α、IL-6 ElISA检测试剂由上海森雄生物技术公司提供;Millicell电阻仪由Millipore公司提供;二氧化碳细胞培养箱由美国NAPCO公司提供BD FACSCanto Ⅱ流式细胞仪由美国Becton Dickinson公司提供。
1.2方法
1.2.1细胞培养及单层上皮细胞模型的建立 用DMEM培养基培养人肠上皮细胞注射株Caco-2细胞,37 ℃、5% CO2条件下培养,隔日换液,检测跨上皮细胞电阻(TER)。体外上皮屏障形成判断标准:培养21~28天后TER明显升高,且数值稳定。
1.2.2Millicell电阻仪和多功能读板仪分别测定TER和异硫氰酸荧光素标记的葡聚糖(FITC-dextran) 将传代至23~31代的Caco-2细胞用于实验,实验开始后换用实验室培养液,由不含谷氨酰胺(Gln)和胎牛血清(FBS)的DMEM、10 nmol/L 4-羟乙基哌乙磺酸(HEPES)、10 g/L丙酮酸钠构成。Caco-2细胞单层以5×105/个接种于96孔板,分别在顶室与底室中加入实验室培养液100 μl和600 μl,隔天换液。显微镜下观察细胞生长情况及紧密连接的完整性。测量不同时间点TER值。细胞在实验前加入无血清培养基饥饿12小时,设置空白对照组(无TNF-α、UTI)和TNF-α处理组,TNF-α处理组分别不加入UTI或加入UTI低(5万U/kg)、中(10万U/kg)、高剂量组(20万U/kg),每组3个复孔,孵育过夜后,空白对照组更换细胞培养液,UTI低、中、高剂量组分别给予5万U/kg、10万U/kg,20万U/kg UTI继续培养24小时。用Millicell电阻仪的两电极置入小室顶侧和基底侧测定TER值。各Caco-2细胞处理48小时,采用FITC-葡聚糖((FITC-dextran))荧光示踪法检测肠上皮细胞通透性。预热D-hank液至37 ℃,清洗Transwell顶室、底室1次,分别添加FITC-葡聚糖(1 mg/ml)100 μl、D-hank液500 μl,置于96孔板内,37 ℃、5%CO2条件下孵育2小时。取底室液体,采用多功能读板仪(芬兰Thermo公司)检测样品荧光长度,激光波长480 nm,发生光波长520 nm,重复测量5次取平均值。
1.2.3ELISA测定IL-6、TNF-α水平 将Caco-2细胞单层以5×105/L接种于24孔板,分组及干预方法同1.2.2,培养24小时后收集上清液,采用ElISA法测定各组IL-6、IL-10水平。
1.2.4流式细胞仪测定细胞凋亡率 将Caco-2细胞单层以每孔3×105/L各细胞接种于6孔板,培养过夜,分组及干预方法同1.2.2。干预24小时后吸除培养液,用PBS清洗细胞3次,制成单细胞悬液,并用PBS重悬,密度为1.0×106个/ml,加入FITC Annexin V和PI各5 μl,室温下孵育15分钟后,加入PBS 400 μl,采用流式细胞仪测定细胞凋亡率。
1.2.5采用免疫蛋白质印记(western blot)技术测定紧密连接蛋白occludin、zo-1表达水平 将Caco-2细胞单层以1.0×105/L接种于24孔板,提取总蛋白,SDS-PAGE电泳,根据抗体实验说明书推荐浓度用一抗稀释液稀释对应抗体,其中兔抗occlidin抗体为1∶800,兔抗ZO-1抗体为1∶200,将封闭好的PVDF膜放入稀释一抗中,孵育过夜,TBST温床上洗膜3次。按照1∶3 000的比例用脱脂奶粉稀释二抗,与PVDF膜孵育,孵育1小时,TBST温床上洗膜3次。按照发光液试剂盒说明书吸取1 ml试剂A和试剂B,混合后滴到PVDF膜上,吸去周边多余发光剂,测量吸光度值,重复测量3次取平均值。
1.3统计学方法 采用SPSS 19.0统计学软件处理数据,计量资料采用均数±标准差(x-±s)表示,多组间比较进行方差齐性检验,如方差齐,采用单因素方差分析,如方差不齐采用Welah校正。组间多重比较在方差齐时选用Dunnett法检验,方差不齐时选用Dunnet T3检验。P<0.05为差异有统计学意义。
2 结 果
2.1TER、FITC-dextran比较 与空白对照组比较,TNF-α模型组、UTI低剂量组、UTI中剂量组、UTI高剂量组TER、FITC-dextran均明显下降(P<0.05);与TNF-α模型组比较,UTI治疗后TER、FITC-dextra明显升高(P<0.05),UTI低剂量组、UTI中剂量组、UTI高剂量组组间比较差异有统计学意义(P<0.05),见表1。

表1 TER、FITC-dextran比较(n=3)
注:与空白对照组比较,*P<0.05;与TNF-α模型组比较,#P<0.05;与UTI低剂量组比较,△P<0.05;与UTI中剂量组比较,▲P<0.05
2.2Caco-2细胞单层炎性水平比较 与空白对照组比较,TNF-α模型组、UTI低剂量组、UTI中剂量组、UTI高剂量组IL-6、IL-10均明显升高(P<0.05);与TNF-α模型组比较,UTI治疗后IL-6、IL-10明显降低(P<0.05),UTI低剂量组、UTI中剂量组、UTI高剂量组组间比较差异有统计学意义(P<0.05),见表2。

表2 Caco-2细胞单层炎性水平比较(n=3)
注:与空白对照组比较,*P<0.05;与TNF-α模型组比较,#P<0.05;与UTI低剂量组比较,△P<0.05;与UTI中剂量组比较,▲P<0.05
2.3Caco-2细胞单层凋亡率及紧密连接蛋白Occludin、ZO-1表达比较 与空白对照组比较,TNF-α模型组、UTI低剂量组、UTI中剂量组、UTI高剂量组细胞凋亡率明显升高(P<0.05),Occludin、ZO-1表达水平明显下降(P<0.05);与TNF-α模型组比较,UTI治疗后细胞凋亡率明显降低(P<0.05),Occludin、ZO-1表达水平明显增加(P<0.05);UTI低剂量组、UTI中剂量组、UTI高剂量组组间比较差异有统计学意义(P<0.05),见表3,见图1,2。
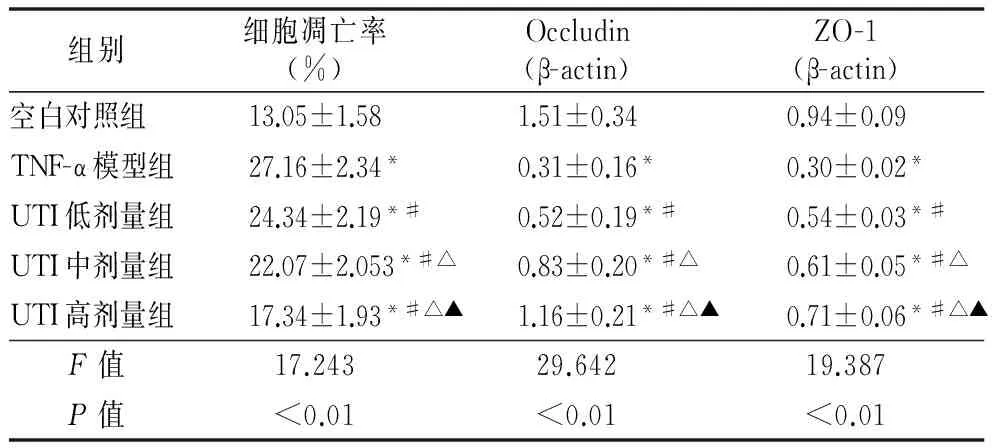
表3 Caco-2细胞单层凋亡率及紧密连接蛋白Occludin、ZO-1表达的比较(n=3)
注:与空白对照组比较,*P<0.05;与TNF-α模型组比较,#P<0.05;与UTI低剂量组比较,△P<0.05;与UTI中剂量组比较,▲P<0.05
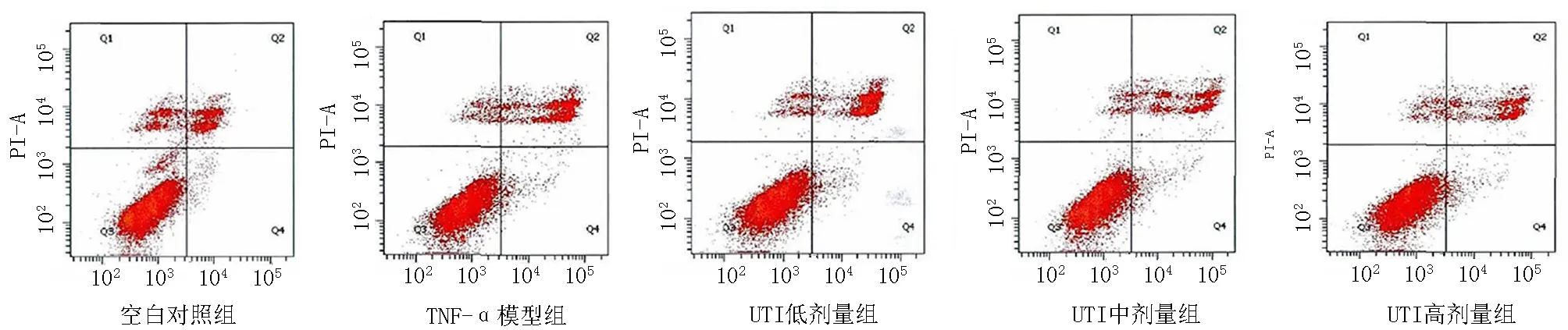
图1Caco-2细胞单层凋亡率分析
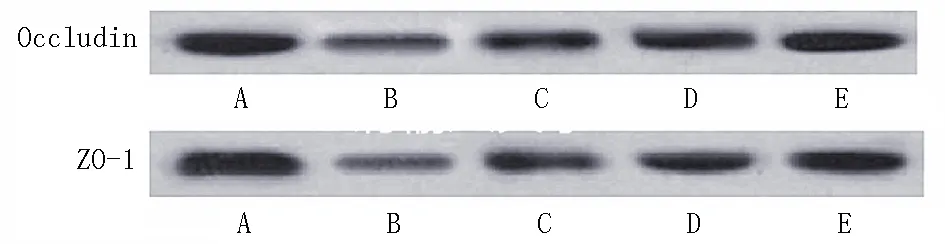
图2紧密连接蛋白Occludin、ZO-1表达A、B、C、D、E分别为空白对照组、TNF-α模型组、UTI低剂量组、UTI中剂量组、UTI高剂量组
3 讨 论
完整的肠道上皮细胞屏障是维持肠道屏障功能重要的一环,可阻止肠内大分子毒素、细菌等穿过肠壁,预防全身炎症反应(SIRS)、多器官功能障碍综合征(MODS)等发生。肠黏膜上皮细胞紧密连接完整与否直接影响肠道上皮屏障功能,一旦上皮紧密连接缺失或变异,细胞间隙通透性明显增加,肠道屏障功能被破坏[5]。紧密连接主要位于上皮细胞顶端,包括Occludin、ZO-1、claudin-2蛋白等,其中Occludin是一种扩膜蛋白,通过Occludin蛋白封闭细胞间隙,与ZO-1蛋白共同形成紧密连接的基础结构,可调控物质的细胞转运途径,是目前研究最多的紧密连接功能蛋白;ZO-1是ZO异构体最为主要的部分,可将缝隙连接(GJ)、黏附连接(AJ)连接在一起,在维持肠黏膜上皮细胞紧密连接完整性中起重要作用[5]。临床研究发现,炎性介质、肠道内细菌、细胞因子等均会导致Occludin、ZO-1等紧密连接蛋白表达异常,增加肠黏膜通透性,影响肠道屏障功能[7]。故本研究选取Occludin、ZO-1作为观察指标。
TNF-α是重要的致炎性因子之一,可通过激活肌球蛋白轻链激酶(MlCK)所接介导的肌球蛋白轻链激酶化,导致紧密连接蛋白重组,破坏肠道屏障功能,一般阻断TNF-α后,肠道屏障功能会有所恢复[8-9]。多数研究指出,TNF-α会增加肠黏膜通透性[10-11]。本实验中,我们在Transwell的上下室均加入TNF-α,以保证Caco-2单层细胞顶部和基底部均可接触到TNF-α,结果显示TER、FITC-dextra均下降,说明TNF-α会破坏Caco-2细胞单层屏障功能,增加细胞通透性增加,与Coskun等[12]研究结果一致。另外,本实验中,TNF-α模型组Occludin、ZO-1蛋白较空白对照组明显降低,提示Occludin、ZO-1蛋白表达异常,可能影响肠黏膜上皮细胞紧密连接完整性。刘行等[13]研究指出,紧密连接蛋白重新分布是TNF-α损害肠道上皮细胞功能的重要机制之一,本研究结果与其一致。
UTI主要来源于人尿的相对分子质量为67 000的糖蛋白,对丝氨酸蛋白酶、透明质酸梅、纤溶酶等多种酶有抑制作用,还可抑制白细胞释放TNF-α、IL-6等炎性介质,降低细胞毒性作用,减轻肠黏膜充血,降低肠道通透性,预防肠道细菌、内毒素移位[14-15]。Shikimi等[16]研究发现,UTI可抑制炎性介质(如TNF-α、IL-6等)释放,减轻其对器官功能的损害。周玉坤等[17]研究发现,UTI对急性重症胆囊炎所致肠黏膜损伤有保护作用,能改善紧密连接相关蛋白表达异常情况。常瑞明等[18]研究指出,UTI可通过降低炎性介质释放、降低肠黏膜Caspase-3等保护心肺复苏后大鼠受损肠黏膜。因此,我们考虑UTI可改善TNF-α诱导的Caco-2细胞屏障功能障碍。为证实这一猜想,本实验组中,加入不同剂量的UTI,结果表明加入UTI后可改善TNF-α引起的TER、FITC-dextran下降,且治疗后IL-6、IL-10明显降低,Occludin、ZO-1表达水平上调,呈现出剂量依赖性,说明UTI可上调紧密连接蛋白表达,降低肠黏膜通透性。
综上所述,TNF-α与肠道上皮细胞屏障损伤密切相关,UTI对TNF-α诱导的肠道上皮细胞屏障损伤有保护作用,其机制可能为抑制IL-6、IL-10炎性介质释放、上调紧密连接蛋白;另外,UTI对肠道上皮细胞屏障损伤的保护作用呈具有剂量依赖性。
[1] 王惠凌, 姜源涛, 张红, 等. 重症脑卒中患者肠粘膜屏障功能的变化[J]. 临床荟萃, 2015, 30(5): 529-532.
[2] 张涛, 李孝建, 邓忠远, 等. 乌司他丁对烧伤患者凝血功能及全身炎症反应的影响[J]. 西部医学, 2016, 28(2): 201-203.
[3] 叶小玲, 陶珮, 陈月娥, 等. 乌司他丁对脓毒症大鼠小肠粘膜屏障功能的保护作用[J]. 中华临床感染病杂志, 2015, 8(6): 549-553.
[4] Shu X, Zhang J, Wang Q, et al. Glutamine decreases intestinal mucosal injury in a rat model of intestinal ischemia-reperfusion by downregulating HMGB1 and inflammatory cytokine expression[J]. Exp Ther Med, 2016, 12(3):1367-1372.
[5] Rodríguez-Feo JA, Puerto M, Fernndez-Mena C, et al. A new role for reticulon-4B/NOGO-B in the intestinal epithelial barrier function and inflammatory bowel disease[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308(12): G981-993.
[6] Tian S, Guo R, Wei S, et al. Curcumin protects against the intestinal ischemia-reperfusion injury: involvement of the tight junction protein ZO-1 and TNF-α related mechanism[J]. Korean J Physiol, 2016, 20(2):147-152.
[7] Ma J, Wang P, Liu Y, et al. Krüppel-like factor 4 regulates blood-tumor barrier permeability via ZO-1, occludin and claudin-5[J]. J Cell Physiol, 2014, 229(7): 916-926.
[8] Watson AJ, Hughes KR. TNF-α-induced intestinal epithelial cell shedding: implications for intestinal barrier function[J]. Ann Y Acad Sci, 2012, 1258(1): 1-8.
[9] Du X, Meng Q, Sharif A, et al. Surfactant proteins SP-A and SP-D ameliorate pneumonia severity and intestinal injury in a murine model of staphylococcus aureus pneumonia[J]. Shock, 2016, 46(2):164-172.
[10] Moran GW, O'Neill C, Mclaughlin JT. GlP-2 enhances barrier formation and attenuates TNFα-induced changes in a Caco-2 cell model of the intestinal barrier[J]. Regul Pep, 2012, 178(1-3): 95-101.
[11] 马远航, 杨松巍, 孙礼刚, 等. SIRT1在TNF-α介导的肠上皮屏障破坏中的作用及机制研究[J]. 重庆医学, 2014, 43(16): 1969-1971.
[12] Coskun M. Involvement of CDX2 in the cross talk between TNF-α and Wnt signaling pathway in the colon cancer cell line Caco-2[J]. Carcinogenesis, 2014, 35(5): 1185-1192.
[13] 刘行, 王凤君. 紧密连接蛋白与烧伤后肠道屏障功能障碍研究进展[J]. 中华烧伤杂志, 2010, 26(5): 351-353.
[14] Feng M, Shu Y, Yang Y, et al. Ulinastatin attenuates experimental autoimmune encephalomyelitis by enhancing anti-inflammatory responses[J]. Neurochem Int, 2014, 64(1): 64-72.
[15] Deng W, Abliz A, Xu S, et al. Severity of pancreatitis-associated intestinal mucosal barrier injury is reduced following treatment with the NADPH oxidase inhibitor apocynin[J]. Mol Med Rep, 2016, 14(4):3525-3534.
[16] Shikimi T, Kaku K, Uegaki J, et al. Serum contents of the free forms of alpha(1)-microglobulin and ulinastatin: relation to diseased states in patients with mood disorders[J]. Neuropsychobiology, 2001, 43(3): 145-149.
[17] 周玉坤, 李刚强. 乌司他丁对急性重症胆管炎所致肝屏障损伤的作用和影响[J]. 肝胆胰外科杂志, 2015, 27(3): 209-213.
[18] 常瑞明, 常建星, 江志鹏, 等. 乌司他丁对心肺复苏后大鼠肠屏障的保护作用[J]. 中华急诊医学杂志, 2015, 24(11): 1234-1238.
Protectiveeffectofulinastatinonintestinalepithelialcellbarrier
Li Yongsheng1, Ma Xiaofeng2
1.DepartmentofEmergency,GansuProvincialHospital,Lanzhou730000,China; 2.DepartmentofMedicine,GansuNationalChangfengMachineryFactoryHospital,Lanzhou730070,China
LiYongsheng,Email:zf26892@126.com
ObjectiveTo investigate the protective effect and mechanism of ulinastatin (UTI) on intestinal epithelial cell barrier.MethodsCaco-2 cells were cultured, epithelial cells monolayer models induced by tumor necrosis factor-α(TNF-α ) were established and were randomly divided into blank control group, TNF-α model group, low-dose UTI group (50 000 U/kg), middle-dose UTI group (100 000 U/kg) and high-dose UTI group (200 000 U/kg). The transepithelial electrical resistance (TER) and fluoresce in isothiocyanate marked dextran FITC-dextran in all groups were determined by Millicell electrical resistance meter and multifunctional plate reader. Interleukin 6 (IL-6) and IL-10 were determined by enzyme-linked immunosorbent assay (ElISA). The apoptosis rate was measured by flow cytometry, and the expression of tight junction protein occludin and ZO-1 were measured by Western blot.ResultsThe expression of TER, FITC-dextran, occludin and ZO-1 were significantly lower in TNF-α model group than those in blank control group, while IL-6, IL-10 and apoptosis rate were significantly higher (P<0.05). After UTI treatment, TER, FITC-dextran, occludin and ZO-1 were significantly higher than those in TNF-α model group, while IL-6, IL-10 and apoptosis rate were significantly lower (P<0.05). UTI change in high-dose group was the most significant (P<0.05).ConclusionUTI may protect the intestinal epithelial cell barrier injury induced by TNF-α through inhibiting the release of inflammatory mediators and regulating the expression of tight junction associated proteins.
intestines; cell mucosal barrier; tumor necrosis factor-alpha; ulinastatin; tight junction protein
李永胜,Email: zf26892@126.com
R322.45
A
1004-583X(2017)11-0953-04
10.3969/j.issn.1004-583X.2017.11.009
2017-05-31 编辑:张卫国

