黄檗雌雄植株增殖培养性别差异研究
张玲,张东来,邓晓华
(1.黑龙江省林业科学研究所,哈尔滨 150081;2.黑龙江省林业科学院,哈尔滨 150081)
黄檗雌雄植株增殖培养性别差异研究
张玲1,张东来2*,邓晓华2
(1.黑龙江省林业科学研究所,哈尔滨 150081;2.黑龙江省林业科学院,哈尔滨 150081)
为解决黄檗无性系繁殖障碍,保护黄檗种质资源及解决苗木短缺问题,选择黄檗雌雄植株水培植株和新萌生枝条茎段为外植体,探讨不同灭菌方法、不同采样时间、不同性别对黄檗增殖培养的影响。结果表明:黄檗增殖培养最佳培养基为MS+1.0 mg/L6-BA+0.2 mg/LNAA+1.0 mg/LGA3,该培养基诱导率达80%以上。黄檗外植体增殖培养灭菌采用0.1% HgCl2灭菌8 min能达到较好效果,不伤害苗木生长。黄檗最佳采样时间为5月份;黄檗雌雄植株增殖培养性别间差异显著,腋芽培养雌株平均增殖率约为雄株2~3倍。黄檗无性系繁殖技术不建全,组织培养是解决黄檗种质资源短缺的最好方法,黄檗雌雄植株新萌生枝条扩繁技术已经获得成功,需要进一步研究黄檗试管苗生根问题。
黄檗;雌雄植株;增殖培养;差异
0 引言
黄檗(PhellodendronamurenseRupr.),又名黄菠萝,雌雄异株植物,为我国特有种,是东北三大珍贵硬阔叶用材树种之一,同时也是我国名贵中药关黄柏的药源植物。以树皮入药,含小檗碱、药根碱、黄檗酮、黄檗内脂及少量防己碱等成分,有清热泻火、健脾止泻、燥湿解毒和抑菌等功效[1]。由于其具有木材和药用双重经济价值而被大量砍伐,导致黄檗资源锐减,已被列为国家一级珍贵树种、国家二级保护易危物种。黄檗的化感作用影响其对自身及其他种群自然更新,主要靠种子和根蘖繁殖,繁殖速度慢,难以满足市场需求。黄檗自然更新差,成熟种子不容易脱落,种子萌发受限,不能完成种子后熟和春化。黄檗扦插繁殖技术不成熟,目前没有找到合适的扦插方法。组织培养技术可在短期内获得大量整齐优质的苗木,是解决种苗短缺的有效途径之一。组织培养技术不受季节限制,繁殖力高等,能够很好地解决这个问题。国内对黄檗的研究多集中在其价值利用、化学成分分析、提取、环境胁迫与次生代谢以及药效学等方面,也有部分工作涉及到人工栽培繁殖、组织培养、种群生态、病虫害等方面[2-8],有关黄檗雌雄植株组织培养在性别上的差异研究未见报道。雌雄异株的物种不同性别间在生理生化、生长、形态、生殖、分布以及基因表达等方面出现明显的差异[9]。不同性别的植物具有不同的经济价值,研究黄檗雌雄植株组织培养性别差异,可以为黄檗无性系繁殖技术从机理角度深入研究提供数据支持。
1 材料与方法
1.1 试验材料
样品采集于哈尔滨松乐公园,黄檗均为人工混交林。乐松公园位于黑龙江省哈尔滨市香坊区,黄檗平均树龄为45 a,郁闭度为0.6左右,林内有白桦、水曲柳和榆树等乔木,忍冬、紫丁香等灌木[9]。在12月末采集的枝条雪藏3月份水培(1)、3月份直接水培(2)、5月份剪取黄檗茎段(3),用流水冲洗1h,再用饱和中性洗涤液清洗枝条,流水冲洗彻底,滤纸吸干表面水分,放到灭好菌的超净工作台上,消毒灭菌,最后用无菌水漂洗3~5次后用无菌滤纸吸干表面水分,接种在已灭过菌的培养基上。
培养基选择:(1)MS+1.0 mg/L6-BA+0.2 mg/LNAA+1.0 mg/LGA3。(2)MS+1.0 mg/L6-BA单位下同+0.05 mg/LNAA+3%蔗糖;(3)MS+0.25 mg/L6-BA+1.5 mg/LNAA+3%蔗糖。
(4)MS+1.0 mg/L6-BA+0.1 mg/LNAA+0.25 mg/LGA3+2.5%蔗糖。所有培养基均附加6 g琼脂,pH为5.8~6.0。每个处理接种30瓶,进行3个批次实验。培养条件:培养温度为(25±2)℃,光照时间12 h/d,光强为30~40 Lx。
1.2 外植体消毒灭菌
(1)0.1% HgCl2溶液浸泡8 min,无菌水冲洗3~5次。
(2)3% NaClO溶液浸泡10 min,无菌水冲洗3~5次。
(3)75%酒精浸泡10 s,无菌水冲洗3~5次。
1.3 数据计算
外植体增殖系数=继代后的外植体总数/继代前外植体总数。
诱导率=分化的外植体总数/接种外植体总数。
存活率=存活的接种数/接种外植体总数。
利用SPSS 19.0软件中的One-sample T test检验各处理之间存在差异,表中数据为平均值±标准差。
2 结果与分析
2.1 不同灭菌方法对外植体的影响
外植体选择5月份萌发嫩枝,接种后的第三天观察试验外植体的灭菌状况,发现75%酒精灭菌出现褐化,并有烧死嫩叶。3% NaClO溶液灭菌不彻底的腋芽开始出现染菌现象。经0.1%氯化汞灭菌8 min的试材污染率较小,并没有出现褐化现象,经过30d观察,组培苗可以正常生长,这说明0.1%氯化汞溶液灭菌8 min适合黄檗外植体灭菌,即可以达到杀菌的目的,又对黄檗外植体无损伤,见表1。
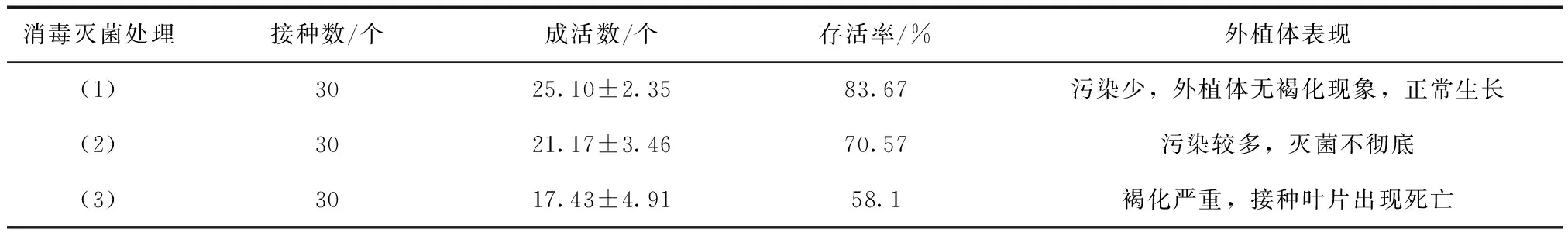
表1 不同灭菌处理对黄檗外植体影响Tab.1 The effects of different sterilization methods on Phellodendron amurense
2.2 不同培养基对黄檗茎段增殖的影响
将外植体切成1 cm左右的顶芽带一对腋芽的茎段转入4种培养基中。因试验采用激素及浓度的差异,外植体出现明显不同生长状况。研究发现6-BA与NAA组合比较适应黄檗组织培养,与前人研究结果一致,但是生长较慢,本研究通过改良培养基中的激素添加适量GA3达到即扩繁又生长的目的。通过观察(1)号培养基接种3 d,叶柄开始脱落,外植体挺直,但未见明显的生长。黄檗生长较慢,接种7 d,外殖体开始变绿,植株开始萌动,10 d开始正常生长,但腋芽未开始增殖,15~17 d,腋芽开始膨胀,20~25 d腋芽分化,诱导率和平均增殖系数见表2。(2)号培养生长缓慢,出现黄化现象,叶片脱落严重;(3)号培养基培养7d茎段与培养基接触处开始膨大,出现愈伤组织,生长较慢;(4)号培养基培养10d左右开始变黄,叶片脱落,无生长迹象。
2.3 不同采样时间对黄檗腋芽增殖的影响
以室外采种接种黄檗茎段进行扩繁增殖培养,筛选出(1)号培养基为最佳增殖培养基。以(1)号培养基筛选黄檗雌雄植株性别间的差异,见表3。(1)水培污染率较小,分化率可以达到80%左右,但生长较慢,其中雌株诱导率为82%,雄株诱导为80%。(2)水培材料结果与(1)号水培材料无显著差异。(3)5月采集嫩枝,诱导率较高,雌株诱导率大于雄株,方差分析结果表现,黄檗植株增殖培养性别间差异存在显著差异(P<0.05),如图1和图2所示。

表2 培养基对黄檗茎段增殖的影响Tab.2 The effects of rapid propagation on different culture medium

表3 黄檗雌雄植株增殖培养性别差异Tab.3 The gender difference on rapid propagation of Phellodendron amurense

图2 黄檗腋芽增殖培养第30天Fig.2 The rapid propagation 30 days of Phelldendron amurense
雌株茎尖的分化频率明显地高于雄株,约为雌株的2~3倍,再生植株的长势也好,污染率低。另外,黄檗组织培养采样时间差异较大,1月份枝条雪藏后水培枝分化率高,但生长慢,5月份萌生枝条分化率高,生长快。因此在选用接种材料时,应充分考虑黄檗个体性别以及采样时间,对再生植株可用腋生分枝迅速增殖。增殖系数过大则会出现丛生芽细弱、矮小、叶柄较长、不易生根或生根后移栽时不易成活等问题。同时还发现,树木个体之间的差异对再生植株诱导率影响很大,有时甚至超过龄级的影响。
3 讨论
(1)黄檗灭菌最好不要选择酒精,容易褐化,并导致死亡。外植体的褐化与外植体自身的生物学特性密切相关,特别是药用植物培养中普遍出现的现象,研究认为是植物体内多酚在多酚氧化酶的作用下转变为醌类物质所致[10-11],主要与植物外植体基因型、生物学特性、生理状态、培养基、植物生长调节剂等条件,以及继代时间过长,转接过程中操作不当等等原因有关,黄檗增殖过程中褐化较严重,经过多次实验探索,将培养基中添加活性炭可以有效地解决了继代褐化现象。本研究考虑到材料比较幼嫩,对高浓度次氯酸钠敏感度较差,3%次氯酸钠溶液并适应减少消毒时间以减少对外植体的伤害,结果表明对外植体伤害较小,但消毒不够彻底,而张玉红研究认为用10%次氯酸钠溶液消毒8 min杀菌效果最理想[3],本研究采用此方法发现,有些细菌杀不完全。
(2)6-BA比例高时有利于芽的分化,NAA是植物组织培养常用的激素,不同激素的浓度及组合效果不一样[12-13]。低浓度的6-BA与NAA混合时,适当NAA浓度可以促进生长,形成愈伤组织,6-BA比例高时有利于芽的分化,比例低时有利于根的分化,因此,本研究6-BA选择1.5 mg/L和NAA0.2 mg/L组合,另外添加GA3,促进细胞分裂并调控其分化。黄檗愈伤组织对不同激素组合的反应,说明不同种类激素的效应差异对植物物种或性别差异反应的特异性,进一步说明了激素作用的复杂性[14-15]。
(3)本研究表明黄檗雌雄植株外植体增殖过程中性别差异显著,产生差异的原因与雌雄植株的生理、生殖以及抗逆性等方面出现的差异有关。雌雄个体在适应自然界的过程中可能采取不同的生态对策,使其在生长、生殖、空间分布和资源配置方面表现出明显的差异[16-18]。
[1] 聂绍荃,袁晓颖,杨逢建,等.黑龙江植物资源志[M].哈尔滨:东北林业大学出版社,2003:441-444.
[2] 李霞,王洋,阎秀峰.水分胁迫对黄檗幼苗三种生物碱含量的影响[J].生态学报,2007,27(1):58-64.
[3] 张玉红,曲伟娣.培养条件对黄檗快速繁殖影响的研究[J].植物研究,2008,28(2):236-240.
[4] 李静贤.中国野生黄檗资源研究和保护现状[J].安徽农业科学,2013,41(7):2896-2897.
[5] 郭勇,石大兴,孙雁霞,等.黄檗的组织培养和快速繁殖[J].植物生理学通讯,2005,41(6):792.
[6] 亓磊,詹亚光.黄波罗的愈伤组织培养[J].东北林业大学学报,2007,35(9):14-16.
[7] Azad M A K,Yokota S,Ohkubo T,et al.In vitro,regeneration of the medicinal woody plant Phellodendron amurense,Rupr.through excised leaves[J].Plant Cell,Tissue and Organ Culture,2005,80(1):43-50.
[8] 曲伟娣,张玉红.不同因子对黄檗愈伤组织诱导的影响[J].经济林研究,2010,28(2):49-54.
[9] 何冬明,严善春,鲁艺芳.黄檗叶片内保护酶活性的时序变化[J].东北林业大学学报,2011,39(9):37-39.
[10] 戴莹,杨世海,赵鸿峥,等.药用植物组织培养中褐化现象的研究进展[J].中草药,2016,47(2):344-351.
[11] Davey M.Secondary metabolism in plant cell cultures[J].Encyclopedia of Applied Plant Sciences,2017:462-467.
[12] Donenbrug H,Knorr D.Strategies for the improvement of secondary metabolite production in plant cell cultures[J].Enzyme & Microbial Technology,1995,17(8):674-684.
[13] 何志祥,曾艳玲,谭晓风.翠冠梨茎段组织培养的研究[J].中南林学院学报,2006,26(1):66-68.
[14] Zegzouti H,Jones B,Marty C,et al.ER5,a tomato cDNA encoding an ethylene-responsive LEA-like protein:characterization and expression in response to drought,ABA and wounding[J].Plant Molecular Biology,1997,35(6):847-854.
[15] Ritchie S W,Hodges T K.Cell culture and regeneration of transgenic plants[J].Academic Press Inc,1993,(3):147-148.
[16] Hughes F M R,Johansson M,Xiong S J,et al.The influence of hydrological regimes on sex ratios and spatial segregation of the sexes in two dioeciou riparian shrub species in northern Sweden[J].Plant Ecology,2010,208(1)77-92.
[17] 范建平,杜军华,徐隆华,等.沙棘属植物单性异株雌雄鉴定及方法的研究[J].青海师范大学学报(自然科学版),2012,43(1):81-85.
[18] 靳振宇,常效须.杜仲雌雄株的早期鉴别[J].中国林业,1997,16(8):41.
StudyontheDifferenceoftheRapidPropagationofPhellodendronamurenseRupr.inDioecious
Zhang Ling1,Zhang Donglai2*,Deng Xiaohua2
(1.Forestry Research Institute of Heilongjiang Province,Harbin 150081;2.Heilongjiang Academy of Forestry,Harbin 150081)
In order to solve thePhellodendronamurensereproduction barrier and to protect germplasm resources and solve the problem of shortage of nursery stock,we chosePhellodendronamurensenew initiation branch stem segments as explants to discuss the different sterilization methods,sampling time,the influence of gender on cultivatingPhellodendronamurensepropagation.The results showed that the best medium for the cultivation ofPhellodendronamurensewas MS+1.0mg/L6-BA+0.2mg/L NAA+1.0mg/L GA3and the induction rate was more than 80%.Sterilized the explants ofPhellodendronamurensein 0.1% HgCl2for 8 min could reach a good effect and no harm to seedling growth.The best sampling time is May.The propagation culture of the male and female plants was remarkable,and the average breeding rate of the female was about two to three times than the male.Phellodendronamurensereproduction technology was incomplete,and the tissue culture technology is the best way to solve the shortage of germplasm resources.Phellodendronamurenseplant propagation technology has been successful with new initiation branches,and needs further study on thePhellodendronamurensetube seedlings rooting problems.
Phellodendronamurense;male and female plant;rapid propagation;difference
S 718
A
1001-005X(2017)06-0011-04
2017-06-09
国家自然科学基金资助项目(31600485);黑龙江省省属科研院所基本科研业务费专项(2016-06)
张玲,博士研究生,副研究员。研究方向:经济林。E-mail:slyszl@126.com
*通信作者:张东来,硕士,副研究员。研究方向:森林培育。E-mail:slkyzdl@163.com
张玲,张东来,邓晓华.黄檗雌雄植株增殖培养性别差异研究[J].森林工程,2017,33(6):11-14.

