核黄素缺乏对1~28日龄北京鸭生长性能、器官指数和血浆生化指标的影响
唐 静 胡 健 江 勇 谢 明 侯水生
(中国农业科学院北京畜牧兽医研究所,北京 100193)
核黄素缺乏对1~28日龄北京鸭生长性能、器官指数和血浆生化指标的影响
唐 静 胡 健 江 勇 谢 明 侯水生*
(中国农业科学院北京畜牧兽医研究所,北京 100193)
本试验旨在研究核黄素缺乏对1~28日龄北京鸭生长性能、屠宰性能、器官指数、组织核黄素含量及血浆生化指标的影响。采用单因子完全随机试验设计,选取360只1日龄健康的雄性北京鸭,随机分为3个组,即核黄素缺乏组、采食配对组(人为控制该组采食量与核黄素缺乏组一致)和自由采食对照组,每组12个重复,每个重复10只鸭。核黄素缺乏组试验鸭饲喂核黄素缺乏饲粮(实测核黄素含量为1.38 mg/kg),采食配对组和自由采食对照组饲喂核黄素充足饲粮(在核黄素缺乏饲粮基础上添加10 mg/kg核黄素)。试验期为28 d。结果表明:与采食配对组和自由采食对照组相比,核黄素缺乏组试验鸭的平均日增重、胸肌率和腿肌率显著降低(P<0.05),料重比和死亡率显著升高(P<0.05),肝脏指数、心脏指数和胰腺指数显著提高(P<0.05),血浆核黄素、肝脏核黄素和黄素单核苷酸含量显著降低(P<0.05),血浆谷草转氨酶活性及总胆固醇和甘油三酯含量显著提高(P<0.05)。由此得出,核黄素是北京鸭生长发育必需的营养素;饲粮中缺乏核黄素可降低1~28日龄北京鸭的生长性能和组织中核黄素含量,可提高肝脏指数并导致血浆总胆固醇和甘油三酯含量及谷草转氨酶活性升高。
北京鸭;核黄素;生长性能;血浆生化指标;器官指数
核黄素是合成黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的重要前体物质。FMN和FAD是很多黄素蛋白的辅酶,参与生物体内多个代谢过程,如脂肪酸氧化、三羧酸循环、线粒体呼吸链电子传递和氨基酸降解等[1-2]。饲粮中核黄素缺乏可显著降低家禽的生产性能,降低平均日增重、平均日采食量和饲料利用率[3-8]。在肉鸭上,饲粮中核黄素缺乏可显著降低生长性能、屠宰性能、血浆及肝脏核黄素含量等,显著提高血浆谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性,并伴随采食量的降低[6-8]。然而,核黄素缺乏导致的这些变化是否与采食量下降有关还不清楚,还有待于进一步研究。因此,本试验通过设置采食量配对组(控制其采食量与核黄素缺乏组一致),研究饲粮核黄素缺乏对1~28日龄北京鸭生长性能、器官指数、组织核黄素含量和血浆生化指标的影响,以期为核黄素在北京鸭饲粮配制中的应用提供参考。
1 材料与方法
1.1试验饲粮
基础饲粮参考NRC(1994)饲养标准中肉鸭营养需要配制,其组成及营养水平见表1。采用高效液相色谱法[9]测得基础饲粮中的核黄素含量为1.38 mg/kg。通过在基础饲粮中添加0和10 mg/kg核黄素配制成核黄素缺乏饲粮和核黄素充足饲粮。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料(不含核黄素)为每千克饲粮提供The premix (without riboflavin) provided the following per kg of the diet:Cu (CuSO4·5H2O) 10 mg,Fe (FeSO4·7H2O) 60 mg,Zn (ZnO) 60 mg,Mn (MnSO4·H2O) 80 mg,Se (NaSeO3) 0.2 g,I (KI) 0.2 mg,Cr (Cr2O3) 0.15 mg,氯化胆碱 choline chloride 1 000 mg,VA 10 000 IU,VD33 000 IU,VE 20 IU,VK32 mg,硫胺素 thiamin 2 mg,VB64 mg,VB120.06 mg,D-泛酸D-pantothenic acid 20 mg,烟酸 nicotinc acid 50 mg,叶酸 folic acid 1 mg,生物素 biotin 0.2 mg。
2)核黄素为实测值,其他营养水平均为计算值。Riboflavin was a measured value, while the other nutrient levels were calculated values.
1.2试验设计及饲养管理
采用单因子完全随机试验设计,选取360只1日龄健康的雄性北京鸭,随机分为3个组,即核黄素缺乏组、采食配对组(人为控制该组采食量与核黄素缺乏组一致)和自由采食对照组,每组12个重复,每个重复10只鸭,试验期为28 d(1~28日龄)。核黄素缺乏组试验鸭饲喂核黄素缺乏饲粮,采食配对组和自由采食对照组饲喂核黄素充足饲粮。核黄素缺乏组和自由采食对照组均自由采食,采食配对组试验鸭于每日08:30一次性投料,投料前收集称量核黄素缺乏组试验鸭前1天剩料量,记录采食量,依据前1天核黄素缺乏组试验鸭耗料量饲喂当天采食配对组试验鸭。
试验鸭采用网上平养,自由饮水,试验期间鸭舍温度由33 ℃按阶段逐步降为22 ℃,采用人工补光制度,24 h光照,其他按常规饲养管理进行。
1.3测定指标
1.3.1 生长性能的测定
试验第28天时,以重复为单位记录鸭空腹重、耗料量,计算各组试验鸭1~28日龄的平均日增重、平均日采食量和料重比,并统计试验期间死亡情况,计算死亡率。
1.3.2 屠宰性能和器官指数的测定
试验第28天时,从各组的每个重复中取接近平均体重的试验鸭2只,分别测定活重、胸肌重、腿肌重、腹脂重、脾脏重、胰腺重、肝脏重和心脏重,并计算胸肌率、腿肌率、腹脂率、脾脏指数、胰腺指数、肝脏指数和心脏指数(分别为该组织或器官的绝对重与活重的比值,用%表示);采集肝脏样品,-20 ℃冷冻保存备用。
1.3.3 基础饲粮、血浆及肝脏中核黄素、FMN和FAD含量的测定
基础饲粮中核黄素的含量参照文献[9]的方法测定,血浆及肝脏中核黄素、FMN和FAD的含量均采用文献[10]的方法测定。
1.3.4 血浆生化指标的测定
试验第28天时,从各组的每个重复中取接近平均体重的试验鸭2只,心脏采血10 mL,放置于经抗凝处理的采血管中,4 ℃、3 000 r/min离心10 min制备血浆,-20 ℃冷冻保存备用。血浆ALT、AST活性及尿酸、总蛋白、白蛋白、总胆固醇和甘油三酯含量均采用北京中生北控生物科技股份有限公司生产的试剂盒在日立721型全自动生化仪上进行测定。
1.4数据分析
试验数据(除死亡率外)用“平均值±标准差”的形式表示,采用SAS 9.0统计软件进行方差分析,运用Duncan氏法进行组间的多重比较,显著水平为P<0.05。
2 结果
2.1核黄素缺乏对1~28日龄北京鸭生长性能的影响
核黄素缺乏对1~28日龄北京鸭生长性能的影响见表2。与自由采食对照组相比,核黄素缺乏组和采食配对组试验鸭的平均日增重和平均日采食量显著降低(P<0.05),且核黄素缺乏组试验鸭的料重比显著升高(P<0.05)。核黄素缺乏组试验鸭的平均日增重显著低于采食配对组(P<0.05),料重比显著高于采食配对组(P<0.05),平均日采食量与采食配对组没有显著差异(P>0.05)。此外,核黄素缺乏组试验鸭的死亡率显著高于采食配对组和自由采食对照组(P<0.05)。
2.2核黄素缺乏对28日龄北京鸭屠宰性能的影响
核黄素缺乏对28日龄北京鸭屠宰性能的影响见表3。核黄素缺乏组试验鸭的胸肌率和腿肌率显著低于采食配对组和自由采食对照组(P<0.05)。核黄素缺乏组和采食配对组试验鸭的腹脂率显著低于自由采食对照组(P<0.05)。

表2 核黄素缺乏对1~28日龄北京鸭生长性能的影响
同行数据肩标相同或无字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same row, values with the same or no letter superscripts mean no significant difference (P>0.05 ), and with different letter superscripts mean significant difference (P<0.05). The same as below.
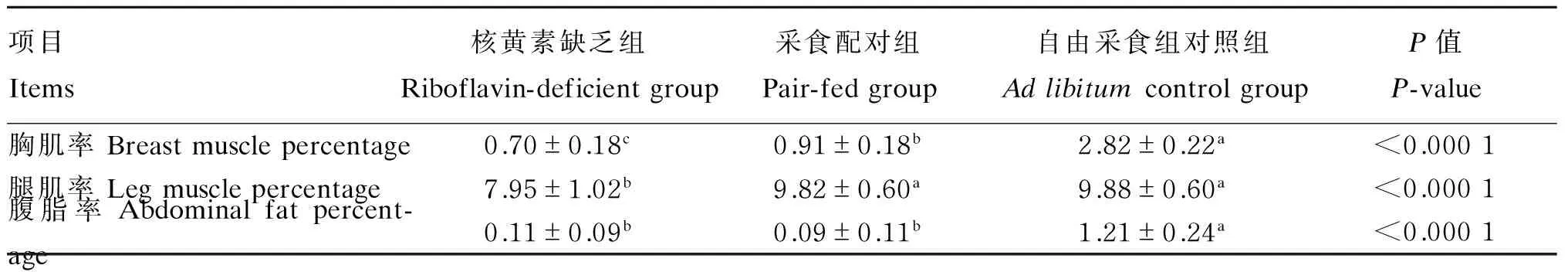
表3 核黄素缺乏对28日龄北京鸭屠宰性能的影响
2.3核黄素缺乏对28日龄北京鸭器官指数的影响
核黄素缺乏对28日龄北京鸭器官指数的影响见表4。与采食配对组和自由采食对照组相比,饲粮缺乏核黄素对北京鸭脾脏指数没有产生显著影响(P>0.05)。核黄素缺乏组试验鸭胰腺指数、心脏指数和肝脏指数均显著高于采食配对组和自由采食对照组(P<0.05),且采食配对组胰腺指数和心脏指数显著高于自由采食对照组(P<0.05)。
2.4核黄素缺乏对28日龄北京鸭血浆及肝脏核黄素、FMN和FAD含量的影响
核黄素缺乏对28日龄北京鸭血浆及肝脏核黄素含量的影响见表5。核黄素缺乏组试验鸭血浆和肝脏核黄素含量显著低于采食配对组和自由采食对照组(P<0.05),采食配对组和自由采食对照组之间没有显著差异(P>0.05)。核黄素缺乏组试验鸭肝脏FMN含量显著低于自由采食对照组(P>0.05),自由采食对照组肝脏FMN含量显著低于采食配对组(P>0.05)。核黄素缺乏组和自由采食对照组试验鸭肝脏FAD含量显著低于采食配对组(P>0.05)。

表4 核黄素缺乏对28日龄北京鸭器官指数的影响
肝脏中核黄素、黄素单核苷酸和黄素腺嘌呤二核苷酸含量均为湿重基础。
The contents of riboflavin, FMN and FAD in liver were based on wet weight basis.
2.5核黄素缺乏对28日龄北京鸭血浆生化指标的影响
核黄素缺乏对28日龄北京鸭血浆生化指标的影响见表6。核黄素缺乏组试验鸭血浆中谷草转氨酶活性以及总蛋白、白蛋白、总胆固醇和甘油三酯含量均显著高于采食配对组和自由采食对照组(P<0.05),而采食配对组和自由采食对照组之间没有显著差异(P>0.05)。核黄素缺乏组试验鸭血浆中谷丙转氨酶活性和尿酸含量显著高于采食配对组(P<0.05),与自由采食对照组没有显著差异(P>0.05)。

表6 核黄素缺乏对28日龄北京鸭血浆生化指标的影响
3 讨 论
3.1核黄素缺乏对1~28日龄北京鸭生长性能和屠宰性能的影响
核黄素缺乏可显著降低动物的采食量[11-16],唐静等[6-8]在北京鸭上的研究也表明饲粮缺乏核黄素可显著降低平均日采食量,故本试验设计中同时包括了采食配对组和自由采食对照组以剔除采食量的影响。国内外多数研究表明,饲粮中缺乏核黄素,家禽生长受阻、饲料利用率降低,饲粮添加核黄素后可显著提高家禽的生产性能[5,17-19]。本试验结果显示,饲粮缺乏核黄素显著降低了北京鸭的平均日增重、平均日采食量,显著提高了料重比,与上述研究报道基本一致。此外,本试验中,饲粮缺乏核黄素还显著降低了北京鸭的胸肌率和腿肌率,这与前人的研究结果[8]一致。
本试验中,尽管核黄素缺乏组与采食配对组试验鸭的采食量相同,但核黄素缺乏组的平均日增重显著低于采食配对组,可见核黄素缺乏组的饲料转化率较低,这与前人在大鼠[12-13,15,20]和猪[16]上的研究结果是一致的。由于核黄素参与脂肪酸氧化、三羧酸循环、线粒体呼吸链电子传递和氨基酸降解等多个代谢过程,核黄素缺乏组饲料转化率较低的原因可能是核黄素缺乏导致机体营养物质氧化不完全,能量利用率降低[21-23]。
3.2核黄素缺乏对28日龄北京鸭血浆及肝脏核黄素含量的影响
血浆核黄素含量是反映机体核黄素营养状况的敏感指标[24-27]。徐琪寿等[24]的研究表明,摄入核黄素缺乏的饲粮后,大鼠血浆核黄素含量很快下降,4周后血浆核黄素含量仅为对照组的8.1%。本试验中,北京鸭饲喂核黄素缺乏的饲粮4周后,血浆核黄素含量降为自由采食对照组的9%,说明血浆核黄素含量能够敏感地反映北京鸭核黄素的营养状况。此外,本试验结果还表明,肝脏核黄素和FMN含量与血浆核黄素含量的变化趋势一致,但是核黄素缺乏组肝脏FAD含量与自由采食对照组相比并没有显著差异,这与Hustad等[26]在人上的研究结果是一致的,可能是机体优先保证FAD的供应所导致的[26,28]。
3.3核黄素缺乏对28日龄北京鸭器官指数和血浆生化指标的影响
核黄素的抗氧化功能已经在国内外的很多研究[18-19,29-30]中得到验证。Levin等[30]证实了核黄素缺乏时细胞抵抗氧化损伤的能力降低,并导致细胞膜功能和流动性改变。血浆中ALT和AST是反映肝功能的敏感指标,其活性与肝脏受损程度呈正相关[31]。本试验结果显示,核黄素缺乏会导致试验鸭血浆中AST的活性显著提高,说明肝脏细胞膜受到损伤,导致细胞膜通透性增强。其原因可能是饲粮中核黄素不足导致北京鸭抗氧化功能减弱,肝脏细胞膜发生脂质过氧化,从而影响细胞膜的生理功能。
器官指数可以反映动物器官发育是否正常、代谢是否旺盛、功能是否完善等状况,并在一定程度上能反映机体的健康状况。本试验中,核黄素缺乏组肝脏指数显著高于采食配对组和自由采食对照组,这与前人在其他物种上所得结果[11-15,20]是一致的。核黄素缺乏组肝脏肿大进一步证明肝脏受到损伤。
在大鼠上的研究显示饲粮缺乏核黄素可导致脂肪肝[32],本试验也发现核黄素缺乏导致北京鸭血浆总胆固醇和甘油三酯含量显著提高,使得血液中脂肪积累。其原因可能是核黄素缺乏导致机体脂酰辅酶A脱氢酶(依赖FAD)活性降低,脂肪酸β氧化受阻,从而导致脂肪积累[33]。
4 结 论
① 在本试验条件下,饲粮中核黄素缺乏可降低1~28日龄北京鸭的平均日增重、胸肌率和腿肌率,提高肝脏指数、心脏指数、胰腺指数。
② 在本试验条件下,饲粮中核黄素缺乏可降低1~28日龄北京鸭血浆及肝脏核黄素含量,提高血浆总胆固醇和甘油三酯含量以及AST活性。
[1] POWERS H J.Riboflavin (vitamin B2) and health[J].The American Journal of Clinical Nutrition,2003,77(6):1352-1360.
[2] LIENHART W D,GUDIPATI V,MACHEROUX P.The human flavoproteome[J].Archives of Biochemistry and Biophysics,2013,535(2):150-162.
[3] RUIZ N,HARMS R H.Riboflavin requirement of broiler chicks fed a corn-soybean diet[J].Poultry Science,1988,67(5):794-799.
[4] CHUNG T K,BAKER D H.Riboflavin requirement of chicks fed purified amino acid and conventional corn-soybean meal diets[J].Poultry Science,1990,69(8):1357-1363.
[5] DEYHIM F,BELAY T,TEETER R G.An evaluation of dietary riboflavin supplementation on growth rate,feed efficiency,ration metabolizable energy content,and glutathione reductase activity of broilers[J].Nutrition Research,1992,12(9):1123-1130.
[6] 唐静,谢明,侯水生,等.1~21日龄不同性别北京鸭核黄素需要量的估测[J].动物营养学报,2012,24(4):661-668.
[7] 唐静,谢明,闻治国,等.核黄素对北京鸭生长性能和抗氧化机能的影响[J].动物营养学报,2013,25(12):2883-2887.
[8] 唐静,谢明,侯水生,等.日粮核黄素水平对1~21日龄北京鸭生长性能、抗氧化能力及激素分泌的影响[J].畜牧兽医学报,2012,43(11):1747-1753.
[9] BRITTON N L,RITER K E N L,SMALLIDGE R L,et al.Reversed-phase liquid chromatographic determination of riboflavin in feeds[J].Journal of AOAC International,2003,86(2):197-201.
[10] 韦京豫,郭长江,徐静,等.测定外周血核黄素及其衍生物含量的HPLC方法研究[J].营养学报,2006,28(1):79-82.
[11] KIM Y S,LAMBOOY J P.Biochemical and physiological changes in the rat during riboflavin deprivation and supplementation[J].The Journal of Nutrition,1969,98(4):467-476.
[12] OLPIN S,BATES C.Lipid metabolism in riboflavin-deficient rats:2.Mitochondrial fatty acid oxidation and the microsomal desaturation pathway[J].British Journal of Nutrition,1982,47(3):589-596.
[13] PATTERSON B E,BATES C J.Riboflavin deficiency,metabolic rate and brown adipose tissue function in sucking and weanling rats[J].British Journal of Nutrition,1989,61(3):475-483.
[14] DUERDEN J M,BATES C J.Effect of riboflavin deficiency on reproductive performance and on biochemical indices of riboflavin status in the rat[J].British Journal of Nutrition,1985,53(1):97-105.
[15] BRADY P S,FENG Y X,BRADY L J.Transcriptional regulation of carnitine palmitoyltransferase synthesis in riboflavin deficiency in rats[J].The Journal of Nutrition,1988,118(9):1128-1136.
[16] BRADY P S,BRADY L J,PARSONS M J,et al.Effects of riboflavin deficiency on growth and glutathione peroxidase system enzymes in the baby pig[J].The Journal of Nutrition,1979,109(9):1615-1622.
[17] 张建海,原广华,庞全海,等.不同核黄素水平对肉仔鸡外周血细胞、免疫器官及生产性能的影响[J].山东家禽,2003(2):9-11.
[18] 蒋守群,周桂莲,林映才,等.饲粮维生素B2水平对1~21日龄黄羽肉鸡生长性能、免疫机能和抗氧化能力的影响[C]//第十四届全国家禽科学学术讨论会论文集.哈尔滨:中国农业技术出版社,2009:1015-1021.
[19] 王艳辉,王安,谢富.维生素B2对笼养蛋雏鸭生长性能、内分泌及抗氧化能力的影响[J].动物营养学报,2009,21(1):31-35.
[20] VEITCH K,DRAYE J P,VAMECQ J,et al.Altered acyl-CoA metabolism in riboflavin deficiency[J].Biochimica et Biophysica Acta:Lipids and Lipid Metabolism,1989,1006(3):335-343.
[21] BURCH H B,HUNTER F E,Jr,COMBS A M,et al.Oxidative enzymes and phosphorylation in hepatic mitochondria from riboflavin-deficient rats[J].Journal of Biological Chemistry,1960,235:1540-1544.
[22] SURE B.Further observations on riboflavin as a food factor in economy of food utilization[J].The Journal of Nutrition,1941,22(3):295-301.
[23] SURE B,DICHEK M,CITRON M M.Riboflavin as a factor in economy of food utilization[J].The Journal of Nutrition,1941,21(5):453-460.
[24] 徐琪寿,韦京豫,杨继军,等.核黄素缺乏大鼠血浆与红细胞核黄素及衍生物浓度的变化[J].营养学报,2005,27(5):386-389.
[25] JACQUES P F,BOSTOM A G,WILSON P W,et al.Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort[J].The American Journal of Clinical Nutrition,2001,73(3):613-621.
[26] HUSTAD S,MCKINLEY M C,MCKINULTY H,et al.Riboflavin,flavin mononucleotide,and flavin adenine dinucleotide in human plasma and erythrocytes at baseline and after low-dose riboflavin supplementation[J].Clinical Chemistry,2002,48(9):1571-1577.
[27] MOAT S J,ASHFIELD-WATT P A,POWERS H J,et al.Effect of riboflavin status on the homocysteine-lowering effect of folate in relation to the MTHFR (C677T) genotype[J].Clinical Chemistry,2003,49(2):295-302.
[28] ROSS N S,HANSEN T P.Riboflavin deficiency is associated with selective preservation of critical flavoenzyme-dependent metabolic pathways[J].Biofactors,1992,3(3):185-190.
[29] CHRISTENSEN H N.Riboflavin can protect tissues from oxidative injury[J].Nutrition Reviews,1993,51(5):149-150.
[30] LEVIN G,COGAN U,LEVY Y,et al.Riboflavin deficiency and the function and fluidity of rat erythrocyte membranes[J].The Journal of Nutrition,1990,120(8):857-861.
[31] 麻晓林,陈伟,金榕兵.肝损伤后检测肝功能指标的实验研究[J].创伤外科杂志,2003,5(1):20-22.
[32] TANIGUCHI M,YAMAMOTO T,NAKAMURA M.Effects of riboflavin deficiency on the lipids of rat liver mitochondria and microsomes[J].Journal of Nutritional Science and Vitaminology,1978,24:363-381.
[33] GIANAZZA E,VERGANI L,WAIT R,et al.Coordinated and reversible reduction of enzymes involved in terminal oxidative metabolism in skeletal muscle mitochondria from a riboflavin-responsive,multiple acyl-CoA dehydrogenase deficiency patient[J].Electrophoresis,2006,27(5/6):1182-1198.
*Corresponding author, professor, E-mail: houss@263.net
EffectsofRiboflavinDeficiencyonGrowthPerformance,OrganIndexesandPlasmaBiochemicalIndicesofPekinDucksfrom1to28DaysofAge
TANG Jing HU Jian JIANG Yong XIE Ming HOU Shuisheng*
(InstituteofAnimalSciences,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
This experiment was conducted to investigate the effects of riboflavin deficiency on growth performance, carcass traits, organ indexes, tissue riboflavin content and plasma biochemical indices of Pekin ducks from 1 to 28 days of age. Using a one-factor completely randomize design, a total of 360 one-day-old male Pekin ducks were divided into 3 groups with 12 replicates each group and 10 birds per replicate. The 3 groups were named as riboflavin-deficient group, pair-fed group andadlibitumcontrol group, respectively, the ducks in riboflavin-deficient group were fed a riboflavin-deficient diet (the measured value of riboflavin content was 1.38 mg/kg), and the ducks in pair-fed group andadlibitumcontrol group were fed a riboflavin-sufficient diet (added 10 mg/kg riboflavin to the riboflavin-deficient diet), and the feed intake of ducks in pair-fed group corresponded with the ducks in riboflavin-deficient group by artificial control. The experiment lasted for 28 days. The results showed as follows: compared with the pair-fed group andadlibitumcontrol group, the average daily gain, breast muscle percentage and leg muscle percentage of ducks were significantly decreased in the riboflavin-deficient group (P<0.05), the feed/gain and mortality of ducks were significantly increased in the riboflavin-deficient group (P<0.05), the liver index, heart index and pancreas index of ducks were significantly increased in the riboflavin-deficient group (P<0.05), the contents of plasma riboflavin, liver riboflavin and flavin mononucleotide of ducks were significantly decreased in the riboflavin-deficient group (P<0.05), and the plasma total cholesterol and triglyceride content and aspartate transaminase activity of ducks were significantly increased in the riboflavin-deficient group (P<0.05). In conclusion, riboflavin is a essential nutrient for the growth and development of Pekin ducks. Dietary riboflavin deficiency can decrease the growth performance and tissue riboflavin content of Pekin ducks from 1 to 28 days of age, and increase the liver index and plasma total cholesterols and triglyceride contents and aspartate transaminase activity.[ChineseJournalofAnimalNutrition,2017,29(11):3899-3905]
Pekin ducks; riboflavin; growth performance; plasma biochemical indices; organ indexes
10.3969/j.issn.1006-267x.2017.11.009
S816
A
1006-267X(2017)11-3899-07
2017-04-06
现代水禽产业技术体系建设专项 (CARS-42)
唐 静(1986—),男,湖北荆州人,博士,研究方向为家禽营养。E-mail: tangjing198601@163.com
*通信作者:侯水生,研究员,博士生导师,E-mail: houss@263.net
(责任编辑 菅景颖)

