产纤溶酶菌株L21的鉴定与发酵条件研究
严 翠,孙玉英,*,刘丹丹,柳 婷,刘斌彬,王淑军
(1.淮海工学院 海洋学院,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222005)
产纤溶酶菌株L21的鉴定与发酵条件研究
严 翠1,孙玉英1,2*,刘丹丹1,柳 婷1,刘斌彬1,王淑军2
(1.淮海工学院 海洋学院,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222005)
利用纤维蛋白平板法从海参体内肠道中筛选到一株产纤溶酶活力较高的菌株L21,通过16S rDNA序列测定比对分析,初步鉴定菌株L21为交替假单胞菌(Pseudoalteromonassp.)。采用单因素试验、Plackett-Burman试验及响应面法对菌株L21的发酵条件进行优化,结果表明,菌株L21最佳发酵工艺条件为NaCl 1 g/L,CaCl21.03 g/L,MgSO40.8 g/L,初始pH 7.40。在此工艺条件下,菌株L21纤溶酶活力达到399.86 U/mL,较优化前(86.09 U/mL)提高了4.64倍。体外溶血实验结果表明该菌株具有作为安全性溶栓剂的潜力。
交替假单胞菌;纤溶酶;Plackett-Burman试验;响应面法
血栓性疾病是严重威胁人类健康的心脑血管疾病,治疗血栓性疾病最为有效、安全的手段主要是采用纤溶酶或纤溶酶原激活剂进行的溶栓疗法[1]。通过溶解过剩的纤维蛋白,使血栓溶解,从而达到血液循环通畅的目的[2]。微生物在自然界中种类多、易培养、繁殖快,而且发酵工业相对完善发达,可短期内得到大量目的产物[3],及其纤溶酶在口服给药的血栓疾病中有一定的优势。因此,微生物纤溶酶的研究在近几十年中已经引起了广大医疗工作者的兴趣。但是长期以来也受以下两个问题的制约:其一,发酵法产酶活力较低,有待于进一步提高;其二,多数已报道的微生物纤溶酶最佳条件和人类生理条件不一致,存在安全性问题,从而使得进一步研究受到限制。如对芽孢杆菌HQS-3粗酶液的体外溶血实验[4]的研究可知,将其开发为溶栓药物的风险会增加;从Alteromonas piscicida中提取的纤溶酶在人体血浆中孵育后[5],酶活力完全受到了抑制,使其应用范围受到限制。
有研究认为,海水的化学性质接近人的血浆,可以提供新的代谢产物,特别是酶,具有较低或没有毒副作用,可以用于治疗血栓[6]。海洋微生物经过漫长的环境适应,其作为产酶资源具有突出的特点和优势。目前,海洋微生物中只有少数几种纤溶酶已经被鉴定及纯化,包括Alteromonas piscicida[5]、Bacillus subtilis[7-8]、Bacillus amyloliquefaciens[9]等。因此,海洋资源具有很大的开发潜力。
本实验室从海参肠道中分离出一株纤溶酶活性较高的海洋菌株L21,其粗酶在体外不引起溶血反应,是一株很有潜力被开发为安全、有效的溶栓药物的细菌。本研究采用单因素试验对菌株L21产纤溶酶所需的碳源、氮源进行筛选,采用Plackett-Burman法挑选对产酶影响较大的因素,然后以纤溶酶酶活为响应值,采用响应面分析法对该菌株产纤溶酶的发酵条件进一步优化,以期提高该菌株的产酶能力。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌种L21:本实验室从海参肠道中筛选得到的产纤溶酶活性较高的海洋菌株。
1.1.2 主要试剂
羧甲基纤维素钠、酪蛋白、NaCl、CaCl2、FeCl3、MgSO4(均为化学纯)、酪氨酸、琼脂糖、琼脂粉(均为生化试剂):国药集团化学试剂有限公司;蛋白胨、酵母提取物(均为生化试剂):英国OXOID公司。
1.1.3 培养基
Luria-Bertani(LB)固体培养基:酵母提取物5 g/L,蛋白胨10 g/L,NaCl 10 g/L,琼脂粉20 g/L,pH 7.0。
血琼脂平板:蛋白胨10 g/L,牛肉膏3 g/L,NaCl 5 g/L,琼脂粉20 g/L,鸡血50~100 mL。
种子培养基:酵母提取物5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH 7.0。
初始发酵培养基:羧甲基纤维素钠5 g/L,酵母提取物5 g/L,酪蛋白2 g/L,NaCl 2 g/L,CaCl20.5 g/L,FeCl30.8 g/L,MgSO40.5 g/L,pH 7.0。
1.2 仪器与设备
SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;CR22G高速冷冻离心机:日本日立公司;5418小型台式高速离心机:德国艾本德股份公司;T6系列紫外可见分光光度计:北京普析通用仪器有限责任公司;DK-8D型电热恒温水槽:上海一恒科技有限公司;T100梯度PCR仪:美国伯乐公司;ZWY-211C恒温培养振荡器:上海智城分析仪器制造有限公司;DYY-2C型电泳仪:北京市六一仪器厂。
1.3 方法
1.3.1 菌株L21的种子液制备及发酵
将菌株L21在LB固体培养基上活化后,从单菌落中挑取一环接种于装液量为50 mL/250 mL种子培养基中,在30℃、160 r/min条件下摇床培养24 h后作为种子液。将4%的菌株L21种子液接种于初始发酵培养基中,于30℃发酵培养60 h。
1.3.2 纤溶酶酶活力的测定
参照VIJAYARAGHAVAN P等[10]的方法有所改进。将发酵液在4℃条件下6 000 r/min离心20 min,上清液即为粗酶液。于25 mL比色管中加2 mL 2.5%的纤维蛋白溶液,再加2 mL 0.1 mol/L的Tris-HCl(含有0.01 mol/L的CaCl2,pH 7.8),然后加1 mL粗酶液,37 ℃孵育30 min后,加入5 mL 0.11mol/L的三氯乙酸(含有0.22mol/L的乙酸钠和0.33mol/L的乙酸)终止反应,10000r/min离心20min,取上清液在波长280 nm处测定吸光度值。并用酪氨酸标准品绘制酪氨酸与吸光度值的标准曲线,线性回归方程为:y=0.0004x+0.0235(相关系数R2=0.993 4)。根据标准回归方程计算样品中酪氨酸的含量。酶活力单位定义:在37℃条件下,每分钟水解纤维蛋白生成1 μg酪氨酸所需的酶量为一个酶活力单位(U/mL)。
1.3.3 菌株鉴定及系统进化树分析
16S rDNA序列扩增与测序:从菌株L21的单菌落中挑取一环于0.1 mL无菌ddH2O中并吹吸混匀后煮沸5 min,以此为模板进行聚合酶链反应(polymerasechainreaction,PCR)扩增。引物序列:27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′),由北京六合华大基因科技股份有限公司合成。PCR反应体系为50μL,反应条件:95℃预变性5min,95℃变性30 s,55℃退火30 s,72℃延伸l min,共30个循环,然后72℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR扩增结果,并用试剂盒纯化产物。PCR产物送北京六合华大基因科技股份有限公司测序,序列用BLAST程序与数据库中核酸序列进行同源性搜索,采用ClustalX 1.81进行序列比对,通过MEGA 6.06软件,采用邻接法(Neighbor-Joining)构建系统发育树。
1.3.4 单因素试验
通过单因素试验,以10 g/L的添加量从羧甲基纤维素钠、壳聚糖、蔗糖、几丁质、麦芽糖、果糖、葡萄糖和淀粉中筛选出最优碳源,以10 g/L的添加量从酪蛋白、牛肉膏、硝酸钠、蛋白胨、尿素、硫酸铵、鱼粉和豆粕粉中筛选出最优氮源。
1.3.5 Plackett-Burman试验设计[11]
本实验采用Plackett-Burman(PB)试验设计,对羧甲基纤维素钠(X1)、酪蛋白(X2)、酵母粉(X3)、NaCl(X4)、CaCl2(X5)、FeCl3(X6)、MgSO4(X7)、接种量(X8)、温度(X9)、装液量(X10)、初始pH(X11)和发酵时间(X12)这12个因素进行考察,从而选出对纤溶酶酶活力影响显著的因子。
1.3.6 响应面分析[12]
根据PB试验的结果,选取对酶活力具有显著性影响的因素,以NaCl(A)、CaCl2(B)、MgSO4(C)和初始pH(D)为影响因素,纤溶酶活力(Y)为响应值,进行响应面优化试验,试验因素与水平见表1。
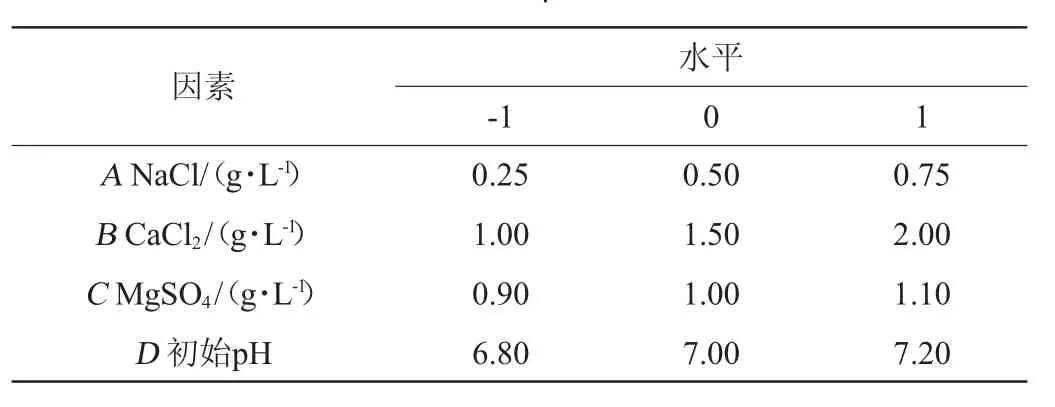
表1 菌株L21发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for fermentation conditions optimization of strain L21
1.3.7 体外溶血实验
参照HUANG S等[13]的方法有所修改。将50 μL粗酶液置于打孔的血琼脂平板上,于37℃孵育3 d,观察是否有透明圈。以枯草芽孢杆菌ATCC6633的粗酶液作为参考。
2 结果与分析
2.1 菌株鉴定及系统进化树分析

图1 基于菌株L21 16S rDNA序列的系统发育树Fig.1 Phylogenetic tree of strain L21 based on 16S rDNA sequence
经PCR扩增并对其产物进行序列测定,得到一段长度为1 498 bp的序列(GenBank accession:KM229514),对其进行同源性序列比对,并下载与该菌株同源性较高的具有代表性的菌株序列,利用ClustalX1.81软件进行序列匹配比对,通过MEGA 6.06软件构建系统发育树,结果见图1。由图1可知,菌株L21与交替假单胞菌聚成一群,菌株的序列相似性达到98%以上,综合其显微形态特征,可初步确定该菌株为交替假单胞菌(Pseudoalteromonassp.)的一个株系,把菌株命名为Pseudoalteromonassp.L21。
2.2 单因素试验
2.2.1 不同碳源对酶活力的影响
考察不同碳源对菌种L21纤溶酶酶活力的影响,结果见表2。
由表2可知,以羧甲基纤维素钠作为碳源时,菌株L21产纤溶酶酶活力最高,为98.56 U/mL,壳聚糖和蔗糖次之,其余碳源产纤溶酶酶活力均低于初始发酵产酶活力(86.09 U/mL),因此,选羧甲基纤维素钠为最优碳源。

表2 不同碳源对纤溶酶酶活的影响Table 2 Effect of different carbon sources on the fibrinolytic enzyme activity
2.2.2 不同氮源对酶活力的影响

表3 不同氮源对纤溶酶酶活的影响Table 3 Effect of different nitrogen sources on the fibrinolytic enzyme activity
由表3可知,以酪蛋白为氮源时,产纤溶酶酶活力最高,且高于初始纤溶酶酶活力(86.09 U/mL),其余氮源产纤溶酶酶活力均低于初始发酵产酶活力,因此选酪蛋白为最优氮源。
2.3 PB试验设计及结果
利用Design-Expert 8.0.6.1软件,选用N=19进行PB试验设计,每个因素取高水平(+1)和低水平(-1)两个水平。以纤溶酶酶活为响应值,每组试验设置3个平行,试验因素和水平见表4,试验结果与分析见表5,主效应分析结果见表6。
由表6中的P值可知,NaCl、CaCl2、MgSO4和初始pH对纤溶酶酶活影响最大,因此选择NaCl、CaCl2、MgSO4和初始pH为自变量进行响应面试验。
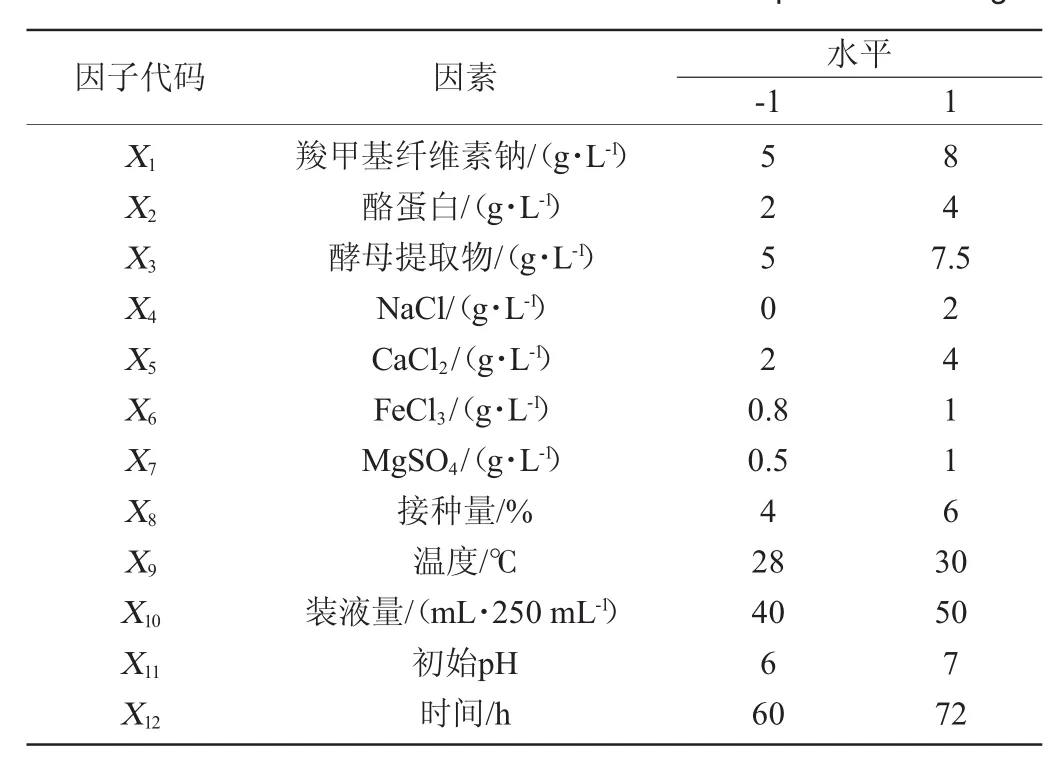
表4 Plackett-Burman试验设计因素与水平Table 4 Factors and levels of Plackett-Burman experiments design
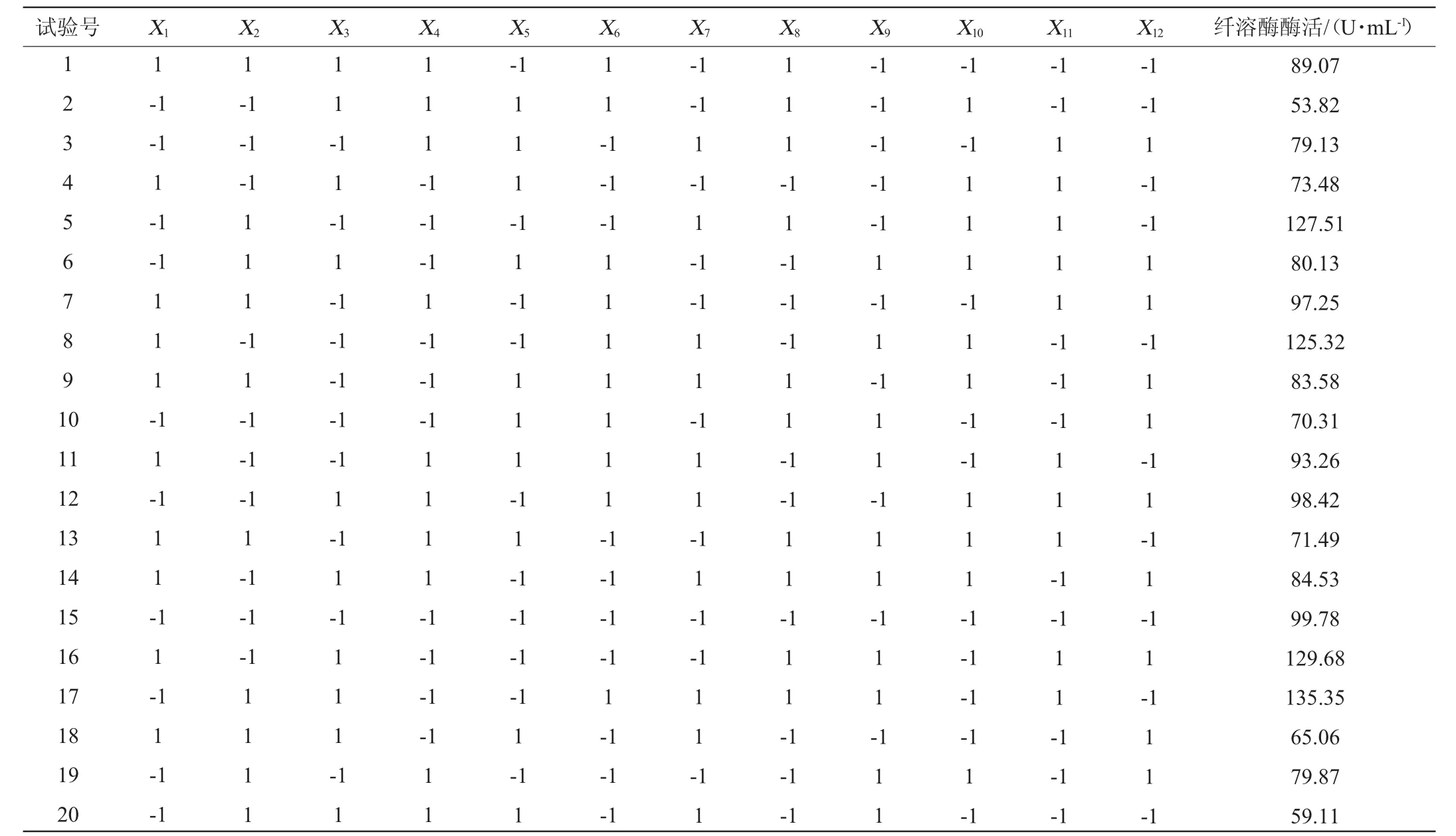
表5 Plackett-Burman试验设计与结果Table 5 Design and results of Plackett-Burman experiments
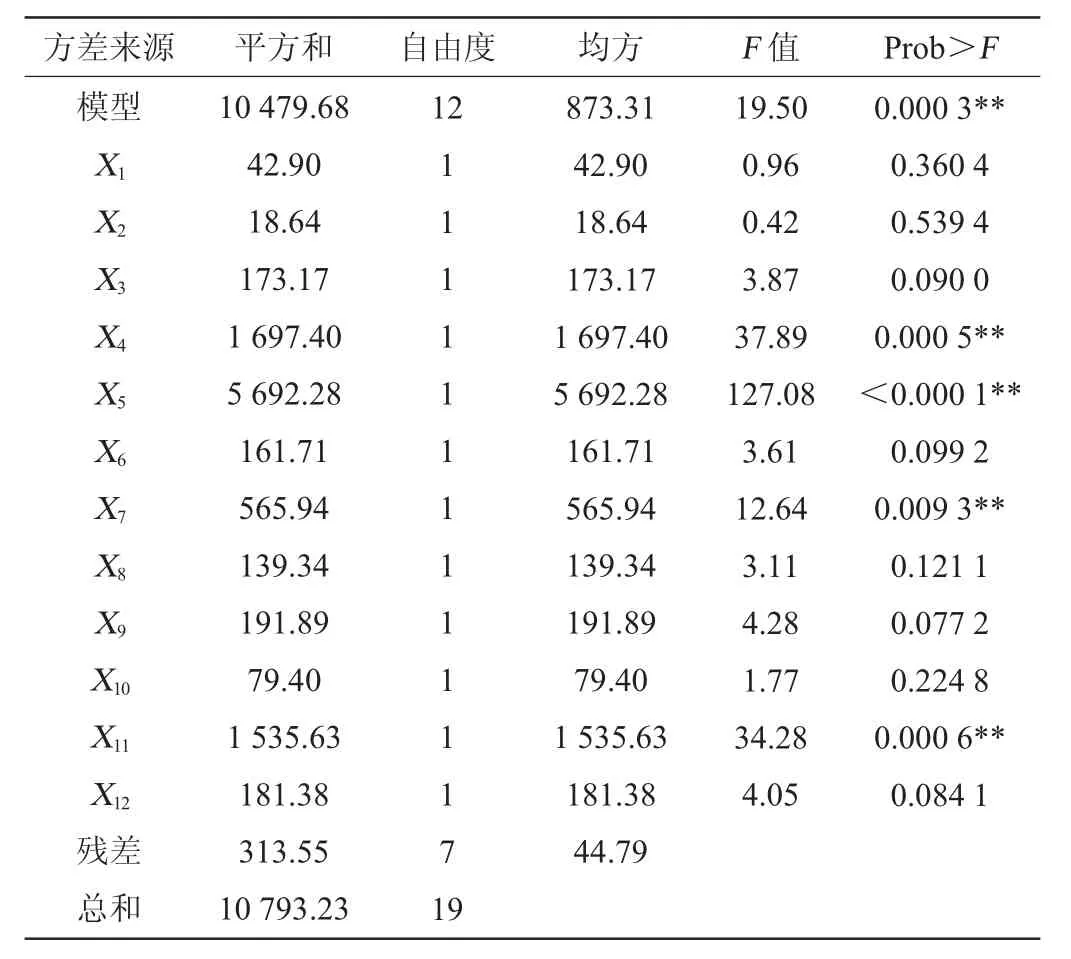
表6 Plackett-Burman试验各因素主效应分析Table 6 Main effects analysis of each factor of Plackett-Burman experiments
2.4 响应面分析试验结果
根据PB试验结果,利用中心组合试验设计(central composite design,CCD)对这4个影响显著的因素NaCl(A)、CaCl2(B)、MgSO4(C)和初始pH(D)进一步优化,其中NaCl的添加量和pH值对纤溶酶酶活力的影响为正效应,MgSO4和CaCl2的添加量对纤溶酶酶活力的影响为负效应,因此,为了提高纤溶酶酶活力,需要增加NaCl的添加量,提高pH值,并降低MgSO4和CaCl2的添加量。中心组合试验设计与结果见表7。

表7 中心组合试验设计与结果Table 7 Design and results of central composite experiments
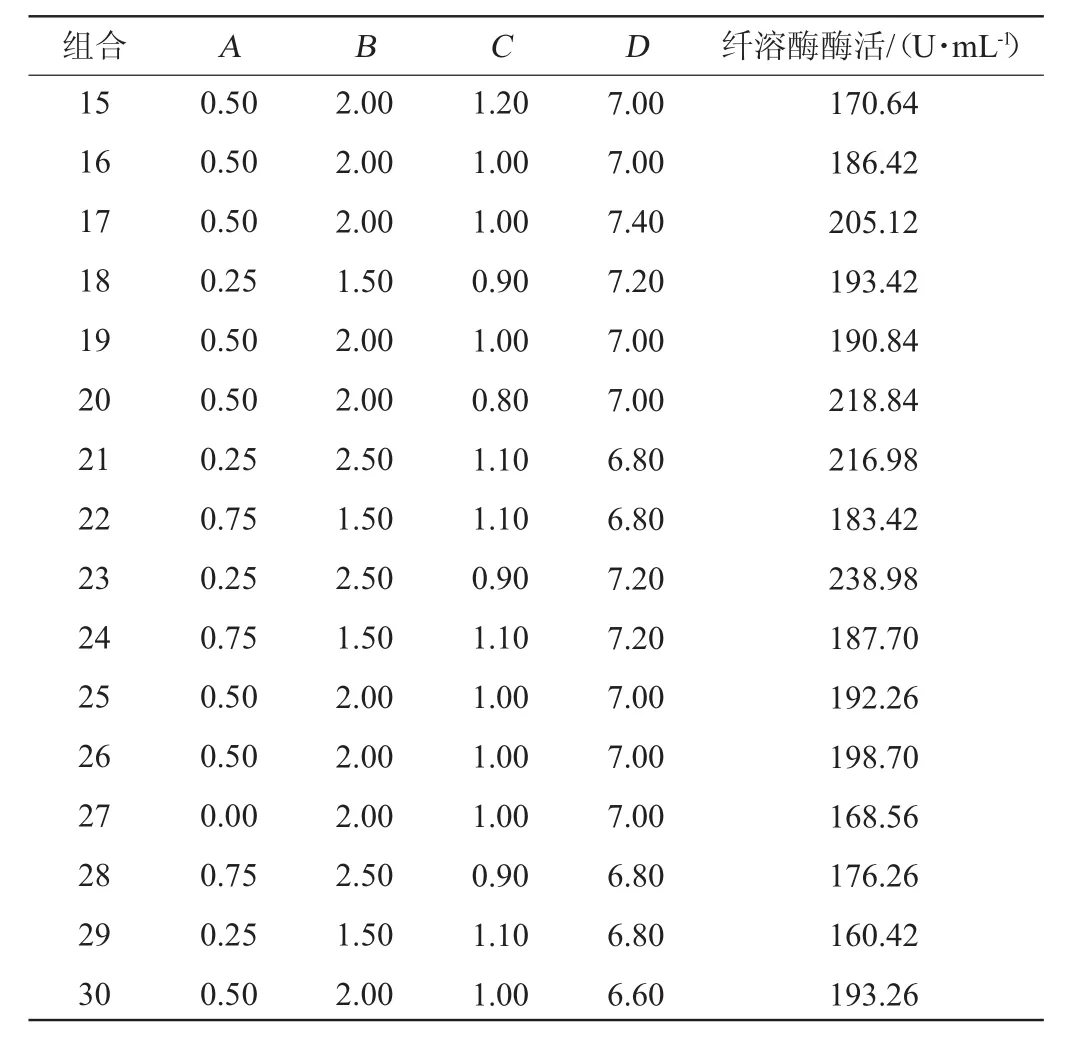
续表
运用Design-Expert 8.0.6.1软件对表7中的数据进行回归分析,方差分析结果见表8。对各因素进行二次多元回归拟合后,得到回归方程:
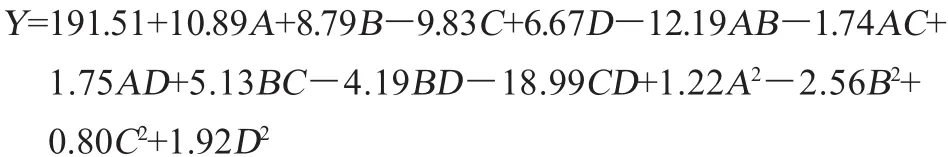
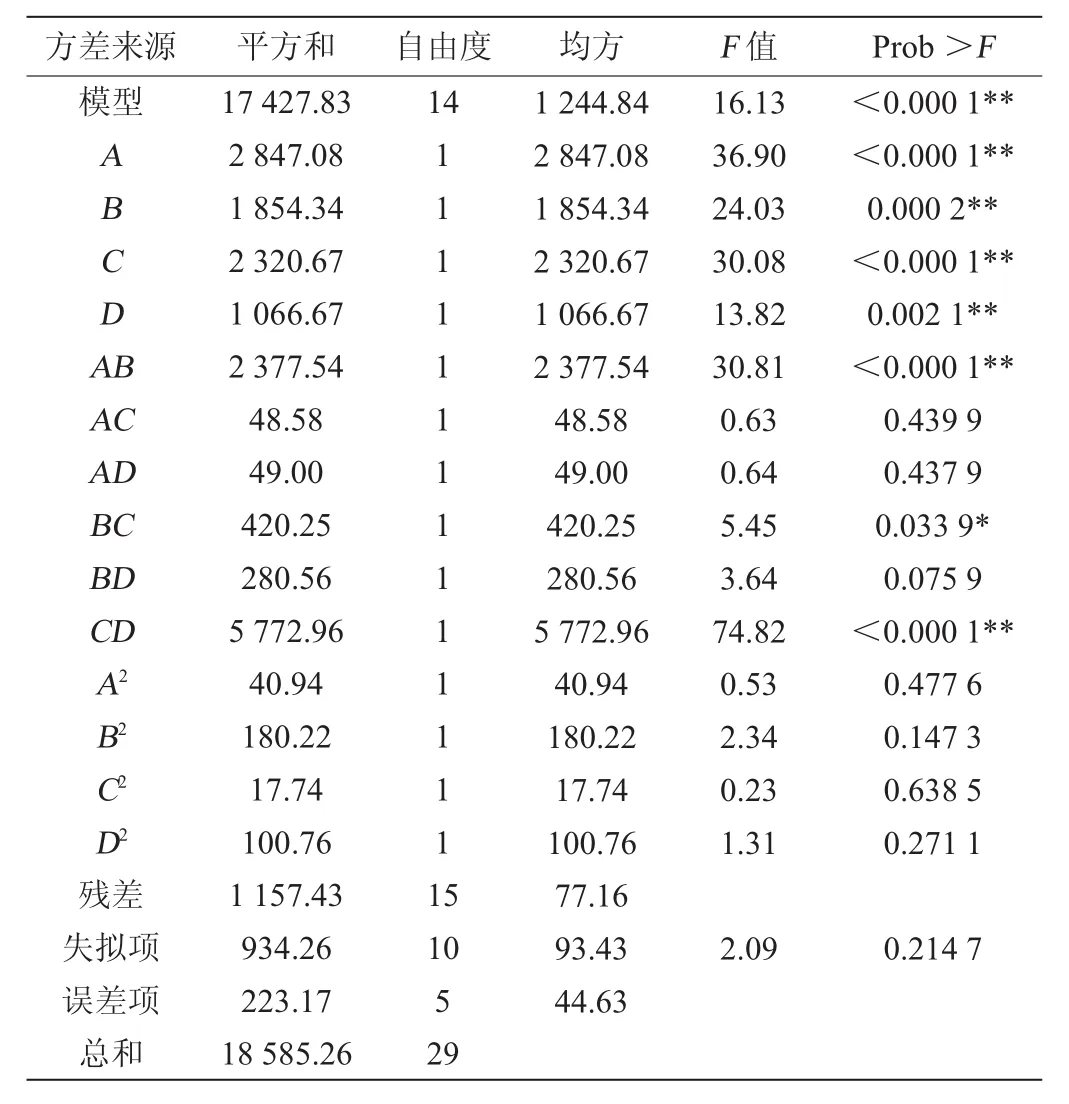
表8 响应面试验结果方差分析Table 8 Variance analysis of response surface experiments results
决定系数R2=0.937 7,修正相关系数R2Adj=0.879 6,表明方程的拟合度很好,可以代替真实试验点结果进行分析。由表8可知,该回归模型的P<0.000 1,该模型的影响极显著,失拟项不显著(P=0.214 7>0.05),表明模型拟合度高,一次项A、B、C、D和交互项AB、CD对响应值的影响极显著(P<0.01),交互项BC对响应值显著影响(P<0.05),说明该模型可以用于该菌株产纤溶酶发酵优化的理论预测[14]。
各因素交互作用的响应面分析结果见图2。

图2 NaCl、CaCl2、MgSO4和初始pH的交互作用对纤溶酶活力影响的响应面与等高线Fig.2 Response surface and contour line of the effects of interaction between NaCl,CaCl2,MgSO4and initial pH on fibrinolytic enzyme activity
由图2可知,3个响应面中只有一个是开口向下的凸形曲线,说明存在极大值,但最优条件并不都在于所设计的因素水平范围内。在回归方程中二次项系数A2、C2、D2系数为正数,B2的系数为负数,表明响应面极值点可能不止一个,不能直接从该响应面上找出最佳工艺。因此需要使用Design-Expert软件对工艺条件进行优化,在模型取值范围内选择最低点为起始点,进行快速上升法优化[15]。
经响应面分析得出菌株L21产纤溶酶最佳发酵条件为:NaCl1g/L,CaCl21.03g/L,MgSO40.8g/L,初始pH7.40,在此条件下进行3次验证试验,纤溶酶酶活力达到399.86U/mL,与预测值(408.82 U/mL)相符,较优化前纤溶酶活力(86.09 U/mL)提高了4.64倍。
2.5 体外溶血试验

图3 菌株L21体外溶血试验结果Fig.3 Results ofin vitrohemolysis experiments of strain L21
由图3可知,目的菌株L21(左)的粗酶液在血琼脂平板上没有形成透明圈,但对照(右)却在平板上形成了透明圈,说明目的菌株L21通过发酵培养并没有产生导致红细胞破裂溶解而引起溶血现象的物质,菌株L21在体外无溶血作用,可作为一种比较安全的溶栓剂,有开发为注射剂或药物制剂的潜力。
3 结论
本实验从海参肠道内筛选出一株产纤溶活力较强的菌株L21,通过16S rDNA序列分析,初步鉴定菌株L21为交替假单胞菌(Pseudoalteromonassp.),并采用响应面分析法对菌株L21产酶发酵条件进行优化。结果表明,菌株L21产酶的最佳条件分别为NaCl 1 g/L,CaCl21.03 g/L,MgSO40.8 g/L,初始pH 7.40。在此条件下,菌株L21发酵产纤溶酶酶活为399.86 U/mL,较优化前纤溶酶活力(86.09 U/mL)提高了4.64倍。因此用响应面法优化菌株L21产纤溶酶发酵条件是有效可行的。体外溶血试验结果表明,菌株L21在体外不引起溶血反应,说明它是一个潜在的安全性较高的溶栓剂。此外,本课题组还研究了该菌株的部分酶学性质,发现该菌株粗酶液的最适pH值为7.5,最适作用温度为35℃,接近人体温度,说明它能在人体内发挥很好的疗效,对其开发为溶栓药物有重要的价值,也对拓展海洋溶栓药物的来源是一个有益的探索。
[1]翁郁华,杨晓彤,杨明俊,等.微生物纤溶酶的多样性及应用前景[J].现代生物医学进展,2010,10(8):1562-1565.
[2]罗文华,郭 勇.食品纤溶酶研究进展[J].中国生物工程杂志,2006,26(8):111-114.
[3]艾瑞波,刘晓兰,邓永平,等.微生物发酵法生产纤溶酶的研究进展[J].食品与机械,2013,29(2):227-230.
[4]SABU A.Sources,properties and applications of microbial therapeutic enzymes[J].Deep Sea Res,2003,30(83):887-902.
[5]DEMINA N S,VESLOPOLOVA E F,GAENKO G P.The marine bacteriumAlteromonas piscicida-a producer of enzymes with thrombolytic action[J].Izvestiia Akademii Nauk Sssr Seriia Biologicheskaia,1990,3(3):415-419.
[6]AGREBY R,HADDAR A,HAJJI M,et al.Fibrinolytic enzymes from a newly isolated marine bacteriumBacillus subtilisA26:characterization and statistical media optimization[J].Can J Microbiol,2009,55(9):1049-1061.
[7]刘延廖,漆光辉,李培玲,等.海洋源纤溶酶高产菌株的诱变育种及液体培养基优化[J].中国酿造,2016,35(12):53-58.
[8]MAHAJAN P M,NAYAK S,LELE S S.Fibrinolytic enzyme from newly isolated marine bacteriumBacillus subtilisICTF-1:media optimization,purification and characterization[J].J Biosci Bioeng,2012,113(3):307-314.
[9]KOTB E.Purification and partial characterization of a chymotrypsin-like serine fibrinolytic enzyme fromBacillus amyloliquefaciensFCF-11 using corn husk as a novel substrate[J].World J Microbiol Biotech,2014,30(7):2071-2080.
[10]VIJAYARAGHAVAN P,VINCENT S G P.Statistical optimization of fibrinolytic enzyme production byPseudoalteromonassp.IND11 using cow dung substrate by response surface methodology[J].Springer Plus,2014,3(1):1-10.
[11]蒋 彪,王常高,杜 馨,等.响应面法优化芽孢杆菌CJPE209产角蛋白酶发酵培养基的研究[J].中国酿造,2017,36(5):76-80.
[12]夏玉林,冯 娟,李 荷.响应面法优化漆酶基因lac1338表达漆酶的发酵条件[J].应用与环境生物学报,2016,22(2):219-223.
[13]HUANG S,PAN S,CHEN G,et al.Biochemical characteristics of a fibrinolytic enzyme purified from a marine bacterium,Bacillus subtilis HQS-3[J].Int J Biol Macromol,2013,62(11):124-130.
[14]窦少华,周新尚,迟乃玉,等.海洋低温α-淀粉酶菌株Bacillus thuringiensisdsh19-1 发酵条件研究[J].中国酿造,2017,36(4):36-39.[15]鲁小静,冯艳波,陈晓瑞,等.响应面法优化黑果枸杞多糖的提取工艺研究[J].中国酿造,2013,32(6):79-83.
Identification of fibrinolytic enzyme-producing strain L21 and its fermentation conditions
YAN Cui1,SUN Yuying1,2*,LIU Dandan1,LIU Ting1,LIU Binbin1,WANG Shujun2
(1.College of Marine Science,Huaihai Institute of Technology,Lianyungang 222005,China;2.Marine Resources Development Institute of Jiangsu,Lianyungang,222005,China)
A high activity fibrinolytic enzyme-producing strain L21 was isolated from the intestinal tract of sea cucumbers by fibrinogen plate method.Strain L21 was identified asPseudoalteromonassp.by 16S rDNA sequence determination and analysis.The single factor experiments,Plackett-Burman experiments and response surface methodology were applied to optimize the fermentation conditions of strain L21.The results showed that the optimum fermentation process conditions of strain L21 were NaCl 1 g/L,CaCl21.03 g/L,MgSO40.8 g/L and initial pH 7.40.Under the conditions,the fibrinolytic enzyme activity of strain L21 was up to 399.86 U/ml,which was 4.64 times higher than that of before optimization(86.09 U/mL).The results ofin vitrohemolysis experiments indicated that strain L21 had potential as a safe-soluble suppository.
Pseudoalteromonassp.;fibrinolytic enzyme;Plackett-Burman experiments;response surface methodology
Q815
0254-5071(2017)10-0076-06
10.11882/j.issn.0254-5071.2017.10.017
2017-06-15
国家自然科学基金资助项目(41306165);碳谷-江苏海资院海洋先进材料联合研究中心(TG-201402);江苏省海洋生物技术重点实验室开放课题(2009HS001)
严 翠(1993-),女,硕士研究生,研究方向为海洋微生物及其活性物质。
*通讯作者:孙玉英(1974-),女,副教授,博士,研究方向为海洋微生物酶技术。

