青藤碱诱导人红白血病细胞株K562凋亡的实验研究❋
牟凤林,陈 华
(重庆三峡医药高等专科学校,重庆 404100)
【实验研究】
青藤碱诱导人红白血病细胞株K562凋亡的实验研究❋
牟凤林,陈 华△
(重庆三峡医药高等专科学校,重庆 404100)
目的: 通过青藤碱(Sinomeine,SIN)诱导K562细胞凋亡实验,研究SIN诱导K562细胞凋亡机制。方法: CCK-8检测细胞增殖,流式细胞术(FMC)检测细胞凋亡,Hoechst 33258染色细胞凋亡形态学改变,Real-time PCR检测 bcl-2和bax 基因表达,Western blot检测Bcl-2、Bax、Caspase-3蛋白表达。结果: CCK-8和FCM结果显示,SIN可抑制K562细胞增殖并诱导其早期凋亡;Hoechst 33258染色结果显示,经SIN诱导48h后表现出细胞凋亡的典型变化;Real-time PCR结果显示, SIN组bax基因表达升高,bcl-2基因表达降低;Western blot结果显示,SIN组中Caspase-3、Bax蛋白表达升高,Bcl-2蛋白表达降低。结论: SIN可诱导K562病细胞凋亡从而抑制细胞增殖。
青藤碱;K562细胞;bcl-2;bax;细胞凋亡
白血病(Leukemia)是一种克隆性起源的造血系统恶性肿瘤[1],已成为我国年轻人最常见的恶性肿瘤之一[2-3]。目前用于治疗白血病的常用方法费用昂贵、毒副作用较大且易产生耐药性,因此急需探索一种价格合适、毒副作用小、安全高效的抗白血病药物[4]。青藤碱(sinomenine,SIN)是从原产于中国和日本的植物青风藤中发现的一种生物碱,作为传统的中药成分,其化学结构明确,对风湿病和关节炎有较好的疗效。最近的研究表明,青藤碱具有抑制肿瘤细胞增殖的作用[5-8],但其有关青藤碱对白血病细胞作用的相关报道较少。本文通过青藤碱体外诱导人红白血病K562细胞凋亡的实验研究,初步探索青藤碱对白血病细胞增殖的抑制作用。
1 材料方法
1.1 药品与试剂
青藤碱购自成都钜龙天然药业生命科技有限公司(纯度99%),紫杉醇(Taxol)购自美国Bristol Caribbean公司,RPMI1640培养基、胎牛血清(FBS)、PBS购自GIBCO公司,Cell Counting Kit-8(CCK-8)试剂盒购自日本同仁化学研究所,Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司;PCR特异性引物由上海英骏生物技术公司合成(中国),Taq酶、DNase I(RNase free)、RNA提取试剂RNAiso Plus及PrimeScript® RT reagent Kit With gDNA Eraser试剂盒购自TaKaRa公司,RIPA裂解液、蛋白酶抑制剂(PMSF)、SDS-PAGE凝胶试剂盒和BCA蛋白浓度测定试剂盒购自江苏碧云天生物技术研究所,聚偏二氟乙烯(PVDF)膜购自密理博公司,ECL显色剂购自美国GE医疗生命科学,兔抗人Bcl-2、Bax多克隆抗体购自宜康生物技术有限公司。
1.2 细胞
人红白血病细胞株(K562细胞)由重庆市抗肿瘤天然药物工程技术研究中心馈赠。
1.3 实验仪器
CO2恒温培养箱、MK3酶标仪由美国 ThermoFisher公司生产, DM2500倒置显微镜、M70D倒置荧光显微镜由德国Leica公司生产,C6流式细胞仪由美国BD公司生产,ABI7500 Real-time PCR定量仪由美国ABI公司生产,Western blot电泳仪由美国BIORAD公司生产。
1.4 方法
1.4.1 青藤碱工作溶液配制 青藤碱分子式C19H23NO4,分子量为329.39 g/mol,取3.23 g青藤碱溶解于1 mL二甲基亚砜(Dimethyl sulfoxide,DMSO),配置成10 mol/L母液,再加9 mL RPMI1640稀释成1000 mmol/L工作液。
1.4.2 K562细胞培养及分组 取对数生长期的K562细胞,用RPMI1640完全培养液(含5% FBS)悬浮细胞,调整密度5×105/ml,接种于6孔板,每孔4 mL。实验分组:本底对照组只加RPMI 1640完全培养液,空白对照组加含最大剂量0.1% DMSO的RPMI 1640完全培养液,阳性对照组浓度为0.1 μmol/L紫杉醇(Taxol)处理,药物组终浓度为1、2、4、8 mmol/L的SIN,在37 ℃、5% CO2饱和湿度下培养12、24、48、72 h。
1.4.3 CCK-8法检测K562细胞增殖活性 取对数生长期的K562细胞,调整细胞密度为8×105/ml,接种至96孔培养板,每孔100μL。本底对照组只加RPMI 1640完全培养液,空白对照组加含最大剂量0.1% DMSO的RPMI 1640完全培养液,阳性对照组加0.1 μmol/L的紫杉醇(Taxol),药物组终浓度为1、2、4、8 mmol/L的SIN,每组设5个复孔。置于37 ℃、5% CO2饱和湿度下培养12、24、48、72 h后,每孔加入10 μL CCK-8工作液,轻轻震荡使之混匀,继续孵育2 h。用酶标仪在450 nm波长的条件下检测各孔的吸光度值(A),同时计算各实验组细胞增殖的抑制率和各个作用时间点的半数抑制浓度(IC50),以IC50为标准确定最适合的药物作用浓度和时间,实验做3次重复。抑制率(IR%)={1-A450SIN (S)组/A450空白对照组}×100%。
1.4.4 FCM检测SIN对K562凋亡的影响 收集各组细胞,用PBS(pH7.2)洗涤2次, 1500 r/min离心5 min,100 μL PBS重悬细胞,加20 μL Annexin V-FITC/PI染料,在4 ℃避光的条件下染色处理30 min,染色完成后用PBS洗涤1遍,最后用300μl PBS重悬细胞,每组取1×104个细胞上流式细胞仪做流式检测,实验重复3次。
1.4.5 Hoechst 33258染色 培养48 h后,收集空白对照组、阳性对照组和分别经1、2、4和8 mmol/L SIN处理的药物组细胞,用预冷PBS洗涤细胞2次,加甲醇/乙醇(3∶1)固定液室温固定15 min;离心去除固定液加Hoechst 33258染色液避光、室温染色30 min,PBS洗涤1次,再加PBS制成细胞悬液滴在载玻片上,50%甘油封片,置于倒置荧光显微镜下观察、采图。
1.4.6 Real-time PCR 检测SIN对K562细胞bcl-2和bax基因表达的影响 收集培养48 h后的各组细胞,按照试剂盒方法裂解细胞提取总RNA,然后逆转录合成cDNA第一条链,以合成的cDNA作为模板,β-actin基因作为内参基因进行PCR反应。反应条件为:95 ℃ 3min,95 ℃ 30 s,60 ℃ 30 s,60 ℃ 30 s,40 cycles。引物序列为:Bcl-2上游引物:GTTTAAATGGGCATTTGTTTGC,下游引物:CCAACCATGGTTGGTCTGC,探针:GAGAGTTCCTCTCTTTCAGC,Bax上游引物:CTGAGCAGATCATGAAGACAG,下游引物:GCTTGAGACACTCGTCAGCTTC,探针:GAGCTGGCCCTGGACCCGGT,β-actin上游引物:GTGATGGTGGGCATGGGTCAG,下游引物:GCAGAAGGTGTGGTGCCAGA,探针:GTACCCCATCGAGCACGGCA。最终数据使用2-△ △Ct公式计算出相对表达量,实验重复3次。
1.4.7 Western blot检测SIN对K562细胞中Bcl-2、Bax、Caspase-3蛋白表达的影响 培养48 h后收集各组细胞,用RIPA裂解液提取K562细胞的总蛋白, BCA法检测各组细胞蛋白的浓度,调节各组蛋白的浓度使其终浓度一致。每组取40 μg的蛋白样品,进行10% SDS-PAGE电泳,电泳完成后将蛋白电转移至PVDF膜上,用5% BSA室温封闭2 h后,用TBST漂洗3次,每次5 min,分别加入1∶2000稀释的抗Bcl-2、Bax、Caspase-3(激活型)抗体及内参照抗 β-actin抗体,室温孵育4 h;用TBST漂洗3次,每次5 min,分别加入稀释度均为1∶1000的二抗,室温条件下孵育2 h,再用TBST漂洗3次,每次5 min,之后用ECL显色剂化学发光再用X光胶片曝光显影,最后扫描仪扫描后用Quantity One软件进行定量分析,目的蛋白的表达水平用目的条带与内参的灰度值之比表示,实验重复3次。
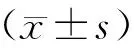
2 结果
2.1 SIN对K562细胞的增殖具有抑制作用
表1显示,在1、2、4、8 mmol/L的浓度范围内SIN可以有效抑制K562细胞的增殖,在处理48 h时各组比较差异有统计学意义(P<0.05)。且随着SIN浓度的增加和作用于细胞时间的延长,抑制作用逐渐增强,8 mmol/L SIN处理组与阳性对照组比较差异无统计学意义(P>0.05)。SIN作用K562细胞12、24、48、72 h的半抑制浓度(IC50)分别为9.8、6.8、4.2、3.9 mmol/L。
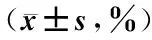
表1 SIN对K562细胞的增殖抑制作用
注:SIN处理K562细胞后与1 mmol/L比较:*P<0.05

表2 SIN可诱导K562细胞早期凋亡[例(%)]
注:SIN处理K562细胞后与control比较:*P<0.05
2.2 SIN可诱导K562细胞早期凋亡
图1表2显示,FCM检测结果示在 2、4、8 mmol/L的浓度范围内,SIN作用于K562细胞48 h能够诱导细胞早期凋亡,并随着SIN浓度的增高早期凋亡率随之升高,8 mmol/LSIN处理组与阳性对照组比较差异无统计学意义(P>0.05),与空白对照组早期凋亡率比较差异有统计学意义(P<0.05)。
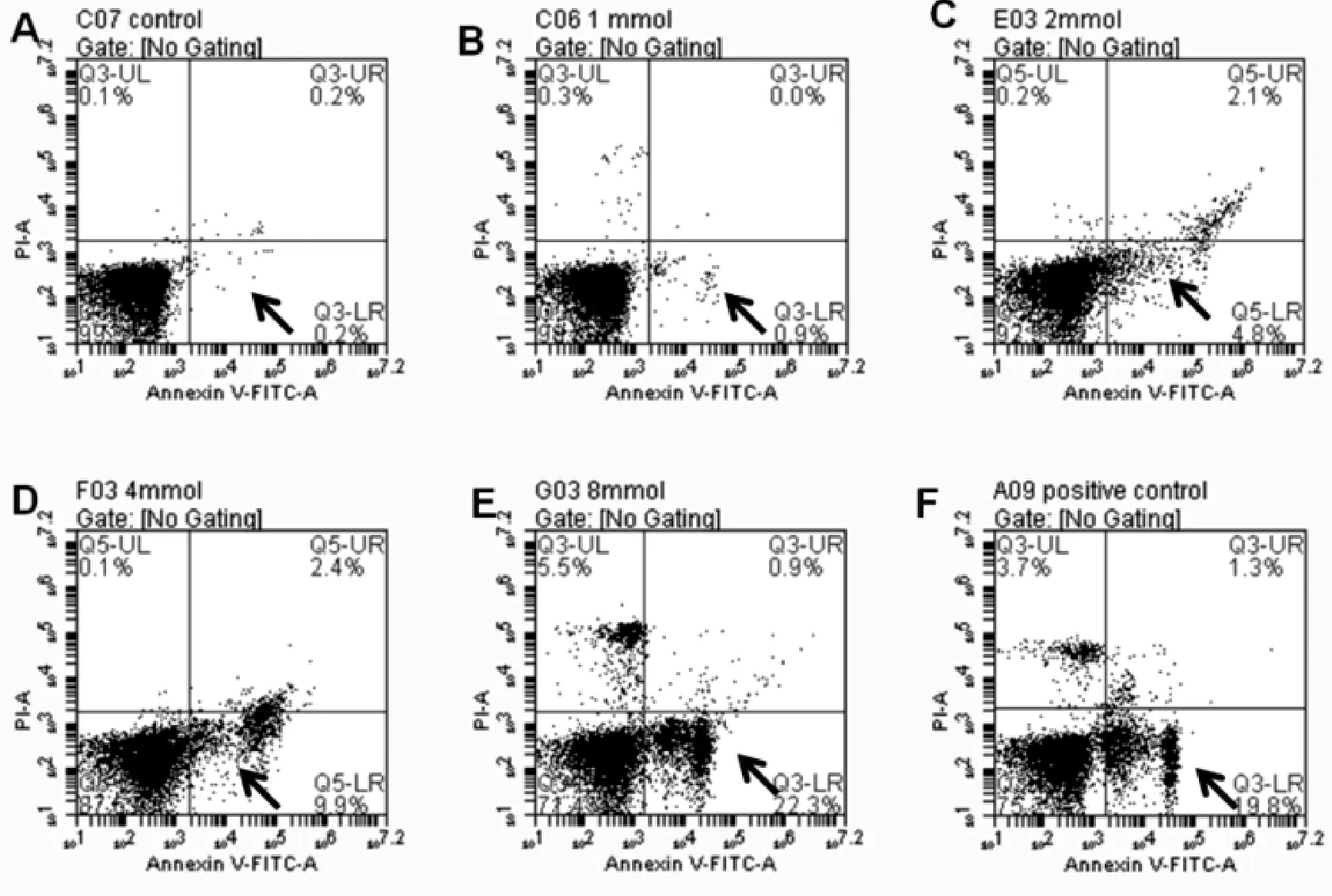
图2 SIN作用48 h后Annexin V-FITC/PI双染检测K562细胞凋亡(箭头所指为凋亡细胞所处位置)注:A.对照组;B.1 mmol/L SIN;C.2 mmol/L SIN;D.4 mmol/L SIN; E.8 mmol/L SIN;F.positive control
2.3 Hoechst 33258染色
图2显示,空白对照组的K562细胞发出均匀的淡蓝色荧光,细胞核无明显的凋亡形态学变化;阳性对照组和分别经2、4、8 mmol/L的SIN诱导48 h后,细胞的核染色质浓缩聚集、核碎裂、核边集,并发出较强的蓝色荧光呈亮白色,表现出细胞凋亡的典型变化,且浓度越高变化越明显。
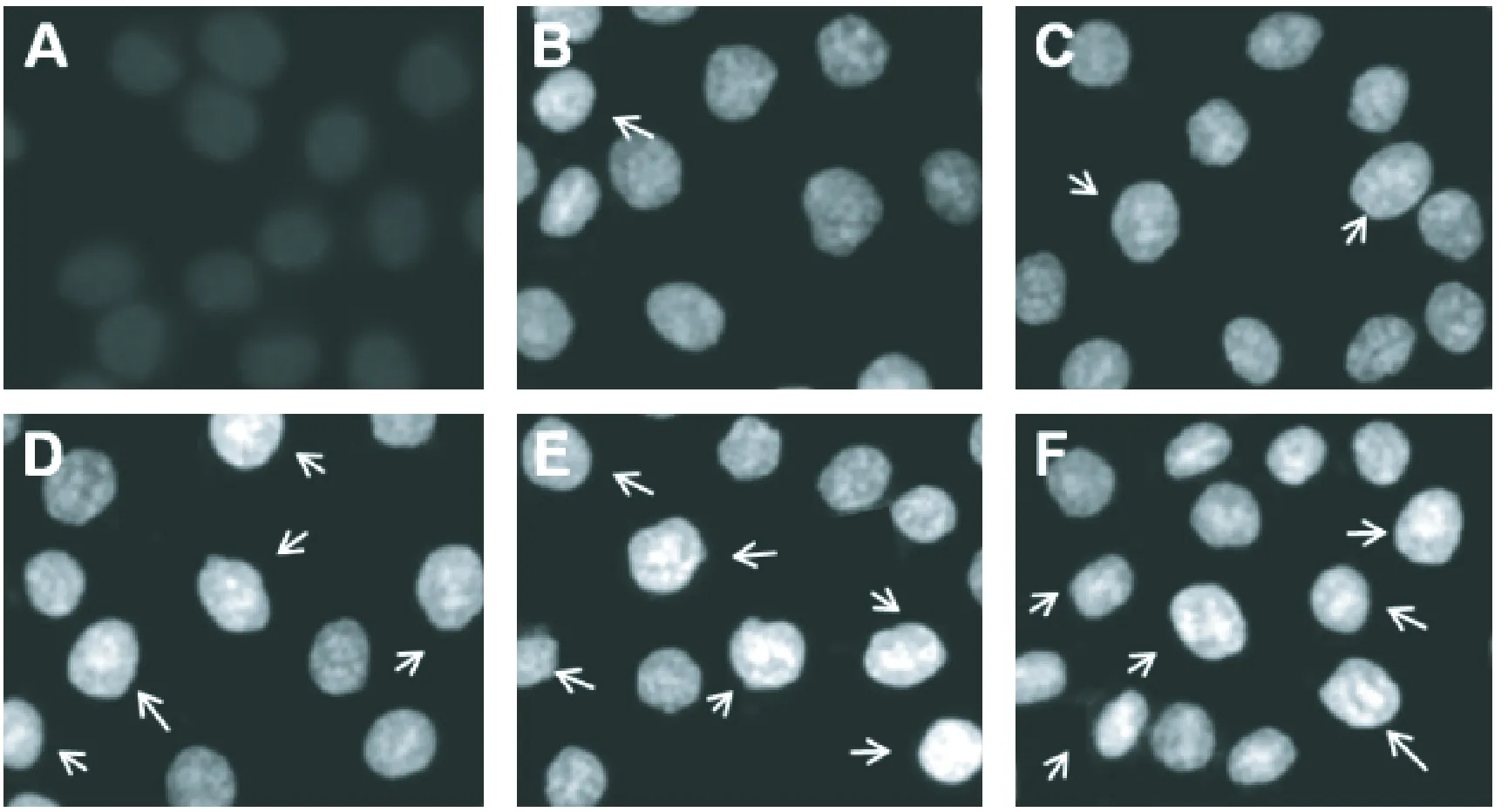
图3 Hoechst 33258染色照片(×400)(箭头所指位置为凋亡细胞群体所处位置)注:A.对照组;B.1 mmol/L SIN;C.2 mmol/L SIN;D.4 mmol/L SIN; E.8 mmol/L SIN;F.positive control
2.4 Real-time PCR 检测SIN对K562细胞bcl-2和bax基因表达的影响
表3显示,Real-time PCR示经2、4、8 mmol/L SIN处理48 h后,实验组K562细胞的bax基因表达与较空白对照组显著升高,差异有统计学意义(P<0.05);8 mmol/LSIN处理组与阳性对照组比较差异无统计学意义(P>0.05)。bal-2基因的表达水平较空白对照组显著降低,差异有统计学意义(P<0.05);8 mmol/L SIN处理组与阳性对照组比较差异无统计学意义(P>0.05)。
2.5 SIN对K562细胞中Caspase-3、Bax、Bcl-2蛋白表达量的影响
图3表4显示,K562细胞经 2、4、8 mmol/L SIN作用48 h后,SIN实验组中Caspase-3和Bax蛋白表达水平显著高于空白对照组,差异有统计学意义(P<0.05),8 mmol/LSIN处理组与阳性对照组比较差异无统计学意义(P>0.05);Bcl-2蛋白表达水平显著低于空白对照组,差异有统计学意义(P<0.05),8 mmol/LSIN处理组与阳性对照组比较差异无统计学意义(P>0.05)。

表3 SIN可诱导K562细胞早期凋亡
注:SIN处理K562细胞后与control比较:*P<0.05

表4 SIN可诱导K562细胞早期凋亡
注:SIN处理K562细胞后与control比较:*P<0.05
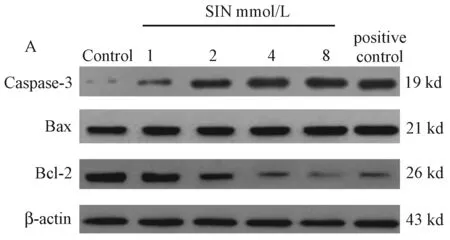
图3 Western blot检测K562细胞中Bcl-2、Bax、Caspase-3蛋白的表达
3 讨论
白血病患者造血细胞增殖不受控制,分化成熟及正常的凋亡途径均受到影响,进而造成大量的异常分化细胞增殖[9],形成白血病症状。目前,白血病的治疗方法主要是大剂量联合化疗,但该方法不良反应多,复发率高,因此寻找一种副作用小且对机体免疫和造血系统抑制程度小的新药是当务之急。
中药如紫杉醇、人参、当归、黄芪等具有明显防治癌症作用,可显著延长患者生存期,提高患者生活质量。尤其是紫杉醇是国内外公认的抗癌中药有效成分,可以通下调Bcl-2、上调Bax和激活Caspase-3来诱导白血病细胞株K562细胞凋亡[10],故本文用紫杉醇作阳性对照。
青藤碱是从防己科植物青藤干燥藤茎提取的生物碱单体,其化学结构已研究清楚。最近的研究表明,SIN具有抗肿瘤的作用。Jiang等[11]研究发现,SIN可通过增加细胞内Bax蛋白表达,降低Bal-2蛋白的表达来诱导肺癌细胞NCI-H460的凋亡;Li等[12]报道,SIN可以通过MAPK信号通路介导乳腺癌细胞停滞在G1/S细胞周期,从而导致癌细胞死亡;Lv等[13]研究表明,SIN可抑制COX-2的表达抗胃癌细胞SGC-7901的增殖。
本研究使用CCK-8法证实在1-8 mmol/L的浓度内SIN可有效抑制K562细胞增殖,且这一作用呈浓度依赖关系。我们进一步通过Hoechst 33258染色和FCM实验显示,SIN可诱导K562早期凋亡,产生抗白血病细胞增殖作用。Bcl-2蛋白为细胞存活促进因子,属于膜整合蛋白,在一些肿瘤细胞中过度表达;Bcl-2蛋白内定位于细胞核膜、内质网以及线粒体上,通过阻止线粒体细胞色素C的释放发挥抗凋亡作用;Bax蛋白是Bcl-2家族中参与细胞凋亡的重要成员之一[14],当细胞受到外界干扰或者刺激发生凋亡时发生迁移、释放,激活Caspase家族,产生Caspase级联反应执行细胞凋亡程序[15];细胞中Bcl-2/Bax的比例决定该细胞是否发生凋亡。本实验检测了执行细胞凋亡相关蛋白因子Caspase-3[16-17]和与细胞凋亡相关的Bcl-2家族成员bcl-2、bax基因以及Bcl-2、Bax蛋白[3,18]的表达。Real-time PCR结果显示,SIN能够降低bcl-2基因的表达,同时上调bax基因的表达。此外,Western blot结果显示,SIN 能有效抑制Bcl-2蛋白的表达,增加促凋亡蛋白Bax并激活Caspase-3蛋白表达,从而促进细胞凋亡的发生,并随着处理浓度的增加该现象越明显。这与Real-time PCR结果一致。也有文献报道,SIN 可通过Caspase-3依赖方式诱导肿瘤细胞凋亡[19]。此外也有研究者认为,SIN 可通过提高Bax蛋白的表达,降低Bcl-2蛋白的表达来诱导肿瘤细胞凋亡[20]。
综上所述,SIN在1、2、4、8 mmol/L浓度范围内均能有效抑制人红白血病K562细胞增殖,并通过下调Bcl-2、上调Bax和激活Caspase-3来诱导其早期凋亡,这一研究为青藤碱用于临床白血病治疗提供实验依据和理论基础。
[1] 刘玉琴,赵凤菊,陈万青,等.中国2009年白血病发病和死亡资料分析[J]. 中国肿瘤, 2013,22(7):528-534.[2] ZHENBEI GAO, XIAO KANG, JUN HU, et al. Erratum to: Induction of apoptosis with mitochondrial membrane depolarization by a glycyrrhetinic acid derivative in human leukemia K562 cells[J]. Cytotechnology,2013, 65: 895.
[3] FLOREAN C, SCHNEKENBURGER M, GRANDJENETTE C, et al. Epigenomics of leukemia: from mechanisms to therapeutic applications[J]. Epigenomics,2011,3(5): 581-609.
[4] 李丹,余涛,吴杰,等. 中药有效成分抗白血病机制研究进展[J].中国药师,2013,16 (7):1068-1070.
[5] 陈伟毅,秦春宏,银晓刚. 青藤碱抗肿瘤作用研究进展[J].中国药师,2013,16(12):1902-1904.
[6] 施荣东.Maspin、Caspase-3、COX-2与宫颈癌的关系及青藤碱与顺铂对其表达的影响[D].太原:山西医科大学,2011.
[7] 任强,孙越华,朱清,等.青藤碱抗炎免疫与抗肿瘤作用研究新进展[J].中国药理学通报,2015,31(8):1040-1043.
[8] 谢冰冰,易浪,董燕,等.青藤碱对肺癌细胞A549增殖及α7 nAChR表达的影响[J]. 中药新药与临床药理,2015,26(2):164-169.
[9] 何志旭,许威.儿童急性白血病发病机制研究进展[J].实用儿科临床杂志, 2011,15:1149-1152.
[10] ROSARIA MR, BARBARA S, ANTONIO B, et al. Late apoptotic effects of taxanes on K562 erythroleukemia cells: Apoptosis is delayed upstream of caspase-3 activation[J]. International Journal of Cancer, 2000,10(1002):527-533.
[11] JIANG T, ZHOU L, ZHANG W, et al. Effects of sinomenine on proliferation and apoptosis in human lung cancer cell line NCI-H460 in vitro[J]. Mol Med Rep, 2010, 3(1): 51-56.
[12] LI X, WANG K, REN Y, et al. MAPK signaling mediates sinomenine hydrochloride-induced human breast cancer cell death via both reactive oxygen species-dependent and independent pathways: an in vitro and in vivo study[J]. Cell Death Dis, 2014, 5: e1356.
[13] LV Y, LI C, LI S, et al. Sinomenine inhibits proliferation of SGC-7901 gastric adenocarcinoma cells via suppression of cyclooxygenase-2 expression[J]. Oncol Lett, 2011, 2(4):74 -75.
[14] MOAZAMI-GOUDARZI M, FARSHDOUSTI-HAGH M, HOSEINPOUR-FEIZI A, et al. The acute lymphoblastic leukemia prognostic scoring whether it is possible by BCL-2, BAX gene promoter genotyping[J]. Caspian J Intern Med,2016, 7(2):105-113.
[15] O’NEILL KL, HUANG K, et al. Inactivation of prosurvival Bcl-2 proteins activates Bax/Bak through the outer mitochondrial membrane[J]. Genes Dev,2016, 30(8):973-988.
[16] DAS C, LUCIA MS, HANSEN KC, et al. CBP/p300-mediated acetylation of histone H3 on lysine 56[J]. Nature,2009,459(7243):113-117.
[17] CHEN J, ODENIKE O, ROWLEY JD. Leukaemogenesis: more than mutant genes[J]. Nat Rev Cancer,2010,10(1):23-36.
[18] HUFFMAN K, MARTINEZ ED. Pre-Clinical Studies of Epigenetic Therapies Targeting Histone Modifiers in Lung Cancer[J]. Front Oncol,2013, 9:235.
[19] 杨海波,施展,马艳春,等.青藤碱对人结肠癌细胞株SW480增殖和细胞周期的影响[J].医学研究杂志,2014,43 (7):72-75.
[20] 周溯.青藤碱联合氟尿嘧啶对人胃腺癌SGC7901细胞增殖及凋亡的影响[J]. 蚌埠医学院学报,2015,8:998-1001.
ExperimentalStudyonApoptosisofHumanErythroleukemiaCellLineK562InducedbySinomenine
MOU Feng-lin, CHEN Hua△
(ChongqingThreeGorgesMedicalCollege,Chongqing404100,China)
Objective: To grope preliminarily the effects of Sinomenine(SIN) on the proliferation inhibition, apoptosis of human erythroleukemia cell line K562. Methods: CCK-8 assay was used to detect the K562 cell proliferation activity. K562 cell apoptotic changes were detected by Flow cytometry (FCM). The cell morphological changes of apoptosis were observed by hoechst staining.The changes of expressions of bcl-2 gene and bax gene were examined by Real-time PCR. The changes of expressions of Bcl-2、Bax and Caspase-3 proteins were examined by western blot analysis. Results: CCK-8 assay result showed that SIN can effectively inhibit the proliferation of K562 cells in vitro, which exhibits a dose-dependent manner. Flow cytometry results indicated that SIN can induce early apoptosis of K562 cells after induced by SIN, which showed statistically significant difference compared with the control group. Hoechst staining revealed that SIN could induce toypical apoptotic morphological changes. Real-time PCR showed that the expressions of bax gene was increased in dose-dependent manner after induced by SIN, while expressions of bcl-2 gene were decreased compared with the control group. Western blot showed that the expressions of Bax, Caspase-3 were increased in dose-dependent manner after induced by SIN, expressions of Bcl-2 proteins were decreased compared with the control group. Conclusion: SIN can inhibit the proliferation of K562 cells and induce its apoptosis through activating Caspase-3 up-regulating the expression of Bax, and down-regulating the expression of Bax.
Sinomenine; K562 cells; bcl-2; bax; apoptosis
R285.5
B
1006-3250(2017)10-1387-04
重庆市基础与前沿研究计划项目(cstc2014jcyjA10049)-构建I型大麻受体真核表达体系制备细胞膜色谱筛选中药中配体的研究;重庆市社会民生科技创新专项细胞色谱筛选新药技术用于中草药研发的示范应用(cstc2016shmszx130028);第二批重庆市高等学校青年骨干教师资助计划项目(2014)
牟凤林(1983-),女,重庆万州人,副教授,医学硕士,从事中药药理研究。
△通讯作者:陈 华(1964-),男,重庆万州人,副教授,医学硕士,从事生物化学研究,Tel:023-58103698,E-mail:2562307586@qq.com。
2017-04-25

