过表达TaGS1/TaGS2对烟草抗盐能力的影响及其机制
贾喜婷,韦一昊,谷明鑫,石爱博,王小纯,
1 河南农业大学 生命科学学院,河南 郑州 450002;
2 河南农业大学 河南粮食作物协同创新中心,河南 郑州 450002
过表达TaGS1/TaGS2对烟草抗盐能力的影响及其机制
贾喜婷1,韦一昊2,谷明鑫1,石爱博1,王小纯1,2
1 河南农业大学 生命科学学院,河南 郑州 450002;
2 河南农业大学 河南粮食作物协同创新中心,河南 郑州 450002
为了阐明提高谷氨酰胺合成酶(GS)活性是否可以提高烟草的耐盐能力,本试验以烟草栽培品种K326为对照,研究TaGS1/TaGS2转基因烟草抗盐能力及其机制。结果表明,盐胁迫条件下,过表达TaGS1/TaGS2烟草与对照相比,根系较发达,烟株生物量较高,TaGS2转基因烟草尤为显著;转基因烟草的叶绿素含量、气孔导度、净光合速率、GS活性、可溶蛋白含量等碳氮代谢功能均显著优于野生型K326;且转基因株系脯氨酸含量及含水量较高,MDA含量较低,叶片渗透调节能力和质膜保护能力比K326强。研究表明TaGS1/TaGS2的过表达提高了烟草的耐盐能力,其高GS活性是维持碳氮代谢抵抗盐胁迫的生理基础。
烟草;GS;转基因;耐盐性
盐碱、干旱、高温、冻害等胁迫环境是限制植物生长发育、影响作物产量的重要因素[1]。我国土壤盐碱化问题很严重,往往由环境污染、不合理灌溉、过量施用化肥等因素引发[2-3]。烟草是重要的模式植物,也是重要的经济作物,提高烟草抗盐能力是提高烟草产量的重要手段之一。因此,研究烟草抗盐机制具有重要的理论意义和应用价值。
脯氨酸作为兼性溶质和渗透保护剂,是植物细胞应对盐胁迫等非生物胁迫产生的最常见的化合物[4]。在盐胁迫条件下,植物组织通过积累脯氨酸减轻过量氨对机体的毒害作用、清除自由基以保护质膜的完整性、调节渗透压防止质膜透性变化,脯氨酸充当植物受胁迫时有效的N、C源和还原剂,但并不干扰细胞代谢[4-7]。
植物脯氨酸的合成有两条途径:一条途径是以谷氨酸(Glu)为底物,经吡咯啉-5-羧酸合成酶(P5CS)和吡咯啉-5-羧酸还原酶(P5CR)等酶的作用合成[8],该合成途径存在于细胞质和叶绿体中[4],且该途径中的谷氨酸主要来源于谷氨酰胺合成酶-谷氨酸合成酶(GS-GOGAT)。另一条途径是以鸟氨酸(Orn)为底物,经鸟氨酸氨基转移酶(OAT)作用合成[9],由于烟草和拟南芥中敲除OAT编码基因对脯氨酸含量没有明显影响[10],因此,该途径仍有争议。在水分胁迫条件下,植物主要通过增强GSGOGAT循环促进以谷氨酸为前体的脯氨酸合成途径,积累脯氨酸以维持机体正常代谢与生长[11]。
植物谷氨酰胺合成酶具有多种同工酶,根据亚细胞定位,分为胞液型谷氨酰胺合成酶(GS1)和质体型谷氨酰胺合成酶(GS2)[12]。GS是植物氮素同化的关键酶[13],催化谷氨酸与NH4+结合产生谷氨酰胺,其活性与脯氨酸累积密切相关。研究表明,添加GS抑制剂,烟草脯氨酸合成受到抑制[14]。烟草GS1反义基因片段Gln1-5转化烟草,其韧皮部GS1表达受到抑制,脯氨酸合成减弱,对盐胁迫敏感[15]。干旱胁迫条件下,百脉根GS2突变体脯氨酸积累和复水能力都低于野生型[16]。因此,植物可能通过提高GS活性来应对盐胁迫和水分胁迫[17-20]
盐胁迫引起的水分胁迫导致无机氮吸收受阻,进而破坏碳、氮代谢平衡[21-22]。GS1参与衰老叶片中氮素转移利用[23-24],GS2参与光呼吸释放出的氨的再同化[25]。因此,提高GS活性有利于实现植物氮素的再利用,从而提高植物抗盐能力。盐胁迫条件下,植物为维持体内水分而关闭气孔,导致细胞二氧化碳浓度减少、光合作用降低。过表达GS2可以提高水稻光合强度和光呼吸强度,增强水稻的抗盐能力[26]。
本研究以烟草栽培品种K326为对照,研究了盐胁迫条件下过表达TaGS1/TaGS2基因对烟草碳氮代谢、脯氨酸积累、膜脂氧化以及生长发育的影响,探究过表达TaGS1/TaGS2基因对烟草抗盐能力的影响及其分子基础,为抗盐及干旱等非生物胁迫品种选育提供理论依据。
1 材料和方法
1.1 材料
烟草品种K326(Nicotiana tabacumL.cv.K326)、过表达TaGS1烟草株系GS1-B和GS1-6-1及过表达TaGS2基因烟草株系GS2-11和GS2-611,转基因烟草均以K326为受体,由本实验室保存。
1.2 烟草幼苗的培养及盐胁迫处理
T2代转基因烟草种子及K326种子用75%酒精消毒4min,然后用6.25%次氯酸钠处理10min,最后用相同体积的无菌水冲洗5次,将转基因烟草种子转入含40mg·L-1潮霉素(Hyg)的MS灭菌培养基中,将K326烟草种子转入MS灭菌培养基中,封口后置于温度为25℃,光照为16 h的培养箱中培养10 d。将烟草幼苗从MS培养基移栽到内径10cm,高度9cm的育苗盆中(营养土和蛭石以1:1.5混匀)每盆5株,培养两周后,将生长一致的烟苗分栽到育苗盆中,每盆1株,继续培养到10片真叶完全展开(苗龄3个月),每个株系分别选取3棵长势均匀一致的烟草进行盐胁迫实验,每2 d用50mL 的300mmol·L-1NaCl溶液浇灌烟草,处理28 d后[27],拍照地上部分形态,并取顶部功能叶进行生理指标测定。烟苗根系清洗后进行拍照。
1.3 光合作用气体交换参数
采用LI-6400便携式光合仪(Li-Cor Inc.,USA)测定净光合速率(Pn,μmol·m-2·s-1),气孔导度(Gs,mmol·m-2·s-1),使用红蓝光源,叶室温度设定为25℃,空气相对湿度为60%,CO2浓度为400 μmol·mol-1,光照强度为l000 μmol·m-2·s-1。各株系随机选取长势一致、生长良好的烟株,测定顶部功能叶片,每隔1 h测定1次,测定5次,取其平均值。
1.4 GS同工酶活性测定
称0.5 g烟草叶片在液氮中研磨成粉,加入1mL提取缓冲液(100mmol·L-1Tris,1mmol·L-1EDTA,1mmol·L-1MgCl2,1mmol·L-1PMFS 和 10mmol·L-1β-巯基乙醇,pH 7.6)研磨成匀浆,转入2mL离心管。于4℃,12000 rpm离心30min,取上清,即为GS酶液。粗酶液与5×上样缓冲液(pH 7.6,25mmol·L-1Tris-HCl,5%(W/V)β-巯基乙醇,0.05%(W/V)溴酚蓝,50%(V/V)甘油)混匀后上样。利用非变性聚丙烯酰胺凝胶电泳系统(3%的浓缩胶和5%的分离胶)分离叶片可溶性蛋白,并进行胶内GS活性染色[28]。
1.5 叶绿素、丙二醛MDA、脯氨酸、可溶蛋白含量
参照鲁燕等的方法测定叶绿素含量[29]、根据Hodges等的方法测定MDA含量[30]、参考Bates等的方法测定脯氨酸含量[31]及参照Bradford等的方法测定可溶蛋白含量[32]。
1.6 数据处理
利用SPSS 20.0对数据进行统计分析,采用Duncan法进行差异显著性检验(P<0.05),结果用平均值±标准差表示。
2 结果与分析
2.1 盐胁迫下TaGS1 /TaGS2过表达对烟草表型的影响
盐胁迫处理前,过表达TaGS1 /TaGS2烟草和K326地上部分表型没有明显差异(图1A),盐胁迫(300mmol·L-1NaCl)处理28 d后,K326叶片严重蜷曲变形,植株矮小且部分叶片出现枯死;过表达TaGS2烟草仅下部叶片失水萎蔫,上部叶片依然正常生长;过表达TaGS1烟草叶片虽表现失水,但明显比野生型高大(图1B)。过表达TaGS1 /TaGS2烟草株系根系比较发达,侧根多且粗壮,GS2-11和GS2-611尤其明显,而野生型烟草根系明显比较弱小,侧根数目较少(图1C)。而且过表达TaGS1 /TaGS2烟草株系株高、地上及地下部干鲜重均显著大于野生型(表1)。此外,过表达TaGS1 /TaGS2烟草含水量均高于野生型(表1)。可见盐胁迫下,K326失水情况严重,生长受到严重抑制;而过表达TaGS1 /TaGS2烟草株系耐盐能力明显强于K326,过表达TaGS2烟草尤为明显。
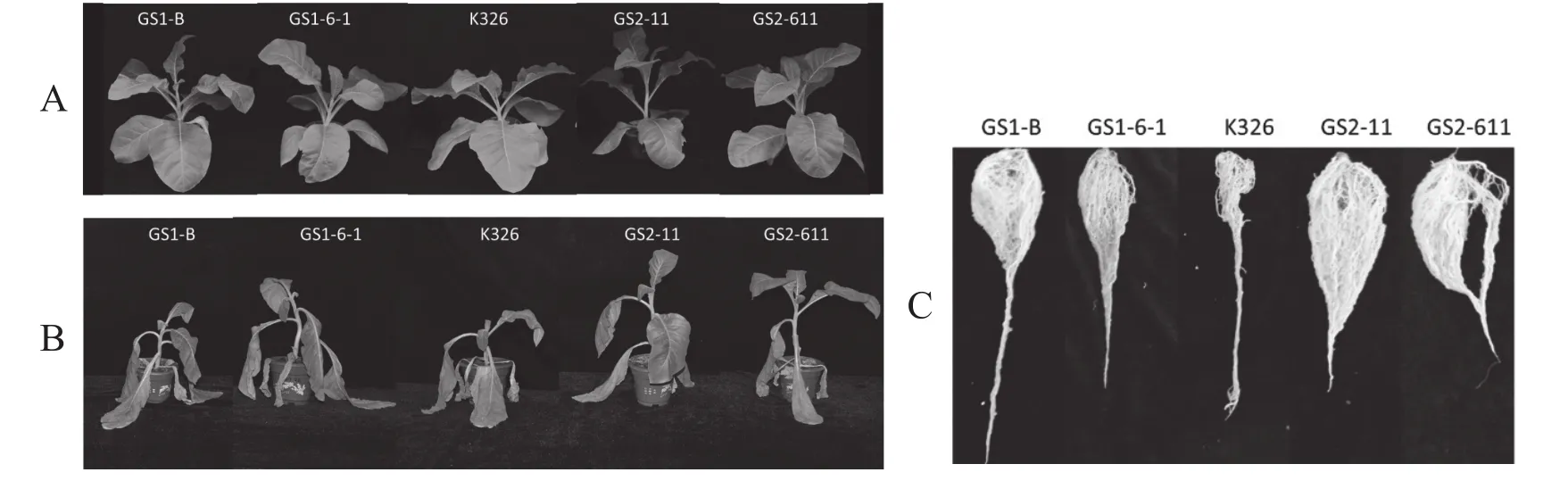
图1 盐胁迫对过表达TaGS1 /TaGS2烟草和K326烟草生长的影响Fig.1 The effects of salt stress on the growth of the overexpressing TaGS1 /TaGS2 tobacco and K326
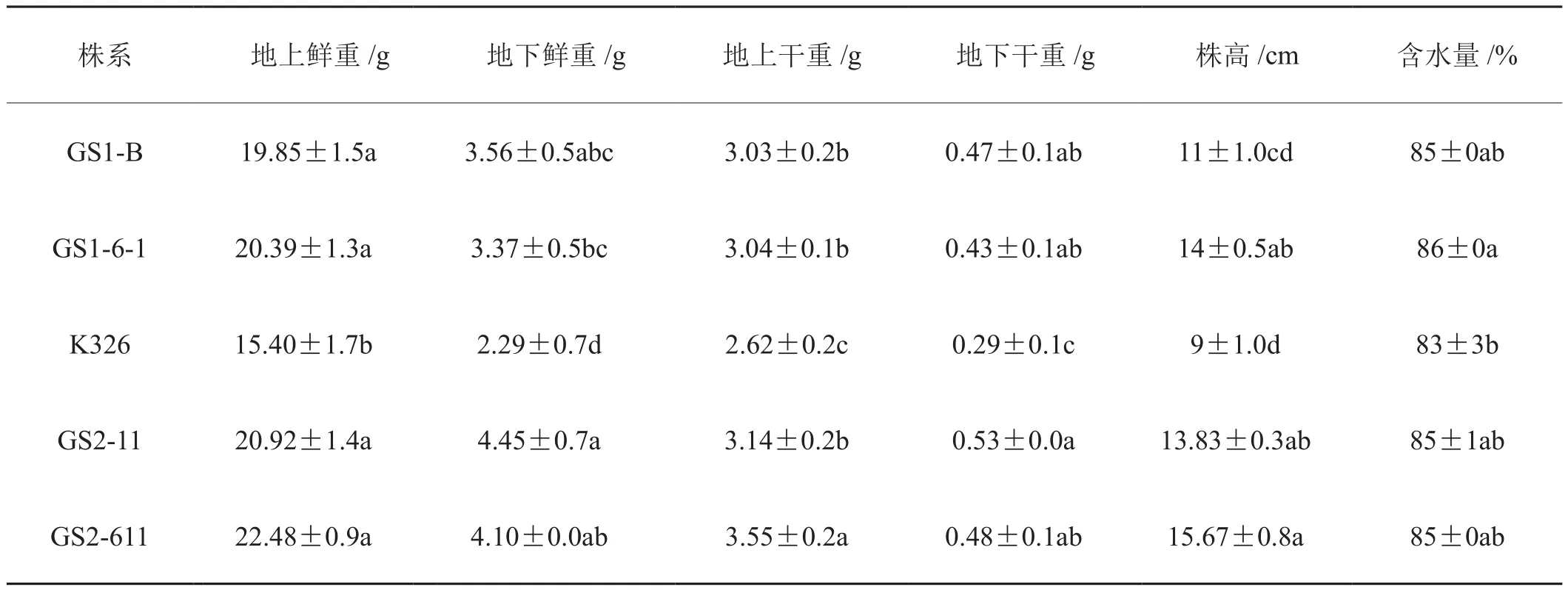
表1 盐胁迫对烟草生物性状的影响Tab.1 The in fluence of salt stress on tobacco biological traits
2.2 盐胁迫下 TaGS1 /TaGS2的过表达对烟草光合特性的影响
光合作用是烟草生长发育的生理基础,叶绿素是植物进行光合作用的主要色素。长时间盐胁迫处理导致叶绿素降解叶片不同程度失绿(图1B),但转基因株系叶绿素含量均高于野生型(图2A)。盐胁迫下,野生型净光合速率为负值,而转基因株系净光合速率均为正值,且显著高于野生型,过表达TaGS1烟草株系净光合速率高于过表达TaGS2烟草(图2B),可能是因为转基因株系气孔导度显著高于K326(图2C)。盐胁迫导致烟草叶片气孔收缩,气孔导度降低,CO2由外界向细胞内扩散的阻力增加,导致 CO2供应减少,光合碳固定的底物减少,从而引起净光合速率下降。转基因株系在盐胁迫下仍能保持相对较高净光合速率和气孔导度,是其耐盐的生理基础。
2.3 盐胁迫下过表达TaGS1 /TaGS2烟草对GS活性及可溶蛋白含量的影响
GS是氮素同化的关键酶,为蛋白质的合成提供原料氨基酸。盐胁迫条件下,TaGS1 /TaGS2转基因烟草的GS活性均高于野生型K326(图3A、B);TaGS1 /TaGS2转基因烟草的可溶蛋白含量也比K326高(图3C)。可见,过表达TaGS1 /TaGS2烟草株系在盐胁迫条件下能够维持较高水平的氮代谢,而可溶蛋白含量高有利于维持高渗透压,防止水分过度散失。
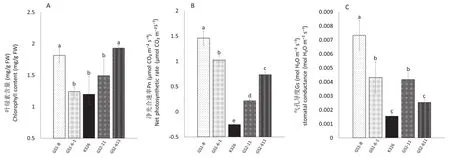
图2 盐胁迫对过表达TaGS1 /TaGS2烟草株系和K326的叶绿素含量和光合特性的影响Fig.2 The effects of salt stress on the chlorophyll content and photosynthetic characteristics of the overexpressing TaGS1 /TaGS2 tobacco and K326
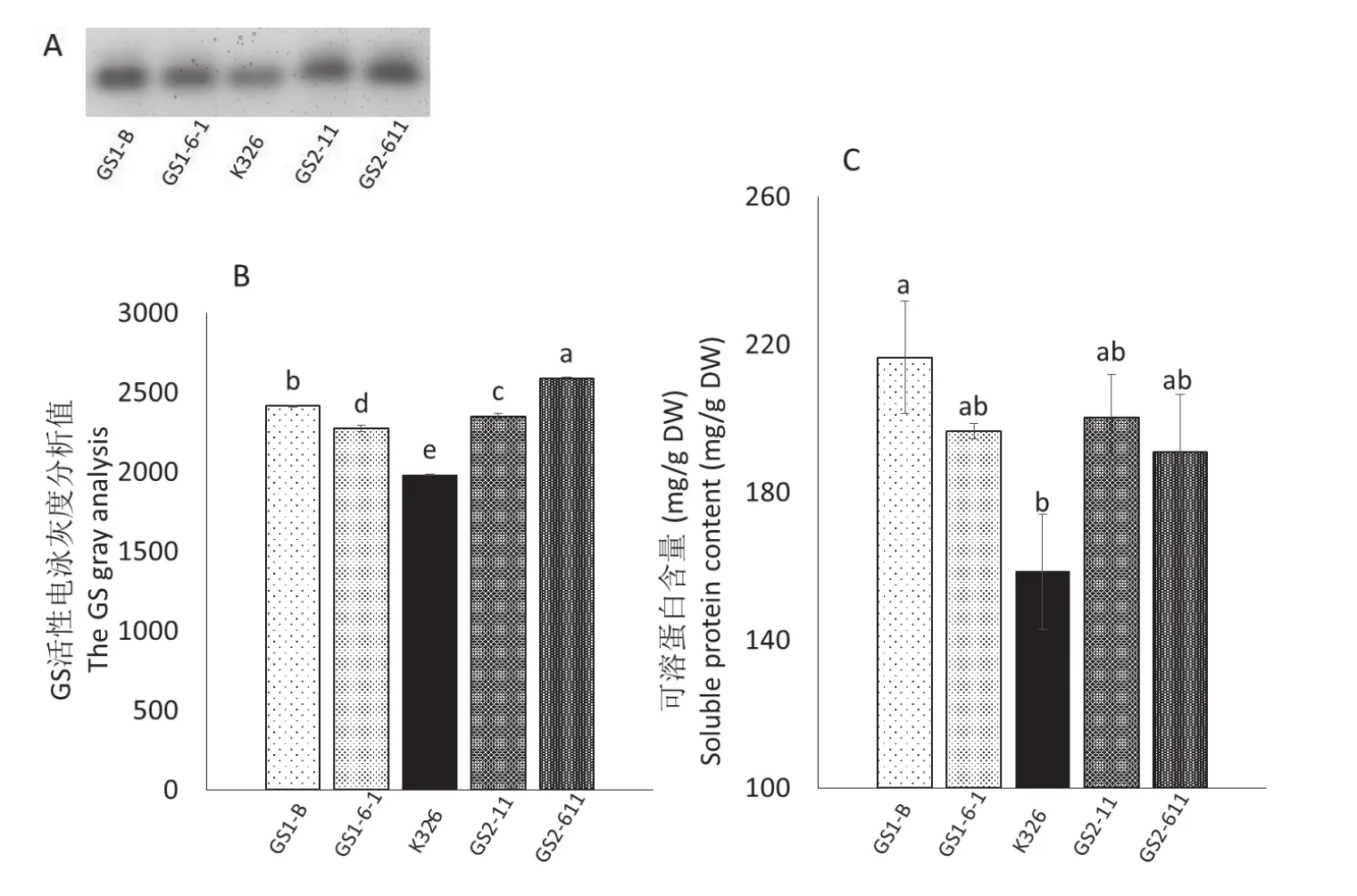
图3 盐胁迫对过表达TaGS1 /TaGS2烟草株系和K326的GS活性及可溶蛋白含量的影响Fig.3 The effects of salt stress on the GS activity and soluble protein content of overexpressing TaGS1 /TaGS2 tobacco and K326
2.4 盐胁迫下TaGS1 /TaGS2过表达对烟草脯氨酸积累和MDA含量的影响
在逆境条件下,植物组织脯氨酸含量是判断其抗逆能力的重要生理指标,丙二醛(MDA)含量是判断膜脂质受损程度的重要指标。从图4可以看出,与K326相比,过表达TaGS1 /TaGS2烟草株系有明显较高的脯氨酸含量,尤其是GS1-B和GS2-611株系脯氨酸含量极显著高于对照;过表达TaGS1 /TaGS2烟草株系MDA含量显著低于对照。可见过表达TaGS1/TaGS2有利于烟草积累脯氨酸,减轻膜脂质受损,提高烟草抗盐胁迫能力。
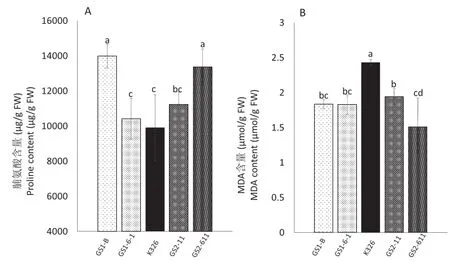
图4 盐胁迫对过表达TaGS1 /TaGS2烟草和K326脯氨酸含量和MDA含量的影响Fig.4 The effects of salt stress on the proline content and MDA content of the overexpressing TaGS1 /TaGS2 tobacco and wild type K326
3 讨论
在盐胁迫条件下,耐盐能力强的植物生长情况相对较好,而耐盐性差的植物,因碳氮代谢严重受阻,导致发育迟滞甚至死亡,因此,可以从植株外观形态判断其抗逆性[33]。本研究首次发现在盐胁迫处理后,转GS基因植物根系发达,营养和水分汲取能力较强,且地上部分生长比K326好,“根深叶茂”可能是其抵御盐胁迫的形态学基础。
在干旱及盐胁迫等逆境条件下,脯氨酸作为渗透调节剂、有效的N、C源和还原剂,能解除氨对机体的毒害及保护质膜的完整性[4,6-7],因此,脯氨酸累积对植物抗逆非常重要[34]。前人研究表明抑制GS酶导致烟叶失水加剧、丙二醛(MDA)含量增加[35],脯氨酸含量降低[14]。本研究发现过表达TaGS1 /TaGS2烟草能显著提高GS活性,在盐胁迫时促进脯氨酸积累,提高可溶性蛋白质含量,保持较高的碳氮代谢活性;而且过表达TaGS1 /TaGS2烟草含水量高,MDA含量低,从而证明GS活性与植物耐盐能力成正相关 。
盐胁迫下,植物渗透压下降,从土壤中吸收无机氮的能力减弱,叶绿素含量下降,叶片开始枯萎,GS1参与衰老叶片中氮素的再转移,维持自身氮素再利用,保持较高的氮代谢[23]。盐胁迫下气孔关闭会使植物体内用于光合作用的二氧化碳减少,影响光合作用,而过表达GS2能提高植物光呼吸能力,为光合作用提供二氧化碳,并参与同化来自光呼吸的氨,从而提高植物光合作用和抗盐能力[26]。本研究显示,过表达TaGS1 /TaGS2烟草在盐胁迫下能显著提高GS活性,促进氮素的转移利用,保持相对较高净光合速率和气孔导度及可溶蛋白含量,这是过表达GS烟草生长良好、抗盐能力优于K326的分子基础。
4 结论
过表达TaGS1 /TaGS2烟草根系强壮、GS活性高,在盐胁迫时能促进脯氨酸积累,提高氮素再利用及光合作用来维持正常生长,积累生物量,从而提高烟草的抗盐能力。
[1]Hare P D,Cress W A,Staden J V.Proline synthesis and degradation:a model system for elucidating stress-related signal transduction[J].Journal of Experimental Botany,1999,50(333):413-434.
[2]苏志学.土壤盐碱化及其防治措施[J].吉林水利,2006,(03):10-12.SU Zhixue.Soil salinization and its control measures[J].Jilin Water Resources,2006,(03):10-12.
[3]周丽萍,戚瑞生.不合理施肥对土壤性质的影响及其防治措施探讨[J].甘肃农业科技,2017,(01):74-78.ZHOU Liping,QI Ruisheng.Effect of unreasonable fertilizer on soil property and its controlling measures[J].Gansu Agricultural Science and Technology,2017,(1):74-78.
[4]Szabados L,Savouré A.Proline:a multifunctional amino acid[J].Trends in Plant Science,2010,15(2):89-97.
[5]Bray E A.Molecular Responses to Water Deficit[J].Plant Physiology,1993,103(4):1035-1040.
[6]Solomon A,Beer S,Waisel Y,et al.Effects of NaCl on the carboxylating activity of Rubisco from Tamarix jordanis in the presence and absence of proline-related compatible solutes[J].Physiologia Plantarum,2006,90(1):198-204.
[7]Verbruggen N,Hermans C.Proline accumulation in plants:a review[J].Amino Acids,2008,35(4):753-759.
[8]Szekely G,Abraham E,Cselo A,et al.Duplicated P5CS genes of Arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis[J].Plant J,2008,53(1):11-28.
[9]Delauney A J,Hu C A,Kishor P B,et al.Cloning of ornithine delta-aminotransferase cDNA from Vigna aconitifolia by transcomplementation in Escherichia coli and regulation of proline biosynthesis[J].The Journal of biological chemistry,1993,268(25):18673-18678.
[10]Funck D,Stadelhofer B,Koch W.Ornithine-delta-aminotransferase is essential for arginine catabolism but not for proline biosynthesis[J].BMC Plant Biology,2008,8(40).
[11]Rhodes D,Handa S,Bressan R A.Metabolic changes associated with adaptation of plant cells to water stress[J].Plant physiology,1986,82(4):890-903.
[12]Bernard S M,Habash D Z.The importance of cytosolic glutamine synthetase in nitrogen assimilation and recycling[J].New Phytologist,2009,182(3):608-620.
[13]Tsai Y C,Kao C H.Light-Dependent Ammonium Ion Toxicity of Rice Leaves in Response to Phosphinothricin Treatment[J].Biologia Plantarum,2002,45(4):569-573.
[14]Larher F,Aziz A,Deleu C,et al.Suppression of the osmoinduced proline response of rapeseed leaf discs by polyamines[J].Physiologia Plantarum,1998,102(1):139–147.
[15]Brugière N,Dubois F,Limami A M,et al.Glutamine Synthetase in the Phloem Plays a Major Role in Controlling Proline Production[J].Plant Cell,1999,11(10):1995-2012.
[16]Díaz P,Betti M,Sánchez D H,et al.Deficiency in plastidic glutamine synthetase alters proline metabolism and transcriptomic response in Lotus japonicus under drought stress[J].New Phytol ,2010,188(4):1001-1013.
[17]Berteli F,Corrales E,Guerrero C,et al.Salt stress increases ferredoxindependent glutamate synthase activity and protein level in the leaves of tomato[J].Physiologia Plantarum,1995,93(2):259–264.
[18]Bauer D,Biehler K,Fock H,et al.A role for cytosolic glutamine synthetase in the remobilization of leaf nitrogen during water stress in tomato[J].Physiologia Plantarum,2006,99(2):241-248.
[19]Borsani O,DıAz P,Agius M A F,et al.Water stress generates an oxidative stress through the induction of a specific Cu/Zn superoxide dismutase in Lotus corniculatus leaves[J].Plant Science,2001,161(4):757-763.
[20]Díaz P,Borsani O,Márquez A,et al.Osmotically Induced Proline Accumulation in Lotus Corniculatus Leaves is A ff ected by Light and Nitrogen Source[J].Plant Growth Regulation,2005,46(3):223-232.
[21]Foyer C H,Valadier M,Migge A,et al.Drought-Induced E ff ects on Nitrate Reductase Activity and mRNA and on the Coordination of Nitrogen and Carbon Metabolism in Maize Leaves[J].Plant Physiology,1998,117(1):283-292.
[22]Xu Z Z,Zhou G S.Combined effects of water stress and high temperature on photosynthesis,nitrogen metabolism and lipid peroxidation of a perennial grass Leymus chinensis[J].Planta,2006,224(5):1080-1090.
[23]Avila-Ospina L,Masclaux-Daubresse C.Autophagy,plant senescence,and nutrient recycling[J].Journal of Experimental Botany,2014,65(14):3799-3811.
[24]Guan M,Møller I S,Schjoerring J K.Two cytosolic glutamine synthetase isoforms play specific roles for seed germination and seed yield structure in Arabidopsis[J].Journal of Experimental Botany,2014,66(1):203-212.
[25]Keys A J.The re-assimilation of ammonia produced by photorespiration and the nitrogen economy of C3 higher plants[J].Photosynthesis Research,2006,87(2):165-175.
[26]Hoshida H,Tanaka Y,Hibino T,et al.Enhanced tolerance to salt stress in transgenic rice that overexpresses chloroplast glutamine synthetase[J].Plant Molecular Biology,2000,43(1):103-111.
[27]Huda K M,Banu M S,Garg B,et al.OsACA6,a P-type IIB Ca2+ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stressresponsive genes[J].Plant Journal for Cell & Molecular Biology,2013,76(6):997 -1015.
[28]Wang X,Wei Y,Shi L,et al.New isoforms and assembly of glutamine synthetase in the leaf of wheat(Triticum aestivum L.)[J].Journal of Experimental Botany,2015,66(21):6827-6834.
[29]鲁燕,徐兆师,张瑞越,等.W6基因的过表达提高转基因烟草的耐盐性[J].作物学报,2008,34(6):984-990.LU Yan,XU Zhaoshi,ZHANG Ruiyue,et al.Overexpression of W6 gene increases salt tolerance in transgenic tobacco plants[J].Acta agronomica sinica,2008,34(6):984-990.
[30]Hodges D,Forney C,Prange R,Jm.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207(4):604-611.
[31]Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies[J].Plant and Soil,1973,39(1):205-207.
[32]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72(s 1–2):248-254.
[33]徐鲜钧,沈宝川,祁建民.植物耐盐性及其生理生化指标的研究进展[J].亚热带农业研究,2007,3(4):275-80.XU Xianjun,SHEN Baochuan,QI Jianmin.Advances in study of salt-stress tolerance and its physiological and biochemical indices in plants[J].Subtropical Agriculture Research,2007,3(4):275-280.
[34]Reddy A R,Chaitanya K V,Jutur P P,et al.Differential antioxidative responses to water stress among five mulberry( Morus alba L.)cultivars[J].Environmental & Experimental Botany,2004,52(1):33-42.
[35]刘化冰,何文苗,尚晓颍,等.谷氨酰胺合成酶抑制剂对烤烟烘烤特性的影响[J].西北植物学报,2015,35(3):553-557.LIU Huabing,HE Wenmiao,SHANG Xiaoying,et al.Effects of glutamine synthetase inhibitor to flue-cured tobaccos curing characteristics[J].Acta Botanica Boreali-Occidentalia Sinica,2015,35(3):553-557.
E ff ects of overexpressingTaGS1/TaGS2on tobacco salt tolerance and its mechanism
JIA Xiting1,WEI Yihao2,GU Mingxin1,SHI Aibo1,WANG Xiaochun1,2*
1 College of Life Science,Henan Agricultural University,Zhengzhou 450002,China;
2 Collaborative Innovation Center of Henan Grain Crops,Henan Agricultural University,Zhengzhou 450002,China
In order to clarify that the increase of glutamine synthetase(GS)activity can improve salt tolerance in tobacco,this paper took cultivar tobacco K326 as control and studiedTaGS1/TaGS2transgenic tobacco salt tolerance and its mechanism.Results showed that under salt stress,TaGS1/ TaGS2transgenic tobaccos,especially TaGS2 transgenic tobacco,had stronger root system and higher biomass than K326,and its ability to resist salt was superior to K326.TaGS1/TaGS2transgenic tobacco had better carbon and nitrogen metabolism with higher chlorophyll content,stomatal conductance,net photosynthetic rate,GS activity,and soluble protein content.Content of proline and water ofTaGS1/TaGS2transgenic tobaccos were higher than that of K326,while content MDA ofTaGS1/ TaGS2transgenic tobaccos were lower than that of K326.Hence TaGS transgenic tobacco had stronger leaf osmotic regulation ability and plasma membrane protection ability.It was concluded that overexpression ofTaGS1/TaGS2could improve salt tolerance in tobacco,and its higher GS activity was the physiological basis to maintain high carbon and nitrogen metabolism and resistance to salt stress.
tobacco; GS; transgene; salt tolerance

贾喜婷,韦一昊,谷明鑫,等.过表达TaGS1/TaGS2对烟草抗盐能力的影响及其机制[J].中国烟草学报,2017,23(5)
国家重点研发计划支持项目(2016YFD0300205);河南省现代农业产业技术体系(S2010-01-G04)
贾喜婷(1992—),硕士,主要从事烟草抗逆研究,Email:xitingjia_005@163.com
王小纯(1966—),教授,硕士生导师,主要从事分子生物学研究,Email:xiaochun.w@163.com
2017-05-02;< class="emphasis_bold">网络出版日期:
日期:2017-09-23
:JIA Xiting,WEI Yihao,GU Mingxin,et al.E ff ects of overexpressingTaGS1/TaGS2on tobacco salt tolerance and its mechanism[J].Acta Tabacaria Sinica,2017,23(5)
*Corresponding author.Email:xiaochun.w@163.com

