葡萄糖依诺沙星注射液的异常毒性检查与体外溶血反应研究
翁鹭娜,宋婧,洪颖,张盈(.厦门市食品药品质量检验研究院,福建厦门60;.厦门大学实验动物中心,福建厦门6005;.福建省食品药品质量检验研究院,福州5000)
葡萄糖依诺沙星注射液的异常毒性检查与体外溶血反应研究
翁鹭娜1*,宋婧2,洪颖1,张盈3(1.厦门市食品药品质量检验研究院,福建厦门361012;2.厦门大学实验动物中心,福建厦门361005;3.福建省食品药品质量检验研究院,福州350001)
目的:对葡萄糖依诺沙星注射液进行异常毒性检查和体外溶血反应研究,为其安全用药提供参考。方法:根据2015年版《中国药典》(二部)附录中“异常毒性检查法”,使用小鼠进行葡萄糖依诺沙星注射液半数致死量(LD50)的测定和异常毒性限值的设定。根据2015年版《中国药典》(二部)附录中“溶血与凝聚检查法”,使用兔血进行体外溶血和凝聚反应的研究。结果:测得葡萄糖依诺沙星注射液对小鼠的LD50为248.9 mg/kg,其异常毒性检查项设定的限值为28.4 mg/kg,按此限值检查结果均符合相关规定。以临床最大剂量(0.2 g/100 mL)进行溶血与凝聚反应的检查结果均符合规定。结论:为减少临床不良反应和确保质量标准的可行性,葡萄糖依诺沙星注射液的异常毒性检查限值应设定为28.4 mg/kg。
葡萄糖依诺沙星注射液;异常毒性;溶血反应;体外
依诺沙星属于第三代氟喹诺酮类抗菌药物,具有抗菌谱广、抗菌能力强、体内吸收分布广等特点[1],在临床上广泛用于敏感菌所致的咽喉、支气管、肺、尿路、前列腺等部位感染[2-4]。但由于依诺沙星具有光敏毒性,作为注射液静脉给药时易引起患者皮肤红肿、疼痛等,严重时易引起静脉炎[5-6],因此根据国家药品计划抽验《国家药品计划抽验项目任务书》对于依诺沙星注射液质量标准提高工作的要求,笔者重新考察了依诺沙星注射液的异常毒性,并对其体外溶血反应进行了研究,初步评价依诺沙星注射液的安全性,以期为其临床使用提供参考。
1 材料
1.1 药品与试剂
葡萄糖依诺沙星注射液(国内A公司,共11批,对应批号、规格详见表1);5%葡萄糖注射液(浙江国境药业有限公司,批号:B14052702,规格:250 mL∶12.5 g);0.9%氯化钠注射液(江西科伦药业有限公司,批号:B130127G2,规格:100 mL∶9 g)。

表1 葡萄糖依诺沙星注射液的批号、规格Tab1 Specifications,batch number of Gluconate enoxacin injection
1.2 动物
普通级新西兰兔,♀,体质量2~3 kg,购自上海市松江区松联实验动物场,动物生产许可证号为SCXK(沪)2012-0011;SPF级ICR小鼠,♀♂各半,体质量18~22 g,购自上海斯莱克实验动物有限责任公司,动物生产许可证号为SCXK(沪)2012-0002。
2 方法与结果
2.1 异常毒性检查
2.1.1 半数致死量(LD50)的测定取小鼠50只,分成5组,以序号命名,每组10只,♀♂各半,实验前禁食6 h,自由饮水。根据预实验结果确定依诺沙星的LD50范围,以5%葡萄糖注射液为溶剂制备质量浓度分别为17.5、14.9、12.6、10.7、9.1 mg/mL的葡萄糖依诺沙星注射液溶液。各组小鼠尾iv上述不同质量浓度的葡萄糖依诺沙星注射液溶液,给药体积均为0.02 mL/g。严密观察给药后72 h内小鼠的反应及死亡情况,记录死亡只数[7-8]。结果显示,给药后部分小鼠出现呼吸急促、四肢抽搐的中毒症状,其中26只小鼠给药后1 min内惊厥死亡,剩余小鼠继续观察。第2天后,剩余小鼠情况良好,活动自如。按Bliss法计算葡萄糖依诺沙星注射液对小鼠的LD50为248.9 mg/kg,95%置信区间为227.0~272.9 mg/kg。葡萄糖依诺沙星注射液的小鼠LD50测定结果见表2。

表2 葡萄糖依诺沙星注射液的小鼠LD50测定结果Tab2 Determination results of LD50value of Gluconate enoxacin injection for mice
2.1.2 异常毒性检查限值的设定及异常毒性检查将葡萄糖依诺沙星注射液的LD50置信区间下限的1/8剂量(28.4 mg/kg)设定为该注射液的异常毒性检查限值[7]。取小鼠60只,随机分成12组,以序号命名,每组5只,♀♂各半,给药剂量均为28.4 mg/kg,分别尾iv终质量浓度为1.1 mg/mL的11批葡萄糖依诺沙星注射液溶液,并设5只尾iv 5%葡萄糖注射液的小鼠作为空白对照组,给药体积为每只0.5 mL。给药后即时观察各组小鼠反应情况,严密观察并记录各组小鼠给药后48 h内的反应、死亡情况和体质量变化。结果显示,小鼠外观、精神状态、行为活动、摄食、大小便、毛色和呼吸等均未见异常,鼻、眼、口腔均无异常分泌物,直至实验结束时,各组小鼠均未死亡;与空白对照组比较,各给药组小鼠均无异常反应,体质量均无明显变化(P>0.05),解剖观察其内脏器官未见异常病变,具体结果见表3。
2.1.3 临床最大剂量的异常毒性检查参照葡萄糖依诺沙星注射液说明书,以临床最大剂量进行异常毒性检查,考察其临床用量安全性。参照葡萄糖依诺沙星注射液说明书,重症患者最大剂量每日不超过0.6 g,以成人体质量70 kg计算,则重症患者每日最大剂量不超过8.6 mg/kg,根据人和小鼠的等效剂量比率,则小鼠每日最大剂量不超过78 mg/kg[8]。按“2.1.2”项下方法分组、给药,给药剂量改为78 mg/kg,另外不设立空白对照组。结果显示,给药后所有小鼠约在1 min内出现呼吸急促、活动减少的现象,之后恢复正常;部分小鼠在给药后48 h内出现尾部坏死现象;实验结束时,全部小鼠均未死亡,具体结果见表4。为了分析毒性与注射液中杂质的关系,笔者按2015年版《中国药典》(四部)中相关方法[7]检测了11批葡萄糖依诺沙星注射液的D-葡萄糖酸-δ-内酯含量,结果见表4。
表3 葡萄糖依诺沙星注射液的异常毒性检查结果(注射剂量为28.4 mg/kg,±s,n=5)Tab3 Results of abnormal toxicity test for Gluconate enoxacin injection(injection dosage of 28.4mg/kg,±s,n=5)

表3 葡萄糖依诺沙星注射液的异常毒性检查结果(注射剂量为28.4 mg/kg,±s,n=5)Tab3 Results of abnormal toxicity test for Gluconate enoxacin injection(injection dosage of 28.4mg/kg,±s,n=5)
组别空白对照组1组2组3组4组5组6组7组8组9组10组11组药物5%葡萄糖注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液葡萄糖依诺沙星注射液批号B14052702 3130801 3131101 3131102 3130301 3130701 3130702 3130901 3131201 3131202 3130902 3130802规格250 mL∶2.5 g 2 mL∶0.1 g 2 mL∶0.1 g 2 mL∶0.1 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g小鼠体质量,g给药前19.7±0.5 20.0±0.4 19.9±0.2 19.4±0.3 19.6±0.2 20.1±0.4 19.7±0.5 20.2±0.3 19.9±0.5 20.4±0.4 19.9±0.3 19.5±0.4给药后21.1±0.3 21.0±0.5 21.1±0.4 20.6±0.4 20.8±0.3 21.3±0.6 21.0±0.3 21.5±0.5 21.6±0.4 21.7±0.6 21.1±0.4 20.5±0.5
表4 葡萄糖依诺沙星注射液临床最大剂量的异常毒性检查结果(注射剂量为78 mg/kg,±s,n=5)Tab4 Results of abnormal toxicity test for Gluconate enoxacin injection of clinical maximum dose(injection dosage of 78 mg/kg,±s,n=5)

表4 葡萄糖依诺沙星注射液临床最大剂量的异常毒性检查结果(注射剂量为78 mg/kg,±s,n=5)Tab4 Results of abnormal toxicity test for Gluconate enoxacin injection of clinical maximum dose(injection dosage of 78 mg/kg,±s,n=5)
小鼠体质量,g组别批号规格反应情况1组2组3组4组5组6组7组8组9组10组11组3130801 3131101 3131102 3130301 3130701 3130702 3130901 3131201 3131202 3130902 3130802 2 mL∶0.1 g 2 mL∶0.1 g 2 mL∶0.1 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g 5 mL∶0.2 g D-葡萄糖酸-δ-内酯含量,%2.7 3.6 2.7 2.6 3.0 2.2 2.7 4.3 2.7 2.6 2.5给药前19.6±0.2 19.5±0.2 19.7±0.1 19.8±0.1 19.8±0.1 19.6±0.1 19.7±0.1 19.6±0.3 19.7±0.1 19.7±0.1 19.7±0.1给药后21.0±0.2 20.6±0.1 20.7±0.1 21.1±0.2 21.1±0.2 20.8±0.1 21.1±0.1 20.9±0.4 21.2±0.2 21.3±0.2 21.2±0.2 5只均呼吸急促、活动减少,其中2只尾部坏死5只均呼吸急促、活动减少,其中2只尾部坏死5只均呼吸急促、活动减少,其中1只尾部坏死5只均呼吸急促、活动减少5只均呼吸急促、活动减少,其中2只尾部坏死5只均呼吸急促、活动减少5只均呼吸急促、活动减少,其中1只尾部坏死5只均呼吸急促、活动减少,其中2只尾部坏死5只均呼吸急促、活动减少5只均呼吸急促、活动减少5只均呼吸急促、活动减少
2.2 体外溶血与凝聚检查
[7,9]方法,以兔血进行体外溶血和凝聚试验。取洁净试管5只,编号:1、2号管为供试品管,3号管为阴性对照管,4号管为阳性对照管,5号管为供试品对照管。按表5所示依次加入2%红细胞混悬液、0.9%氯化钠注射液、蒸馏水和葡萄糖依诺沙星注射液(按每0.2 g加入到5%葡萄糖注射液100 mL内溶解),混匀后,立即置于(37±0.5)℃的恒温箱中进行温育,3 h后观察各试管的溶血和凝聚反应情况。结果显示,3号管无溶血和凝聚发生,红细胞全部下沉,上清液无色澄明;4号管有溶血发生,溶液呈澄明红色,管底无细胞残留;5号管没有加入红细胞,所以溶液澄清透明无色;1、2号管3 h内均未发生溶血和凝聚,故以临床用药浓度(0.2 g/100 mL)作为限值浓度。体外溶血和凝聚试验结果见表6(表中,“+”表示溶血或凝聚,“-”表示不溶血或不凝聚)。
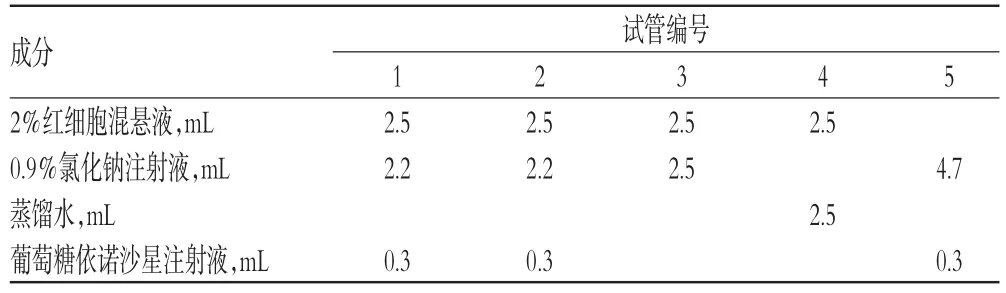
表5 体外溶血和凝聚试验设计Tab5 Design for in vitro hemolysis and agglomeration test
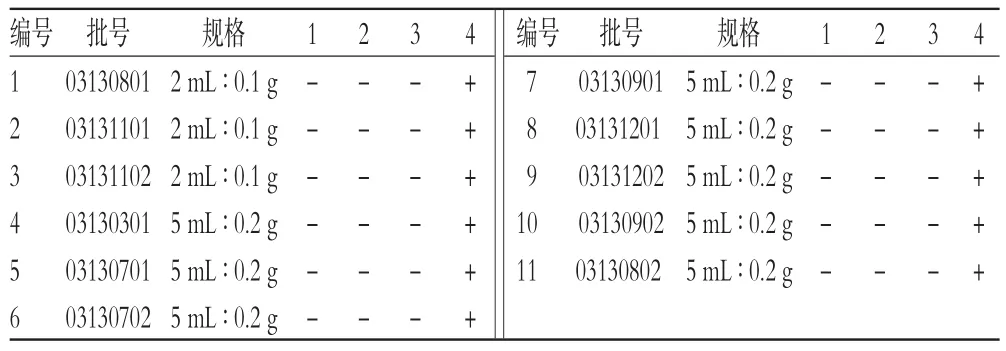
表6 体外溶血和凝聚试验结果Tab6 Results of in vitro hemolysis and agglomeration test
3 讨论
3.1 建议异常毒性检查限值为28.4 mg/kg
本实验通过测定葡萄糖依诺沙星注射液对小鼠的LD50,设定其异常毒性检查限值。首先,将LD50可信限下限1/8剂量(28.4 mg/kg)设定为该注射液异常毒性检查限值,该剂量下各给药组小鼠均无异常反应,且实验结束时体质量增加,说明设定的异常毒性检查限值28.4 mg/kg是安全可靠的。其次,以临床最大给药剂量78 mg/kg进行异常毒性检查,给药后1 min内异常毒性反应明显,虽然1 min之后小鼠恢复正常,无死亡现象,但仍表明该剂量使用存在安全隐患。从表4结果可知,内酯含量越高,出现异常毒性反应越明显,部分小鼠尾部出现坏死现象,推测可能与该注射液会产生静脉炎副作用有关。D-葡萄糖酸-δ-内酯是该注射液中的唯一辅料,提示该注射液中引起异常毒性反应的物质可能是辅料D-葡萄糖酸-δ-内酯或及其相关的代谢产物,且异常毒性反应与内酯含量呈正相关性。为使依诺沙星注射液质量标准提高后的质量标准切实可行,建议将该品种的异常毒性检查限值设置为28.4 mg/kg。
3.2 溶血和凝聚反应检查限值为临床用药浓度
本试验对11批葡萄糖依诺沙星注射液进行了体外溶血和凝聚检查。结果表明,11批样品在3 h内均未发生溶血和凝聚反应,但是第8组样品(批号:03131201,规格:5 mL∶0.2 g)在2 h后出现红细胞悬液颜色加深现象。表4结果显示,第8组样品在11批样品中D-葡萄糖酸-δ-内酯含量最高(4.3%),而其他批次样品D-葡萄糖酸-δ-内酯含量均低于4%,且在观察时间3 h内均未出现异常。这提示葡萄糖依诺沙星注射液杂质含量的高低可能对其溶血和凝聚性存在影响。但由于缺少药动学方面的研究资料,尚不知晓葡萄糖依诺沙星注射液静脉给药后,是以原型还是依诺沙星与D-葡萄糖酸-δ-内酯形成的复合物入血,同时也不了解相应物质在体内的血药峰浓度、血浆蛋白结合率以及消除半衰期,因此无法判断药液使红细胞悬液颜色变深是否对临床用药安全性存在影响。在试验过程中笔者仅对1家企业生产的葡萄糖依诺沙星注射液进行了研究,缺乏代表性,尚不具有普遍意义。另一方面本品的原液具有溶血作用,最终确定的溶血和凝聚反应检查限值为临床用药浓度(0.2 g/100 mL),以其进行静脉注射用药,可以达到《注射剂安全性指导原则》中的要求。
3.3 依诺沙星注射液毒性研究需要进一步深入
药品上市后再评价是对已批准的药品在社会人群中的疗效、不良反应、用药方案以及药物稳定性、药物经济学等方面进行科学评估。药物的活性成分及其代谢产物、辅料、有关物质及其理化性质(如pH值、渗透压等)均有可能引起毒性反应以及溶血和凝聚的发生[10-13]。目前,对葡萄糖依诺沙星注射液的毒性研究缺少深度,主要集中在对综述、不良反应病例的报道和分析层面,而对其毒性深入研究甚少。因此,探寻解决葡萄糖依诺沙星注射液不良反应的应对措施迫在眉睫,且有很大的应用价值。本试验不仅为依诺沙星进一步结构改造、降低毒性及不良反应提供了依据,更有助于降低依诺沙星注射液临床使用中的风险,确保患者的用药安全。
参考文献
[1] 贾博奇,鲁云兰.现代临床实用药物手册[M].2版.北京:北京医科大学出版社,2001:489-497.
[2] 刘栋,汤长明.葡萄糖依诺沙星注射液无菌检查方法的建立及验证[J].中国药房,2015,26(9):1263-1265.
[3] Appelbaum PC,Hunter PA.The fluoroquinolone antibacterials:past,present and future perspectives[J].Int J Antimicrob Ag,2000,16(1):5-15.
[4] Czyrski A.Analytical methods for determining third and fourthgenerationluoroquinolones[J].Chromatographia,2017,80(2):181-200.
[5] 高丽云,闵简书,岳建国.输液配伍中值得注意的问题[J].中国药学杂志,2002,37(2):149-150.
[6] 李勇,陈小波.葡萄糖酸依诺沙星注射液的疗效、不良反应和配伍禁忌[J].临床医药文献杂志,2016,3(9):5912-5916.
[7] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:59-61、153、159.
[8] 徐淑云.药理实验方法学[M].北京:人民卫生出版社,1982:400-405、1184.
[9] 中国药品生物制品检定所.中国药品检验操作规范[S].北京:中国医药科技出版社,2010:429-430.
[10] 颜敏,吴晔,王兰明,等.药品上市后再评价工作的现状与思考[J].中药新药杂志,1999,8(7):433-436.
[11] 班雅倩,常新义,袁晓龙,等.对我国药品上市后再评价工作的文献分析[J].中国药房,2014,25(9):859-862.
[12] 姚静.药用辅料应用指南[M].北京:中国医药科技出版社,2011:5-8.
[13] 谢华,袁海玲,陈玉芳,等.含辅料注射剂的临床合理用药[J].中国现代应用药学,2016,33(4):488-492.
Abnormal Toxicity Test and Study on the in vitro Hemolytic Reaction of Gluconate Enoxacin Injection
WENG Luna1,SONG Jing2,HONG Ying1,ZHANG Ying(31.Xiamen Institute for Food and Drug Quality Control,Fujian Xiamen 361012,China;2.Laboratory Animal Center of Xiamen University,Fujian Xiamen 361005,China;3.Fujian Institute for Food and Drug Quality Control,Fuzhou 350001,China)
OBJECTIVE:To conduct the abnormal toxicity test and study on the in vitro hemolytic reaction of Gluconate enoxacin injection,and provide reference for its safe use.METHODS:According to“Test for Abnormal Toxicity”in Chinese Pharmacopoeia(2015 edition,Vol.Ⅱ),half lethal dose(LD50)of Gluconate enoxacin injection and setting of abnormal toxicity limit were carried out in mice.According to“Test for Haemolysis and Agglomeration”in Chinese Pharmacopoeia(2015 edition,Vol.Ⅱ),study for the in vitro hemolytic and agglomeration reaction was carried out in rabbits.RESULTS:The LD50of Gluconate enoxacin injection for mice was 248.9 mg/kg;the setting limit of abnormal toxicity test was 28.4 mg/kg,and the results derived from the test using this limit met requirements.The haemolysis and agglomeration results derived from the test using clinical maximum concentration(0.2 g/100 mL)met requirements.CONCLUSIONS:In order to reduce the clinical ADR and feasibility of ensuring quality standard,the abnormal toxicity limit of Gluconate enoxacin injection should be set as 28.4 mg/kg.
Gluconate enoxacin injection;Abnormal toxicity;Hemolysis reaction;in vitro
R927
A
1001-0408(2017)31-4398-03
DOI 10.6039/j.issn.1001-0408.2017.31.20
*副主任药师。研究方向:药理毒理学检验。电话:0592-5619827。E-mail:lnwyjyl@163.com
2017-03-16
2017-08-17)
(编辑:邹丽娟)

