土木香乙酸乙酯提取物对人胰腺癌Capan-2细胞增殖的抑制作用及机制研究Δ
王霖玲,曾健梅,阎优优,张博,林能明,#(.浙江中医药大学附属杭州第一医院转化医学研究中心,杭州30006;.杭州市第一人民医院/南京医科大学附属杭州医院转化医学研究中心,杭州30006)
土木香乙酸乙酯提取物对人胰腺癌Capan-2细胞增殖的抑制作用及机制研究Δ
王霖玲1*,曾健梅1,阎优优2,张博2,林能明1,2#(1.浙江中医药大学附属杭州第一医院转化医学研究中心,杭州310006;2.杭州市第一人民医院/南京医科大学附属杭州医院转化医学研究中心,杭州310006)
目的:研究土木香乙酸乙酯提取物(IHE)对人胰腺癌Capan-2细胞增殖的抑制作用及机制。方法:采用MTT法测定0、0.5、1、2、4、8 μg/mL的IHE作用48 h后细胞的增殖抑制率,克隆形成试验观察0、1、2 μg/mL的IHE作用1周后对细胞克隆形成的影响,Hoechst 33342染色法观察0、2、4 μg/mL的IHE作用48 h后细胞核形态的变化,流式细胞术检测0、4、8、16 μg/mL的IHE作用48 h后细胞的凋亡率,JC-1染色法观察0、4、8、16 μg/mL的IHE作用24 h后细胞线粒体膜电位变化,Western blot法检测0、4、8、16 μg/mL的IHE作用48 h后细胞线粒体凋亡相关蛋白Bcl-2、Bax、Mcl-1和p53上调凋亡因子(PUMA)、多聚二磷酸腺苷核糖聚合酶(PARP)蛋白的表达。结果:2、4、8 μg/mL的IHE对细胞的增殖有明显抑制作用,且呈浓度依赖性,半数抑制浓度为6.6 μg/mL;1、2 μg/mL的IHE可明显抑制细胞的克隆形成;4 μg/mL的IHE可明显造成细胞核固缩;8、16 μg/mL的IHE可明显促进细胞凋亡,16μg/mL的IHE作用48 h后细胞凋亡率达到45.53%;16 μg/mL的IHE作用24 h后可引起82.47%的细胞线粒体膜电位下降;8 μg/mL的IHE可明显下调细胞中Bcl-2、Mcl-1、PUMA、PARP蛋白表达,16 μg/mL的IHE可明显下调细胞中Mcl-1、PUMA表达。结论:IHE可能通过引起细胞线粒体膜电位的下降,下调细胞中PUMA、Mcl-1蛋白的表达,引起细胞的凋亡,从而发挥其抑制人胰腺癌Capan-2细胞增殖的作用。
土木香;乙酸乙酯提取物;人胰腺癌Capan-2细胞;线粒体;细胞凋亡
胰腺癌是恶性程度最高的肿瘤之一,预计在2030年将成为病死率第二高的恶性肿瘤[1]。由于大多数胰腺癌患者确诊时已处于晚期,失去了手术机会,因此全身化疗对于晚期胰腺癌患者来说显得至关重要。尽管已有大量的研究致力于开发抗胰腺癌药物,但胰腺癌患者的5年生存率在过去40年没有明显提高,仍低于5%[2]。我国中药资源丰富,尚有许多具有抗肿瘤活性的天然药物仍处于开发阶段。土木香系菊科旋覆花属植物,为多年生草本,其根供药用,具有健胃、利尿和驱虫的功效[3]。有研究表明,土木香的醇提取物中富含倍半萜内酯类成分,而该类成分具有较强的抗肿瘤活性,对头颈部鳞状细胞癌、成胶质细胞瘤、前列腺癌等具有明显的细胞毒作用,但对胰腺癌的作用尚不明确[4]。本研究在获得土木香醇提取物的基础上[5-6],进一步用乙酸乙酯萃取,得到了富含倍半萜内酯类成分的土木香乙酸乙酯提取物(Inula helenium ethyl acetate extract,IHE),并探讨IHE对人胰腺癌Capan-2细胞增殖的抑制作用及机制。
1 材料
1.1 仪器
FACSCantoⅡ型流式细胞仪(美国BD公司);SpectraMax M3型全波长多功能酶标仪(美国Molecular Devices公司);高速冷冻离心机(美国Thermo Fisher公司);Microsystems CMS GmbH Am Friendensplatz 3型荧光显微镜(德国Leica公司);ChemiDoc XRS+型凝胶成像系统(美国Bio-Rad公司)。
1.2 药品与试剂
RPMI 1640培养基、胎牛血清(美国Gibco公司);胰蛋白酶-EDTA消化液(0.25%)、MTT(北京索莱宝科技有限公司);荧光素异硫氰酸(FITC)标记的膜联蛋白Ⅴ(AnnexinⅤ-FITC)/碘化丙啶(PI)凋亡检测试剂盒(美国BD公司,批号:6119908);线粒体膜电位检测试剂盒(美国SAB公司,批号:H16);Hoeschst 33258染色液(碧云天生物技术研究所);兔源B细胞白血病2(Bcl-2)、Bax、p53上调凋亡因子(PUMA)、髓样细胞白血病1(Mcl-1)、多聚二磷酸腺苷核糖聚合酶(PARP)单克隆抗体和鼠源β-肌动蛋白(β-actin)单克隆抗体(美国Abcam公司);辣根过氧化酶(HRP)标记的二抗(武汉艾美捷科技有限公司);其余试剂均为分析纯。
1.3 细胞
人胰腺癌Capan-2细胞购于中国科学院上海生物化学与细胞生物学研究所细胞库,以含10%胎牛血清的RPMI 1640为培养基,在37℃、5%CO2培养箱中培养。
2 方法
2.1 IHE的提取
将10.0 kg干燥的土木香根茎磨成粗粉,95%乙醇浸泡48 h,在室温下用20倍的95%乙醇渗滤提取,真空浓缩,得到粗提物,约3.7 kg。将粗提物溶于1.5 L温水中,并用3倍量的乙酸乙酯(3×1.5 L)萃取后,减压蒸发,得到370.16 g的IHE(产率为3.7%)。用香草醛-硫酸比色法验证IHE中含有生物活性化合物[3]。临用时,用二甲基亚砜(DMSO)制备成高浓度母液后,用培养基稀释成不同质量浓度的IHE样品溶液。
2.2 MTT法检测细胞的增殖活性
收集对数生长期的Capan-2细胞,以离心半径为13.5 cm、1 000 r/min离心3 min,弃上清液,用培养基吹打成细胞悬液。然后分别以5×103个细胞/孔的密度接种于96孔板中,每孔100 μL,置于细胞培养箱中培养24 h,然后分别加入质量浓度分别为0(空白对照,含DMSO的培养液,下同)、1、2、4、8 μg/mL的IHE。作用48 h后,弃培养液,加入50 μL的MTT溶液,在细胞培养箱中继续孵育4 h后,离心去上清,每孔加入100 μL的DMSO,轻微振荡使蓝色结晶完全溶解。用全波长多功能酶标仪测每孔的光密度(OD),检测波长为570 nm,参照波长为650 nm。试验重复3次,每次设定5个平行复孔。细胞增殖抑制率(%)=(1-给药孔OD均值/空白对照孔OD均值)×100%。使用GraphPad Prism 5软件计算半数抑制浓度(IC50)。
2.3 克隆形成试验检测细胞的克隆形成能力
收集对数生长期的Capan-2细胞,计数,以500个细胞/孔的细胞密度接种于6孔板中,置于细胞培养箱中培养72 h后,加入0(空白对照)、1、2 μg/mL的IHE,置于培养箱中培养1周。取出,弃去原培养液,以磷酸盐缓冲液(PBS)洗2遍,然后用4%的多聚甲醛固定20 min,用吉姆萨(Giemsa)染液染色20 min。PBS洗干净后晾干,拍照观察细胞集落形成数量。试验重复3次。
2.4 Hoechst 33342染色试验观察细胞核形态变化
收集对数生长期的Capan-2细胞,以2×104个细胞/孔的密度接种于24孔板中,置于培养箱中培养24 h后,加入0(空白对照)、2、4 μg/mL的IHE,培养48 h。弃原培养液,用PBS洗2遍,然后每孔加入1 mL的4%多聚甲醛固定20 min。用PBS洗2遍后,再每孔加入300 μL的Hoechst 33342荧光染色液,于细胞培养箱中培养20 min。取出后弃培养液,PBS洗2遍,用荧光显微镜观察细胞核变化,并拍照记录。试验重复3次。
2.5 AnnexinⅤ-FITC/PI双染法流式细胞术检测细胞的凋亡情况
收集对数生长期的Capan-2细胞,以2×105个细胞/孔的密度接种于6孔板中,将细胞置于培养箱中培养24 h后,加入0(空白对照)、4、8、16 μg/mL的IHE培养48 h,收集上清培养液,用胰酶消化细胞并收集。之后加入300 μL的AnnexinⅤ-FITC凋亡检测试剂盒中的缓冲液、5 μL的AnnexinⅤ-FITC染液,轻轻混匀后,于2~8℃避光条件下培养15 min。再加入10 μL的PI,轻轻混匀,于2~8℃避光条件下培养5 min后,流式细胞仪检测,计算细胞凋亡率(%)。试验重复3次。
2.6 JC-1染色法检测细胞内线粒体膜电位
收集对数生长期的Capan-2细胞,以2×105个细胞/孔的密度接种于6孔板中,将细胞置于培养箱中培养24 h后,加入0(空白对照)、4、8、16 μg/mL的IHE培养24 h。收集上清培养液,用胰酶消化并收集细胞,然后用PBS洗2遍。每个样本加入500 μL的JC-1工作液,于细胞培养箱中培养15 min后,用流式细胞仪检测膜电位下降细胞比例。试验重复3次。
2.7 Western blot法检测细胞中凋亡相关蛋白的表达
收集对数生长期的Capan-2细胞,分别加入0(空白对照)、4、8、16 μg/mL的IHE培养48 h后,采用细胞裂解液收集细胞。二喹啉甲酸(BCA)蛋白定量检测试剂盒测定总蛋白浓度,将样品调整至等浓度后分装,-80℃保存。以β-actin为内参进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并转移至聚偏二氟乙烯膜(PVDF)上。用50 g/L的脱脂奶粉溶液室温封闭1 h后,分别加入1∶1 000稀释的一抗(Bcl-2、Bax、Mcl-1、PUMA、PARP、β-actin),4℃孵育过夜,用缓冲液TBST洗膜3次,每次10 min。然后加入HRP标记的二抗(1∶5 000),于室温条件下培养2 h,再用缓冲液TBST洗膜3次,每次10 min。用超敏化学发光试剂显影检测,应用化学发光成像仪进行图像采集,以目标蛋白条带的灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。试验重复3次。
2.8 统计学方法
3 结果
3.1 IHE对Capan-2细胞体外增殖的影响
IHE对细胞的增殖抑制率呈明显的浓度依赖性增加。与0µg/mL比较,2、4、8 μg/mL的IHE作用48 h后细胞的增殖抑制率均明显升高(P<0.05或P<0.01),其中8 μg/mL的IHE对Capan-2的抑制率超过了80%。1、2、4、8 μg/mL的IHE作用48 h后,细胞的增殖抑制率分别为(7.01±1.84)%、(12.39±3.84)%、(38.23±3.30)%、(80.83±1.37)%(n=3),IC50为6.6 μg/mL。
3.2 IHE对Capan-2细胞克隆形成的影响
克隆形成试验也表明,不同质量浓度IHE对Capan-2细胞的增殖有不同程度的抑制作用。经Giemsa染色后可看出,IHE作用于细胞1周后,随着其质量浓度的增加,细胞集落形成数逐渐减少。与0 μg/mL比较,2 μg/mL的IHE作用1周后细胞集落形成数明显减少(P<0.01)。0、1、2 μg/mL的IHE作用1周后细胞集落形成数分别为(362.67±17.90)、(234.67±17.79)、(74.33±6.11)个(n=3)。
3.3 IHE对Capan-2细胞核的影响
以2、4 μg/mL的IHE作用于细胞48 h后,细胞核固缩,荧光强度显著增加,且4 μg/mL的IHE作用较2 μg/mL明显。这一结果也证实了IHE能抑制Capan-2细胞的增殖,染色后荧光显微图见图1。
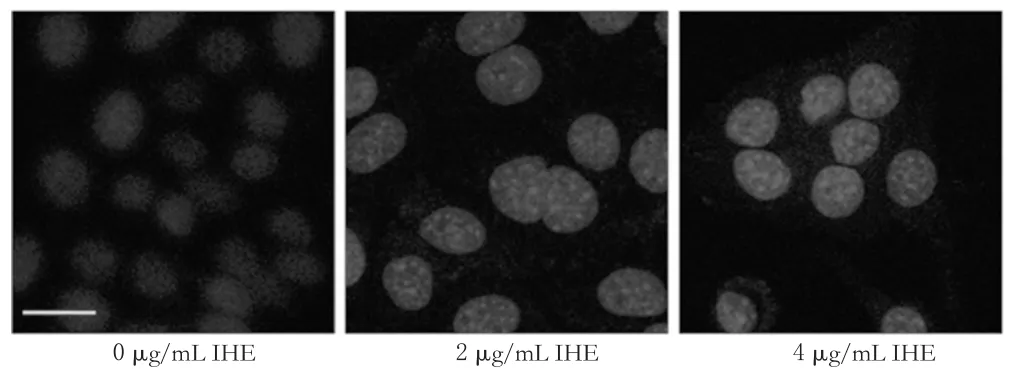
图1 不同质量浓度IHE作用48 h后细胞核的荧光显微图(Hoechst 33342染色,×40)Fig1 Fluorescence micrographs of nuclear morphology after 48 h with different mass concentrations of IHE(Hoechst 33342 staining,×40)
3.4 IHE对Capan-2细胞凋亡的影响
4、8、16 μg/mL的IHE作用于细胞48 h后,细胞凋亡率均不同程度升高,且呈明显的浓度依赖性。与0 μg/mL比较,8、16 μg/mL的IHE作用后细胞凋亡率均明显升高(P<0.01)。0、4、8、16 μg/mL的IHE作用48 h后细胞的凋亡率依次为(8.43±2.47)%、(12.87±4.52)%、(23.97±3.24)%、(40.60±8.27)%(n=3),流式图见图2。

图2 不同质量浓度IHE作用48 h后细胞凋亡的流式图Fig2 Flow cytometry charts of cell apoptosis after 48 h with different mass concentrations of IHE
3.5 IHE对细胞线粒体膜电位的影响
4、8、16 μg/mL的IHE作用于细胞24 h后,均可不同程度地降低细胞线粒体膜电位,且呈明显的浓度依赖性。与0 μg/mL比较,16 μg/mL的IHE作用后线粒体膜电位下降细胞比例为(82.47±1.25)%(P<0.01)。0、4、8、16 μg/mL的IHE作用24 h后线粒体膜电位下降的细胞比例依次为(3.8±0.61)%、(10.87±0.83)%、(19.2±1.01)%、(82.47±1.25)%,结果见图3。
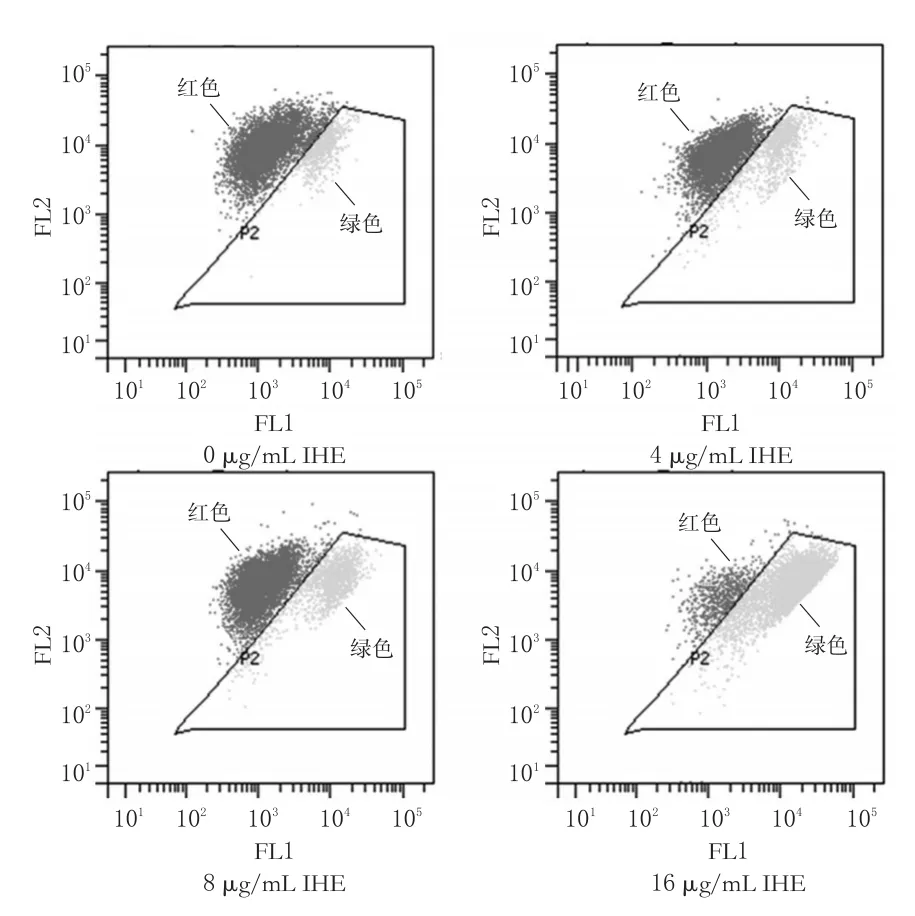
图3 不同质量浓度IHE作用24 h后细胞线粒体膜电位的流式图Fig3 Flow cytometry charts of mitochondria membrane potential after 24 h with different mass concentrations of IHE
3.6 IHE对细胞线粒体凋亡相关蛋白表达的影响
与0 μg/mL比较,8 μg/mL的IHE作用于细胞48 h后,细胞中Bcl-2、Mcl-1、PUMA、PARP蛋白表达明显减弱(P<0.05或P<0.01);16 μg/mL的IHE作用于细胞48 h后,细胞中PUMA、Mcl-1蛋白表达明显减弱(P<0.01)。蛋白表达电泳结果见图4、测定结果见表2。
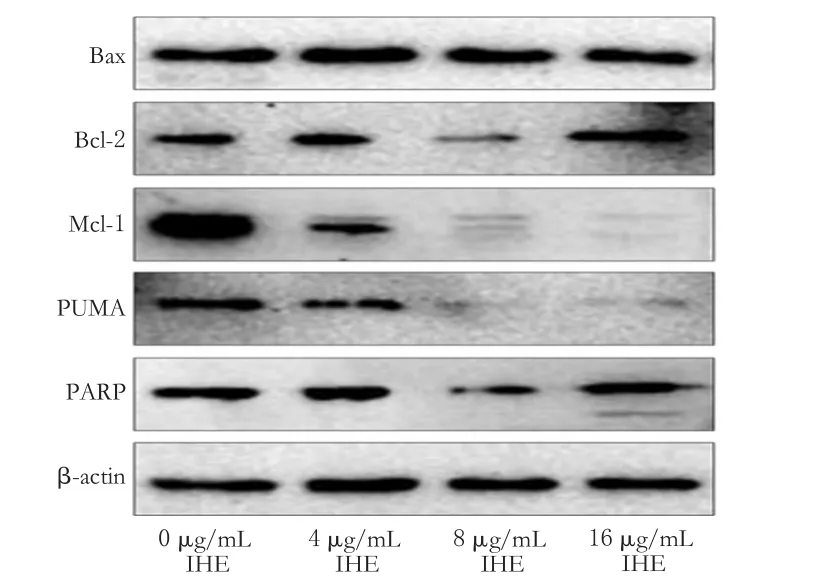
图4 不同质量浓度IHE作用48 h后细胞线粒体凋亡相关蛋白的电泳图Fig4 Electrophoresis charts of mitochondrial apoptosis-related proteins after 48 h with different mass concentrations of IHE
4 讨论
在本研究中,笔者采用了不同方法来验证IHE对胰腺癌Capan-2细胞有增殖抑制作用,包括MTT试验、克隆形成试验和细胞核荧光染色试验。在进行克隆形成试验时,因作用时间较长,药物浓度应低于IC50,故笔者采用了0、1、2 μg/mL的IHE进行试验。在MTT预试验中,笔者设置了0、0.5、1、2、4、8、16、32 μg/mL的等浓度梯度,结果当IHE质量浓度为8 μg/mL时细胞的增殖抑制作用已经达到峰值,故正式试验时IHE的质量浓度设置为0、0.5、1、2、4、8 μg/mL。
表2 不同质量浓度IHE作用48 h后细胞线粒体凋亡相关蛋白的测定结果(±s,n=3)Tab2 Determination results of mitochondrial apoptosis-related proteins after 48 h with different mass concentrations of IHE(±s,n=3)

表2 不同质量浓度IHE作用48 h后细胞线粒体凋亡相关蛋白的测定结果(±s,n=3)Tab2 Determination results of mitochondrial apoptosis-related proteins after 48 h with different mass concentrations of IHE(±s,n=3)
注:与0 μg/mL比较,*P<0.05,**P<0.01Note:vs.0 μg/mL,*P<0.05,**P<0.01
PARP/β-actin 0.77±0.01 0.66±0.01 0.31±0.02*0.78±0.01 IHE质量浓度,μg/mL 0481 6 Bax/β-actin 1.41±0.02 1.27±0.01 1.26±0.02 1.28±0.03 Bcl-2/β-actin 0.82±0.03 0.58±0.01 0.41±0.02*0.98±0.03 Mcl-1/β-actin 1.48±0.08 0.51±0.02 0.17±0.01**0.08±0.01**PUMA/β-actin 1.01±0.03 0.63±0.01 0.23±0.01**0.28±0.03**
JC-1是一种阳离子染料,可以检测细胞线粒体膜电位的变化。当细胞线粒体膜电位较高时,JC-1能聚集在线粒体基质中,形成聚合物,产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集,以单体存在,此时产生绿色荧光[7]。当JC-1从红色荧光到绿色荧光转变时可以反映出线粒体膜电位的下降,而线粒体膜电位下降则是细胞早期凋亡的一个重要标志。线粒体膜电位下降后可以促使线粒体释放细胞色素C[8],细胞色素C与凋亡酶激活因子(Apaf-1)结合后能够催化半胱氨酸天冬氨酸蛋白酶9(Caspase-9)的活化,最终使下游Caspase-3活化而诱导细胞凋亡[9]。PARP作为细胞凋亡核心成员Caspase水解的切割底物,其在DNA损伤修复和细胞凋亡中发挥着重要作用。PARP在体内是Caspase-3的主要切割对象,被剪切后PARP的羧基端的催化结构域(89 kD)和氨基端的DNA结合结构域(24 kD)分离,使其失去酶活力,其裂解片段的出现被认为是细胞凋亡的重要信号[7]。Bcl-2家族蛋白成员是线粒体凋亡通路的重要调节因子,如Bak、Bax等可以促进细胞凋亡,Bcl-2、Mcl-1等可以抑制细胞凋亡,另外还有一些BH3-only蛋白(如NOXA、PUMA等)也可促进细胞凋亡。
本研究结果显示,Capan-2细胞经IHE处理后,随着IHE质量浓度的增加细胞线粒体膜电位明显下降,细胞凋亡率明显升高。此外,从Western blot的结果也可以看到,抑凋亡蛋白Mcl-1的表达随着IHE质量浓度的增加而减弱;而Bcl-2的表达也随着IHE质量浓度的增加而减弱,但在高质量浓度(16 μg/mL)IHE的作用下则有反馈性的上调;而促凋亡蛋白Bax则无明显变化。BH3-only蛋白PUMA的表达也随着IHE质量浓度的增加而减弱。PARP在高质量浓度IHE处理后出现裂解片段。本研究结果表明,IHE可能是通过引起线粒体膜电位的下降,从而引起胰腺癌Capan-2细胞的凋亡。
综上所述,IHE对人胰腺癌Capan-2细胞具有较强的体外增殖抑制作用。其作用机制可能是通过引起线粒体膜电位的下降,下调细胞中Mcl-1、PUMA蛋白的表达,从而引起胰腺癌细胞的凋亡。
[1] Rahib L,Smith BD,Aizenberg R,et al.Matrisian projecting cancer incidence and deaths to 2030:the unexpected burden of thyroid,liver,and pancreas cancers in the United States[J].Cancer Res,2014,74(14):2913-2921.
[2] Siegel RL,Miller KD,Jemal A.Cancer statistics:2016[J].CA Cancer J Clin,2016,66(1):7-30.
[3] 张乐,方羽,陆国红,等.土木香化学成分及药理研究概况[J].中成药,2015,37(6):1313-1316.
[4] 小西天二.土木香中抑制肿瘤细胞增殖的成分[J].国外医学:中医中药分册,2003,25(3):174.
[5] 赵永明,张嫚丽,霍长虹,等.土木香化学成分的研究[J].天然产物研究与开发,2009,21(4):616-618.
[6] Ren Y,J Yu,Kinghorn AD.Development of anticancer agents from plant-derived sesquiterpene lactones[J].Curr Med Chem,2016,23(23):2397-2420.
[7] Hamacher-Brady A,Brady NR.Bax/Bak-dependent,Drp1-independent targeting of X-linked inhibitor of apoptosis protein(XIAP)into inner mitochondrial compartments counteracts Smac/DIABLO-dependent effector Caspase activation[J].J Biol Chem,2015,290(36):22005-22018.
[8] 赵秀梅,周冰,张桂贤,等.扶正解毒祛瘀方联合奥沙利铂对人结肠癌HT-29细胞增殖与凋亡的影响及机制研究[J].中国药房,2017,28(19):2613-2616.
[9] Horbay R,Bilyy R.Mitochondrial dynamics during cell cycling[J].Apoptosis,2016,21(12):1327-1335.
Study on the Inhibitory Effect and Mechanism of Inula helenium Ethyl Acetate Extract on Proliferation of Human Pancreatic Cancer Capan-2 Cells
WANG Linling1,ZENG Jianmei1,YAN Youyou2,ZHANG Bo2,LIN Nengming1,2(1.Transformational Medicine Research Center,Hangzhou First Hospital Affiliated to Zhejiang University of TCM,Hangzhou 310006,China;2.Transformational Medicine Research Center,Hangzhou First People’s Hospital/Hangzhou Hospital Affiliated to Nanjing Medical University,Hangzhou,310006,China)
OBJECTIVE:To study the inhibitory effect and mechanism of Inula helenium ethyl acetate extract(IHE)on proliferation of human pancreatic cancer Capan-2 cells.METHODS:MTT was used to determine the cell proliferation inhibition rate after treated by 0,0.5,1,2,4,8 μg/mL IHE;clone formation test was used to observe the effects of 0,1,2 μg/mL IHE treating for 1 week on cell clone formation;Hoechest 33342 staining was used to observe the changes of nuclear morphology after treated by 0,2,4 μg/mL IHE for 48 h;flow cytometry was used to detect the cell apoptosis rate after treated by 0,4,8,16 μg/mL IHE for 48 h;JC-1 staining was used to observe the changes of intracellular mitochondrial membrane potential after treated by 0,4,8,16 μg/mL IHE for 24 h;Western blot was used to detect the expressions of mitochondrial apoptosis-related proteins Bcl-2,Bax,Mcl-1,p53 upregulated modulator of apoptosis(PUMA),and polymerase(PARP)after treated by 0,4,8,16 μg/mL IHE for 48 h.RESULTS:2,4,8 μg/mL IHE had obvious inhibitory effect on cell proliferation,showing concentration-dependent relationship,with IC50of 6.6 μg/mL;1,2 μg/mL IHE can obviously inhibit the clone formation of cells;4 μg/mL IHE can obviously cause cell nuclear condensation;8,16 μg/mL IHE can obviously promote the cell apoptosis,and the cell apoptosis rate reached 45.53%after treated by 16 μg/mL IHE for 48 h;16 μg/mL IHE treating for 24 h can cause the decrease of 82.47%cells’mitochondrial membrane potential;8 μg/mL IHE can obviously down-regulate the protein expressions of Bcl-2,Mcl-1,PUMA and PARP,and 16 μg/mL IHE can obviously down-regulate the expressions of Mcl-1 and PUMA.CONCLUSIONS:IHE may show its inhibitory effect on proliferation of human pancreatic cancer Capan-2 cells by causing the decrease of mitochondrial membrane potential in cells and down-regulating the protein expressions of Mcl-1 and PUMA to cause cell apoptosis.KEYWORDSInula helenium;Ethyl acetate extract;Human pancreatic cancer Capan-2 cells;Mitochondrion;Cell apoptosis
R285.5
A
1001-0408(2017)31-4384-05
DOI 10.6039/j.issn.1001-0408.2017.31.17
浙江省卫生高层次创新人才培养工程项目(No.2010-190-4)
*硕士研究生。研究方向:肿瘤药理学。电话:0571-56007664。E-mail:sweetyling@126.com
#通信作者:教授,主任药师,博士生导师。研究方向:临床药理学、临床毒理学。电话:0571-56007809。E-mail:lnm1013@163.com
2017-02-09
2017-08-10)
(编辑:林静)

