阿司匹林磷脂复合物自微乳在大鼠体内的药动学及生物利用度研究Δ
徐旖旎,王益,严俊丽,贺智勇,周雪,沈祥春,陶玲#(1.贵州医科大学药学院,贵阳550004;.贵州省普通高等学校天然药物药理与成药性评价重点实验室,贵阳55005)
阿司匹林磷脂复合物自微乳在大鼠体内的药动学及生物利用度研究Δ
徐旖旎1,2*,王益1,2,严俊丽1,2,贺智勇1,2,周雪1,2,沈祥春2,陶玲1,2#(1.贵州医科大学药学院,贵阳550004;2.贵州省普通高等学校天然药物药理与成药性评价重点实验室,贵阳550025)
目的:研究阿司匹林磷脂复合物自微乳在大鼠体内的药动学行为及生物利用度。方法:将12只SD大鼠随机分为阿司匹林混悬液组(10 mg/kg)和阿司匹林磷脂复合物自微乳组(10 mg/kg),每组6只。各组大鼠分别ig给药,并于给药前及给药0.083、0.25、0.5、0.75、1.0、2.0、3.0、4.0、6.0、8.0、12.0 h后于颈静脉采血0.6 mL。采用高效液相色谱法测定2组大鼠血浆中水杨酸的浓度,并采用DAS 2.0药动学软件计算药动学参数和相对生物利用度。结果:阿司匹林混悬液和阿司匹林磷脂复合物自微乳在大鼠体内的药动学过程均符合一室模型。水杨酸在阿司匹林混悬液组和阿司匹林磷脂复合物自微乳组大鼠的cmax分别为(1.904±0.208)、(6.457±1.091)µg/mL,AUC0-12h分别为(12.860±1.327)、(47.270±12.860)µg/(h·mL),tmax分别为(2.167±0.983)、(0.917±0.540)h。与ig阿司匹林混悬液比较,ig阿司匹林磷脂复合物自微乳在大鼠体内水杨酸的cmax、AUC0-12h均显著增加(P<0.01),tmax显著减小(P<0.05),相对生物利用度为367.57%。结论:阿司匹林制成磷脂复合物自微乳后可提高水杨酸在胃肠道的吸收,相对生物利用度较高。
阿司匹林;磷脂复合物;自微乳;高效液相色谱法;药动学;相对生物利用度;大鼠
随着我国人口老龄化的急剧发展,阿司匹林作为抑制血小板聚集的常用药物在临床的应用越来越广泛[1],但其生物利用度低、胃黏膜副作用严重[2-3]。自微乳给药系统(Self-microemulsion drug delivery system,SMEDDS)是一种新型药物载体,由油相、乳化剂、助乳化剂、不含或含少量水构成,口服后遇体液并在胃肠蠕动下(通常在37℃)可自发分散形成水包油型微乳,是一种透明或半透明、低黏度、动力学和热力学都很稳定的混合体系。本课题组前期研究表明,将阿司匹林制备为磷脂复合物后,其生物利用度有显著提高,对大鼠胃黏膜的损伤大幅减轻。为了进一步发挥阿司匹林磷脂复合物的优势,结合其脂溶性较高的特点,笔者研制了阿司匹林磷脂复合物自微乳给药系统[4-8],并对阿司匹林磷脂复合物自微乳在大鼠体内的药动学行为和相对生物利用度进行考察,为阿司匹林新递送系统的研究提供一定的实验基础。
1 材料
1.1 仪器
2700紫外可见分光光度计(日本岛津公司);BS223S分析天平(北京赛多利斯仪器有限公司,精度:0.001 g);1100高效液相色谱仪(美国Agilent公司);20R台式离心机(美国贝克曼库尔特公司)。
1.2 药品与试剂
阿司匹林原料药[阿拉丁试剂(上海)有限公司,批号:D1316056,纯度:99%];水杨酸对照品(批号:100106-201104,纯度:99.9%)、苯甲酸对照品(批号:100419-201302,纯度:100.0%)均购自中国食品药品检定研究院;冰醋酸(上海申博化工有限公司,批号:201601101);水合氯醛(天津市大茂化学试剂厂,批号:20150526);四氢呋喃(天津市科密欧化学试剂有限公司,批号:20140922);乙腈、甲醇为色谱纯;阿司匹林混悬液(批号:2017021501,主要含阿司匹林原料药和羧甲基纤维素钠)、阿司匹林磷脂复合物(批号:2017021502)均由贵州省普通高等学校天然药物药理与成药性评价重点实验室自制;其余试剂均为分析纯。
1.3 动物
健康SD大鼠12只,♀♂各半,体质量210~250 g,由贵州医科大学实验动物中心提供,实验动物生产许可证号:SCXK(黔)2012-0001。
2 方法与结果
2.1 阿司匹林磷脂复合物自微乳的制备
根据实验室前期研究,按阿司匹林磷脂复合物自微乳最优处方,在阿司匹林磷脂中加入辛癸酸甘油酯0.70 g、大豆磷脂0.067 g、15-羟基硬脂酸聚乙二醇酯0.133 g、无水乙醇0.10 g,置于60℃水浴加热至完全溶解,涡旋混匀,得淡蓝色、半透明的阿司匹林磷脂复合物微乳;滴加50 mL纯净水后,磁力搅拌器搅拌(50 r/min)2 min后,即得阿司匹林磷脂复合物自微乳(相当于阿司匹林10.0 mg)。
2.2 色谱条件
色谱柱:Ultimate®LP-C18(150 mm×4.6 mm,5µm);流动相:乙腈-四氢呋喃-冰醋酸-水(20∶5∶5∶70,V/V/V/V)[9];柱温:30℃;检测波长:276 nm(苯甲酸)、303 nm(水杨酸);流速:1.0 mL/min;进样量:15µL。
2.3 溶液的制备
2.3.1 水杨酸对照品溶液的制备精密称取水杨酸对照品5 mg,置于50 mL量瓶中,甲醇溶解并定容,制备成质量浓度为100 μg/mL的水杨酸对照品贮备液。分别精密吸取贮备液适量,甲醇稀释制成质量浓度为0.04、0.08、0.2、0.4、0.8、1.6、3.2 μg/mL的系列对照品溶液,过0.45 μm的微孔滤膜,取续滤液,保存备用。
2.3.2 内标溶液的制备精密称取苯甲酸(内标)对照品10 mg,置于50 mL棕色量瓶中,甲醇溶解并定容,制备成质量浓度为200 μg/mL的内标贮备液。精密吸取内标贮备液1 mL,置于25 mL棕色容量瓶,甲醇稀释制成质量浓度为4 μg/mL的内标溶液,过0.45 μm的微孔滤膜,取续滤液,避光保存,备用。
2.4 分组、给药与血浆样品采集
将12只SD大鼠随机分为2组,每组6只,实验前禁食不禁水12 h。2组大鼠分别ig阿司匹林混悬液和阿司匹林磷脂复合物自微乳(给药剂量均相当于阿司匹林10 mg/kg,根据预实验确定)。分别于给药前及给药0.083、0.25、0.5、0.75、1.0、2.0、3.0、4.0、6.0、8.0、12.0 h后于颈静脉取血0.6 mL,置于肝素化的离心管中,5 000r/min离心(离心半径为8 cm)10 min,吸取上层血浆约0.2 mL,置于-20℃条件下保存,备用[10]。
2.5 血浆样品处理
精密吸取空白血浆200µL于2 mL离心管中,分别精密加入甲醇1.0 mL和内标溶液(4 μg/mL)200µL[11],涡旋混匀1 min,10 000 r/min离心(离心半径为12 cm)5 min,精密吸取上清液15 μL,用于进样测定。
2.6 方法学考察
2.6.1 专属性考察分别取大鼠空白血浆、空白血浆+内标溶液、空白血浆+水杨酸对照品溶液(8 μg/mL)以及大鼠ig阿司匹林磷脂复合物自微乳2 h后的血浆样品,按“2.5”项下方法处理后(不加内标),按“2.2”项下色谱条件进样测定,记录色谱图。结果,苯甲酸、水杨酸的保留时间分别为6.712、8.975 min,2种成分色谱峰分离度为9.02,分离效果良好,血浆内源性物质对于含量测定无干扰,色谱图见图1。
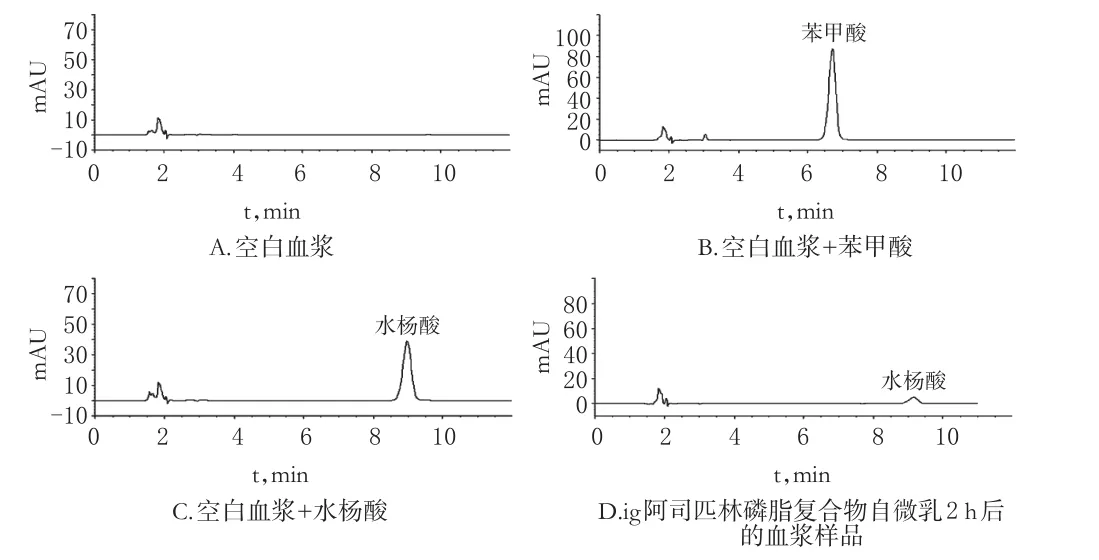
图1 高效液相色谱图Fig1 HPLC chromatograms
2.6.2 标准曲线与检测限精密吸取大鼠空白血浆0.2 mL,分别加入系列对照品溶液1.0 mL,混匀,制成水杨酸质量浓度分别为0.2、0.4、1.0、2.0、4.0、8.0、16.0µg/mL的血浆样品,按“2.5”项下方法处理后,按“2.2”项下色谱条件进样测定,记录峰面积。以水杨酸与内标峰面积的比值为纵坐标(y)、水杨酸质量浓度为横坐标(x)进行线性回归,得回归方程为y=4.036 6x+1.630 6(r=0.998 8)。结果表明水杨酸质量浓度在0.2~16.0µg/mL内线性关系良好,检测限(信噪比为3)为0.084µg/mL。
2.6.3 精密度、稳定性、回收率考察按相关规定进行操作,考察精密度、稳定性、方法回收率与提取回收率。结果,日内(n=6)、日间(n=5)精密度的RSD≤5.81%,稳定性试验的RSD≤4.19%(n=3),方法回收率为98.61%~103.55%(RSD≤5.24%,n=5),提取回收率为75.36%~86.77%(RSD≤4.54%,n=5),均符合相关规定。
2.7 阿司匹林磷脂复合物在大鼠体内的药动学研究
2.7.1 血药浓度的测定取“2.4”项下血浆样品,按“2.5”项下方法处理后,按“2.2”项下色谱条件进样测定。2组大鼠的药-时曲线见图2。
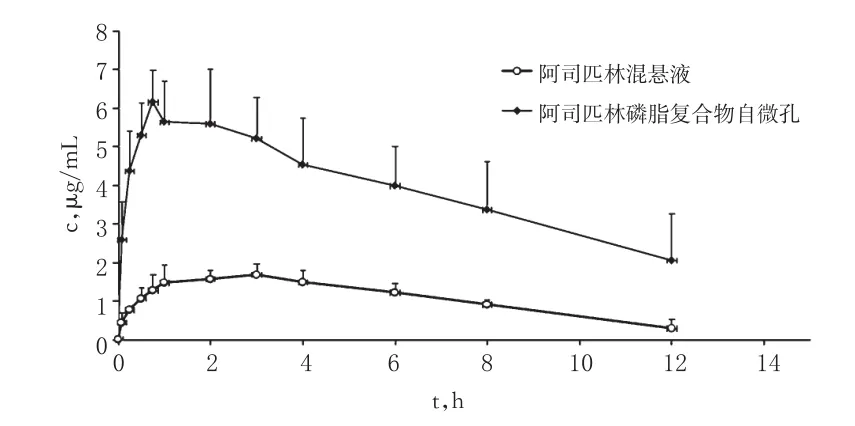
图2 2组大鼠体内水杨酸的药-时曲线Fig2 Plasma concentration-time curves of salicylic acid in rats in vivo in 2 groups
2.7.2 药动学参数与相对生物利用度的计算采用DAS 2.0药动学软件计算药动学参数,采用Excel 2007软件进行t检验,结果见表1。结果,阿司匹林混悬液和阿司匹林磷脂复合物自微乳在大鼠体内的药动学过程均符合一室模型,权重因子为1/C。2组大鼠体内水杨酸的药动学参数见表1。
表1 两组大鼠体内水杨酸的药动学参数(±s,n=6)Tab1 Pharmacokinetic parameters of salicylic acid in ratsin vivo in 2 groups(±s,n=6)

表1 两组大鼠体内水杨酸的药动学参数(±s,n=6)Tab1 Pharmacokinetic parameters of salicylic acid in ratsin vivo in 2 groups(±s,n=6)
注:与阿司匹林混悬液比较,*P<0.05,**P<0.01Note:vs.aspirin suspension,*P<0.05,**P<0.01
阿司匹林磷脂复合物自微乳47.270±12.860**74.040±36.170**0.917±0.540*6.457±1.091**4.928±0.389 5.663±3.412药动学参数AUC0-12h,μg/(h·mL)AUC0-∞,μg/(h·mL)tmax,h cmax,μg/mL MRT0-12h,h t1/2,h阿司匹林混悬液12.860±1.327 16.720±3.086 2.167±0.983 1.904±0.208 4.762±0.175 5.208±1.699
结果表明,阿司匹林磷脂复合物自微乳在大鼠血浆中水杨酸的tmax、cmax、AUC0-12h分别是阿司匹林混悬液的42%(P<0.05)、3.39倍(P<0.01)和3.72倍(P<0.01)。利用公式(相对生物利用度=AUC0-12h阿司匹林磷脂复合物自微乳/AUC0-12h阿司匹林混悬液×100%)计算相对生物利用度,结果阿司匹林磷脂复合物自微乳的相对生物利用度为367.57%,表明与阿司匹林混悬液相比,阿司匹林磷脂复合物自微乳显著提升了药物的口服生物利用度。
3 讨论
阿司匹林进入体内后,在血浆中易被酯酶水解成水杨酸,通常通过测定血浆中水杨酸的浓度变化来研究体内阿司匹林的药动学过程[12]。本研究所用血浆样品中也未检测到阿司匹林,因此,参考2015版《中国药典》(二部)测定水杨酸含量的流动相条件,通过HPLC法测定血浆中水杨酸含量。方法学考察结果表明,该方法能使血浆中内源物质和内标、水杨酸得到较好的分离,方法简便,测定结果准确,重复性良好。
磷脂是生物膜的主要成分,近来已有较多报道提出,将弱吸收的药物与磷脂制备成磷脂复合物后,可以有效提升药物的口服生物利用度[13-14]。前期实验中,笔者成功将阿司匹林制备成磷脂复合物,提高了阿司匹林的脂溶性和油水分配系数。
本文在阿司匹林磷脂复合物基础上进行了自微乳递送系统研究,结果表明,阿司匹林磷脂复合物自微乳的AUC显著高于阿司匹林混悬液,cmax也有显著的提升,而tmax明显缩短,说明阿司匹林磷脂复合物自微乳递送系统吸收速度加快,吸收程度也显著提高。这可能是因为自微乳在胃肠道自发形成细小纳米乳滴,增大有效的比表面积,增加了药物与胃肠上皮细胞的接触;且处方中表面活性剂改变了胃肠道屏障的特性,从而增加药物的转运、促进药物吸收,使生物利用度得到明显提升。另外可能的原因是微乳中的脂质在胰酶和胆汁的作用下发生脂解,形成粒径更小的微乳乳滴和胆盐胶束,可以进一步增加药物的溶解度和促进药物的跨膜吸收转运;处方中的脂质成分可以经肠道淋巴管吸收,减小药物的首关效应,进而进一步提高生物利用度。与阿司匹林混悬液比较,阿司匹林磷脂复合物自微乳相对生物利用度达到367.57%,是阿司匹林磷脂复合物的1.91倍,显著高于阿司匹林磷脂复合物的生物利用度(前期研究结果显示阿司匹林磷脂复合物相对于阿司匹林混悬液的相对生物利用度为192.03%),可以推测阿司匹林磷脂复合物自微乳生物利用度的提高,是磷脂复合物和自微乳协同作用的结果。
[1] Schmitz A,Romann L,Kienbaum P,et al.Dipyrone(metamizole)markedly interferes with platelet inhibition by aspirin in patients with acute and chronic pain:a case-control study[J].Eur J Anaesthesiol,2017,34(5):288-296.
[2] Miyake K,Akimoto T,Hanad Y,et al.Proton pump inhibitors are associated with lower gastrointestinal tract bleeding in low-dose aspirin users with ischaemic heart disease[J].Dig Liver Dis,2015,47(9):757-762.
[3]Fan DD,Lin S,Song YP,et al.AstragalosideⅣprotects rat gastric mucosa against aspirin-induced damage[J].Int Immunopharmacol,2016,41:47-55.
[4] 张红艳,孙洪胜,刘健,等.葛根素固体自微乳胶囊在大鼠体内的药动学研究[J].中国药房,2015,26(34):4773-4775.
[5] 杨文莲,牛涛,傅春升,等.葛根素自微乳制剂的制备工艺研究[J].中国药房,2012,23(15):1375-1377.
[6] 张杰,孙敏捷,平其能,等.芒果苷-磷脂复合物的油制剂在大鼠灌胃后的生物利用度[J].中国新药杂志,2014,23(9):1092-1098.
[7] Wu X,Xu J,Huang X,et al.Self-microemulsifying drug delivery system improves curcumin dissolution and bioavailability[J].Drug Dev Ind Pharm,2011,37(1):15-23.
[8] Sacré PY,Netchacovitch L,De Bleye C,et al.Thorough characterization of a self-emulsifying drug delivery system with raman hyperspectral imaging:a case study[J].Int J Pharm,2015,484(1/2):85-94.
[9] 国家药典委员会.中华人民共和国药典:二部[S].2015年版.北京:中国医药科技出版社,2015:544.
[10] 胡霓霓,谭群友,张犁,等.美斯地浓磷脂复合物大鼠体内药代动力学研究[J].四川大学学报(医学版),2012,43(6):873-876.
[11] 刘嘉,李俊松,狄留庆,等.丹酚酸B及其磷脂复合物在SD大鼠的生物利用度研究[J].中国药学杂志,2010,45(18):1408-1411.
[12] 施兵奇,刘增娟,杨秀岭,等.丁苯酞对阿司匹林在大鼠体内药动学的影响[J].中国药房,2015,26(28):3944-3946.
[13] Guo B,Liu H,Li Y,et al.Application of phospholipid complex technique to improve the dissolution and pharmacokinetic of probucol by solvent-evaporation and co-grinding methods[J].Int J Pharm,2014,474(1/2):50-56.
[14] Zhang K,Gu L,ChenmJ,et al.Preparation and evaluation of kaempferol-phospholipid complex for pharmacokinetics and bioavailability in SD rats[J].J Pharm Biomed Anal,2015,114:168-175.
Pharmacokinetic and Bioavailability Study of Aspirin Phospholipid Complex Self-microemulsion in Rats in vivo
XU Yini1,2,WANG Yi1,2,YAN Junli1,2,HE Zhiyong1,2,ZHOU Xue1,2,SHEN Xiangchun2,TAO Ling1,2(1.School of Pharmacy,Guizhou Medical University,Guiyang 550004,China;2.High Educational Key Libratory of Natural Medicinal Pharmacology and Drugability of Guizhou Province,Guiyang 550025,China)
OBJECTIVE:To study the pharmacokinetics behaviors and the bioavailability of aspirin phospholipid complex self-microemulsion in rats in vivo.METHODS:12 SD rats were randomly divided into aspirin suspension group(10 mg/kg)and aspirin phospholipid complex self-microemulsion group(10 mg/kg),6 in each group.Rats were intragastrically administrated,and blood sample 0.6 mL was taken from jugular vein before administration and after 0.083,0.25,0.5,0.75,1.0,2.0,3.0,4.0,6.0,8.0,12.0 h of administration.HPLC was used to determine the concentration of salicylic acid in rats’plasma.DAS 2.0 pharmacokinetic software was adopted to calculate the pharmacokinetic parameters and relative bioavailability.RESULTS:The pharmacokinetic processes of both aspirin suspension and aspirin phospholipid complex self-microemulsion were in line with one-compartment model.The salicylic acid of cmaxof rats in aspirin suspension group and aspirin phospholipid complex self-microemulsion group were(1.904±0.208),(6.457±1.091)µg/mL;AUC0-12hwere(12.860±1.327),(47.270±12.860)µg/(h·mL);tmaxwere(2.167±0.983),(0.917±0.540)h,respectively.Compared with aspirin suspension,salicylic acid of cmaxand AUC0-12hof aspirin phospholipid complex self-microemulsion in rats in vivo were significantly increased(P<0.01),while tmaxwas significantly decreased(P<0.05);the relative bioavailability was 367.57%.CONCLUSIONS:Making aspirin into phospholipid complex self-microemulsion can improve the gastrointestinal absorption,with high relative bioavailability.
Aspirin;Phospholipid complex;Self-microemulsion;HPLC;Pharmacokinetics;Relative bioavailability;Rats
R945
A
1001-0408(2017)31-4373-04
DOI 10.6039/j.issn.1001-0408.2017.31.14
贵州省科技计划项目(No.黔科合支撑〔2017〕2890);贵州省科技创新人才团队建设项目(No.黔科合人才团队〔2015〕4025号);贵州省高层次创新型人才培养项目(No.黔科合人才〔2015〕4029);贵阳市科技计划项目(No.筑科合同〔20141001〕12号);贵州省普通高等学校创新团队建设项目(No.黔教合人才团队字〔2014〕31)
*讲师,博士研究生。研究方向:心血管药理。电话:0851-8418160。E-mail:605446623@qq.com
#通信作者:教授,硕士生导师。研究方向:药物制剂新技术和新剂型。电话:0851-8418160。E-mail:649511230@qq.com
2017-06-09
2017-09-10)
(编辑:刘明伟)

