不同产地淡豆豉优势发酵菌群的筛选及酶活性分析Δ
陈丽艳,刘青,孙银玲,王萍,张蕾,王伟明(黑龙江省中医药科学院,哈尔滨150036)
不同产地淡豆豉优势发酵菌群的筛选及酶活性分析Δ
陈丽艳*,刘青,孙银玲,王萍,张蕾,王伟明#(黑龙江省中医药科学院,哈尔滨150036)
目的:为淡豆豉生产标准化提供参考。方法:分别采集黑龙江、河北、甘肃、山东、安徽、云南等6个产地的淡豆豉,以青蒿、桑叶选择性培养基培养发酵菌,分别采用福林酚法、纤维蛋白平板法、对硝基苯酚-β-D-葡萄糖苷显色法测定菌株的蛋白酶、纤溶酶、β-葡萄糖苷酶活性以筛选发酵优势菌。结果:从6个产地淡豆豉中共分离出14个野生型菌株,包括3株细菌和11株霉菌。其中,从黑龙江产淡豆豉中分离出杆状细菌1株和毛霉菌1株;从河北产淡豆豉中分离出毛霉菌2株和杆状细菌1株;从甘肃产淡豆豉中分离出毛霉菌1株、青霉菌1株、微球菌1株、曲霉菌1株;从山东产淡豆豉中分离出毛霉菌2株;从安徽产淡豆豉中分离出毛霉菌1株和曲霉菌1株;从云南产淡豆豉中仅分离出毛霉菌1株。根据菌种类别及酶活性测定结果分析,初步判定其中的1号杆状细菌、9号曲霉菌、11号和14号毛霉菌为优势发酵菌,4种菌的3种酶总活性分别为22.77、25.49、41.32、39.13 U/g。结论:不同产地淡豆豉中发酵菌有所不同,通过酶活性分析可初步筛选出优势发酵菌。
淡豆豉;产地;选择性培养基;优势菌;酶活性
淡豆豉饮片为豆科植物大豆[Glycine max(L.)Merr.]的成熟种子的发酵加工品,具有解表、除烦、宣发郁热等功效[1-2],从1963年版《中国药典》(一部)开始一直到2015年版均有记载。从古至今,淡豆豉的生产一直采用传统自然发酵工艺,参与发酵的菌种不明确,且菌种随环境的变化而不同,因此造成不同产地、不同批次的产品质量差异较大,阻碍了淡豆豉生产工艺标准化进程,进而直接影响了其临床用药的安全性和有效性。淡豆豉质量标准化关键在于发酵菌种标准化,因此筛选优势发酵菌种极为重要。
豆豉、淡豆豉发酵菌群的培养通常采用常规培养基[3-4],培养出的微生物种类较多。淡豆豉为青蒿、桑叶的煎煮液浸泡大豆后经自然发酵而得,而常规培养基与淡豆豉基质成分存在明显差异,对于淡豆豉的菌种分离不具更好的适应性和选择性,使菌种的筛选过程烦琐、耗时长。作者前期研究已建立了用含有青蒿、桑叶煎煮液的选择性培养基分离培养淡豆豉发酵优势菌的方法[5],此方法可快速、准确地筛选淡豆豉优势菌。另外,发酵过程中微生物会产生丰富的酶:蛋白酶可将大豆蛋白水解成小分子肽类和游离氨基酸[6];β-葡萄糖苷酶能催化水解烃基与糖基的糖苷键,将大豆中的苷类降解为苷元,更利于人体吸收[7];纤溶酶是豆豉发酵过程中微生物产生的具有溶栓作用的活性物质[8]。这3种酶的活性高低均会影响淡豆豉的功效。
本研究通过青蒿、桑叶选择性培养基分离培养不同产地淡豆豉饮片的发酵菌群,并通过蛋白酶、β-葡萄糖苷酶及纤溶酶的活性测定初步筛选发酵优势菌,为淡豆豉生产和质量标准化提供依据。
1 材料
1.1 仪器
DL-CJ-2N净化工作台(北京东联哈尔仪器制造有限公司);BSA224S电子天平[赛多利斯科学仪器(北京)有限公司];MF3多功能一体机(杭州迅数科技有限公司);DHP-9272恒温培养箱(上海一恒科学仪器有限公司);WH-2微型涡旋混合仪(北京京立离心机有限公司);Legend Micro 17R冷冻高速离心机[赛默飞世尔科技(中国)有限公司];M2000多功能酶标仪[帝肯(上海)贸易有限公司];400C离心机(北京白洋离心机有限公司)。
1.2 药材
桑叶、青蒿购自河北祁新中药颗粒饮片有限公司,经黑龙江省中医药科学院王伟明研究员鉴定分别为桑科植物桑(Morus alba L.)的叶和菊科植物黄花蒿(Artemisia annua L.)的干燥地上部分。根据我国淡豆豉生产企业所处的地理位置及生产环境共采集6个具有代表性的产地的淡豆豉饮片进行分析,详细信息见表1。

表1 6个产地淡豆豉饮片信息Tab1 Information of Sojae semen praeparatum from 6 production places
1.3 试剂
马铃薯葡萄糖琼脂(PDA,批号:20150916)、琼脂粉(批号:20150606)均购自北京奥博星生物技术有限责任公司;尿激酶标准品(批号:140604-201224)、纤维蛋白原(批号:140626-201611)、凝血酶原(批号:20130306)均购于中国食品药品检定研究院;对硝基苯酚-β-D-葡萄糖苷(PNPG)、酪氨酸、对硝基苯酚均为分析纯。
2 方法
2.1 样品的处理及发酵菌培养
参照作者前期研究方法[5]制备选择性培养基及菌液样品。采用平板稀释法将不同浓度菌液接种至铺有选择性培养基的平皿上,于(28±2)℃恒温培养2~6 d,观察并记录菌落生长情况。
2.2 菌种的初步鉴定
将分离菌种纯化后用试管马铃薯葡萄糖琼脂斜面培养基培养并于4℃保存。通过菌落形态及显微特征并参照《伯杰细菌鉴定手册》[9]和《真菌鉴定手册》[10]对菌种进行初步鉴定。然后对细菌进行革兰氏染色,对霉菌采用扦片法培养后进行显微观察。
2.3 酶活性测定
经“2.1”“2.2”项下方法得到的菌株进行酶活性测定,以筛选优势发酵菌群。分别采用福林酚法测定蛋白酶活性[11],PNPG显色法测定β-葡萄糖苷酶活性[12],纤维蛋白平板法测定纤溶酶活性[13]。
3 结果
3.1 不同产地淡豆豉发酵菌群分离结果
不同产地淡豆豉发酵菌的种类及数量见表2。

表2 不同产地淡豆豉发酵菌的种类及数量Tab2 Species and quantities of fermentive bacteria in Sojae semen praeparatum decoction pieces from different production places
由表2可见,从6个产地淡豆豉中共分离出14株野生型菌株,经初步鉴定,其中细菌3株(杆状细菌2株、微球菌1株)、霉菌11株(其中毛霉菌8株、曲霉菌2株、青霉菌1株)。可见,不同产地淡豆豉中发酵菌有所不同,其中从CD1淡豆豉中筛选出杆状细菌1株和毛霉菌1株;从CD2淡豆豉中筛选出毛霉菌2株和杆状细菌1株;从CD3淡豆豉中筛选出毛霉菌1株、青霉菌1株、微球菌1株、曲霉菌1株;从CD4淡豆豉中筛选出毛霉菌2株;从CD5淡豆豉中筛选出毛霉菌1株和曲霉菌1株;从CD6淡豆豉中仅分离出毛霉菌1株。
3.2 酶活性测定结果
不同产地淡豆豉发酵菌的酶活性见图1。
由图1可见,其中1、11、14号菌的纤溶酶活性较高,2、7、10号菌的β-葡萄糖苷酶活性较高,9、11、14号菌的蛋白酶活性较高,而4、10、13号菌的蛋白酶活性处于较低水平。1、9、11、14号菌的酶活性综合水平较高,3种酶总活性分别为22.77、25.49、41.32、39.13 U/g,初步确定为优势发酵菌群。
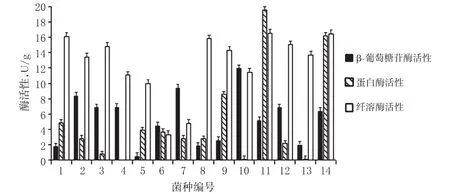
图1 不同产地淡豆豉发酵菌的酶活性比较Fig1 Comparison of enzyme activities of fermentive bacteria in Sojae semen praeparatum from different production places
3.3 优势发酵菌的显微形态观察结果
淡豆豉优势发酵菌群的显微特征观察结果见图2。
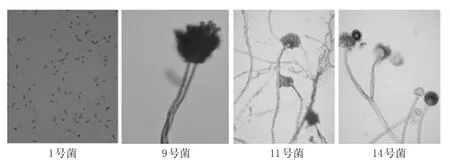
图2 淡豆豉优势发酵菌的显微特征Fig2 Microscopic features of dominant fermentive bacteria in Sojae semen praeparatum
结合菌落形态并根据《伯杰细菌鉴定手册》[9]和《真菌鉴定手册》[10],可初步判定1号菌为杆状细菌,9号菌为曲霉菌,11、14号菌均为毛霉菌,但显微形态仍有差异,可能为同属不同种,但分离的菌株仍需进一步鉴定。
4 讨论
淡豆豉为自然条件下多菌种混合发酵而成,因地区、季节及生产环境不同菌群会发生变化,而淡豆豉质量、风味、功效也会随菌群变化而存在差异。本研究对6个不同产地淡豆豉样品进行菌群种类、数量及酶活性分析,结果表明,不同产地淡豆豉的微生物群系及主要发酵菌存在明显不同,通过酶活性分析可初步确认优势发酵菌。
与文献[14]报道的不同产地淡豆豉发酵菌的研究比较,本研究应用青蒿、桑叶选择性培养基是以2015年版《中国药典》(一部)中淡豆豉饮片的炮制工艺为基础,模拟淡豆豉发酵环境并经实验验证该培养基可选择性抑制有害菌、保留发酵优势菌,分离筛选出的菌种种类较少,使菌种筛选更加简便、快捷。鉴于饮片在干燥、存贮、运输及销售过程中难免发生二次污染,因此在制备菌液时,需用无菌生理盐水多次洗涤淡豆豉饮片以尽可能减少外界杂菌干扰,使发酵优势菌更具代表性。淡豆豉为自然条件下多菌种混合发酵而成,通过酶活性分析筛选出发酵优势菌。可根据不同菌的酶学特性重新组合发酵菌种,再进一步考察其发酵工艺及异黄酮类等功效成分变化,为淡豆豉发酵菌种标准化提供依据。
综上所述,本研究所获得的优势菌均为自然界野生型菌株,通常作为始发菌,再经人工选育,即以功效产物为靶标,采用定向诱变等遗传育种技术才能获得更高活性的生产用菌株。此外,还需进行传统发酵工艺向现代发酵工艺的转变,为优良菌种提供最佳发酵环境条件,从而获得功效稳定、安全可控的淡豆豉产品,实现真正意义上的淡豆豉生产标准化。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:328.
[2] 李刚,梁永红,杨安金,等.淡豆豉不同制法其成品性状及异黄酮类化学成分含量的比较[J].中国药房,2014,25(47):4461-4463.
[3] 管泳宇,吴满刚,葛庆丰,等.曲霉型豆豉优势菌株筛选与鉴定[J].食品工业科技,2012,33(23):178-182.
[4] 李刚,龙凯,苏明声,等.淡豆豉炮制至“黄衣上遍”过程中微生物菌群动态变化的初步研究[J].中国实验方剂学杂志,2014,20(11):139-142.
[5] 陈丽艳,刘青,张蕾,等.分离筛选淡豆豉发酵菌的培养基优化[J].中国现代中药,2016,18(7):822-825.
[6] 房翠兰.豆豉加工过程中蛋白质和膳食纤维生物学变化的研究[D].重庆:西南大学,2007.
[7] 孙艳梅,张永忠.水解制备大豆异黄酮苷元研究进展[J].食品研究与开发,2002,23(3):11-13.
[8] 朱春节,汤祝华,谢秀祯.豆豉纤溶酶产生菌分离和鉴定[J].微生物学通报,2010,37(12):1779-1785.
[9] 布坎南RE,吉本斯NE.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:16-1207.
[10] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:1-649.
[11] 国家国内贸易局.中华人民共和国专业标准SB/T10317-1999蛋白酶活力测定法[S].1999-04-15.
[12] 郑芳,曹小芳,张亚玲,等.一株β-葡萄糖苷酶产生菌株的分离鉴定及酶学性质研究[J].微生物学通报,2012,39(8):1059-1068.
[13] 刘向辉,戈峰.蚯蚓纤溶酶活性影响因子的研究[J].中国中药杂志,2002,27(6):423-426.
[14] 汤扬,熊敏刚.贵州中成药用淡豆豉发酵菌种的分离鉴定及纯种发酵[J].贵州医药,1999,23(4):318-319.
Screening and Enzymatic Activity Analysis of Dominant Fermentive Bacteria of Sojae Semen Praeparatum from Different Production Places
CHEN Liyan,LIU Qing,SUN Yinling,WANG Ping,ZHANG Lei,WANG Weiming(Heilongjiang Academy of Traditional Chinese Medicine,Harbin 150036,China)
OBJECTIVE:To provide reference for the standardized production of Sojae semen praeparatum(SSP).METHODS:SSP samples from Heilongjiang,Hebei,Gansu,Shandong,Anhui and Yunnan were respectively collected.The fermentive bacteria were cultured with the selective medium contained artemisiae annuae herba and mori folium.Foline-phenol method,fibrous protein plate method and p-nitrophenol-β-D-glucoside colorimetric method were respectively conducted to determine the activities of protease,plasmin and β-glucosidase of the strains to screen dominant fermentive bacteria.RESULTS:Totally 14 wild strains were separated from SSP samples from 6 production places,including 3 strains of bacteria and 11 strains of molds.1 strain of rod-shaped bacteria and 1 strain of Mucor sp.were separated from SSP from Heilongjiang;2 strains of Mucor sp.and 1 strain of rod-shaped bacteria were separated from SSP from Hebei;1 strain of Mucor sp.,1 strain of Penicillium sp.,1 strain of Streptococcus sp.and 1 strain of Aspergillus sp.were separated from SSP from Gansu;2 strains of Mucor sp.were separated from SSP from Shandong;1 strain of Mucor sp.and 1 strain of Aspergillus sp.were separated from SSP from Anhui;and only 1 strain of Mucor sp.was separated from SSP from Yunnan.According to the strains category and enzyme activities,No.1 bacillus,No.9 Aspergillus sp.,No.11 and No.14 Mucor sp.were preliminary authenticated as dominant fermentation microorganism,total enzyme activities of the 4 strains were 22.77,25.49,41.32,39.13 U/g respectively.CONCLUSIONS:The fermentive bacteria of SSP from different production places were different,and the dominant one can be screened preliminary through enzyme activity analysis.
Sojae semen praeparatum;Production place;Selective medium;Dominant bacteria;Enzyme activity
R932
A
1001-0408(2017)31-4359-03
DOI 10.6039/j.issn.1001-0408.2017.31.10
国家中医药管理局公益性行业科研专项经费项目(No.201507004-03);黑龙江省应用技术研究与开发计划新创办企业项目(No.PB15F005)
*主任药师,硕士。研究方向:发酵类中药的研究。电话:0451-55653086-6845。E-mail:cly9998@163.com
#通信作者:研究员,博士。研究方向:中药新药开发及中药资源研究。电话:0451-55665478。E-mail:1442540238@qq.com
2017-02-15
2017-05-10)
(编辑:余庆华)

