盐碱胁迫对柳树抗氧化酶的影响
刘 铎, 丛日春, 高卫东, 党宏忠, 李庆梅, 刘德玺, 杨庆山
(1.中国林业科学研究院 荒漠化研究所, 北京100091; 2.中国林业科学研究院 林业研究所国家林业局林木培育重点实验室, 北京 100091; 3.山东省林科院, 山东 济南 250014)
盐碱胁迫对柳树抗氧化酶的影响
刘 铎1, 丛日春1, 高卫东2, 党宏忠1, 李庆梅2, 刘德玺3, 杨庆山3
(1.中国林业科学研究院 荒漠化研究所, 北京100091; 2.中国林业科学研究院 林业研究所国家林业局林木培育重点实验室, 北京 100091; 3.山东省林科院, 山东 济南 250014)
[目的] 探讨柳树抗氧化系统对盐胁迫和碱胁迫响应的差异机制,以期为今后耐盐碱柳树选育工作提供科学依据。[方法] 以盐柳1号为试验材料,分别以中性盐NaCl和NaSO4、碱性盐NaHCO3和Na2CO3混合模拟盐、碱胁迫(两者摩尔比均为9∶1),共设计了5个梯度处理(0~200 mmol/L),共胁迫14 d来研究盐与碱胁迫下柳树幼苗相关生理表现。[结果] 在碱胁迫情况下随着盐浓度升高,柳树叶片的SOD,POD,CAT这3种酶活性呈先升后降变化趋势,其中SOD在盐浓度为100 mmol/L时达到最大为对照的1.48倍,POD和CAT在盐浓度为150 mmol/L达到最大,分别为对照的4.26和5.24倍。中性盐胁迫下SOD和POD活性一直保持增大,在盐浓度为200 mmol/L时达到最大值分别对照的1.33和3.26倍,在盐浓度为150 mmol/L时CAT活性达到最大值为对照的2.79倍。碱胁迫下柳树叶片中丙二醛(MDA)含量明显高于中性盐胁迫下,当盐浓度为150 mmol/L时为同浓度中性盐胁迫下的2.23倍。[结论] 从氧化胁迫角度分析,碱胁迫和盐胁迫是两种不同性质的胁迫,碱胁迫对柳树抗氧化系统造成的危害更大。
柳树; 酶活性; 丙二醛; 盐胁迫; 碱胁迫
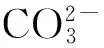
柳树是中国重要的造林绿化水土保持树种,具有速生、耐水湿、抗性强、易繁殖等特点,同时柳树也是非常好的用材与能源树种,对于生态环境建设具有非常重要的作用[6]。但是有关碱性盐对于柳树造成氧化胁迫的影响目前还未见报道。本试验拟通过人工模拟天然盐碱生境分析盐胁迫和碱胁迫对柳树幼苗的各种抗氧化酶活性及过氧化物含量差异性变化,探讨柳树抗氧化系统对盐胁迫和碱胁迫响应的差异机制,以期为今后耐盐碱柳树选育工作提供科学依据。
1 试验材料与方法
1.1 试验材料与设计
本试验在中国林业科学研究院科研温室内进行,所选用的柳树无性系材料为引种自山东省滨州由山东林科院选育的“盐柳1号(SalixpsammophilaYanliu yihao)”新品种。2014年3月选取长度为15 cm,直径1 cm左右的当年生柳树插条,扦插定植在高和直径均为15 cm的装有洗净河沙并加入适量珍珠岩的花盆内进行盆栽。定期浇灌1/2 Hogland营养液进行培养,扦插后培养45 d,枝条长到30~40 cm时,选取长势一致的柳树幼苗进行盐胁迫。以1/2 Hogland营养液为本底配制盐溶液,2种中性盐NaCl,Na2SO4及2种碱性盐NaHCO3,Na2CO3均按照摩尔比9∶1进行配制,保持Na+浓度不变。盐胁迫与碱胁迫均设置0,50,100,150,200 mmol/L这5个梯度,用pH电子笔测定各梯度处理液pH值,中性盐pH值变化范围为6.5~6.9,碱性盐pH值变化范围为9.1~9.28,每处理设置6个重复。胁迫时浇透盐水,为了避免盐冲击现象,逐次增加浇灌盐水浓度,最终达到最高浓度,以后定期按称重法补充浇灌营养液。盐胁迫时间从达到最高盐浓度之日算起,总共胁迫14 d。
1.2 试验指标测定方法
盐碱胁迫14 d之后,采集各个植株相同部位的功能叶片进行生理指标测定,每个指标重复测定4次。
(1) 酶液制备。取0.5 g叶片并剪碎,置于预冷的研钵中,准确加入10 ml预冷的50 mmol/L的pH=7.8的磷酸缓冲液及适量石英砂,在冰浴中进行研磨,然后将匀浆转入10 ml离心管中,于4 ℃下12 000 r离心10 min,最后提取上清液在4 ℃下保存备用[6]。超氧化物歧化酶(SOD)的活性测定采用四唑氮蓝法,以一直NBT光化还原50%为一个酶活性单位[7]过氧化物酶(POD)的测定用愈创木酚法,以每1 min内A470读数增加0.01为一个过氧化物酶活性单位[6],过氧化氢酶(CAT)的测定用紫外吸收法,以每min内A240减少0.01为一个酶活性单位[6]。
(2) 丙二醛(MDA)测定。用硫代巴比妥酸法,取新鲜叶片0.5 g,加入10%TCA5.0 ml和少量石英砂研磨;转移到离心管中,4 000 r离心10 min。上清液即为提取液,然后取1.5 ml提取液与2.0 ml硫代巴比妥酸(TBA)在恒温水浴锅反应20 min,最后测定MDA含量[8]。
2 结果与分析
2.1 盐碱胁迫对柳树SOD活性的影响
SOD是存在于植物中活性氧清除系统的主要酶之一,其主要作用是清除超氧自由基,它能够催化活性氧发生歧化反应产生H2O2,以提高植物的抗氧化能力[9]。图1为盐与碱胁迫下柳树叶片内SOD活性变化关系。
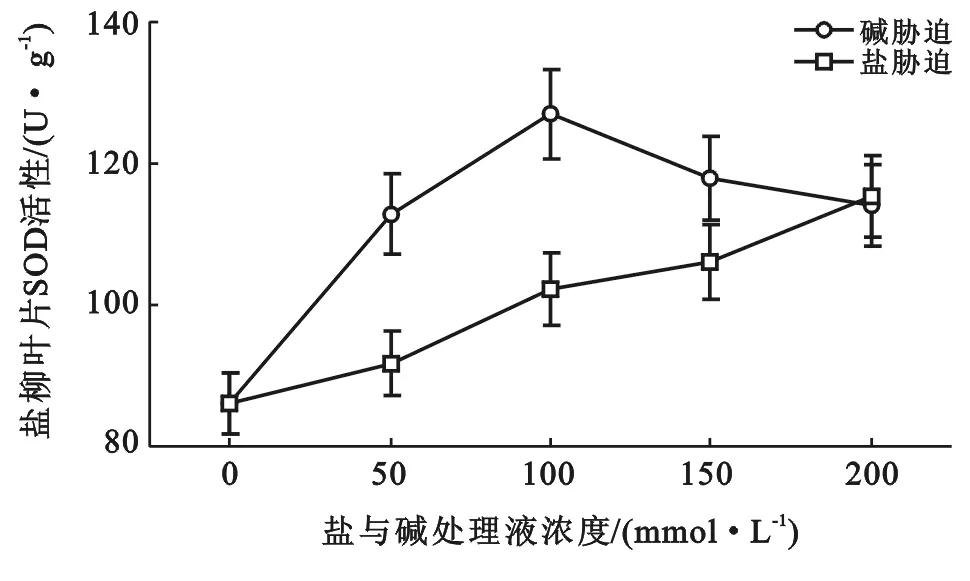
图1 盐与胁迫下柳树叶片内SOD活性变化
由图1可以看出,随着盐浓度的升高,柳树叶片中的SOD活性总体呈上升趋势,但是在碱胁迫的情况下,SOD活性呈先升后将降的变化趋势。当碱性盐浓度达到100 mmol/L时,SOD活性达到最大值为对照的1.48倍(p<0.05)达到显著差异,为同浓度中性盐胁迫下的1.24倍(p>0.05)差异不显著。但是在碱胁迫下,随着盐浓度的继续增大,叶片SOD活性开始下降。这可能是由于盐浓度的增大,使得植物的活性氧清除系统遭到破坏,而导致SOD活性降低。在中性盐胁迫下,随着盐浓度的升高,SOD活性则一直呈上升趋势,当盐浓度为200 mmol/L时达到最大,为对照的1.33倍(p>0.05)差异不显著。由此可看出:碱性盐对柳树SOD活性的影响更大,造成的损伤更严重。
2.2 盐碱胁迫对柳树POD活性的影响
在活性氧清除系统中,POD的作用是催化H2O2与其底物反应,以充分分解H2O2,从而解除由于逆境胁迫产生的活性氧对于植物细胞的伤害[10]。图2为盐碱胁迫下柳树叶片内POD活性变化关系。
由图2可以看出,在2种盐胁迫14 d的情况下,随着盐浓度的升高,柳树叶片的POD活性总体呈现上升趋势,但在碱胁迫下POD活性呈现先升后降的变化趋势,并且相比中性盐胁迫情况下变化幅度更大。当碱性盐浓度达到150时,叶片POD活性达到最大值为对照的4.26倍(p<0.01)达到极显著性差异。当中性盐浓度达到50,100,150,200 mmol/L时,叶片POD活性分别为对照的1.55,2.05,2.55,3.26倍。可以看出在相同盐浓度下,碱胁迫下叶片中POD活性高于中性盐胁迫下叶片中POD活性,并且当碱性盐浓度为150 mmol/L时POD活性达到最大值,碱胁迫下为中性盐胁迫下的1.71倍(p<0.05),差异显著。随着碱性盐浓度的升高,叶片中POD活性开始下降,说明在碱性盐浓度超过150 mmol/L时柳树叶片的抗氧化系统遭受到了损害,抗氧化功能有所下降。而在中性盐胁迫下,随着盐浓度的增加,POD活性一直在增大,抵抗由于盐胁迫造成的氧化损伤。由上面分析可以看出,随着盐浓度的升高,在中性盐胁迫的情况下,叶片中POD活性一直呈上升趋势,但是在碱胁迫的情况下,随着盐浓度的升高,叶片中POD活性呈现,先升后降的变化趋势,由此可以看出,随着碱性盐浓度的升高对于叶片POD活性调节功能会造成损伤,使得POD活性有所降低,由此可得出碱胁迫对于柳树叶片的POD活性造成的损伤更大。

图2 盐与碱胁迫下柳树叶片内POD活性变化
2.3 盐碱胁迫对柳树CAT活性的影响
由图3可以看出,在盐胁迫的情况下,随着盐浓度的升高柳树叶片的CAT活性呈上升趋势。在中性盐胁迫情况下,随着盐浓度的升高,叶片CAT活性也缓慢升高,当盐浓度为、50,100,150,200 mmol/L时叶片CAT活性分别为对照的1.74,2.07,2.79,2.29倍,当盐浓度为150 mmol/L时达到最大值。在碱胁迫下,随着碱性盐浓度的升高,叶片中CAT活性先缓慢上升又降低,当浓度为150 mmol/L时又急剧增加而达到最大值为对照的5.24倍(p<0.01)达到极显著性差异,随着碱性盐浓度继续升高到200 mmol/L时CAT活性略有下降为对照的3.54倍。在相同盐浓度情况下,相比于中性盐在碱胁迫下,叶片中CAT活性更高。当盐浓度为150,200 mmol/L时,分别为中性盐胁迫下CAT活性的1.88,1.55倍。试验表明:在碱胁迫下柳树叶片CAT活性所受影响更大。
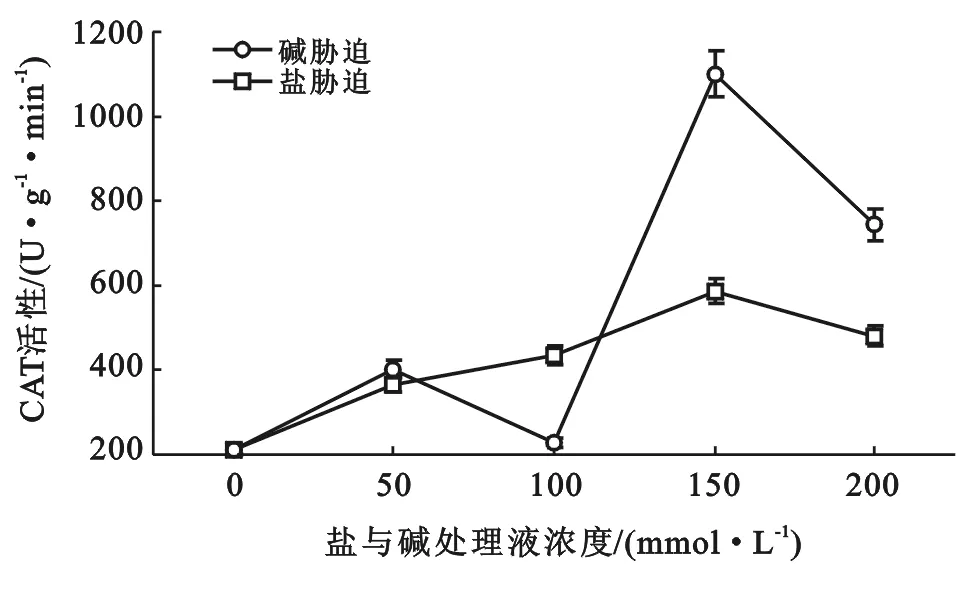
图3 盐与碱胁迫下柳树叶片内CAT活性变化
2.4盐碱胁迫对柳树MDA含量的影响
植物在非生物逆境胁迫条件下,在植物体内会发生膜质过氧化作用,从而使植物细胞膜系统结构和功能受损,丙二醛(MDA)是膜质过氧化作用的终产物,是膜系统受伤害的重要标志之一,在逆境条件下植物积累的MDA越多,则表明植物组织细胞的保护能力越弱,细胞质膜遭受的破坏越严重[11]。图4为盐与碱胁迫下柳树叶片内MDA含量变化关系。

图4 盐与碱胁迫下柳树叶片内MDA含量变化
由图4可以看出,随着中性盐与碱性盐处理浓度的升高,柳树叶片中的丙二醛(MDA)含量发生了相应的变化。其中,随着盐浓度的升高,在碱胁迫下相比对照处理柳树叶片中丙二醛含量大幅增加,但中性盐胁迫下叶片中的丙二醛(MDA)含量相比于对照处理变化不大。在盐浓度较低为50 mmol/L时,相比于对照盐胁迫下的柳树叶片中的MDA含量差异并不大。但随着碱性盐的浓度继续升高,叶片中MDA含量急剧增加。当碱性盐浓度达到100,150时,叶片中MDA含量分别为对照的1.59,1.95倍,其中在浓度为200 mmol/L时叶片中MDA含量达到最大值,为对照的2.19倍(p<0.05)达到显著性差异。并且当碱性盐浓度达到100,150,200 mmol/L时叶片中MDA含量分别为同浓度中性盐胁迫下的1.58,2.23,2.13倍(p<0.05)差异显著,当盐浓度为150 mmol/L时差异最大。试验表明:相比于中性盐在碱胁迫下,柳树叶片中会积累更多的MDA,由此可见碱胁迫下会使柳树质膜过氧化作用更强,对于柳树叶片细胞膜系统与功能损伤更大。
3 讨论与结论

袁琳等[18]发现,在盐胁迫下,长果阿浑子和Kerman叶片中SOD,CAT,POD活性随着盐浓度升高而增强。李会云等[19]盐胁迫对葡萄砧木品种研究的结果表明,随着土壤含盐量的增加,SOD,CAT,POD均呈现先上升后下降的变化趋势。马丽清等[20]在研究盐胁迫对珠美海棠和山定子膜保护酶系统的影响中发现,当超过一定盐浓度时山定子叶片中SOD,CAT,POD活性,随着盐浓度的升高3种酶活性降低。
本研究表明:在盐与碱胁迫14 d情况下随着盐浓度的增大,柳树叶片的SOD,POD和CAT这3种酶活性总体呈上升趋势。在中性盐胁迫14 d的情况下,除CAT活性在盐浓度在150 mmol/L时达到最大值,随着盐浓度继续升高活性略有下降外,SOD和POD活性一直保持上升。相比于中性盐,碱胁迫下柳树叶片内3种酶活性变化幅度更大。并且,随着碱性盐浓度的增大,3种酶活性并不是一直保持增大。如SOD,POD和CAT分别在盐浓度为100和150 mmol/L时酶活性达到峰值之后开始下降。与此同时,当盐浓度相同时,相比于中性盐在碱胁迫下,柳树叶片中会积累更多的MDA,当碱性盐浓度为200 mmol/L时叶片中MDA为对照的2.19倍,为同浓度中性盐胁迫下MDA含量的2.13倍。造成以上现象的原因主要是由于,植物细胞在盐胁迫下所能忍受的活性氧水平存在一个阈值。在此阈值内,植株能通过提高抗氧化酶的活性,有效消除活性氧自由基所带来的伤害;当超过这个阈值时,植物抗氧化系统遭到破坏,抗氧化酶活性就会下降,活性氧的积累量将超过其被清除的量,从而使植株受到损害。由此得出,在中性盐及低浓度碱胁迫14 d的情况下,SOD,POD和CAT能有效清除胁迫所产生的超氧阴离子自由基和H2O2,但在高浓度碱胁迫的情况下,由于高pH值的影响,SOD,POD和CAT这3种酶的保护作用受到了明显抑制。
综上所述,盐与碱胁迫对于柳树幼苗的抗氧化系统的影响表现出明显的不同,是两种不同的胁迫,一定浓度盐与碱胁迫对于柳树都会造成不同程度的氧化胁迫。尤在高pH碱胁迫的影响下,会对柳树造成更严重的氧化胁迫,碱胁迫对于柳树各项抗氧化生理指标的影响明显大于盐胁迫。植物适应盐与碱胁迫是一个受到多基因控制的复杂过程,目前有关植物耐盐碱性的很多机理尚不是很清楚有很多疑问,还有待进一步深入研究。
[1] 史小丽,叶茂,王晓峰,等.NaCl胁迫对塔里木河下游罗布麻抗性酶的影响[J].干旱区资源与环境,2011,25(5):209-212.
[2] 雷金银,班乃荣,张永宏.柽柳对盐碱土养分与与盐分的影响及其区化特征[J].水土保持通报,2011,31(2):73-76.
[3] 李彬,王志春,孙志高,等.中国盐碱地资源与可持续利用研究[J].干旱地区农业研究,2005,23(2):154-158.
[4] 武德,曹帮华,刘欣玲.盐碱胁迫对刺槐和绒毛白蜡叶片叶绿素含量的影响[J].西南林学院学报,2007,22(3):51-54.
[5]Lv Bingsheng, Li Xiaowei, Ma Hongyuan, et al. Differences in growth and physiology of rice in response to different saline-alkaline stress factors[J]. Agronomy Journal, 2013,105(4):1119-1128.
[6] 张建,李敏,李玉娟,等.盐胁迫下3个柳树新品系生理变化[J].江苏农业科学,2012,40(8):197-199.
[7] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006:119-124.
[8] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2001.
[9] 代莉慧,蔡禄,周耀龙,等.NaCl和Na2CO3胁迫对内蒙古河套灌区盐地碱蓬种子萌芽生理指标的影响[J],种子,2013,32(7):14-17.
[10] 刘金文,佟丹丹,关利娅.NaCl胁迫对不同苜蓿品种超氧化物歧化酶同工酶的影响[J].黑龙江八一农垦大学学报,2006,18(6):4-7.
[11] 周建,刘弘,尤杨等.碱胁迫对紫荆幼苗生长与光合作用的影响[J].东北林业大学学报,2008,30(6),13-15.
[12] 颜志明,魏跃,贾思振,等.盐胁迫对草莓抗氧化系统和离子吸收的影响[J].北方园艺,2013(9):1-4.
[13] 周瑞莲,王海鸥,赵哈林.不同类型沙地植物保护酶系统对干旱、高温胁迫的响应[J].中国沙漠,1999,19(1):49-54.
[14] Bowler C, Montagu M, Inze D. Superoxide dismutase and stress tolerance[J]. Annual Review of Plant Biology, 1992,43(1):83-116.
[15] van Camp W, Capiau K, van Montagu M, et al, Enhancement of oxidative stress tlerance in transgenic tobacco plants overproducing Fe-superoxide dismutase in chloroplasts[J]. Plant Physiology,1996,112(4):1703-1714.
[16] Meloni D A , Oliva M A, Martinez C A, et al. Photosynthesis and activity of superoxide dismutase, peroxide and glutathione redutase in cotton under salt stress[J]. Environmental and Experimental Botany,2003,49(1):69-76.
[17] 张继澍.植物生理学[M].北京:高等教育出版社,2006:431.
[18] 袁琳,克热木·伊力.NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响[J].植物生态学报,2005,29(6),985-996.
[19] 李会云,郭修武.盐胁迫对葡萄砧木叶片保护酶活性和丙二醛含量的影响[J].果树学报,2008,25(2),240-243.
[20] 马丽清,韩振海,周二峰,等.盐胁迫对珠美海棠和山定子膜保护酶系统的影响[J].果树学报,2006,23(4),495-499.
EffectsofSaltandAlkaliStressesonAntioxidasesofWillow
LIU Duo, CONG Richun, GAO Weidong, DANG Hongzhong, LI Qingmei, LIU Dexi, YANG Qingshan
(1.InstituteofDesertificationStudies,ChineseAcademyofForestry,Beijing100091,China; 2.KeyLaboratoryofForestSilvicultureofStateForestryAdministration,ResearchInstituteofForestry,ChineseAcademyofForestry,Beijing100091,China, 3.ShandongForestryResearchInstitute,Jinan,Shandong250014,China)
[Objective] To illustrate the comparative effects of salt and alkali stresses on antioxidases of willow, and to provide scientific basis for willow breeding. [Methods] A willow cultivarSalixpsammophila(Yanliu yihao) was used in this study. The stress conditions were simulated by five levels of salinities and alkalities with 14 days duration. The salinities were simulated by two neutral salts (NaCl and NaSO4) and alkalities were simulated by two alkaline salts (NaHCO3and Na2CO3). The two neutral and alkaline salts were both mixed in the molar ratio of 9∶1. The concentrations ranged from 0 to 200 mmol/L both for salt and alkali stress. [Results] Under alkali stress, the activities of superoxide dismutase (SOD), peroxidase(POD) and CAT all presented a tendency of increasing at low concentration stress and then decreasing at high stress. The peak of SOD activity emerged when the willow was treated with 100 mmol/L, which was 1.48 times of the control’s; the peak of POD and CAT activities emerged when it was treated with 150 mmol/L, which were 4.26 and 2.79 times of the control’s values. Under alkali stress, the activities of SOD,POD and CAT all presented an increasing tendency. The peaks of SOD,POD and CAT activities all emerged at highest contrcentration of 200 mmol/L, they were 1.33,3.26 and 2.29 times of the control’s corresponding values. The content of MDA of willow leaf was higher in alkali treatment than that in salt treatment. When the concentrations of neutral and alkaline salts were at 150 mmol/L, the difference of MDA content was biggest. [Conclusion] The alkali stress is different from salt stress, the alkali has stronger injury to willow than the salt stress has.
willow;enzymeactivity;MDA;saltstress;alkalistress
A
1000-288X(2017)05-0053-05
Q945.78
文献参数: 刘铎, 丛日春, 高卫东, 等.盐碱胁迫对柳树抗氧化酶的影响[J].水土保持通报,2017,37(5):53-57.
10.13961/j.cnki.stbctb.2017.05.009; Liu Duo, Cong Richun, Gao Weidong, et al. Effects of salt and alkali stresses on antioxidases of willow[J]. Bulletin of Soil and Water Conservation, 2017,37(5):53-57.DOI:10.13961/j.cnki.stbctb.2017.05.009
2014-08-08
2017-04-25
中央级公益性行业科研院所基本科研业务费“柳树抗复杂盐胁迫机理研究”(CAFYBB2016MA011); 江苏省科技支撑计划项目(BE2016328)
刘铎(1991—),男(汉族),甘肃省白银市人,硕士,研究方向为盐碱地治理、耐盐碱树种筛选。E-mail:liuduo6125358@163.com。
丛日春(1963—),男(汉族),内蒙自治区赤峰市人,博士,研究员,主要从事盐碱地治理、耐盐碱树种筛选工作。E-mail:congrichun888@163.com。

