Zn2+、Cd2+在腐植酸上的吸附动力学与解吸作用研究
李春玲 罗庆军 李春峰
(内蒙古多伦县环境监测站 锡林郭勒 027300)
Zn2+、Cd2+在腐植酸上的吸附动力学与解吸作用研究
李春玲 罗庆军 李春峰
(内蒙古多伦县环境监测站 锡林郭勒 027300)
研究了Zn2+、Cd2+在腐植酸上的吸附动力学及其解吸特征。考察了初始pH与温度对吸附作用的影响。结果表明,金属离子的吸附量随初始pH的升高而增大,随温度升高而增大。Zn2+、Cd2+在腐植酸上的吸附符合伪二级吸附速率模型。吸附在腐植酸上的Zn2+、Cd2+在H2O、HCl、NaOH和NaCl溶液中的解吸量的关系是:HCl>NaOH>NaCl>H2O。
锌 镉 腐植酸 吸附动力学 解吸
腐植酸与进入环境中的金属离子会发生作用,形成各种络合物和螯合物。腐植酸与金属的这种作用,对金属离子的迁移转化有着重要的影响,水体腐植酸除明显影响重金属形态、迁移转化、富集等环境行为外,还对重金属的生物效应产生影响。天然水体中金属离子与可溶性有机物相互作用研究方面,国外学者主要研究的是受污染较少的天然湖泊中的可溶性天然有机物[1~3];国内学者主要是对金属离子与腐植酸相互作用的动力学和等温线等进行研究[4~9]。动力学研究主要是用伪一级和伪二级2种动力学模型进行拟合,等温线研究主要用Langmuir模型和Freundlich模型进行拟合,从而探究作用机理。本文主要研究了锌(Zn2+)、镉(Cd2+)与腐植酸的相互作用受pH、温度的影响,吸附动力学及Zn2+、Cd2+的解吸特征,为水体中金属离子与有机物的相互作用研究提供了参考借鉴。
1 材料与方法
1.1 试剂与仪器
腐植酸(生化试剂,上海巨枫化学科技有限公司生产。粉末状,200目,可溶于水。羧酸型腐植酸,总腐植酸含量>97%,总酸性基含量为135.14 mg/g,羧基量为132.5 mg/g,酚羟基量为2.64 mg/g);高纯锌粒(成都中建材光电材料有限公司);高纯镉(成都中建材光电材料有限公司);硝酸(优级纯,天津科密欧化学试剂有限公司);NaOH(分析纯,天津市风船化学试剂科技有限公司);SHZ-82型水浴恒温振荡器;PHS-25C微机型酸度计;TAS-990型原子吸收分光光度计。
1.2 实验方法
1.2.1 pH对吸附作用的影响
在室温(293.15 K)转速为150 r/min条件下,将0.05 g腐植酸加入到50 mL、初始浓度为10 mg/L的Zn2+或Cd2+的初始pH值分别为2、3、4、5、6、7、8的不同溶液中,吸附时间为180 min,从Zn2+、Cd2+的吸附量考察pH的影响。
1.2.2 温度对吸附作用的影响
在转速为150 r/min下,将0.05 g腐植酸加入到50 mL初始浓度为10 mg/L Zn2+或Cd2+的溶液中,考察温度分别为293、303和313 K时的吸附量随时间变化。
1.2.3 吸附动力学
在150 r/min的转速下,温度分别为293、303和313 K,对初始浓度为10 mg/L Zn2+或Cd2+的溶液进行吸附实验,吸附时间为180 min,并对动力学模型拟合得到的饱和吸附量与实际实验达到吸附平衡时的吸附量作对比。
1.2.4 吸附量计算
不同金属离子的吸附量通过式(1)得到:
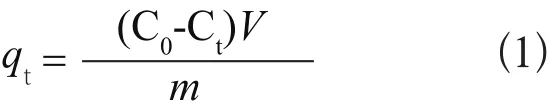
式中,qt为t时刻金属离子的吸附量,mg/g;C0为溶液中金属离子的初始浓度,mg/L;Ct为t时刻金属离子的剩余浓度,mg/L;V为溶液的体积,L;m为吸附剂的质量,g。
1.2.5 Zn2+、Cd2+的解吸
首先,在室温(293.15 K)转速为150 r/min条件下,将10 g腐植酸加入到100 mL Zn2+、Cd2+的初始浓度为2000 mg/L的溶液进行实验,吸附达到平衡时,过滤,晒干后得到所需腐植酸样品,然后将上述吸附有Zn2+、Cd2+的腐植酸样品0.5 g分别在50 mL去离子水(H2O)、0.01 mol/L HCl、0.01 mol/L NaOH和0.01 mol/L NaCl中进行解吸实验。金属离子的解吸量通过式(2)得到:
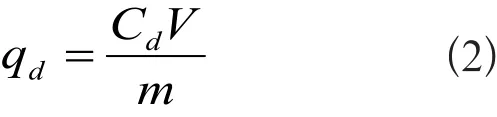
式中,qd为金属离子的解吸量,mg/g;Cd为解吸后溶液中金属离子的浓度,mg/L;V为解吸溶液体积,L;m为腐植酸样品的质量,g。
2 结果与讨论
2.1 pH对相互作用的影响
由图1可知,金属离子的吸附量是随pH值上升而增大的,在pH值小于4的情况下,Zn2+、Cd2+的吸附量都较低,当pH值在6~8时,Zn2+、Cd2+的去除率分别达到98.9%、98.7%,金属离子几乎全部被去除。这是因为溶液中金属的形态随着pH的增加是有变化的,较高的pH条件下金属离子易被腐植酸吸附,水解生成其氢氧化物而沉降。腐植酸[简式为Hum(OH)COOH]是一种多元酸,含有的羧基和羟基等官能团,与金属离子(M2+)络(螯)合,释放出H+[10],反应式如下:
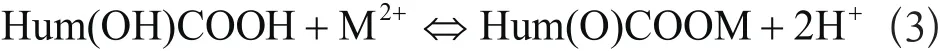
低pH下溶液中较多的H+不利于正反应的进行,抑制了H+的释放,同时金属离子与H+对相互作用点位的竞争[11],相反高的pH对于H+释放有利,从而使金属离子的吸附量升高。因此,中性条件是适合吸附反应进行的。
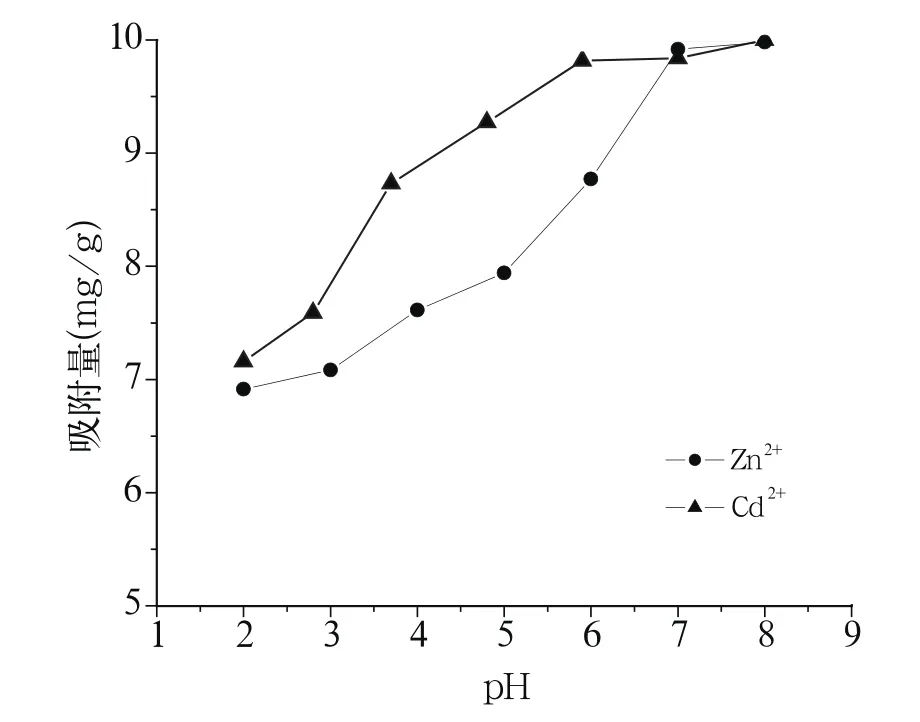
图1 初始pH对Zn2+、Cd2+吸附量的影响Fig.1 Effect of initial pH on the adsorption capacity of Zn2+, Cd2+
2.2 温度对相互作用的影响
在293、303和313 K的不同温度下,对腐植酸在初始浓度分别为10 mg/L的Zn2+、Cd2+的溶液中的吸附量进行实验,各反应液的初始pH调节到5,考察腐植酸对Zn2+、Cd2+的吸附量受温度的影响。
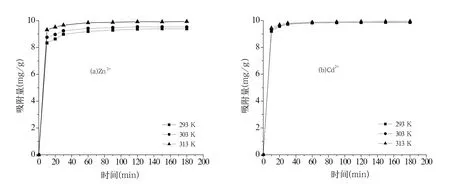
图2 Zn2+、Cd2+在腐植酸上的吸附量受温度的影响Fig.2 Effect of temperature on the adsorption capacities of Zn2+, Cd2+ on humic acid
图2 分别表示Zn2+、Cd2+在腐植酸上不同热力学温度下的吸附量随时间变化曲线,随着温度的升高,Zn2+、Cd2+在腐植酸上的吸附量随之增加。由此说明金属离子与腐植酸的相互作用是吸热的,温度升高,金属离子的扩散速度相应提高,离子的活性也相应增大,从而使金属离子进入吸附剂腐植酸的结构中[12]。与Zn2+相比,Cd2+受温度的影响较小。
2.3 吸附动力学
吸附过程的动力学研究主要是用来描述吸附剂吸附溶质的速率快慢,通过动力学模型对数据进行拟合,从而探讨其吸附机理。本文用2种动力学模型对数据进行了拟合,以期得到最适合的描述。
(1) 伪一级吸附模型,采用Lagergren[13]方程计算吸附速率:
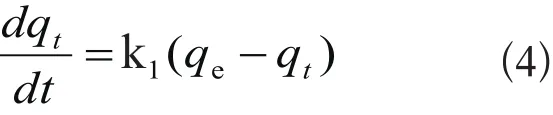
式中,qt和qe分别为t时刻和平衡态时的吸附量,mg/g;k1为伪一级吸附速率常数,min-1。对式(4)从t=0到t>0(q=0到q>0)进行积分,可以得到:
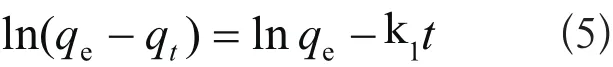
(2) 伪二级吸附模型方程表达式[14]为:
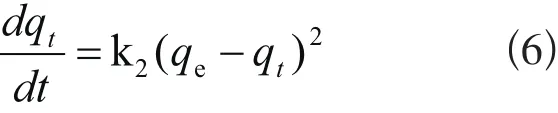
式中,k2为伪二级吸附速率常数,min-1。
对式(6)从t=0到t>0(q=0到q>0)进行积分,写成直线形式为:
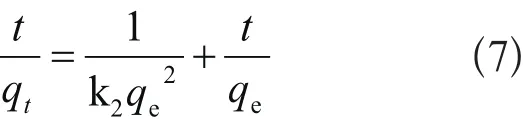
令

(7)(8)两式中,qt和qe分别表示t时刻和平衡态时的吸附量,mg/g;h表示初始吸附速率常数,mg/(g·min)。
按照伪一级和伪二级2种动力学模型,利用最小二乘法对实验数据进行线性拟合,通过直线的斜率和截距进行计算得到的动力学参数见表1。比较表1中各个方程拟合的线性相关系数R2可知,伪二级方程对Zn2+、Cd2+的吸附行为都有很好的描述(R2>0.999),伪一级方程的拟合程度较差。这是因为,尽管一级动力学模型已经广泛地应用于各种吸附过程,但它却有局限性[15]。一级模型常常只适合吸附初始阶段的动力学描述,而不能准确地描述吸附的全过程。相比之下,伪二级模型包含了吸附的所有过程,如外部液膜扩散、表面吸附和颗粒内扩散等[16],更真实全面地反映了金属离子在腐植酸上的吸附机理。以Zn2+在腐植酸上的吸附为例,在293、303和313 K 3个温度下用伪二级模型计算出的qe值分别为9.506、9.615、9.980 mg/g,与实际测量值(分别为9.512、9.609、9.973 mg/g)非常接近,相对误差非常小。
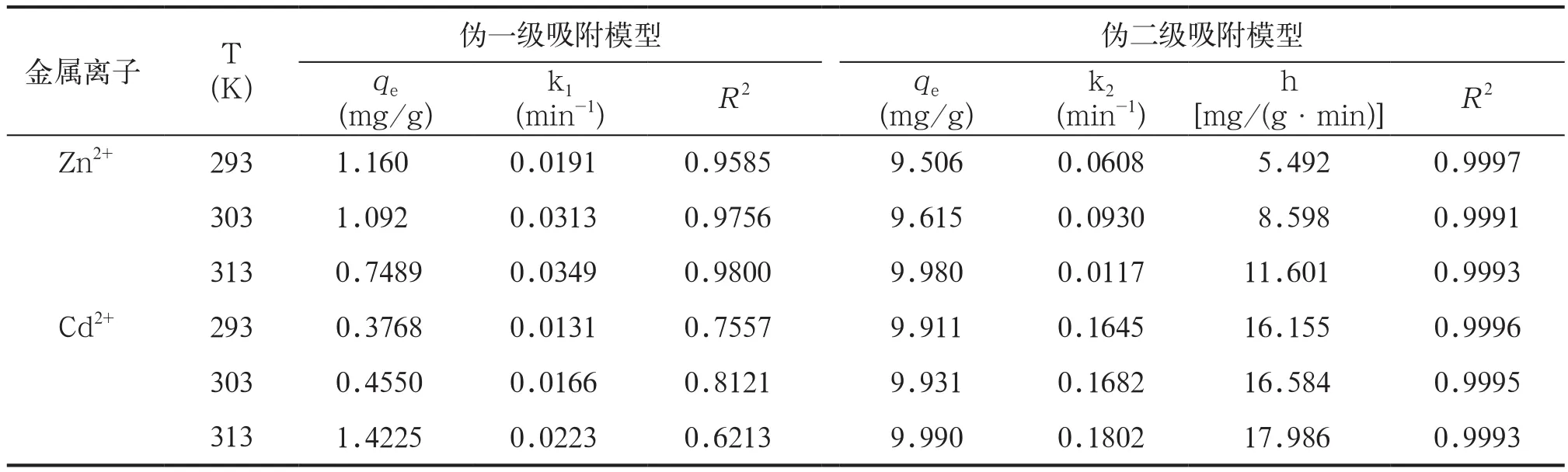
表1 Zn2+、Cd2+在腐植酸上的动力学模型拟合Tab.1 Fitting of the dynamic models of Zn2+, Cd2+ on humic acid
2.4 吸附活化状态函数
根据Arrhenius公式得到:
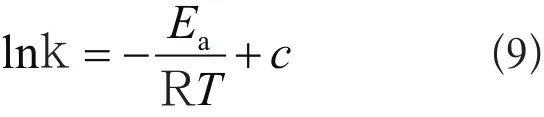
式中,k为反应速率常数(取伪二级吸附速率常数k2);Ea为活化能,kJ/mol;R为理想气体常数。
由线性拟合的斜率可以求得吸附过程的活化能Ea,Zn2+、Cd2+在腐植酸上吸附的lnk对1/T图,见图3。计算得到Zn2+在腐植酸上吸附的Ea为24.89 kJ/mol;Cd2+在腐植酸上吸附的Ea为3.455 kJ/mol。物理吸附速度较快,需要的活化能很小,大约为8.368~25.1 kJ/mol;而化学吸附所需要的活化能通常大于83.72 kJ/mol[17]。由于较小的活化能导致吸附反应速率较快[18],达到平衡所需的时间较短。因此,Zn2+和Cd2+在腐植酸上吸附均以物理吸附为主,吸附速率较快,且受温度的影响比较小。
2.5 Zn2+、Cd2+的解吸
吸附有Zn2+、Cd2+的腐植酸在不同的溶液中解吸,解吸量的差别很大,解吸量如表2所示。在H2O、HCl、NaOH和NaCl中的解吸量的关系是:HCl>NaOH>NaCl>H2O。在去离子水中是没有解吸,说明Zn2+、Cd2+与腐植酸结合的很牢固,不容易脱附;在盐溶液中的解吸量也很小;在碱溶液中的解吸量增大;在HCl中的解吸量最大。这说明pH对解吸有影响,pH较低或较高时解吸量都较大,中性条件下解吸量较小,但盐对其有一定影响。另外,这两种离子的解吸量次序与吸附量相反:Zn2+>Cd2+。说明金属离子的吸附除与环境因子相关外,其本身化学性质很重要[19]。根据离子的吸附机理,将物质对金属离子的吸附分为非专性吸附和专性吸附。非专性吸附由静电引起,物质表面电荷密度越大,离子带的电荷越多,就越容易吸附,其吸附力也越强,但被吸附的离子可以进行交换,也容易被解吸。专性吸附由离子的水合作用及共价键和氢键作用将被吸附的离子固定在腐植酸内,被吸附的离子不容易被解吸,大多数金属离子属于专性吸附。该实验结果表明,Zn2+、Cd2+的解吸率都较低。这表明Zn2+、Cd2+在腐植酸上被专性吸附的可能性较大[20],腐植酸是一种有效的吸附剂,能起到较好地固定金属离子的作用。实验还表明,溶液中的Zn2+、Cd2+在较短时间内被腐植酸大量吸附,从而使溶液中的Zn2+、Cd2+被有效固定下来。
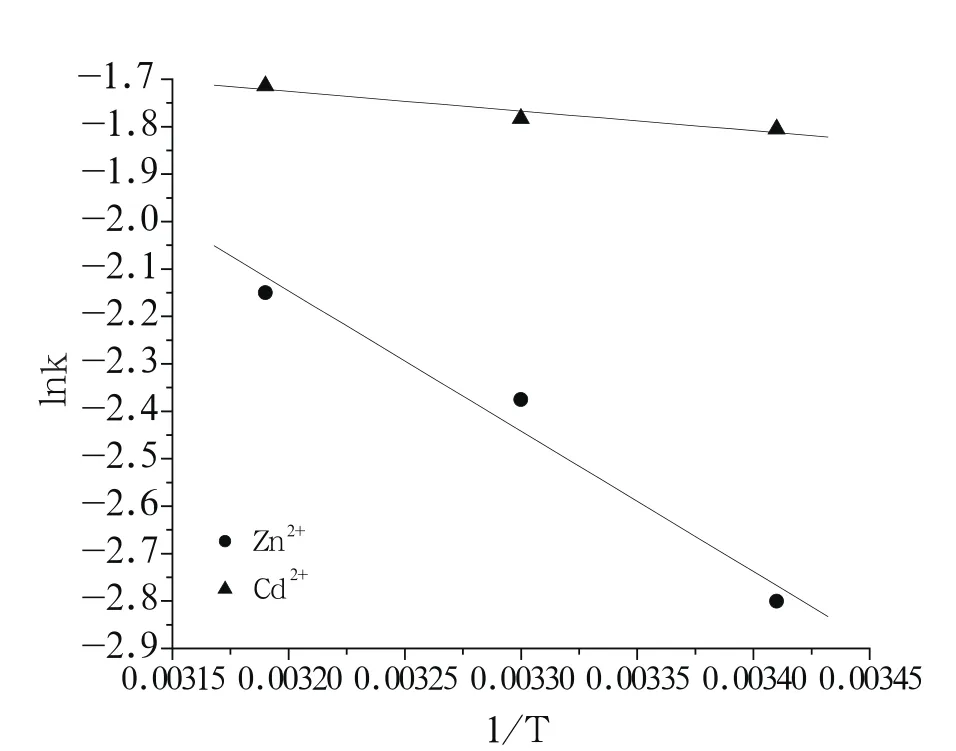
图3 Zn2+、Cd2+在腐植酸上吸附的lnk对1/T图Fig.3 Plot of lnk vs. 1/T for adsorption of Zn2+, Cd2+ on humic acid
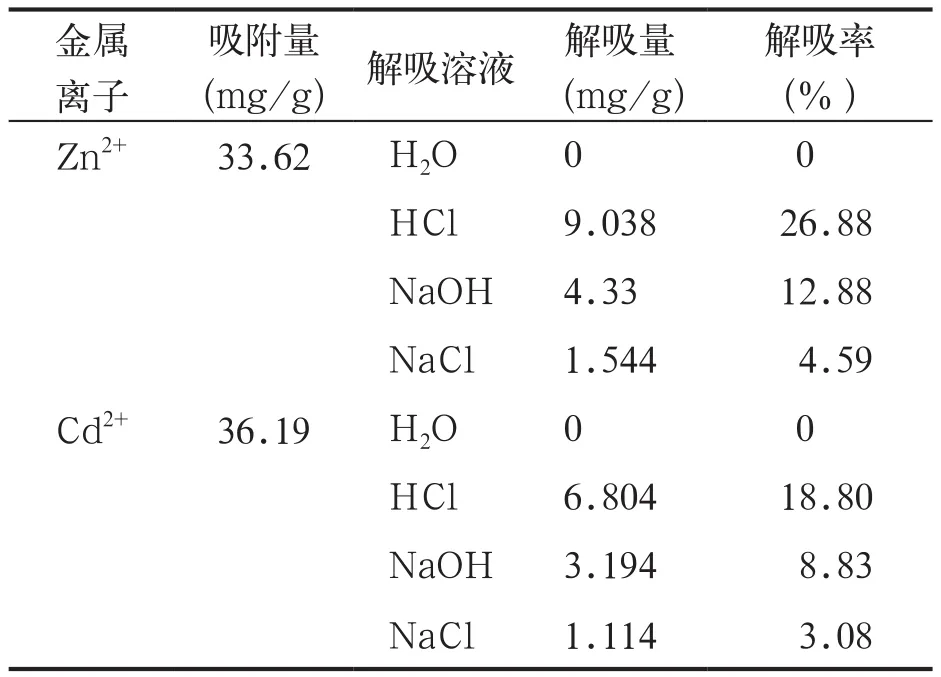
表2 Zn2+、Cd2+在不同溶液中的解吸量比较Tab.2 Comparison of desorption capacities of Zn2+, Cd2+in different solutions
3 结论
(1) Zn2+、Cd2+在腐植酸上的吸附量是随初始pH值上升而增大的,在pH值小于4的情况下,Zn2+、Cd2+的吸附量都较低,当pH值在6~8时,Zn2+、Cd2+几乎全部被去除。随着温度的升高,Zn2+、Cd2+的吸附量随之增加。这说明Zn2+、Cd2+与腐植酸的相互作用是吸热的,结合能力随温度升高而增大。与Zn2+相比,Cd2+受温度的影响较小。
(2) Zn2+、Cd2+在腐植酸上的吸附符合伪二级吸附动力学模型。计算得到Zn2+在腐植酸上吸附的Ea为24.89 kJ/mol;Cd2+在腐植酸上吸附的Ea为3.455 kJ/mol。实验表明,吸附过程以物理吸附为主。
(3) 吸附有Zn2+、Cd2+的腐植酸在不同的溶液中解吸,解吸量的差别很大,在H2O、HCl、NaOH和NaCl溶液中的解吸量的关系是:HCl>NaOH>NaCl>H2O。
[1]Volesky B., Weber J., Vieira R.. Adsorption of Cd and Cu by different types of sargassum biomass[J]. Process Metal, 1999, (9): 473~482
[2]Baker B., Khalili F.. A study of complication thermodynamic of humic acid with cadmium (II) and zinc(II) by schubert’s ion-exchange method[J]. Analytica Chimica Acta: Including Cumilative Indexes, 2005, 542: 240~248
[3]Mahmoud S., Bassam E., Fawwaz K.. Adsorption of humic acid on bentonite[J]. Applied Clay Science, 2007, 38:51~56
[4]王丹丽, 关子川, 王恩德. 腐殖质对重金属离子的吸附作用[J]. 黄金, 2003, 24(1): 47~49
[5]王旭东,王虎,李利敏,等. Fe2+与胡敏酸的络合特征及其抗氧化性和生物有效性研究[J]. 植物营养与肥料学报, 2004,10(3): 267~271
[6]吕福荣, 刘艳. 腐殖酸与钴和镉的作用研究[J]. 大连大学学报, 2002, 23(4): 63~67
[7]李光林,魏世强,牟树森. 土壤胡敏酸对Pb的吸附特征与影响因素[J]. 农业环境科学学报, 2004, 23(2):308~312
[8]王亚军,朱琨. 腐殖酸对六价铬在砂土中吸附行为的影响研究[J]. 兰州交通大学学报, 2005, 24(4): 67~71
[9]李英, 李树源,杨洪年. 滩涂沉积物中腐殖酸对Cr(III)的吸附平衡实验[J]. 岩石矿物学杂志, 2006,25(2): 157~161
[10]杨春文. 腐殖质与Ca2+、Mg2+、Co2+、Ni2+的络合作用及其在农业中的应用[J]. 西北民族大学学报(自然科学版),2003,24(3):67~73
[11]祝春水,赵宇侠,魏涛,等. 柠檬酸对膨润土吸附镍离子的影响研究[J]. 工业安全与环保,2002,33(7):1~4
[12]马明广,周敏,蒋煜峰,等. 不溶性腐殖酸对重金属离子的吸附研究[J]. 安全与环境学报,2006,6(3):68~71
[13]Aksu Z.. Biosorption of reactive dyes by dried activated sludge: equilibrium and kinetic modelling[J]. Biochemical Engineering Journal, 2001, 7 (1): 79~84
[14]Ho Y. S., McKay G.. Pseudo-second order model for sorption processes[J]. Process Biochemistry, 1999, 34:451~465
[15]丁世敏,封享华,汪玉庭,等. 交联壳聚糖多孔微球对染料的吸附平衡及吸附动力学分析[J]. 分析科学学报,2005,21(2):127~130
[16]Chang M. Y., Juang R. S.. Adsorption of tannic acid,humic acid, and dyes from water using the composite of chitosan and activated clay[J]. Colloid and Interface Sci,2004, 278: 18~25
[17]舒月红,贾晓珊. CTMAB-膨润土吸附水中1,2,4-三氯苯的动力学[J]. 中山大学学报,2006,45(5):2~19
[18]舒月红,贾晓珊. CTMAB-膨润土从水中吸附氯苯类化合物的机理——吸附动力学与热力学[J]. 环境科学学报,2005,25(11):1530~1536
[19]单奇华,张彩峰,俞元春,等. 土壤Cu2+和Cd2+的吸附解吸特征及差异分析[J]. 安徽农业科学,2007,35(19):5808~5810
[20]徐明岗. 土壤离子吸附: 离子吸附的类型及研究方法[J]. 土壤肥料,1997,34(5):3~7
Study of Adsorptive Kinetics and Desorption of Zn2+, Cd2+on Humic Acid
Li Chunling, Luo Qingjun, Li Chunfeng
(Environmental Monitoring Station of Inner Mongolia Duolun County, Xinlin Gol, 027300)
The effects on the adsorption with a series of initial pH and temperature were studied to know the adsorptive kinetics and desorption of Zn2+, Cd2+on humic acid. The results showed that the adsorption capacities of the metal ions increased with increasing initial pH and higher temperature. The adsorption process followed the pseudo secondary adsorption rate model. The desorption capacities of adsorption on the humic acid Zn2+, Cd2+in different solutions were HCl > NaOH > NaCl > H2O.
zinc; cadmium; humic acid; adsorptive kinetics; desorption
TQ314.1,O647.31
1671-9212(2017)05-0020-06
A
10.19451/j.cnki.issn1671-9212.2017.05.005
2017-03-16
李春玲,女,1983年生,工程师,研究方向为环境监测与污染治理,E-mail: 53982346@qq.com。

