基于定向进化技术提高地衣芽孢杆菌L-天冬酰胺酶活性
邵泽香,焦琳舒,陆兆新,别小妹,赵海珍,张 充,吕凤霞*
(南京农业大学食品科技学院,江苏 南京 210095)
基于定向进化技术提高地衣芽孢杆菌L-天冬酰胺酶活性
邵泽香,焦琳舒,陆兆新,别小妹,赵海珍,张 充,吕凤霞*
(南京农业大学食品科技学院,江苏 南京 210095)
为提高地衣芽孢杆菌L-天冬酰胺酶活性,通过定向进化技术对其进行分子改造。经过两轮易错聚合酶链式反应和一轮DNA shuffling,从19 100多个突变株中筛选到突变体S10、S16和S21,其酶比活力较野生型分别提高了106%、74%和43%,且突变酶Kcat/Km都有所增大。其中,突变体S10氨基酸序列发生3 个突变,K 43E、N67S和I269L。三维模拟结果显示,第43位氨基酸突变为谷氨酸、第67位氨基酸突变为丝氨酸,可能提高了底物亲和力和催化效率,从而提高酶活性。圆二色谱分析表明,相比野生酶,突变酶的α-螺旋数减少、无规则卷曲有所增加,表明其刚性略有降低,柔性有所增加。利用定向进化策略能够有效地提高地衣芽孢杆菌L-天冬酰胺酶活性。
L-天冬酰胺酶;定向进化;酶活性
L-天冬酰胺酶Ⅱ(L-asparaginaseⅡ,EC3.5.1.1)可以催化L-天冬酰胺脱氨基转化成L-天冬氨酸和氨。近几年研究发现,L-天冬酰胺酶可以减少热加工食品中致癌物——丙烯酰胺的形成[1-5],而丙烯酰胺是由天冬酰胺和还原糖(果糖和葡萄糖)经美拉德反应生成[6]。采用L-天冬酰胺酶去除原料中的天冬酰胺是目前用于控制高热加工食品中丙烯酰胺含量最有效的方法。同时,对生产工艺、产品外观、风味以及营养等方面没有任何改变[7-8]。但目前L-天冬酰胺酶普遍存在稳定性差、酶活性低等问题,难以满足食品预处理的复杂环境要求。
蛋白质工程是用于克服天然酶在工业应用过程中缺陷的重要手段[9],通常蛋白质工程策略主要包括理性设计和非理性设计(定向进化)等[10]。目前国内外关于L-天冬酰胺酶分子改造方面的研究主要集中于理性设计,如Sudhir等[11]对地衣芽孢杆菌L-天冬酰胺酶进行定点突变使得氨基酸D103V发生变化;Long Shuiqing等[12]通过定点突变改变了枯草芽孢杆菌L-天冬酰胺酶氨基酸G107D,定点突变后的突变酶,催化活力和热稳定性均得到提高。而有关L-天冬酰胺酶的定向进化研究报道甚少。
本实验室在前期研究中发现地衣芽孢杆菌L-天冬酰胺酶活性很低,限制其在食品工业中的广泛应用。为提高地衣芽孢杆菌L-天冬酰胺酶活性,本研究采用易错聚合酶链式反应(polymerase chain reaction,PCR)技术与DNA shuffling相结合的方法,对地衣芽孢杆菌L-天冬酰胺酶进行分子改造,以期获得酶活性显著提高的突变体,为工业化生产L-天冬酰胺酶提供依据。
1 材料与方法
1.1 材料与试剂
pET30a(+)-BliansZ重组质粒由南京农业大学酶工程实验室构建。
LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L。
限制性内切酶SacⅠ与XhoⅠ 大连宝生物公司;2×Taq PCR M ixture、卡纳青霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG) 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JY 98-Ⅲ超声波细胞粉碎机 宁波新芝科学仪器研究所;5840R冷冻高速离心机 德国Eppendorf公司;UV-2450紫外分光光度计 日本岛津公司;PTC-100TMPCR仪 美国MJ Research公司;PowPacTM高电流电泳仪 美国Bio-Rad有限公司;JS-380C全自动数码凝胶成像仪 上海培清科技有限公司。
1.3 方法
1.3.1 易错PCR突变文库构建
以p ET 30a(+)-B liansZ重组质粒为模板,使用含有SacⅠ酶切位点(下划线)的上游引物(5’-CGAGCTCATGACGAAAAAACGAATG-3’)和含有XhoⅠ酶切位点(下划线)的下游引物(5’-CCGCTCG AGTCAATATTCTTCAAAATAGG-3’)进行易错随机诱变。易错PCR诱变体系为:0.2 mmol/L dCTP、dTTP,3/5/7mmol/L Mg2+,0.05mmol/L Mn2+,上下游引物各2.0μL,DNA模板1.0μL,2×Taq PCR M ix 25.0μL,ddH2O补足50.0μL。将第1轮PCR的有益突变质粒作为模板,进行第2轮易错PCR。易错PCR程序:94℃预变性3 m in,94℃变性40 s,58℃退火40 s,72℃延伸1 m in,30个循环,72℃延伸10 m in。1%琼脂糖凝胶电泳验证PCR产物,并使用DNA凝胶回收试剂盒进行纯化。纯化的PCR产物用SacⅠ和XhoⅠ进行双酶切,酶切后回收目的片段与pET-30a表达载体进行重组。将重组产物转入大肠杆菌BL21(DE3),构建随机诱变文库。
1.3.2 DNA shuffl ing突变文库构建
以易错PCR突变文库筛选获得酶活性最高的4个突变体基因为模板,使用Pfu聚合酶进行扩增。将等浓度的亲本DNA片段混合并用DNaseⅠ消化。消化条件为:DNaseⅠ酶0.000 4 U/μL、37 ℃消化10m in。消化完成后90 ℃加热15 m in终止消化反应。使用2%琼脂糖凝胶电泳验证,参考易错PCR纯化方法回收大小为50~100 bp的片段。将50~100 bp片段进行无引物PCR扩增,反应体系组成为25μL 50~100 bp胶回收片段,25μL 2×Taq PCR M ixture缓冲液。无引物PCR扩增程序为:94℃预变性3 m in,94℃变性30 s,58 ℃退火30 s,72℃延伸90 s,40个循环后,72 ℃延伸10 m in。再以无引物PCR纯化产物作为模板,使用1.3.1节引物扩增全长基因,建立突变文库。
1.3.3 突变体文库的高通量筛选
参考Guo Fangfang等[13]建立的重组大肠杆菌产脂肪氧合酶高通量筛选方法,稍作修改。高通量筛选方法:从LB-卡纳青霉素平板上挑取单菌落,接种到96孔板,每孔含有600 μL LB(50 μg/m L卡纳青霉素)培养基,以BlansZ作为阳性对照;37 ℃、200 r/m in培养12 h后,将20 μL菌液接种到另一含有600 μL LB(50 μg/m L卡纳青霉素)培养基中;37 ℃、200 r/m in培养至OD600nm达到0.6,加入IPTG使终质量浓度为60 μg/m L;16 ℃、200 r/m in培养16 h。离心收集菌体,50 μL质量浓度为1.5 m g/m L的溶菌酶缓冲液重悬,37 ℃水浴30 m in,-70 ℃冷冻30 m in,37 ℃溶解20 m in,反复冻融3 次破碎细胞,离心后上清液即为粗酶液。通过96 孔板高通量筛选获得酶活性提高的突变体进行摇瓶发酵复筛,以确定酶活性提高的突变体。
1.3.4 酶的表达和纯化
将重组菌单菌落接种在LB培养基(50 μg/m L卡纳青霉素)中培养10 h,按照1%的接种量转接。培养至OD600nm达到0.6时,加入IPTG使终质量浓度至100 μg/m L,16 ℃诱导16 h。离心收集菌体,50 mmol/L磷酸盐缓冲液(pH 8.0)重悬,超声破碎。破碎液离心后上清液即粗酶液。重组L-天冬酰胺酶含有组氨酸标签,使用镍柱亲和层析对野生型和突变体酶进行纯化。纯化后的蛋白用Bradford法测定蛋白质浓度[14],纯酶使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析和进行酶学性质研究。
1.3.5 酶活性的测定
参照Pradhan等[15]的方法。向700 μL磷酸盐缓冲液中加入100 μL 189 mmol/L L-天冬酰胺底物溶液和100 μL粗酶液,37 ℃水浴反应25 m in,加入100μL 1.5 mol/L三氯乙酸终止反应。12 000 r/m in离心2m in,取30 μL上清液加入到2.67 m L蒸馏水和300 μL纳氏试剂中,混匀,室温静置10 m in,测定436 nm波长处的吸光度。空白对照为先加入三氯乙酸终止反应,再进行后续的水浴处理。酶活力单位定义:在酶反应条件下,单位时间内产生1 μmol/L NH3所需的酶量为1 个酶活力单位。
1.3.6 酶学性质分析
1.3.6.1 酶的最适温度及温度稳定性
最适反应温度测定:将酶液置于25~50 ℃范围内进行酶促反应,测定酶活性。温度稳定性测定:将酶液置于50 ℃热处理8 h,间隔2 h取样,以处理0 h酶活性作为100%,测定残余酶活性。每次反应均在同等条件下设置3 个平行,去掉空白后以平均值为此条件下的酶活性。
1.3.6.2 酶的最适pH值及pH值稳定性
最适反应pH值测定:将酶液置于pH 4~10范围内,测定酶活性。pH值稳定性测定:将酶液置于pH 4~11范围内处理酶液12 h,以处理0 h酶活性作为100%,测定残余酶活性。
1.3.6.3 酶动力学参数的测定
以0.5~5 mmol/L L-天冬酰胺为底物,加入过量的纯酶液,置于最适条件下反应,测定L-天冬酰胺酶活性,通过Lineweaver-Burk作图法计算获得Km和Kcat值。
1.3.6.4 三维结构模拟及分析
将野生型氨基酸序列提交到SW ISS-MODEL服务器得到其三维结构。利用PYMOL软件分析氨基酸残基间氢键相互作用和突变位点对蛋白质二级结构的影响。
1.3.6.5 突变酶圆二色谱分析
将纯化的野生型酶和突变酶溶解在10 mmol/L磷酸缓冲液(phosphate buffer solution,PBS)(pH 8.0)中,在190~250 nm波长范围内进行扫描。蛋白质质量浓度为100 μg/m L,以缓冲液10 mmol/L PBS(pH 8.0)用作空白,分析野生型酶及突变酶蛋白质二级结构的变化情况。
2 结果与分析
2.1 突变文库高通量筛选
经两轮易错PCR,构建突变文库库容量约12 600,获得6株酶活性提高的突变体,结果见表1。由表1可知,最佳突变体F5A11,酶活性是野生型酶活性的2.26倍,其氨基酸序列有4个位点发生突变,分别为K42E、N67S、M 92V、V137I。
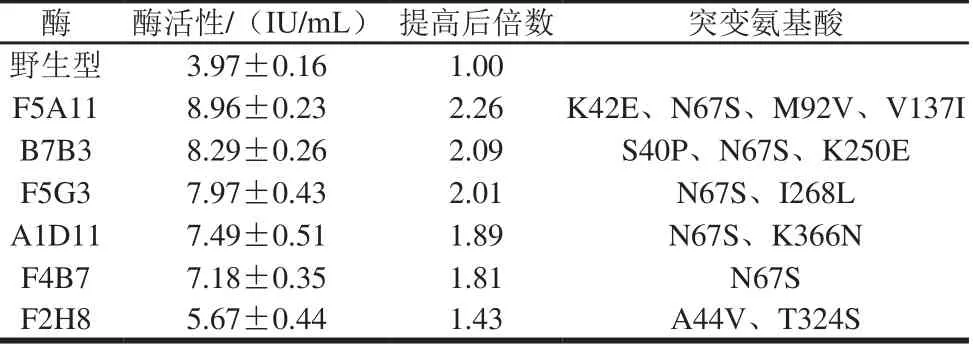
表1 野生型酶和易错PCR突变酶活性和氨基酸突变Table 1 L-asparaginase activity of the w ild-type strain and mutants generated from epPCR
以酶活性提高最多的突变体F5A 11、B7B3、F5G3和A 1D11重组质粒作为模板进行DNA shuffling,构建含有6 500 个突变体的突变文库,获得3 株酶活性显著提高的突变体,结果见表2。最佳突变酶S10,比活力为(306.59±3.21)IU/mg,比野生型酶提高106%。此突变体只发生3 个氨基酸突变,K43E、N67S和I269L。
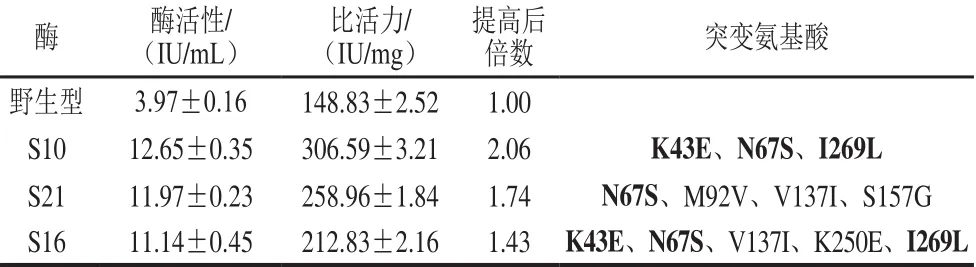
表2 野生型酶和DNA shuffl ing突变酶活性及氨基酸突变Table 2 L-asparaginase activity and the w ild-type strain and mutants generated from DNA shuffl ing
2.2 纯化酶的SDS-PAGE分析
将野生型酶和突变酶表达纯化后,通过SDS-PAGE分析,结果见图1。蛋白目的条带均在46 kD左右,与理论值相符。

图1 SDS-PAGE检测结果Fig. 1 SDS-PAGE electrophoresis of w ild-type and mutant enzymes
2.3 酶学性质分析
2.3.1 酶的最适温度及温度稳定性
将野生酶与突变酶纯酶液分别置于25~50 ℃条件下,测定酶活性,结果如图2所示。S10和S16的最适反应温度与野生酶相同,S21最适反应温度为45 ℃,高于野生型最适温度5 ℃。

图2 野生型酶和突变酶最适反应温度Fig. 2 Effects of temperature on the activity of wild-type and mutant enzymes
将野生酶与突变酶纯酶液置于50 ℃进行温度稳定性研究,结果见表3。突变酶S16和S21在50 ℃半衰期分别为9.35 h和19.12 h,分别较野生型缩短11.97 h和2.2 h,表明突变酶S16和S21的温度稳定性有所降低。突变酶S10半衰期为23.27 h,较野生型延长1.95 h,表明其温度稳定性在突变前后无较大变化。
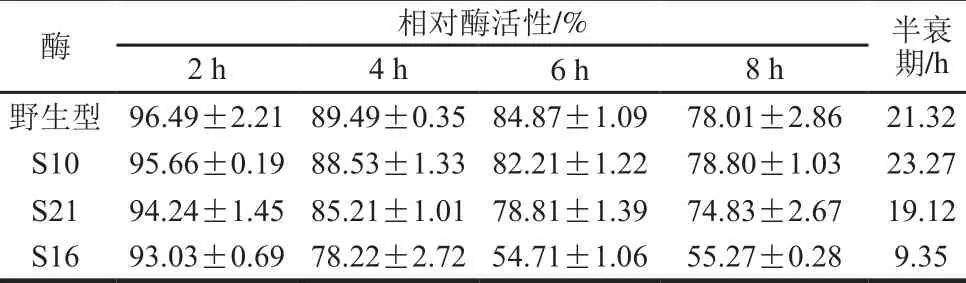
表3 野生型酶和突变酶热稳定性Tab le 3 Thermal stability of w ild-type and mutant enzymes
2.3.2 酶的最适pH值及pH值稳定性
将野生酶与突变酶液分别置于pH 4.0~10.0的缓冲液中,测定L-天冬酰胺酶活性,结果如图3所示。突变酶S10和S21与野生型酶最适反应pH值相同,而突变酶S16在pH 9.0时表现出最高酶活性。

图3 野生型酶和突变酶最适反应pH值Fig. 3 Effect of pH on the activity of w ild-type and mutant enzymes
野生酶与突变酶液在pH 4.0~11.0的缓冲液处理12 h后,相对酶活性如图4所示。在弱碱性环境范围内突变酶S10和S21均具有较高的相对酶活性,表明其具有良好的稳定性,能够更好地应用于食品加工环境。

图4 野生型酶和突变酶pH值稳定性Fig. 4 pH stability of w ild-type and mutant enzymes
2.3.3 酶的动力学参数动力学研究结果见表4,3 个突变酶的Km值均比野生型低,说明突变体酶对底物的亲和力有所增强;突变酶的Kcat/Km值都高于野生型,表明其催化效率有所提高。

表4 野生型酶和突变酶动力学参数Tab le 4 K inetics of w ild-type and mutant enzymes
2.3.4 三维结构模拟及分析
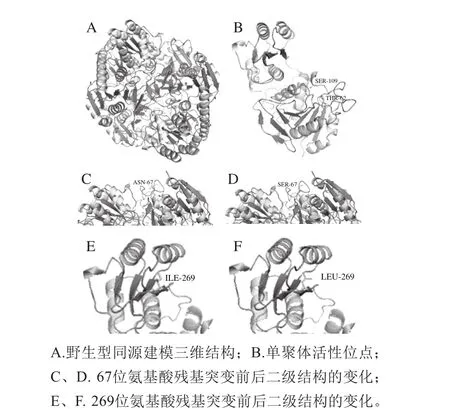
图5 地衣芽孢杆菌L-天冬酰胺酶三维建模结构Fig. 5 Protein 3-D structure of L-asparaginase from Bacillus licheniform is
为分析突变体S10、S16和S21酶活性提高的原因,拟建立蛋白质三维结构模型,从氨基酸残基间的相互作用力和空间结构的变化来分析。因地衣芽孢杆菌L-天冬酰胺酶晶体结构尚未解析,将野生型氨基酸序列提交到SW ISS-MODEL服务器,以与其序列相似度达到60.62%的同源四聚体蛋白(PDB,id:5i4B.1A)为模板得到其三维结构模型(图5A)。地衣芽孢杆菌L-天冬酰胺酶活性中心位点为62位的苏氨酸和109位的丝氨酸(图5B)。由图5B可知,活性位点位于Loop环上,靠近N末端。3 个突变体发生的主要氨基酸突变位点在第43位和第67位,因三维结构模板不全,模型无法构建第43位氨基酸残基,第67位突变前后的蛋白质二级结构变化见图5C、D。由图5可知,67位氨基酸残基位于柔性较大的Loop环上,由天冬酰胺突变为丝氨酸后可能增大了该处的柔性,更有利于单聚体间相互作用,形成完整四聚体结构进而促进催化作用[16]。突变酶S10和S16均在269位发生氨基酸突变,异亮氨酸突变为亮氨酸,两者都是脂肪族类氨基酸,性质相似,由图5E、F可知,突变前后蛋白质二级结构变化不大,表明此位点可能对酶活性无影响。
2.3.5 突变酶圆二色谱分析
表5 突变酶二级结构的比例Tab le 5 Proportions of secondary structures in mutant enzymes二级结构 比例/%野生型 S10 S16 S21 α-螺旋 38.4 39.1 35.7 36.8 β-折叠 28.2 26.5 24.6 27.1转角 4.3 3.1 5.5 4.4无规则卷曲 29.1 31.3 34.2 31.7
在圆二色谱仪190~250 nm范围内测定蛋白质的椭圆率[17],计算突变酶蛋白质二级结构比例,并对突变酶进行蛋白二级结构分析,突变酶蛋白二级结构比例见表5。由表5可知,与野生型酶相比,突变体S10的α-螺旋从38.4%增加到39.1%,无规则卷曲从29.1%增加到31.3%,整体二级结构变化不大,这与突变体S10热稳定性无明显变化的实验结果相一致。突变酶S16和S21的α-螺旋数分别由38.4%减少到35.7%和36.8%,无规则卷曲由29.1%分别增加到34.2%和31.7%。研究表明,α-螺旋具有维持蛋白质结构稳定的作用[18],无规则卷曲的增加提高了蛋白质柔性结构,不利于维持蛋白质的稳定性[19-21],这与热稳定性研究结果相一致。
3 讨 论
目前关于L-天冬酰胺酶分子改造方面的研究,主要针对酶催化活力和稳定性的提高,国内外学者大部分采用理性设计的方法。如2007年,Li Liangzhu等[22]通过用脯氨酸替代位于氢键环内的Asp178获得大肠杆菌D178P突变体,突变体具有较高的热稳定性,且不影响酶活性;Shikha等[23]通过替换表面氨基酸残基得到几株酶活性和稳定性均提高的突变株;2014年,Vidya等[24]通过对大肠杆菌克隆的ansB基因的定点诱变研究了表面电荷对L-天冬酰胺酶Ⅱ的稳定性的影响。而关于L-天冬酰胺酶定向进化研究的报道甚少,只有2009年Georgia等[25]使用定向进化方法建立来源于欧文氏菌(Erw inia)的L-天冬酰胺酶突变文库,获得热稳定性有所改善的突变体Asp133Val。
本研究利用易错PCR和DNA shuffling策略对地衣芽孢杆菌L-天冬酰胺酶基因进行随机突变,从19 100 个突变株中获得酶活性提高的3个突变体S10、S16和S21,突变酶比活较野生型分别提高106%、74%和43%。最佳突变体S10酶比活力达到(306.59±3.21)IU/m g,高于张显[26]、Long Shuiqing[12]等定点突变的最佳突变体酶活性。动力学研究结果表明突变酶S10的Km值为0.598 mmol/L,高于野生型酶(0.692 mmol/L),Kcat/Km为522.26 L/(mmol·m in),较野生型提高75%,说明该突变酶对底物的亲和力有所增强,同时催化效率也大幅度提高,该结果优于Saurabh[27]、Long Shuiqing[12]等定点突变后突变酶催化效率。
为探究突变酶酶活性提高的原因,对野生型氨基酸序列进行三维结构模拟,结果见图5。突变体S10、S16和S21都在第67位发生突变,该位点氨基酸残基由天冬酰胺突变为丝氨酸。此突变位点位于Loop环上,靠近四聚体催化活性中心界面,且丝氨酸侧链较短,是一种柔性较大的强亲水性氨基酸。圆二色谱结果显示,相比野生酶,突变酶的α-螺旋减少、无规则卷曲有所增加,表明其刚性略有降低,这与热稳定性研究结果相一致[18-21];柔性有所增加,突变酶Loop环结构与野生酶相比有所上升,柔性结构的增大可能增加了Loop环结构,利于酶与底物结合和产物的释放,提高了转化效率,这可能是这3 个突变酶活性提高的主要原因[28-29]。在突变体S10和S16中都发生第43位赖氨酸突变为谷氨酸,但因其三维结构模板不全,模型无法构建出第43位氨基酸残基。推测第43位赖氨酸突变为谷氨酸后,在此位点引入了更多的氢键相互作用,可能增加了酶分子和底物间的氢键相互作用,提高了底物亲和力[19,23,30]。另一方面,谷氨酸携带强的负电荷,可与正电离子相互作用,降低催化反应的活化能,从而提高酶的催化效率[27]。
本研究通过定向进化技术提高地衣芽孢杆菌L-天冬酰胺酶的酶活性,提高了该酶的工业应用潜力,说明利用定向进化策略能够有效地提高地衣芽孢杆菌L-天冬酰胺酶活性。
[1] FRIEDMAN M. Chemistry, biochemistry, and safety of acrylamide. A review[J]. Journal of Agricultural and Food Chem istry, 2003, 51(16):4504-4526. DOI:10.1021/jf030204.
[2] W ILSON K M, RIMM E B, THOMPSON K M, et al. Dietary acrylamide and cancer risk in humans: a review[J]. Journal Für Verbraucherschutz Und Lebensm ittelsicherheit, 2006, 1(1): 19-27. DOI:10.1007/s00003-006-0005-6.
[3] ANSSE M, QUARTA B, PELOUX L, et al. Effect of formulation on the capacity of L-asparaginase to m inim ize acrylam ide formation in short dough biscuits[J]. Food Research International, 2011, 44(9):2837-2842. DOI:10.1016/j.foodres.2011.06.025.
[4] MOHAN N S, SHIMRAY C A, INDRANI D, et al. Reduction of acrylam ide formation in sweet bread w ith L-asparaginase treatment[J].Food and Bioprocess Technology, 2013, 7(3): 741-748. DOI:10.1007/s11947-013-1108-6.
[5] MEDEIROS R, MESTDAGH F, DEMEULENAER B, et al.Acrylamide formation in fried potato products—present and future,a critical review on mitigation strategies[J]. Food Chem istry, 2012,133(4): 1138-1154. DOI:10.1016/j.foodchem.2011.08.001.
[6] SALOME M F P, CARRASCO J A, GRANBY K. Patented techniques for acrylam ide m itigation in high-temperature[J]. Recent Patents on Food, Nutrition & Agriculture, 2011, 3: 158-171.
[7] CAPUANO E, FERRIGNO A, ACAMPA I, et al. Effect of flour type on Maillard reaction and acrylam ide formation during toasting of bread crisp model system s and m itigation strategies[J]. Food Research International, 2009, 42(9): 1295-1302. DOI:10.1016/j.foodres.2009.03.018.
[8] KUKUROVA K, MORALES F J, BEDNARIKOVA A, et al. Effect of L-asparaginase on acrylam ide m itigation in a fried-dough pastry model[J]. Molecular Nutrition & Food Research, 2009, 53(12): 1532-1539. DOI:10.1002/mnfr.200800600.
[9] BÖTTCHER D, BORNSCHEUER U T. Protein engineering of m icrobial enzymes[J]. Current Opinion in M icrobiology, 2010, 13(3):274-282. DOI:10.1016/j.m ib.2010.01.010.
[10] YANG H Q, LU X Y, LIU L, et al. Fusion of an Oligopeptide to the N term inus of an alkaline α-amylase from Alkalimonasamylolytica simultaneously improves the enzyme’s catalytic efficiency, thermal stability, and resistance to oxidation[J]. Applied and Environmental M icrobiology, 2013, 79(9): 3049-3058. DOI:10.1128/AEM.03785-12.
[11] SUDHIR A P, AGARWAAL V V, DAVE B R, et al. Enhanced catalysis of L-asparaginase from Bacillus licheniformis by a rational redesign[J]. Enzyme and M icrobial Technology, 2016, 86: 1-6.DOI:10.1016/j.enzm ictec.2015.11.010.
[12] LONG S Q, ZHANG X, RAO Z, et al. Am ino acid residues adjacent to the catalytic cavity of tetramer L-asparaginaseⅡ contribute significantly to its catalytic efficiency and thermostability[J].Enzyme and M icrobial Technology, 2015, 82: 15-22. DOI:10.1016/j.enzm ictec.2015.08.009.
[13] GUO F F, ZHANG C, BIE X M, et al. Improving the thermostability and activity of lipoxygenase from Anabaena sp. PCC 7120 by directed evo lution and site-directed mutagenesis[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 107: 23-30. DOI:10.1016/j.MOLCATB.2014.05.016.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of m icrogram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochem istry, 1976, 72(1/2): 248-254.DOI:10.1016/0003-2697(76)90527-3.2.
[15] PRADHAN B, DASH S, SAHOO S. Screening and characterization of extracelluar L-asparaginase producing Bacillus subtilis strainhswx88,isolated from Taptapanihotspring of Odisha, India[J]. Asian Pacific Journal of Tropical Biomedicine, 2013, 3(12): 936-941. DOI:10.1016/S2221-1691(13)60182-3.
[16] MEZENTSEV Y V, MOLNAR A A, SOKOLOV N N, et al.Specificity of molecularrecognition in oligomerization of bacterial L-asparaginases[J]. Biochem istry(M oscow) Supp lement Series B: Biomedical Chem istry, 2011, 5(2): 124-134. DOI:10.1134/S1990750811020107.
[17] MOHSEN M, ZARGHAM S, AZADEH E H, et al. Enhancing activity and thermostability of lipase A from Serratiamarcescens by sitedirected mutagenesis[J]. Enzyme and M icrobial Technology, 2016, 94:18-28. DOI:10.1016/j.enzm ictec.2016.07.006.26.
[18] SELVARAJ S, GORM IHA M M. Importance of long-range interaction in (α/β)8barrel fold[J]. Journal of Protein Chem istry, 1998, 17: 691-697. DOI:10.1007/BF02780972.28.
[19] KIM M S, LEI X G. Enhancing thermostability of Escherichia coli phytase AppA 2 by error-prone PCR[J]. Applied M icrobiology and Biotechnology, 2008, 79(1): 69-75. DOI:10.1007/s00253-008-1412-7.
[20] YUEN C M, LIU D R. Dissecting protein structure and function using directed evolution[J]. Nature Methods, 2007, 4(12): 995-997.DOI:10.1038/nmeth1207-995.
[21] KAMAL M Z, AHMAD S, MOLUGU T R, et al. In vitro evolved nonaggregating and thermostable lipase: structural and thermodynam ic investigation[J]. Journal of Molecular Biology, 2011, 413(3): 726-741.DOI:10.1016/j.jmb.2011.09.002.
[22] LI L Z, X IE T H, LI H J, et al. Enhancing the thermostability of L-asparaginaseⅡ by substitution w ith pro in predicted hydrogenbonded turn structures[J]. Enzyme and M icrobial Technology, 2007,41(4): 523-527.
[23] SHIKHA V, RANJIT K M, PRASANTA M, et al. Improvement of stability and enzymatic activity by site-directed mutagenesis of E. coli asparaginaseⅡ[J]. Biochim ica et Biophysica Acta, 2014, 1844(7):1219-1230. DOI:10.1016/j.bbapap.2014.03.013.
[24] VIDYA J, USHASREE M V, PANDEY A. Effect of surface charge alteration on stability of L-asparaginaseⅡ from Escherichia sp.[J].Enzyme & M icrobial Technology, 2014, 56(6): 15-19.
[25] KOTZIA G A, LABROU N E. Engineering thermal stability of L-asparaginase by in vitro directed evolution[J]. FEBS Journal, 2009,276: 1750-1761.
[26] 张显, 龙水清, 饶志明, 等. 定点突变提高枯草芽孢杆菌L-天冬酰胺酶的活力及稳定性[J]. 食品与生物技术学报, 2015, 34(11): 1128-1134.
[27] SAURABH B, ANKIT S, GOUTAM M, et al. Hyperthermophilic asparaginase mutants with enhanced substrate affinity and antineoplastic activity: structural insights on their mechanism of action[J]. Faseb Journal,2012, 26(3): 1161-1171. DOI:10.1096/fj.11-191254.
[28] TSOU C L. Location of the active sites of some enzymes in lim ited and flexible molecular regions[J]. Trends in Biochem ical Sciences,1986, 11(10): 427-429. DOI:10.1016/0968-0004(86)90178-7.
[29] VERMA S, MEHTA R K, MA ITI P, et al. Im p rovement o f stability and enzymatic activity by site-directed mutagenesis of E. coli asparaginaseⅡ[J]. Biochim ica et Biophysica Acta (BBA)-Proteins and Proteom ics, 2014, 1844(7): 1219-1230. DOI:10.1016/j.bbapap.2014.03.013.
[30] WONG K S, FONG W P, TSANG P W. A single Phe54Tyr substitution im proves the catalytic activity and thermostability of Trigonopsis variabilis D-am ino acid oxidase[J]. New Biotechnology, 2009, 27(1):78-84. DOI:10.1016/j.nbt.2009.11.002.
Improving L-Asparaginase Activity from Bacillus licheniformis by Directed Evolution
SHAO Zexiang, JIAO Linshu, LU Zhaoxin, BIE Xiaomei, ZHAO Haizhen, ZHANG Chong, LÜ Fengxia*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
In order to improve its L-asparaginase activity, the L-asparaginase gene of Bacillus licheniformis was molecularly modified by directed evolution. Mutants S10, S16 and S21 were screened out of more than 19 100 mutants by two rounds of error-prone PCR and one round of DNA shuffl ing, whose specific activities were increased by 106%, 74% and 43%,respectively, as compared to that of the w ild type, together increased Kcat/Km. The am ino acid sequence of S10 showed three mutations, K43E, N67S and I269L. The results of three-dimensional simulation showed that amino acid mutations at position 43 for glutam ic acid and at position 67 for serine may improve substrate affinity and catalytic efficiency, thereby increasing enzymatic activity. The circular dichroism analysis showed that the mutant enzymes contained less α-helix and more random coil than the w ild enzyme, indicating a slight decrease in rigidity and an increase in flexibility. This study indicates that directional evolution can effectively improve the L-asparaginase activity from B. licheniformis.
L-asparaginase; directed evolution; enzyme activity
10.7506/spkx1002-6630-201722002
TS201.3
A
1002-6630(2017)22-0008-06
邵泽香, 焦琳舒, 陆兆新, 等. 基于定向进化技术提高地衣芽孢杆菌L-天冬酰胺酶活性[J]. 食品科学, 2017, 38(22): 8-13.
DOI:10.7506/spkx1002-6630-201722002. http://www.spkx.net.cn
SHAO Zexiang, JIAO Linshu, LU Zhaoxin, et al. Improving L-asparaginase activity from Bacillus licheniformis by directed evolution[J]. Food Science, 2017, 38(22): 8-13. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722002.http://www.spkx.net.cn
2017-05-11
国家自然科学基金面上项目(31671800)
邵泽香(1990—),女,硕士研究生,主要从事食品微生物研究。E-mail:2014108005@njau.edu.cn
*通信作者:吕凤霞(1963—),女,教授,博士,主要从事酶工程研究。E-mail:lufengxia@njau.edu.cn

