淋巴细胞特有重组激活基因蛋白载体构建及功能鉴定
赵小惠,李 琛,张 华,郑铭喆,季延红 (西安交通大学医学部基础医学院病原生物学和免疫学系,陕西西安710061)
淋巴细胞特有重组激活基因蛋白载体构建及功能鉴定
赵小惠,李 琛,张 华,郑铭喆,季延红 (西安交通大学医学部基础医学院病原生物学和免疫学系,陕西西安710061)
目的:淋巴细胞特异性重组激活基因(RAG)蛋白1和2共同组成的RAG重组酶是造成淋巴细胞发育及产生抗体多样性的关键性蛋白.本研究构建并优化同时表达RAG1和RAG2的慢病毒载体,为研究RAG1和RAG2的结构和功能奠定基础.方法:构建同时表达RAG1、RAG2和绿色荧光蛋白(GFP)的载体;Western Blotting验证该载体RAG1和RAG2蛋白表达;体外重组实验证实该载体表达的RAG蛋白具有催化断裂DNA的功能.结果:构建了表达RAG重组酶的载体pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP;Western Blotting验证了该载体表达RAG1和RAG2蛋白,并显示该载体RAG1和RAG2蛋白的表达量具有较高的一致性.体外重组实验证实该载体表达的RAG1和RAG2组成的重组酶具有更好的催化断裂DNA的活性.结论:优化后的pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体可以保证RAG1和RAG2同时有效表达,GFP可作为荧光标记,为后续细胞以及动物实验奠定基础.
载体优化;重组激活基因蛋白;P2A序列;绿色荧光蛋白(GFP)
0 引言
哺乳动物免疫应答主要依赖于B或T淋巴细胞在发育过程中通过基因重排产生多样性的免疫球蛋白(immunoglobulins,Igs)或T细胞受体(T⁃cell receptors,Tcrs)分子.Igs和Tcrs分别包括Igh、Igκ、Igλ和Tcrβ、Tcrα、Tcrδ、Tcrγ7个抗原受体基因位点.每个抗原受体基因在淋巴前体细胞或非淋巴细胞中以无翻译表达蛋白功能的胚系基因片段簇形式存在,表现为每个基因位点的5'端含有多个可变区(varia⁃ble,V)和连接区(joining,J)基因片段,3'端含有数个恒定区(constant,C)基因片段.此外,Igh、Tcrβ和Tcrδ在V和J基因片段中间还含有多样区(diversity,D)基因片段,V、D和J基因片段的重排过程称为V(D)J重组[1].这些特异性基因片段的V(D)J重组是由淋巴细胞特有的重组激活基因(recombination activating gene,RAG1和RAG2)编码的重组激活基因蛋白(RAG1和RAG2)组成的RAG重组酶(后简称RAG),结合于V、D、J基因片段旁的重组信号序列(recombination signal sequence,RSS),催化基因片段和RSS之间的DNA断裂.然后通过传统的非同源末端连接途径(non⁃ho⁃mologous end joining,NHEJ)将断裂的基因片段组合在一起,形成编码抗原受体可变区的基因,与编码恒定区基因共同转录翻译形成完整的Igs或Tcrs分子[2].RSS是由5'端高度保守的回文结构——七聚体Heptamer(5'⁃CACAGTG⁃3'),3'端富含A/T碱基的九聚体Nonamer(5'⁃ACAAAAACC⁃3')组成,和它们之间序列相对不保守,但长度固定在12 bp或23 bp空间间隔序列,把间隔序列长度为12 bp或23 bp的RSS分别称为12RSS或23RSS.正常的V(D)J重组只发生在一个12RSS和一个23RSS之间,这种限制特点称为12/23规则[3-4].淋巴细胞特有的重排机制不仅对其发育和产生获得性免疫应答起着决定性作用,而且V(D)J重组过程出现错误也可以促进淋巴系统恶性肿瘤的发生[2].
小鼠全长RAG1(full length RAG1,fRAG1)含有1040个氨基酸,是重组酶必需的催化活性单位[5].fRAG1从功能上分为两部分,羧基端384⁃1008氨基酸为核心区(core RAG1,cRAG1),氨基端的1⁃383氨基酸为非核心区(non⁃core RAG1)[6-7].390⁃448氨基酸区域称为九聚体结合域(nonamer binding domain,NBD),能够结合RSS的nonamer;528⁃760氨基酸区域能够与RAG2相互作用并执行RAG催化断裂DNA的功能[8-9].小鼠全长RAG2(full length RAG2,fRAG2)包括527个氨基酸,是RAG重组酶必需的辅助单位[10-13].fRAG2在功能上也分为核心区和非核心区,氨基端的1⁃383氨基酸为核心区(core RAG2,cRAG2),羧基端384⁃527氨基酸为非核心区(non⁃core RAG2)[5].尽管RAG2本身没有直接结合DNA的活性,但可以与RAG1相互作用,增强RAG1结合DNA的亲和力,是RAG催化断裂DNA必不可少的单位[14].RAG2的非核心区包含多个调控功能,非核心区的414⁃487氨基酸称为植物同源结构域(plant homeodomain⁃finger,PHD⁃finger),能够特异性地识别三甲基化修饰的组蛋白H3K4(H3K4me3),引导RAG2结合到活化的染色质区增强RAG的催化断裂活性[15-18].RAG2氨基酸序列的第490位的苏氨酸(threonine,T)位点对于调节RAG2的稳定性起着重要的作用.RAG2非核心区360⁃408富含酸性氨基酸,称为酸性铰链区(acidic hinge region),可以调控RAG介导的V(D)J重组DSB以c⁃NHEJ进行修复,起着维持基因组稳定性的作用[19-21].本研究通过构建同时表达RAG1和RAG2的慢病毒载体,并对其进行优化,验证它们的表达及功能,为进一步深入研究RAG1和RAG2的结构和功能奠定基础.
1 材料和方法
1.1 材料pWPI⁃fRAG1、pWPI⁃fRAG2、pMSCV⁃P2A⁃Thy1.1、pWPI⁃IRES⁃GFP、pWPI⁃RAG1⁃IRES⁃RAG2质粒和重组载体pMX⁃Thy1.1均由本实验室提供.293T细胞储存于液氮中.RAG1、RAG2抗体由Schatz lab提供.FuGENE⁃6(Cat#1814443,Roche)、抗hCD4抗体(Cat#555347,abcam)、抗Thy1.1抗体(Cat#561409,abcam).PCR扩增引物见表1.
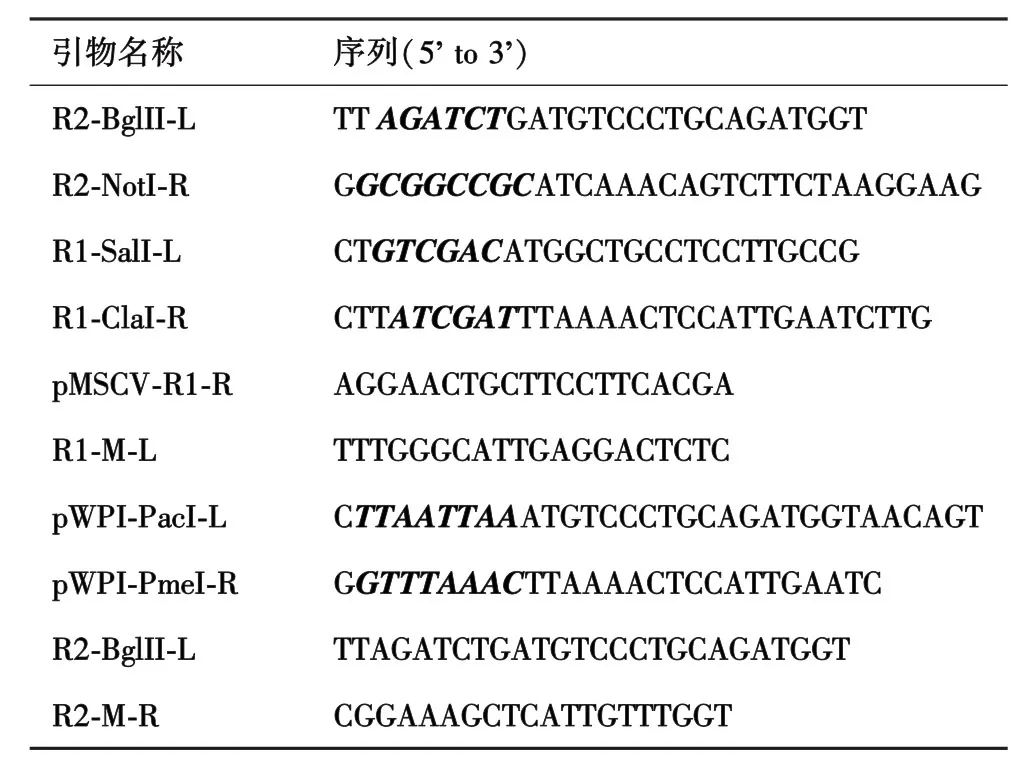
表1 引物序列
1.2 方法
1.2.1 构建pMSCV⁃RAG2⁃P2A⁃Thy1.1载体 设计末端带有BglII、NotI限制性酶切位点和能够扩增全长RAG2的引物,以pWPI⁃fRAG2为模板,利用表1引物R2⁃BglII⁃L和R2⁃NotI⁃R按94℃、30 s,58℃、30 s,72℃、1 min,30 cycles的步骤PCR扩增并获得全长RAG2,并利用BglII、NotI限制性核酸内切酶消化全长RAG2片段及pMSCV⁃P2A⁃Thy1.1载体,通过T4连接酶将全长RAG2连接到pMSCV⁃P2A⁃Thy1.1上,利用表1引物R2⁃BglII⁃L、R2⁃NotI⁃R进一步进行菌液PCR、酶切鉴定阳性克隆并测序,获得序列正确的pMSCV⁃RAG2⁃P2A⁃Thy1.1载体.
1.2.2 构建pMSCV⁃RAG2⁃P2A⁃RAG1⁃Thy1.1载体
设计末端带有SalI、ClaI限制性酶切位点和能够扩增全长RAG1的引物,以pWPI⁃fRAG1为模板,利用表1引物R1⁃SalI⁃L和R1⁃ClaI⁃R按照94℃、30 s,58℃、1 min,72℃、1 min,30 cycles的步骤进行PCR扩增并获得全长RAG1,并利用SalI、ClaI限制性核酸内切酶消化全长RAG1片段及pMSCV⁃RAG2⁃P2A⁃Thy1.1载体,通过T4连接酶将全长RAG1连接到pMSCV⁃RAG2⁃P2A⁃Thy1.1上,利用表1引物pMSCV⁃R1⁃R、R1⁃M⁃L,按照94℃、30 s,60℃、30 s,72℃、1 min,30 cycles的步骤进一步进行菌液PCR、酶切鉴定阳性克隆并测序,获得序列正确的pMSCV⁃RAG2⁃P2A⁃RAG1⁃Thy1.1载体.
1.2.3 构建pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体
设计末端带有PacI、PmeI限制性酶切位点和能够扩增全长RAG2⁃P2A⁃RAG1的引物,以pMSCV⁃RAG2⁃P2A⁃RAG1⁃Thy1.1为模板,利用表1引物pWPI⁃PacI⁃L、pWPI⁃PmeI⁃R,按照94℃、1 min,60℃、1 min,72℃、2 min,30 cycles的步骤PCR扩增并获得全长RAG1,利用PacI、PmeI限制性核酸内切酶消化全长RAG2⁃P2A⁃RAG1片段及pWPI⁃IRES⁃GFP载体,通过T4连接酶将全长RAG2⁃P2A⁃RAG1连接到pWPI⁃IRES⁃GFP上,利用表1引物R2⁃BglII⁃L、R2⁃M⁃R、按照94℃、30 s,58℃、30 s,72℃、1 min,30 cycles的步骤进一步进行菌液PCR、酶切鉴定阳性克隆并测序,获得序列正确的pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体.
1.2.4 载体转染293T细胞 用FuGENE⁃6转染法将pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体转染293T细胞,37℃培养72 h.
1.2.5 Western Blotting实验 收集转染后的293T细胞并提取蛋白,测定蛋白浓度,加入3×SDS,100℃变性10 min;配制分离胶(8%)和浓缩胶(4%),每孔上样20 μg,电泳结束以后采用湿转的方法进行转膜,100 V恒压转PVDF膜,电流差达到250 mA停止转膜.将膜置于5%牛奶封闭液中封闭,室温下在摇床上孵育2 h.按照1∶1000稀释RAG1、RAG2抗体,置于4℃摇床上孵育过夜;第二天用TBST洗膜3次,15 min/次;用5%牛奶稀释二抗(1∶5000稀释),室温下在摇床上避光孵育45 min;用TBST洗膜3次,20 min/次;用ECL发光液进行显影.
1.2.6 体外重组实验 pWPI⁃RAG1⁃IRES⁃RAG2或pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体分别跟pMX⁃Thy1.1重组载体一起转染293T细胞,72 h荧光显微镜下观察GFP表达,随后收集细胞.取1×106上述转染的293T细胞,4℃,1500 rpm,离心5 min,弃上清,预冷1×PBS洗2次,100 μL预冷1×PBS重悬.每管加入5 μL hCD4抗体,2 μL Thy1.1抗体,4℃,避光,20 min,预冷1×PBS洗2次,500 μL预冷1×PBS重悬细胞,过滤,流式细胞仪检测.
2 结果
2.1 构建pWPI-RAG2-P2A-RAG1-IRES-GFPPCR扩增带有BglII,NotI限制性酶切位点的全长RAG2序列(图1A).用BglII,NotI限制性内切酶消化全长RAG2的DNA以及pMSCV⁃P2A⁃Thy1.1载体,克隆形成pMSCV⁃RAG2⁃P2A⁃Thy1.1载体,利用引物R2⁃BglII⁃L和R2⁃NotI⁃R进行菌液PCR鉴定阳性克隆(图1B),将阳性克隆提质粒后酶切并测序(图1C).PCR扩增带有SalI,ClaI酶切位点的全长RAG1序列(图1D),克隆形成pMSCV⁃RAG2⁃P2A⁃RAG1⁃Thy1.1载体,利用引物pMSCV⁃R1⁃R、R1⁃M⁃L进行菌液PCR鉴定阳性克隆(图1E),将阳性克隆提质粒后酶切并测序(图1F).PCR扩增带有PacI,PmeI限制性酶切位点的全长RAG2⁃P2A⁃RAG1序列(图1G),用PacI,PmeI限制性内切酶消化全长RAG2⁃P2A⁃RAG1的DNA以及pWPI⁃IRES⁃GFP载体,形成pW⁃PI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体,利用引物R2⁃BglII⁃L、R2⁃M⁃R进行菌液PCR,将阳性克隆提质粒后酶切并测序(图1H、I).
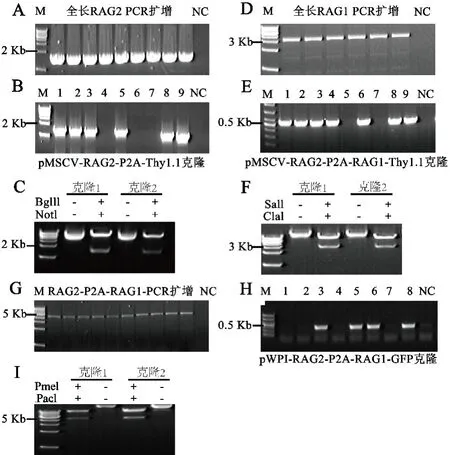
图1 pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体构建过程
2.2 pWPI-RAG2-P2A-RAG1-IRES-GFP载体表达RAG1、RAG2和GFP成功构建pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体(图2A),将其和实验室原有的pWPI⁃RAG1⁃IRES⁃RAG2载体分别转染293T细胞,72 h后收集细胞.流式细胞术显示pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP表达GFP,效率为93%(图2B).提取细胞蛋白,蛋白定量后Western Blotting检测RAG1和RAG2蛋白表达,显示pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体两种蛋白的表达量一致性高于PWPI⁃RAG1⁃IRES⁃RAG2载体(图2C).
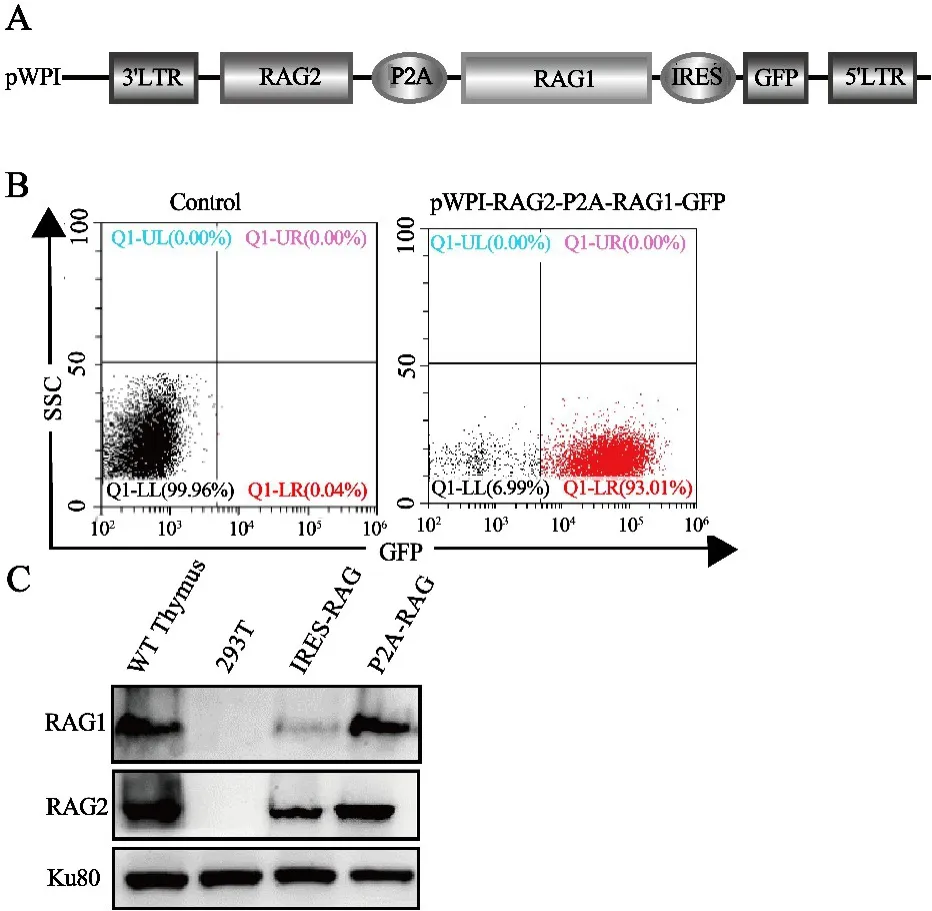
图2 pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体表达RAG1和RAG2
2.3 pWPI-RAG2-P2A-RAG1-IRES-GFP载体具有催化断裂RSS的功能重组pMX⁃Thy1.1载体含有hCD4序列为标记基因,反义的Thy1.1的序列为报告基因,其两端分别为12RSS和23RSS.RAG结合并断裂pMX⁃Thy1.1载体12RSS和23RSS,通过NHEJ途径把断裂的DNA连接在一起,反义的Thy1.1序列倒置成正义序列,断端被修复,载体即可表达Thy1.1(图3A).pWPI⁃RAG1⁃IRES⁃RAG2和pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP转染293T细胞,pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP转染后的细胞荧光显微镜下可观察到GFP绿色荧光(图3B).验证RAG重酶组的功能验证时,流式结果显示转染pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体的293T细胞表达12.9%,pWPI⁃RAG1⁃IRES⁃RAG2载体表达7.9%.说明pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体表达重组酶的活性高于pWPI⁃RAG1⁃IRES⁃RAG2载体表达重组酶的活性(图3C).
3 讨论
目前,慢病毒载体已经被作为一种常用的基因表达工具,广泛应用于基因治疗等其他研究领域[22].对于基础研究者来说,设计并构建功能完整的慢病毒载体是进行后续基础研究的基石.淋巴细胞发育过程中经历的基因重排对其发育和产生获得性免疫起决定性作用,反之,这种基因的重排过程出现错误将导致淋巴系统恶性肿瘤的发生.介导重组的蛋白为RAG重组酶,由RAG1和RAG2共同组成.因此,建立RAG1和RAG2同时有效表达的载体对研究淋巴细胞发育和RAG异常表达造成淋巴系统恶性增殖性疾病至关重要.
内部核糖体进入位点(internal ribosome entry site,IRES)序列来源于脑心肌炎病毒,其被广泛应用的原因如下.①位于IRES上下游基因可以同时表达;②促进核糖体结合在mRNA上,并促使不同位点的mRNA进行翻译[23].因此,IRES连接的两个基因可以被同时转录并翻译,使两种蛋白同时表达.但研究发现含有IRES序列的载体其上下游基因表达水平不一致[24].小RNA病毒如手足口病病毒和马鼻炎病毒等含有特定的2A序列,研究证实2A肽段由18~22个氨基酸组成,其C末端序列高度保守,为⁃AspxGluxAsnProGlyPro⁃,这种肽段能在其C末端介导多聚蛋白的剪切,而剪切断裂常发生在Gly⁃Pro残基之间[25].但2A肽剪切蛋白的功能并不通过蛋白水解酶作用,而是经“核糖体跳跃”实现的[26],研究认为2A肽改变了核糖体的活性,促进2A肽残基Gly与tRNAGly之间的酯链水解,所以从转录复合物上释放上游多肽的同时又推进了下游蛋白的翻译,从而可以保证2A肽上下游蛋白同时表达.研究[27]表明2A肽上下游蛋白的同时有效表达可以避免IRES上下游蛋白表达不一致的缺点,所以本研究通过应用P2A这种2A肽构建表达重组激活基因蛋白的载体,并证实了P2A序列连接的RAG1与RAG2蛋白表达量一致性高于由IRES序列连接的RAG1与RAG2蛋白;在功能方面,含有P2A序列载体表达的RAG蛋白结合与断裂DNA的活性也高于含有IRES序列的载体;而且pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP载体具有绿色荧光蛋白标记,对后期载体转染细胞检测转染效率、分选等都提供了便利.
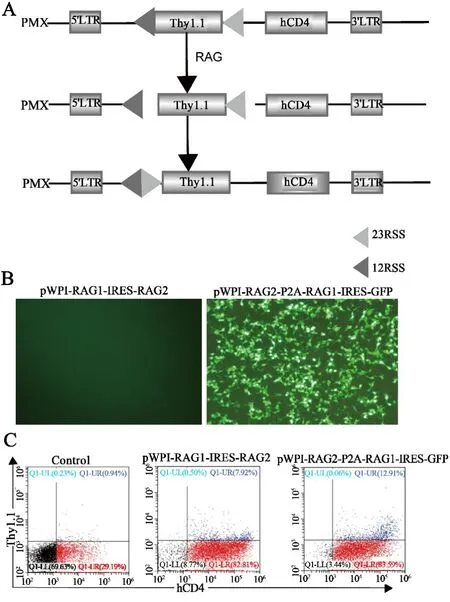
图3 流式检测Thy1.1表达量
本研究结果表明,优化后的重组激活基因蛋白载体的两种蛋白RAG1与RAG2表达效率高于实验室原有的表达RAG重组酶的载体,同时也增强了RAG蛋白的功能,其带有的绿色荧光蛋白也为载体提供了荧光标记,这为研究RAG重组酶对淋巴细胞发育及淋巴细胞恶性肿瘤的作用提供了更好的实验基础.
[1] Helmink BA,Sleckman BP.The response to and repair of RAG⁃mediatedDNA double⁃strand breaks[J].Annu Rev Immunol,2012,30:175-202.
[2] Schatz DG,Ji Y.Recombination centres and the orchestration of V(D)J recombination[J].Nat Rev Immunol,2011,11(4):251-263.
[3] Schatz DG,Swanson PC.V(D)J recombination:mechanisms of initiation[J].Annu Rev Genet,2011,45:167-202.
[4] Pulivarthy SR,Lion M,Kuzu G,et al.Regulated large⁃scale nucleosome density patterns and precise nucleosome positioning correlate with V(D)J recombination[J].Proc Natl Acad Sci USA,2016,113(42):E6427-E6436.
[5] De P,Rodgers KK.Putting the pieces together:identification and characterization of structural domains in the V(D)J recombination protein RAG1[J].Immunol Rev,2004,200:70-82.
[6] Kumar A,Bhandari A,Sarde SJ,et al.Data on the evolutionary history of the V(D)J recombination⁃activating protein 1⁃RAG1 coupled with sequence and variant analyses[J].Data Brief,2016,8:87-92.
[7] Callebaut I,Mornon JP.The V(D)J recombination activating protein RAG2 consists of a six⁃bladed propeller and a PHD fingerlike domain,as revealed by sequence analysis[J].Cell Mol Life Sci,1998,54(8):880-891.
[8] McMahan CJ,Sadofsky MJ,Schatz DG.Definition of a large region of RAG1 that is important for coimmunoprecipitation of RAG2[J].J Immunol,1997,158(5):2202-2210.
[9] Huye LE,Purugganan MM,Jiang MM,et al.Mutational analysis of all conserved basic amino acids in RAG⁃1 reveals catalytic,step arrest,and joining⁃deficient mutants in the V(D)J recombinase[J].Mol Cell Biol,2002,22(10):3460-3473.
[10] Rodgers KK,Bu Z,Fleming KG,et al.A zinc⁃binding domain involved in the dimerization of RAG1[J].J Mol Biol,1996,260(1):70-84.
[11] Landree MA,Wibbenmeyer JA,Roth DB.Mutational analysis of RAG1 and RAG2 identifies three catalytic amino acids in RAG1 critical for both cleavage steps of V(D)J recombination[J].Genes Dev,1999,13(23):3059-3069.
[12] Swanson PC.The bounty of RAGs:recombination signal complexes and reaction outcomes[J].Immunol Rev,2004,200:90-114.
[13] Fugmann SD,Lee AI,Shockett PE,et al.The RAG proteins and V(D)J recombination:complexes,ends,and transposition[J].Annu Rev Immunol,2000,18:495-527.
[14] Fugmann SD,Schatz DG.Identification of basic residues in RAG2 critical for DNA binding by the RAG1⁃RAG2 complex[J].Mol Cell,2001,8(4):899-910.
[15] Bettridge J,Na CH,Pandey A,et al.H3K4me3 induces allosteric conformational changes in the DNA⁃binding and catalytic regions of the V(D)J recombinase[J].Proc Natl Acad Sci U S A,2017,114(8):1904-1909.
[16] Elkin SK,Ivanov D,Ewalt M,et al.A PHD finger motif in the C terminus of RAG2 modulates recombination activity[J].J Biol Chem,2005,280(31):28701-28710.
[17] Shimazaki N,Tsai AG,Lieber MR.H3K4me3 stimulates the V(D)J RAG complex for both nicking and hairpinning in trans in addition to tethering in cis:implications for translocations[J].Mol Cell,2009,34(5):535-544.
[18] Liu Y,Subrahmanyam R,Chakraborty T,et al.A plant homeodomain in RAG⁃2 that binds Hypermethylated lysine 4 of histone H3 is necessary for efficient antigen⁃receptor⁃gene rearrangement[J].Immunity,2007,27(4):561-571.
[19] Dong Y,Liu F,Wu C,et al.Illegitimate RAG⁃mediated recombination events are involved in IKZF1 Δ3⁃6 deletion in BCR⁃ABL1 lymphoblastic leukaemia[J].Clin Exp Immunol,2016,185(3):320-331.
[20] Coussens MA,Wendland RL,Deriano L,et al.RAG2's acidic hinge restricts repair⁃pathway choice and promotes genomic stability[J].Cell Rep,2013,4(5):870-878.
[21] Gigi V,Lewis S,Shestova O,et al.RAG2 mutants alter DSB repair path⁃way choice in vivo and illuminate the nature of‘alternative NHEJ’[J].Nucleic Acids Res,2014,42(10):6352-6364.
[22] Suwanmanee T,Ferris MT,Hu P,et al.Toward personalized gene therapy:characterizing the host genetic control of lentiviral⁃vector⁃mediated hepatic gene delivery[J].Mol Ther Methods Clin Dev,2017,5:83-92.
[23] Kim JH,Lee SR,Li LH,et al.High cleavage efficiency of a 2A peptide derived from porcine teschovirus⁃1 in human cell lines,zebrafish and mice[J].PLoS One,2011,6(4):e18556.
[24] Szymczak AL,Workman CJ,Wang Y,et al.Correction of multi⁃gene deficiency in vivo using a single‘self⁃cleaving’2A peptide⁃based retroviral vector[J].Nat Biotechnol,2004,22(5):589-594.
[25] Tang X,Liu X,Tao G,et al.“Self⁃cleaving”2A peptide from porcine teschovirus⁃1 mediates cleavage of dual fluorescent proteins in transgenic Eimeria tenella[J].Vet Res,2016,47(1):68.
[26] Donnelly ML,Luke G,Mehrotra A,et al.Analysis of the aphthovirus 2A/2B polyprotein‘cleavage’mechanism indicates not a proteolytic reaction,but a novel translational effect:a putative ribosomal‘skip’[J].J Gen Virol,2001,82(Pt 5):1013-1025.
[27] Subramanian V,Schuster LA,Moore KT,et al.A versatile 2A peptide⁃based bicistronic protein expressing platform for the industri⁃al cellulase producing fungus,Trichoderma reesei[J].Biotechnol Biofuels,2017,10:34.
Construction and functional identification of lymphocytes specific recombination activating gene protein vector
ZHAO Xiao-Hui,LI Chen,ZHANG Hua,ZHENG Ming-Zhe,JI Yan-Hong
Department of Pathogenic Biology and Immunology,School of Basic Medical Sciences,Xi'an Jiaotong University Health Science Center,Xi'an 710061,China
AIM:To construct and optimize the vector expressing recombination activating gene(RAG)protein 1 and RAG protein 2 simultaneously and lay a solid foundation for studying the structure and function of RAG recombinase.METHODS:Vector expressing RAG1,RAG2 and green fluorescent protein(GFP)simultane⁃ously were constructed;The expression of RAG1 and RAG2 protein were identified by Western Blotting,then the function of RAG protein was detected by in vitro recombinant experiment.RESULTS:A recombinant vector expressing RAG recombinase was successfully constructed,and Western Blotting indicated that the expression level of RAG1 had a good consistency with the expres⁃sion of RAG2 protein in this vector.Vitro recombinant experiment suggested that pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFP vector has a better DNA cleavage activity,and GFP reporter gene of the optimized pWPI⁃RAG2⁃P2A⁃RAG1⁃IRES⁃GFPvectorcould be used as cell labeling.CONCLUSION:After optimization,the RAG vector can ensure the expression of RAG1 and RAG2 at the same level effectively,and the reporter gene GFP can be used as a fluorescent marker and lays the foundation for further animal and cell experiments.
vector optimization;recombinant activated gene(RAG)protein;P2A sequence;GFP
R392.9
A
2017-08-11;接受日期:2017-08-26
国家自然科学基金面上项目(31170821,31370874,81670157)
赵小惠.硕士生.E⁃mail:18229016281@163.com
季延红.博士,教授,博导.研究方向:抗体多样性机制.Tel:029⁃82655182 E⁃mail:jiyanhong@xjtu.edu.cn
2095⁃6894(2017)10⁃21⁃05

