利用正交设计优化倒挂金钟的增殖培养
付远志,胡根海,张许柯,雷砚峰,杨靖,孙海燕
利用正交设计优化倒挂金钟的增殖培养
付远志1,2,胡根海1,2,张许柯1,2,雷砚峰1,2,杨靖1,2,孙海燕1,2
(1.河南科技学院棉花研究所,河南新乡453003;2.现代生物育种河南省协同创新中心,河南新乡453003)
为了获得倒挂金钟中间繁殖体增殖的最优培养基,采用L9(34)正交试验,选用MS为基本培养基,比较分析3种重要因素6-BA(6-苄基腺嘌呤)、NAA(α-奈乙酸)和蔗糖,在不同质量浓度下对倒挂金钟丛生芽增殖的影响.结果表明:培养基中6-BA、NAA、蔗糖的质量浓度分别为1.5 mg/L、0.05 mg/L、30 g/L时,对倒挂金钟分化和增殖的效果最好,各因素对增殖作用的影响主次水平依次为蔗糖>6-BA>NAA.蔗糖质量浓度过高易导致丛生芽褐化,过低易导致丛生芽玻璃化、黄化;6-BA和NAA质量浓度过低时,易导致丛生芽褐化,6-BA质量浓度高时易导致丛生芽玻璃化.试验确立了倒挂金钟中间繁殖体增殖的最优方案.
倒挂金钟;增殖;快繁
倒挂金钟(Fuchsia hybida)又名吊钟海棠、灯笼花,柳叶菜科,倒挂金钟属,原产南美洲的秘鲁、北美洲的墨西哥等热带高原地区,为落叶亚灌木状多年生草本,株高50~80 cm,花萼和花瓣有红、粉、紫等颜色,整个花朵下垂,形似吊钟[1],是很好的园艺花卉观赏资源.倒挂金钟常规条件下大多扦插繁殖[2-3],但扦插繁殖其增殖系数低,速度慢,且受季节限制,繁殖周期长,不利于工厂化育苗.通过倒挂金钟的组织培养能提高增殖效率,解决以上难题,但目前倒挂金钟的组培快繁报道非常少[4],研究的内容也很有限,尚未深入研究其增殖快繁要素.
植物组织或细胞在离体培养条件下,通常需要添加外源生长素和细胞分裂素,来调节内源激素平衡和代谢,促进器官的形态建成.生长素和细胞分裂素的比例在植物组织培养中对增殖效果起着至关重要的作用,细胞分裂素配合一定比例的生长素有利于外植体的增殖,植物生长调节剂6-BA和NAA在植物组织培养中一直广为应用.如张红兵等[5]研究发现,铁皮石斛茎段腋芽诱导的最佳培养基为MS+NAA 1.0 mg/L+6-BA 3.0 mg/L,诱导率达到95%;NAA与6-BA配合可显著促进高山红景天雄株叶片愈伤组织的生长和分化[6-7];当6-BA和NAA的质量浓度分别为4.0 mg/L、0.2 mg/L时最有利于凤头姜试管苗的增殖[8];在MS培养基中加入NAA能显著促进大樱桃组培苗的生根[9];金花等[10]研究发现,KC培养基中添加0.5 mg/L的NAA和0.5 mg/L的BA可显著促进玉花兰根状茎的增殖.有研究表明,在激素水平不变的条件下,合理的蔗糖用量也可以大大提高丛芽的增殖率和试管苗的生根率[11].
植物组织培养中,除了要尽量提高丛芽的增殖率外,还要重点防范经常出现的褐化、污染以及玻璃化问题[12-13].褐化主要是由于酚类物质在多酚氧化酶的作用下被氧化形成醌而引起的[14].董艳山[15]研究发现,蔗糖是影响褐化的主要因素,且浓度越高越容易引起红豆杉细胞培养的褐化,可能是因为蔗糖促进了酚类化合物的氧化.而合适比例的细胞分裂素和生长素可以抑制褐化的产生[16-17].玻璃化苗由于其组织结构和生理功能异常,分化增殖能力低且生根困难,严重影响着组培苗的规模化生产.
本试验选取影响增殖的常见重要因素6-BA、NAA和蔗糖,利用正交设计,优化倒挂金钟的增殖培养基,了解倒挂金钟的褐化和玻璃化规律,以期为倒挂金钟快繁的集约化、工厂化生产提供理论参考.
1 材料与方法
1.1 试验材料
市场出售的盆栽倒挂金钟.
1.2 试验方法
1.2.1 材料预处理 剪取当年生的倒挂金钟幼嫩枝条,去除枝条上带有的叶子以及叶柄.将剪下的枝条用质量分数为1%的洗衣粉溶液洗去表面残留的泥土和灰尘,然后放在自来水下冲洗30 s,将洗干净的枝条放入培养皿中,转入超净工作台.在超净工作台中首先用体积分数为75%的乙醇溶液浸泡枝条30 s,然后用无菌水冲洗3~5次,再用质量分数为0.1%的氯化汞溶液消毒8 min,用无菌水冲洗4~6次.将经过初步处理的枝条转入无菌培养皿中,然后用无菌滤纸吸干枝条表面残留的无菌水.切掉枝条两端受伤比较严重的部分,余下的部分剪成带1~2个腋芽的茎段接种于腋芽诱导培养基中培养,30 d后获得无菌丛生芽,作为正交试验的外植体.
1.2.2 培养基配制与接种以MS培养基为基本培养基,添加适量琼脂,采用L9(34)设计三因素三水平(见表1)的正交试验,考察不同质量浓度的6-BA、NAA、蔗糖对倒挂金钟不定芽增殖的影响.培养基配制后,调节pH值为5.8,分装完成后置于高压蒸汽灭菌锅中灭菌(121℃,20 min).在超净工作台上,将经腋芽诱导萌发产生的无菌丛生芽切割下来,挑选1.5~2.0 cm长度、生长比较健壮且长势较一致的腋芽切下,尽量使腋芽基部保持完整,接入冷却后的培养基中,每瓶接入3个腋芽,每种培养基接6瓶,重复3次.材料接种后,在培养温度为25±1℃,光照强度为2 000 lx,光照时间为12 h/d的条件下培养.每隔10 d观察记录一次,培养30 d后统计结果.
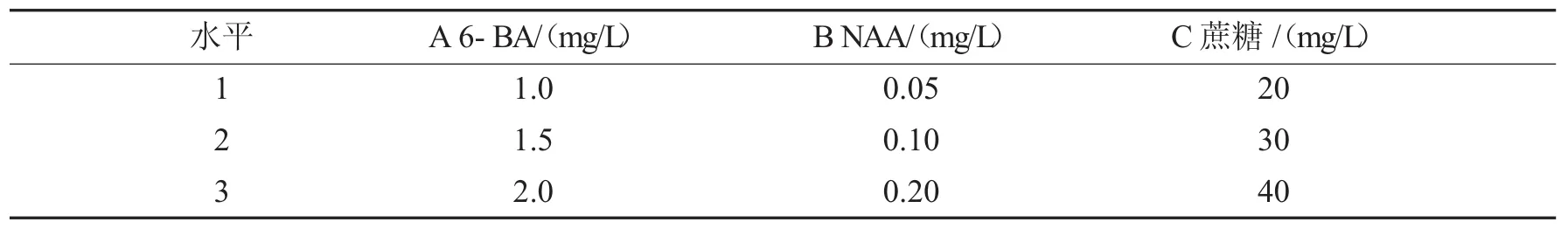
表1 增殖培养基L9(34)正交设计的因素与水平Tab.1 Factors and levels ofL9(34)orthogonal design for value-added medium
1.3 数据处理
采用Excel整理数据,SPSS19.0软件进行极差分析和方差分析.
2 结果与分析
2.1 外植体生长状况
不同激素配比处理倒挂金钟30 d后不定芽的增殖情况见表2.
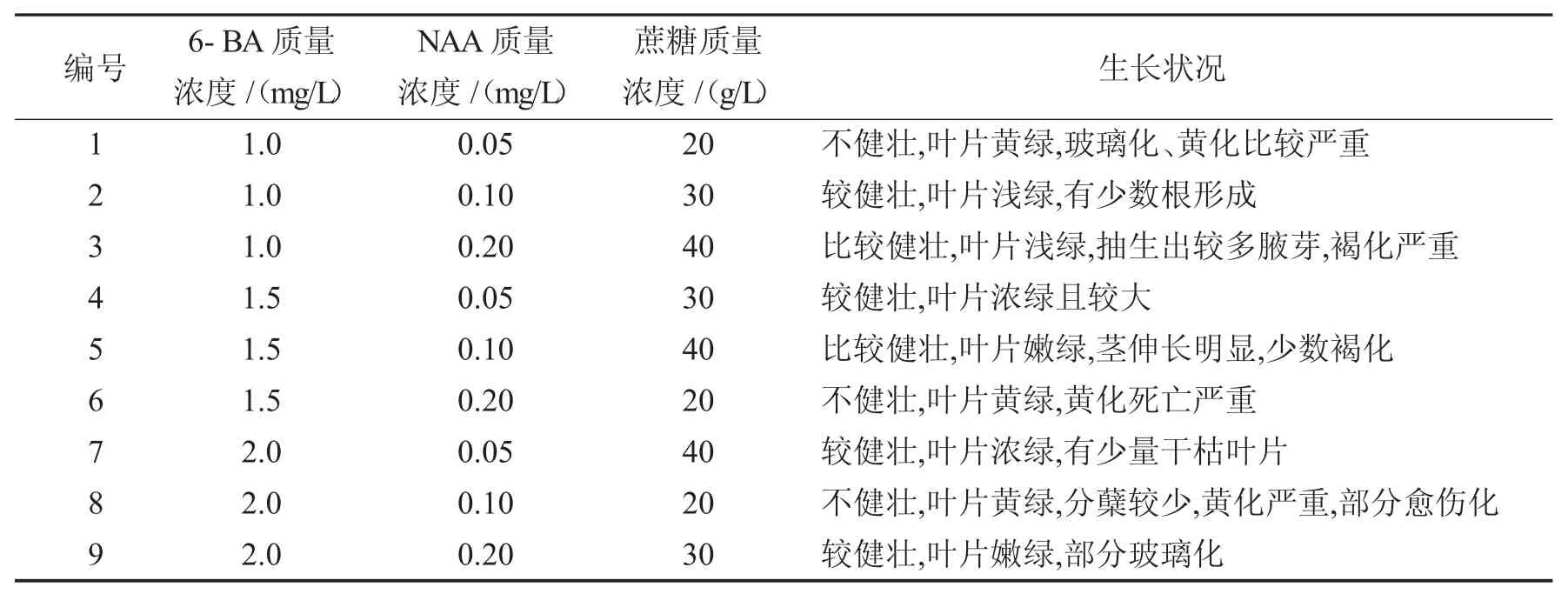
表2 不同激素配比处理倒挂金钟的不定芽增殖情况Tab.2 The added value offuchsia under different ratioofhormone
接种培养10 d后观察发现,各培养基配方中的植株长势已经有非常明显的变化.其中,3号、7号、9号培养基中的植株抽生出较多腋芽,且叶片浓绿,整体较健壮;1号和5号培养基中的植株与试验初始相比有稍微增殖现象;2号和6号培养基中的植株大部分叶片发黑枯死,长势比较弱;4号和8号培养基中的植株叶片稀疏.接种培养20 d后观察发现,不同培养基配方中的植株长势已经拉开比较明显的差距,并且与10 d时的观察结果有所不同.1号、6号、8号培养基中的植株叶片边缘黄化严重,大且稀疏,新生叶比较少;3号、4号、5号、7号培养基中的植株长势比较均匀,叶片浓绿,分化出较多的腋芽,长势健壮;2号和9号培养基中的植株与上次的观察结果相比,无明显的增殖现象,但叶片颜色变为淡绿色.接种培养30 d后观察发现,增殖倍数和生长状况较好的培养基配方有4号、5号、3号,小苗长势健壮,叶片浓绿较大;而8号、1号、6号培养基中的植株增殖率最低,生长状况也最差.由观察可知4号培养基配方为最佳,即6-BA、NAA、蔗糖的质量浓度分别为1.5 mg/L、0.05 mg/L、30 g/L时,倒挂金钟外植体的生长状况最佳(见表 2).
2.2 极差分析
正交试验的极差分析结果见表3.
K值、k值反映了某一因素在不同质量浓度时对倒挂金钟丛生芽增殖作用的大小,K值或k值最大的一项为该因素的最佳质量浓度[5].从表3可以看出,A2、B1、C23个水平对应的K值或k值均最大,说明6-BA、NAA、蔗糖质量浓度分别为1.5 mg/L、0.05 mg/L、30 g/L时对倒挂金钟丛生芽增殖的促进作用最大.极差值R越大,说明某一因素的质量浓度变化对试验结果的影响也越大.从极差值来看,对倒挂金钟影响最重要的因素是蔗糖,在20 g/L的各组合培养基中新生茎节数最少,增殖效果基本不明显,随着蔗糖质量浓度的增加,丛生芽增殖系数逐渐增大,但当蔗糖质量浓度大于30 g/L时,增殖系数有所下降;其次为6-BA,在相同蔗糖质量浓度配比的情况下,1.5 mg/L的6-BA更有助于倒挂金钟丛生芽的分化;而NAA的影响作用很小.从增殖倍数看,4号培养基中倒挂金钟丛生芽的增殖倍数最高,为5.06倍.因此,可以得出倒挂金钟丛生芽增殖培养的最佳培养基组合为A2B1C2,即最佳配比中6-BA、NAA、蔗糖的质量浓度分别为1.5 mg/L、0.05 mg/L、30 g/L,和观察结果一致.
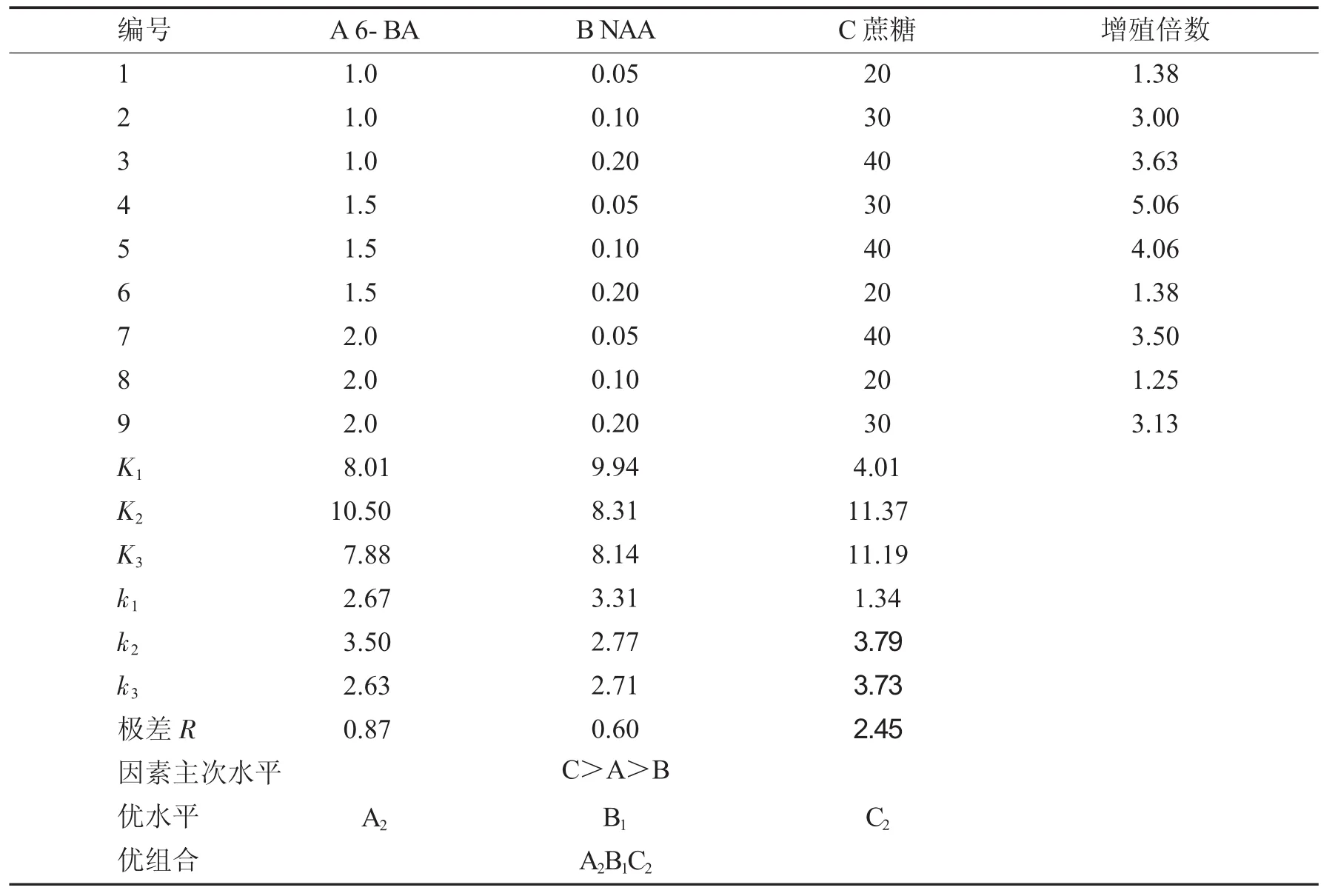
表3 正交试验结果Tab.3 Results oforthogonal esperiment
2.3 方差分析
为进一步探讨处理间及各因子水平之间的差异,故进行方差分析,结果见表4.
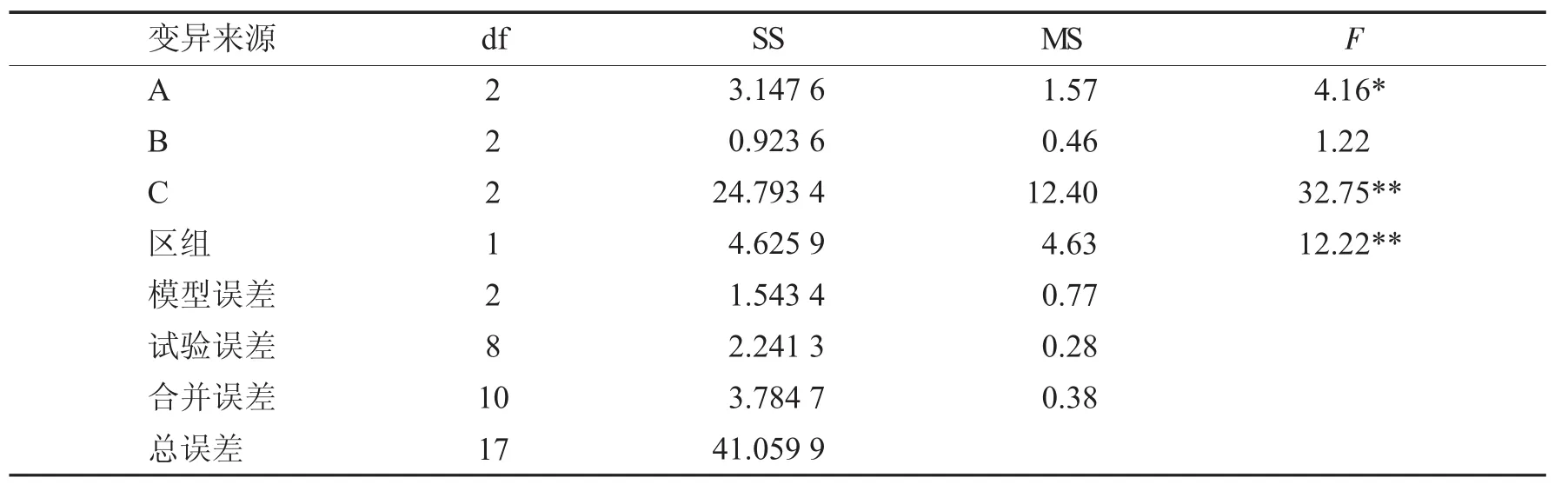
表4 方差分析Tab.4 Variance analysis
由表4中的F检验结果可知,C因素质量浓度水平对倒挂金钟丛生芽增殖有极显著影响,A因素质量浓度水平有显著影响,而B因素质量浓度水平对增殖的影响不明显,两个区组间差异极显著.即蔗糖质量浓度变化对倒挂金钟的增殖效果有非常明显的作用,6-BA质量浓度变化对倒挂金钟增殖作用显著,NAA质量浓度水平对倒挂金钟增殖无明显作用.
3 结论与讨论
本试验以MS为基本培养基,选取影响倒挂金钟快繁的3种重要因素6-BA、NAA与蔗糖,通过正交试验得出最佳增殖培养基中6-BA、NAA、蔗糖的质量浓度分别为1.5 mg/L、0.05 mg/L、30 g/L,各因素对增殖作用影响的主次水平依次为蔗糖>6-BA>NAA.另外,蔗糖质量浓度过高则组培苗容易褐化,过低则组培苗容易玻璃化、黄化;6-BA和NAA比例过低时,组培苗容易褐化,6-BA质量浓度高时组培苗容易玻璃化.本研究为倒挂金钟的增殖快繁及工厂化育苗提供了重要的理论依据.
方差分析结果显示,蔗糖在倒挂金钟组织培养中,起着非常显著的作用.较低质量浓度(20 g/L)时会不利于组培苗的正常生长,在培养初期就开始抑制组培苗的正常生长,不仅增殖系数过低,茎节间距大,还会出现严重的玻璃化、黄化现象;而较高质量浓度(40 g/L)时则会抑制组培苗的增殖作用;以30 g/L的蔗糖增殖效果最好,此时组培苗植株健壮,长势旺盛,抽生出较多新芽且叶片颜色较绿.
试验观察还发现,当蔗糖质量浓度过高,或6-BA与NAA质量浓度比值过低时,组培苗就会出现比较严重的褐化.蔗糖质量浓度过低或6-BA质量浓度过高,也会导致组培苗一定程度的玻璃化,这与韩淑兰等[18]、张春华等[19]的结果一致.蔗糖质量浓度过低会导致培养基的渗透势较低,因此容易引起玻璃化,而6-BA或许从激素水平调控了玻璃化.
[1]韩俭.吊钟海棠盆栽养护[J].花卉,2012(6):18.
[2]武新琴,智顺.不同基质及激素对倒挂金钟扦插生根的影响[J].山西林业科技,2010(3):34-36.
[3]金方伦,李晓松,万敏,等.不同处理方法对吊钟扦插苗生长发育的影响[J].贵州农业科学,2012(6):181-183.
[4]秦改花,王雪娟,张雪平,等.倒挂金钟的离体快繁及其培养基简化试验[J].激光生物学报,2009,(1):96-100.
[5]张红兵,武芸,刘金龙,等.铁皮石斛茎段组培快繁体系的改良研究[J].湖北民族学院学报(自然科学版),2011,29(3):282-284.
[6]李美善.NAA和6-BA对高山红景天雄株组织培养的影响[J].延边大学农学学报,2015,37(4):307-311.
[7]邵春绘,廉美兰,李铁军,等.几种因素对高山红景天愈伤组织诱导和增殖的影响[J].延边大学农学学报,2013,35(4):289-292.
[8]赵卓,舒佳礼,葛台明.不同浓度的NAA、6-BA对凤头姜试管苗生长的影响[J].湖北民族学院学报(自然科学版),2011,29(3):278-281.
[9]李金蓉,丁遥,姜利建,等.MS和生长素浓度对大樱桃“明珠”组培苗生根的影响[J].延边大学农学学报,2015,37(2):123-126.
[10]金花,朴炫春,廉美兰.培养基种类和BA与NAA浓度对玉花兰根状茎增殖生长的影响[J].延边大学农学学报,2005,27(2):121-125.
[11]董艳山.红豆杉细胞培养过程中褐化机理及其控制[D].武汉:华中科技大学,2015:86-87.
[12]戴莹,杨世海,赵鸿峥,等.药用植物组织培养中褐化现象的研究进展[J].中草药,2016(2):344-351.
[13]周丽艳,郭振清,秦子禹,等.白玉兰组织培养中的褐化控制[J].河北科技师范学院学报,2008,22(4):19-22.
[14]曹孜义,刘国民.实用植物组织培养教程[M].兰州:甘肃科技出版社,1996:13-15.
[15]董艳山.红豆杉细胞培养过程中褐化机理及其控制[D].武汉:华中科技大学,2015:86-87.
[16]ABOHATEMM,ZOUINE J,HADRAMI I E.Low concentration of BAP and high rate of subcultures improve the establishment and multiplication ofsomatic embryos in date palmsuspension culture bylimitingoxidative browningassociated with high levels oftotal phenols and peroxidase activities[J].Scientia Horticulturae,2011,130(1):344-348.
[17]吴瑕,娄继龙,刘芳,等.降低沙棘组培过程中外植体褐化的研究[J].黑龙江八一农垦大学学报,2009,21(5):10-13.
[18]韩淑兰,王慧梅,张丹.降低黄芩再生苗玻璃化率及其生根的研究[J].植物研究,2016(1):90-96.
[19]张春华,朴炫春,廉美兰,等.培养基组成对满天星试管苗增殖的影响[J].延边大学农学学报,2005,27(1):35-39.
Optimization for propagation culture of Fuchsia hybida on orthogonal design
FU Yuanzhi1,2,HU Genhai1,2,ZHANG Xuke1,2,LEI Yanfeng1,2,YANG Jing1,2,SUN Haiyan1,2
(1.Cotton Research Institute,Henan Institute ofScience and Technology,Xinxiang453003,China;2.Collaborative Innovation Center ofModern Biological Breeding,Henan Province,Xinxiang453003,China)
The rapid propagation of Fuchsia hybida in vitro was studied to gain the optimal formula of three main factors that influencing the propagule value-added in this paper.According to the L9(34) orthogonal test table,MS medium was used as basic medium,three factors of 6-BA,NAA and sucrose under different concentrations were analyzed the effect to F.hybida bud value-added.The results showed that the medium 6-BA(1.5 mg/L),NAA(0.05 mg/L),sucrose (30 g/L) was the best one for F.hybida differentiation and proliferation,and it was concluded that different factors on the value-added role of primary and secondary level,followed by sucrose,6-BA and NAA.Another high sucrose concentration was easy to go brown,low concentration easy vitrification,yellow;It was easy to go brown when the proportion of 6-BA and NAA was too low,the vitrification was easy when 6-BA concentration was high.So the optimal solutions for the F.hybida rapid propagation was established.
Fuchsia hybida;propagation;rapid propagation
S685.99
A
1008-7516(2017)05-0016-05
10.3969/j.issn.1008-7516.2017.05.003
2017-07-05
河南省科学技术研究重点项目(14A210006)
付远志(1978―),女,河南睢县人,硕士,实验师.主要从事生物技术育种研究.
(责任编辑:邓天福)

