12个油茶品种的SSR特征指纹鉴别
李海波 丁红梅 陈友吾 徐 梁 李 楠 胡传久
(浙江省林业科学研究院;浙江省森林资源生物与化学利用重点实验室1,杭州 310023)(浙江中医药大学2,杭州 310053)
12个油茶品种的SSR特征指纹鉴别
李海波1丁红梅2陈友吾1徐 梁1李 楠1胡传久1
(浙江省林业科学研究院;浙江省森林资源生物与化学利用重点实验室1,杭州 310023)(浙江中医药大学2,杭州 310053)
为了对普通油茶(Camelliaoleifera)优良品种的准确鉴别开发一种新的分子识别方法,为油茶优良品种资源的保护提供技术支持,本研究拟利用SSR荧光标记构建12个长林系列油茶品种的SSR特征指纹。14对多态性SSR引物从12个油茶品种的14个SSR位点共扩增出62个多态性条带、检测出77种基因型,平均每个SSR引物扩增出4.4个多态性条带、检测出5.5种基因型。12个油茶品种14个SSR位点的多态信息含量变化范围和Dice遗传相似系数变异范围分别为0.08~0.84和0.39~0.90。基于12个油茶品种在14个SSR位点的基因型差异,共选出45种SSR特征引物与其对应的基因型组合,即SSR特征引物-基因型,可作为11个油茶品种的SSR特征指纹,为品种鉴别提供分子依据。本研究也为在更大层面上建立油茶品种的DNA指纹数据库、为油茶品种的辅助选育、以及应用于DUS测试提供了技术思路。
油茶 基因型 品种鉴别 SSR指纹 荧光检测
普通油茶(Camelliaoleifera)在我国的栽培历史悠久,具有分布区域广、栽培面积大、用途多等特点,并集经济价值于一身[1]。油茶是我国南方重要的木本油料树种,在生态经济建设中占有重要地位。早在上个世纪60年代以来,我国林业育种工作者就开展了油茶品种的选育工作,并取得了重大突破。先后选育出了一批优良的单株、无性系和家系等[2],其中,具有早实、 丰产和稳产特点的油茶优良无性系已作为我国油茶生产上最重要的品种资源而广为推广应用[3]。亩产油量达到50 kg以上的新品系,成为油茶发展的主栽品种[4]。近年来,在国家政策的大力扶持下,油茶产业迅速发展,油茶品种苗木市场在出现供不应求的同时,也出现了品系混杂、 以假乱真、以次充好的现象。油茶无性系品种的真实性问题一度成为困扰油茶产业化发展的主要问题之一。
对普通油茶各无性系的识别主要依赖于对其表观特征的选择,但是由于许多形态性状的鉴定周期长,受环境影响大,而且随着无性系数量的不断增多,鉴别也愈加困难。况且,用于大面积推广的油茶芽砧苗尚不具备可用于识别的形态、 生物学特征以及经济性状[2]。21世纪以来,分子标记技术包括随机扩增多态性DNA(Random Amplified Polymorphic DNA, RAPD)[5]、简单重复序列间区(inter simple sequence repeat, ISSR)[6]、相关序列扩增多态性(sequence-related amplified polymorphism, SRAP)[7]开始陆续应用于油茶的生产技术研究,为油茶优良无性系的品种鉴别与优良品系的分子选育提供一种新的技术手段[2,4,8-11]。简单重复序列(Simple sequence repeats,SSR)主要是以2~5个核苷酸为基本重复单位的串联重复序列[12]。SSR为共显性标记,能区分纯合子和杂合子,能检测复等位基因,且具有多态性丰富、操作简单、结果可靠、重复性好等优点。通过构建 SSR 指纹图谱可以快速、准确进行品种鉴定,已在水稻、小麦、玉米等一些重要作物上得以应用[13-15]。因此,探索基于SSR标记构建油茶品种的特征DNA指纹,不仅可用于油茶品种的真伪鉴定,为品种的知识产权保护提供科学依据,也可为油茶新品种的分子辅助选育奠定基础。截至目前,SSR标记在油茶上的应用包括SSR-PCR体系的优化研究[16]和种质资源的遗传多样性分析[17-19]。此外,也有山茶属(Camellia)内红花油茶(C.chekiangoleosa)的SSR标记开发[20]、小果油茶(C.meiocarpa)与普通油茶的种间杂交渐渗的报道[21],但鲜有基于SSR标记的油茶品种DNA指纹图谱构建及品种鉴别的研究报道。
通过国家林木品种审定的长林系列油茶品种是经过优树选择、采穗圃观察和当代鉴定的系统程序选育出来的,具有早实丰产、稳产、出籽率高、含油量高、抗性强、适应性广等特性的优良无性系。本研究选用长林系列油茶的12个品种作为材料,首次通过Illumina转录组测序(transcriptome sequencing)平台挖掘出有价值的SSR标记,建立油茶品种的SSR特征指纹,为油茶优良无性系的准确鉴别开发一种新的分子识别方法,为油茶优良品种资源的保护提供技术支持。
1 材料与方法
1.1 植物材料
用于本研究的12个长林系列油茶(C.oleifera)品种无性系来自浙江省林业科学研究院在浙江省武义县俞源镇钟蓬村建立的百灵谷油茶幼林基地,分别为:长林3号(CL3)、4号(CL4)、18号(CL18)、21号(CL21)、23号(CL23)、26号(CL26)、27号(CL27)、40号(CL40)、53号(CL53)、55号(CL55)、56号(CL56)、166号(CL166)。12个油茶优良无性系的主要经济性状参见林萍等[4]的报道。在本试验中,对每个油茶品种均采集3株,取每株3~5个幼嫩叶片,放置于装有硅胶的密封袋干燥保存,至完全失水后作为提取基因组DNA的供试材料。
1.2 主要试剂
新型快速植物基因组DNA提取试剂:北京BioTeke公司;PCR扩增试剂2TSINGKE Master Mix:北京Tsingke公司。在SSR正向引物上加注的荧光染料是FAM(蓝),SSR引物由北京Tsingke公司合成。毛细管电泳检测的内标试剂:Hi-DiTMFormamide、GeneScanTM-500 LIZ Size Standard,美国Applied Biosystems公司。
1.3 主要仪器与设备
PCR仪:杭州博日科技有限公司;凝胶电泳仪:美国伯乐公司;凝胶成像系统,美国伯乐公司;NanoDrop 2000分光光度计,美国热电公司;DNA分析仪:3730 xl,美国Applied Biosystems公司。
1.4 方法
1.4.1 油茶基因组DNA的提取及浓度测定
将每个油茶品种3株经硅胶干燥后的幼嫩叶片粉碎,取等量混合后作为基因组DNA的提取样品。DNA提取方法参照新型快速植物基因组DNA提取试剂的操作说明,提取后的DNA经分光光度计测定浓度,并经1.5%琼脂糖凝胶电泳检测,于-20 ℃保存备用。
1.4.2 油茶SSR标记来源
根据课题组前期对长林油茶的Illumina转录组测序获得的序列数据,共筛选出了9个具有稳定多态性的EST-SSR标记引物;除此之外,根据彭婵等[17]、Jia等[18]、Wen等[20]和黄勇[21]报道的54对茶属SSR引物,共筛选出了5个具有稳定多态性的SSR标记引物(表1)。
1.4.3 SSR-PCR分析
1.4.4 毛细管电泳检测
内标配制:取10 mL Hi-Di和80 μL GeneS-canTM-500 LIZ Size Standard混匀,离心,以每孔10L分装于96孔内标板,离心。将SSR-PCR产物电泳,根据电泳胶图做一定稀释(最低可检测标准为0.1 ng/L),离心。取稀释产物0.5L加入到分配好的内标板中,混匀,离心,放入PCR仪,于96 ℃变性5 min。20℃下迅速冷冻2 min,离心。置入DNA分析仪进行毛细管电泳检测。用Data Collection 3.0软件收集数据。
1.5 数据统计与分析
用GeneMapper 4.1软件对Data Collection 3.0软件收集的原始数据进行分析。软件系统将根据目标峰的位置与同一泳道中的内标GeneScanTM-500 LIZ Size Standard进行比较,直接给出目标SSR片段的准确数值(bp)。纯合位点的等位变异数据记录为X/X, 其中X为该等位变异的数值大小;杂合位点的等位变异数据记录为X/Y,其中X、Y为该位点2个不同等位变异的数值大小。
SSR多态性分析评价采用以下参数:总条带数、多态性条带数、多态率,以及多态性信息含量(Polymorphic information content,PIC)。PIC的计算公式[22]为:PICi=1-∑Pij2,式中:PICi指分子标记i的多态性信息量,Pij指i标记中第j个类型所发生的频率。

表1 用于本研究的油茶多态性SSR引物
遗传关系分析:对于每个检测位点,具有相同数值的SSR标记记为1,无该数值的SSR标记记为0,构成0/1原始数据矩阵。利用 NTSYS-pc2.10e软件进行遗传多样性分析,使用软件中的SimQual程序计算样品间的Dice遗传相似系数,用SAHN程序进行UPGMA(非加权成对算术平均法)聚类分析,通过Tree plot模块生成聚类图。
2 结果与分析
2.1 油茶SSR标记多态性分析
14对SSR引物在12个油茶品种中共扩增出67个条带,扩增片段大小为96~273 bp,每对引物扩增出的条带数为2~9个,平均为4.8个。67个条带中的62个为多态性条带,平均每对引物扩增出4.4个多态性条带。综合多态率为92.5%,每个引物的平均多态率为91.7%。多态信息量(Polymorphic information content,PIC)为0.08~0.84,平均为0.53(表2)。
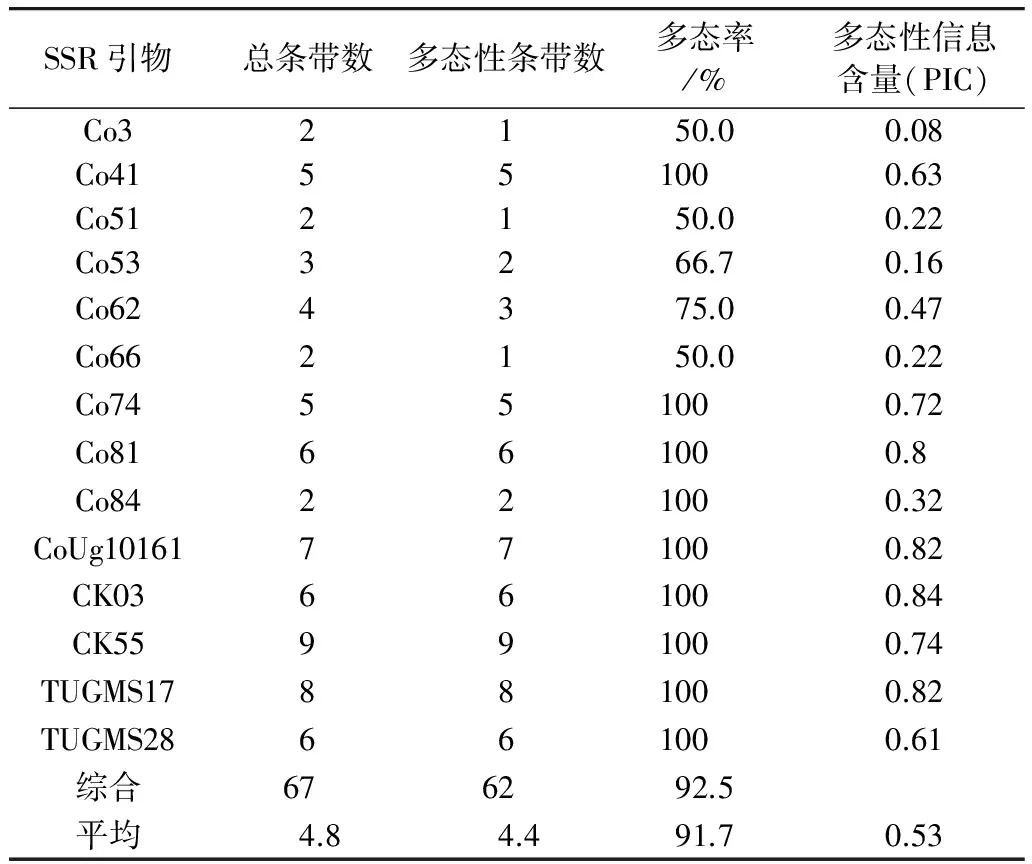
表2 供试油茶品种的SSR标记扩增结果
2.2 基于SSR标记的的遗传关系分析
基于14对SSR引物扩增出的67个条带对12个油茶品种的聚类结果显示(图1),12个油茶品种没有形成明显的具有规律性的成组分类,表明12个油茶品种间的遗传背景复杂,遗传差异较大。从聚类图上可以看出,12个油茶品种在Dice遗传相似系数大约为0.43时聚在一起,在大约0.59时可分聚为7个组,分别为长林3号与56号,21号与166号,4号、27号与40号,23号与55号,以及三个单组包括长林53号、18号和26号。从Dice遗传相似系数来看,12个油茶品种的Dice遗传相似系数变异范围在0.39(长林3号与26号)至0.90(长林27号与40号)之间,这与聚类图显示的长林27号与40号在0.90时聚为一组、长林3号与26号各自位于聚类图的顶部与底部具一致性,表明长林27号与40号的遗传差异最小,亲缘关系最为接近;而长林3号与26号的遗传差异最大,亲缘关系最远。

图1 基于SSR标记构建的12个油茶品种聚类树状图
2.3 油茶SSR位点的基因型差异分析
表3显示,14个SSR引物对在12个供试油茶品种的14个SSR位点共检测出了77种不同的基因型,每对引物检测出2~10种基因型,最低的为引物Co3、Co51、Co66和Co84,最高的为引物CoUg10161,平均为5.5种。在77种基因型中,纯合型为33种,杂合型为44种。此外,12个油茶品种在不同SSR位点表现出的基因型数量存在较大差异。例如,在Co3位点,12个油茶品种仅有2种基因型;在Co41位点,有5种基因型;而在CoUg10161引物位点,有10种基因型。
SSR位点上丰富的基因型差异为油茶品种鉴别提供了可能,特别是某个油茶品种在一些SSR引物位点所特有的基因型。表3显示,除长林40号油茶外,其他11个油茶品种在14个SSR位点上均表现出特有基因型。例如,在Co3位点,长林26号表现出特有基因型138/141;在Co53位点,长林18号和166号分别表现出特有基因型267/273和267/270;在CoUg10161位点,长林3号、18号、21号、23号、26号、53号、55号、56号和166号分别表现出特有基因型196/196、186/186、186/196、188/188、190/190、190/192、188/190、190/200和196/208。不同油茶品种在14个SSR位点的基因型差异,尤其是特有基因型的发现为油茶品种SSR指纹图谱的建立提供了有价值的数据。
2.4 油茶品种的SSR特征指纹与品种鉴定
基于12个油茶品种在SSR位点的基因型差异,进一步比较、选出每个油茶品种的特征引物与其对应的基因型,即特征引物-基因型,如CoUg10161-196/196、TUGMS17-218/242、CK55-182/200等,可作为各个油茶品种的SSR特征指纹,为品种鉴别提供分子依据(表4)。表4显示,除长林40号油茶品种缺乏特征引物-基因型外,其他11个品种共有45种不同的特征引物-基因型,即45种SSR特征指纹。而且,这11个油茶品种具有不同的SSR特征指纹数,依次为:长林23号=53号=56号(6种指纹)>长林21号=26号=166号(5种)>长林18号=55号(4种)>长林3号(2种)>长林4号=27号(1种)。从特征引物在12个油茶品种间检测出的特异基因型的数量来看,依次为:CoUg10161(9种)>TUGMS17(7种)>CK55(6种)>Co81= Co74(5种)>CK03(4种)>TUGMS28(3种)>Co41= Co53(2种)>Co62=C53(1种)。这表明不同SSR引物对油茶品种鉴别的贡献大小不同。因此,基于本研究开发的SSR特征指纹,在实际应用中可以优先选用多态性高、贡献大的特征引物,以提高鉴别效率。同时,每个油茶品种的多个SSR特征指纹均可以用于鉴别,以提高鉴别的可靠性。

表3 12个供试油茶品种的基因型
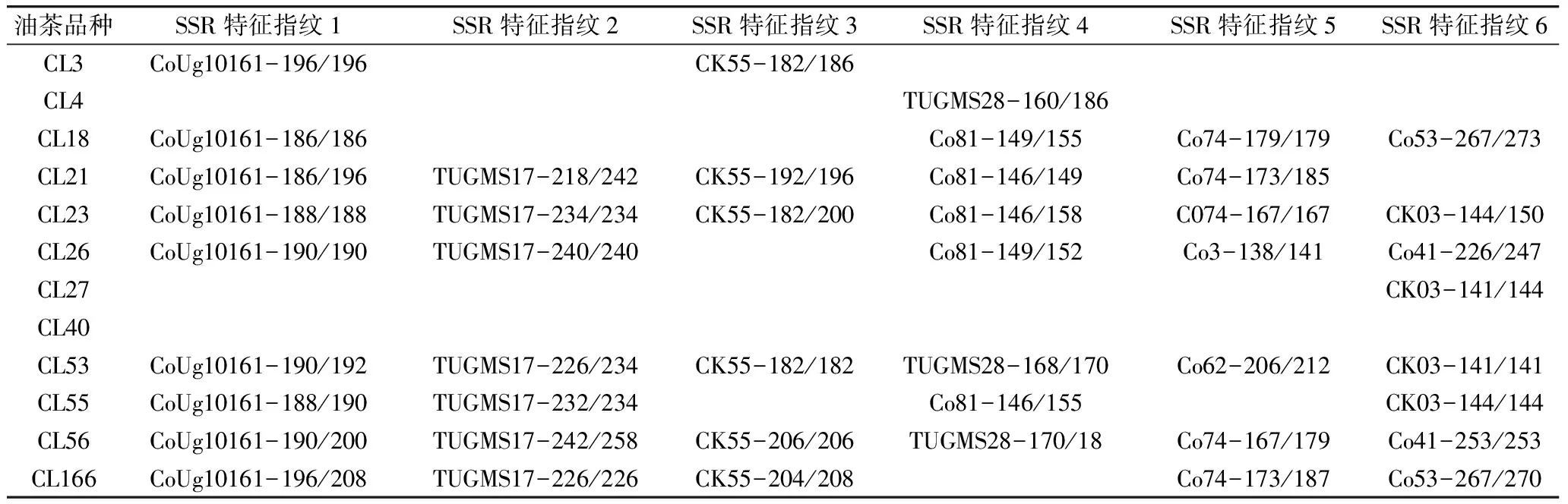
表4 12个供试油茶品种的SSR特征指纹(特征引物-基因型)
对于长林40号品种,由于缺乏特征引物-基因型,可以采用二对引物或二对以上的SSR引物的联合使用来鉴别。根据表3显示的基因型差异,可以联合使用引物Co62和CK03,根据二对引物在长林40号品种检测的基因型Co62-209/212和CK03-135/141来鉴别长林40号品种;也可以联合使用引物CK55和TUGMS28,根据它们检测的基因型CK55-198/200和TUGMS28-164/186来鉴别长林40号品种。
3 讨论
目前,我国林业工作者选育出的普通油茶良种都是从实生群体中选育而来,群体中遗传基因交流频繁,具有高度杂合性,而且生殖周期较长,没有自交、 杂交的纯系[23],这也使得油茶的遗传背景相对复杂,遗传多样性丰富。此外,普通油茶的倍性较为复杂,一个SSR位点可能检测到多个等位基因[21]。本研究结果不仅进一步支持了我国油茶品种具有高度杂合的遗传背景,也提示这14个多态性SSR标记可以用于更多的普通油茶品种,以揭示种内更为丰富的基因型差异而用于品种鉴别,也可用于普通油茶遗传多样性分析、遗传图谱构建以及山茶属(Camellia)内物种间的遗传关系研究。
SSR荧光标记是基于DNA测序仪为平台的检测方法,克服了传统银染法聚丙烯酰胺凝胶电泳检测的不足,具有快速、高效、精确、灵敏等技术优势。该技术在小麦[24]、玉米[25]、烟草[26]、水稻[27]、高粱[28]等物种上的应用得出在同一检测成本上,荧光标记技术检测效率远高于银染法,更适用于高通量材料的指纹图谱构建和品种鉴定研究。本研究采用SSR荧光标记毛细管电泳检测方法,直接以碱基数目(bp)确定了12个油茶品种在14个SSR位点的基因型,基于基因型差异建立了可用于11个品种鉴别的特征SSR指纹,数据更为精确可靠,证明了SSR荧光标记用于油茶品种指纹图谱构建和品种鉴定的可行性。
获得多态性高的SSR引物是SSR指纹鉴别的必要保证。多态性信息含量(PIC)值的高低和等位变异的数量是衡量SSR引物多态性的基本指标。与彭婵等[17]、Jia等[18]和张恩慧等[19]的研究相比,本研究所采用的14个多态性SSR引物的PIC值和基因型数量的变化幅度均较大,且PIC值偏低(0.08~0.84,平均0.53),基因型数量较高(2~10种,平均5.5种)。这是由于所采用SSR引物的多态性高低存在较大差异,因而对油茶品种SSR指纹鉴别的贡献大小不一。因此,在SSR指纹鉴别中,不仅需要开发出更多、多态性更高的SSR引物,获得单个品种(例如本研究的11个品种)特征引物-基因型,同时也要采用不同的引物组合才能完成多个品种的相互鉴别,正如本研究利用Co62和CK03组合、和CK55和TUGMS28组合来鉴别长林40号品种。
DUS(特异性Distinctness、一致性Uniformity、稳定性Stability)测试是植物新品种保护的技术基础和授权的科学依据。国际植物新品种保护联盟(UPOV)已将SSR标记作为DNA指纹数据库构建的推荐标记之一。国内外已有不少将SSR标记用于玉米[29-30]、小麦[31]、水稻[32]、油菜[33]、多花黑麦草[34]、棉花[35]、茶树[36]等DNA指纹数据库构建的报道,但迄今将SSR分子标记应用于油茶DUS测试的研究还未见报道。因此在本研究基础上,今后工作的重点是将SSR分子标记技术拓展到油茶品种分子标记DUS测试指南的研制和油茶品种DNA指纹数据库的构建,为油茶新品种申请、测试与鉴定提供补充依据。
开发出一套油茶品种的高效分子鉴别技术,无论在科研服务层面上对于油茶品种鉴别、保护油茶品种知识产权,还是在产业层面上对于油茶产业的持续健康发展,均提供了一种有价值的技术支撑。本研究表明利用SSR荧光标记技术可以获得油茶品种在SSR位点的特征指纹,可弥补在油茶芽砧苗期不具备可识别特性的不足,从而用于对油茶品种的辅助鉴别,从根本上保证油茶种苗的质量。
[1]江南,谭晓风,张琳,等.基于RNA-Seq的油茶种子-亚麻酸代谢途径及相关基因分析[J].林业科学,2014,50(8):68-75
Jiang N, Tan X F, Zhang L, et al. Gene Analysis of-Linolenic Acid Metabolism ofCamelliaoleiferaSeeds Based on RNA-Seq [J]. Scientia Silvae Sinicae, 2014, 50 (8): 68-75
[2]温强,雷小林,叶金山,等.油茶高产无性系的ISSR分子鉴别[J].中南林业科技大学学报,2008,28(1):39-43
Wen Q, Lei X L, Ye J S, et al. Identification ofCamelliaoleiferasuperior clones by ISSR molecular markers [J]. Journal of Central South Forestry University, 2008, 28 (1): 39-43
[3]陈永忠,王湘南.油茶生物技术育种研究前景展望[J].湖南林业科技,2005,32(4):5-7
Chen Y Z, Wang X N. 2005. The outlook of the biotechnology breeding research on oil tea Camellia [J]. Hunan Forestry Science & Technology, 2005, 32 (4): 5-7
[4]林萍,姚小华,王开良,等.油茶长林系列优良无性系的SRAP分子鉴别及遗传分析[J].农业生物技术学报,2010,18(2):272-279
Lin P, Yao X H, Wang K L, et al. Identification and genetic analysis ofCamelliaoleiferachanglin series superior clones by SRAP molecular marker [J]. Journal of Agricultural Biotechnology, 2010, 18 (2): 272-279
[5]Williams J G K, Kubelik A R, Livak K J, et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers [J]. Nucleic Acids Research, 1990, 18: 6531-6535
[6]Fisher P J, Gardner R C, Richardson T E. Single locus microsatellites isolated using 5′ anchored PCR. Nucleic Acids Research, 1996, 24: 4369-4371
[7]Li G, Quiros C F. Sequence-related amplified polymorphism (SRA P), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theoretical and Applied Genetics, 2001, 103: 455-461
[8]黄永芳,陈锡沐,庄雪影,等.油茶种质资源遗传多样性分析[J].林业科学,2006,42(4):38-43
Huang Y F, Chen X M, Zhuang X Y, et al. Analysis of genetic diversity inCamelliaoleiferagermplasms [J]. Scientia Silvae Sinicae, 2006, 42 (4): 38-43
[9]张国武,钟文斌,乌云塔娜,等.油茶优良无性系ISSR分子鉴别[J].林业科学研究,2007,20(2):278-282
Zhang G W, Zhong W B, Wuyun T N, et al. Identification of oil tea (Camelliaoleifera) superior clones by ISSR molecular marker [J]. Forest Research, 2007, 20 (2): 278-282
[10]孙佩光,奚如春,李俊成,等.25个油茶优良无性系的遗传分析与分子鉴别[J].华南农业大学学报,2014,35(6):83-88
Sun PG, Xi R C, Li J C, et al. Genetic analyses and molecular identification of 25 superior clones ofCamelliaoleifera[J]. Journal of South China Agricultural University, 2014, 35 (6): 83-88
[11]刘扬,彭赟,贺瑞,等.基于ISSR标记的海南油茶种质资源遗传多样性分析[J].分子植物育种,2016,(2):517-523
Liu Y, Peng Y, He R, et al. Genetic diversity ofCamelliaoleiferain Hainan by ISSR [J]. Molecular Plant Breeding, 2016, (2): 517-523
[12]Kalia R, Rai M, Kalia S, et al. Microsatellite markers: an overview of the recent progress in plants [J]. Euphytica, 2011, 177 (3): 309-334
[13]王凤格,赵久然,郭景伦,等.中国玉米新品种DNA指纹库建立系列研究Ⅰ.玉米品种纯度及真伪鉴定中SSR技术标准实验体系的建立[J].玉米科学,2003,11(1):3-6
Wang F G, Zhao J R, Guo J L,et al. Series of research on establishing DNA fingerprinting pool of Chinese new maize cultivarⅠ. The establishment of a standard SSR system fitting for maize cultivars identification [J]. Journal of Maize Sciences, 2003, 11 (1): 3-6
[14]庄杰云,施勇烽,应杰政,等.中国主栽水稻品种微卫星标记数据库的初步构建[J].中国水稻科学,2006,20(5):460-468
Zhuang J Y, Shi Y F, Ying J Z,et al. Construction and testing of primary microsatellite database of major rice varieties in China [J]. Chinese Journal of Rice Science, 2006, 20 (5): 460-468
[15]张敏.贵州省部分小麦种质资源SSR遗传多样性研究及指纹图谱构建[D].贵州:贵州大学,2007
Zhang M.Study on genetic diversity of Guizhou partial wheat germplasam resources and establishment of fingerprinting based on SSR [D]. Guizhou: Guizhou University, 2007
[16]范小宁,林萍,张盛周.油茶SSR-PCR反应体系的优化研究[J].安徽农业科学,2011,39(23): 14098-14102
Fan X N, Lin P, Zhang S Z. Optimization of SSR-PCR System for C.oleifera [J]. Journal of Anhui Agricultural Sciences, 2011, 39 (23): 14098-14102
[17]彭婵,李振芳,陈慧玲,等.湖北油茶种质资源SSR分析[J].湖北林业科技,2013,42(5):1-5
Peng C, Li Z F, Chen H L, et al. Genetic analysis of the germ plasm of camellia oleifera from Hubei province based on SSR marker [J]. Hubei Forestry Science and Technology, 2013, 42 (5): 1-5
[18]Jia B, Lin Q, Zhang L, et al. Development of 15 genic-SSR markers in oil-tea tree (Camelliaoleifera) based on transcriptome sequencing [J]. Genetika,2014, 46 (3): 789-797
[19]张恩慧,王晓云,覃子海,等.广西普通油茶种质资源遗传多样性的SSR分析[J].广西植物,2016,36(7):806-811
Zhang E H,Wang X Y, Qin Z H, et al. Genetic diversity analysis ofCamelliaoleiferain Guangxi using SSR markers [J]. Guihaia, 2016, 36 (7): 806-811
[20]Wen Q, Xu L, Gu Y, et al. Development of polymorphic microsatellite markers inCamelliachekiangoleosa(Theaceae) using 454-ESTs [J]. American Journal of Botany, 2012, 99 (5): e203-e205
[21]黄勇.小果油茶与普通油茶居群遗传结构及种间杂交渐渗[J].应用生态学报,2013,24(8):2345-2352
Huang Y. Population genetic structure and interspecific introgressive hybridization betweenCamelliameiocarpaandC.oleifera[J]. Chinese Journal of Applied Ecology, 2013, 24 (8): 2345-2352
[22]Botstein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment polymorphisms [J]. American Journal of Human Genetics, 1980, 32: 314-331
[23]高超,袁德义,杨亚,等.油茶自交不亲和性的解剖特征[J]. 林业科学,2015,51(2):60-68
Gao C, Yuan D, Yang Y, et al. Anatomical Characteristics of Self-Incompatibility inCamelliaoleifera[J]. SCIENTIA SILVAE SINICAE, 2015, 51 (2): 60-68
[24]郝晨阳,王兰芬,贾继增,等.SSR荧光标记和银染技术的比较分析[J].作物学报,2005,31:144-149
Hao C Y, Wang L F, Jia J Z,et al. Comparison of fluorescence and Silver-staining detection systems of microsatellite markers [J]. Acta Agronomica Sinica, 2005, 31:144-149
[25]易红梅,王凤格,赵久然,等.玉米品种SSR标记毛细管电泳荧光检测法与变性PAGE银染检测法的比较研究[J].华北农学报,2006,21(5):64-67
Yi H M, Wang F G, Zhao J R, et al. Comparison of two maize SSR detection methods: capillary electrophoresis with fluorescence detection method and denaturing PAGE Silver-staining detection method [J]. Acta Agriculturae Boreali-Sinica, 2006, 21 (5): 64-67
[26]陈雅琼,李凤霞,李锡坤,等.烟草SSR荧光标记与毛细管电泳检测技术研究[J].中国烟草科学,2011,32(2):66-80
Chen YQ, Li F X, Li X K, et al. Fluorescent detection and capillary electrophoresis in tobacco SSR [J]. Chinese Tobacco Science, 2011, 32 (2): 66-80
[27]程本义,夏俊辉,龚俊义,等.SSR荧光标记毛细管电泳检测法在水稻DNA指纹鉴定中的应用[J].中国水稻科学,2011,25:672-676
Cheng B Y,Xia J H, Gong J Y, et al. Application of capillary electrophoresis detection with fluorescent SSR markers in rice DNA fingerprint identification [J]. Chinese Journal of Rice Science, 2011, 25: 672-676
[28]王瑞,张福耀,程庆军,等.利用SSR荧光标记构建20个高梁品种指纹图谱[J].作物学报,2015,41(4):658-665
Wang R, Zhang F Y, Cheng Q J, et al. Establishment of 20 sorghum hybrids fingerprints using SSR fluorescent marker [J]. Acta Agronomica Sinica, 2015, 41 (4): 658-665
[29]张金渝,张建华,杨晓洪,等.玉米DUS测试标准品种的SSR分子指纹图谱的构建[J].玉米科学,2006,14(4):47-52
Zhang J Y, Zhang J H, Yang X H, et al. Buliding of SSR fingerprinting map of standard varieties on maize in DUS testing [J]. Journal of Maize Sciences, 2006, 14 (4):47-52
[30]Gunjaca J, Buhinicek I, Jukic M, et al. Discriminating maize inbred lines using molecular and DUS data [J]. Euphytica, 2008, 161: 165-172
[31]张晗,姚凤霞,刘永杰,等.EST-SSR标记在冬小麦品种DUS测试中的应用[J].麦类作物学报,2010,30(5):801-806
Zhang H, Yao F X, Liu Y J, et al. Application of EST-SSRs to distinctness test of new varieties [J]. Journal of Triticeae Crops, 2010, 30 (5): 801-806
[32]陆徐忠,倪金龙,李莉,等.利用SSR分子指纹和商品信息构建水稻品种身份证[J].作物学报,2014,40(5):823-829
LuX Z, Ni J L, Li L, et al. Construction of rice variety indentity using SSR fingerprint and commodity information [J]. Acta Agronomica Sinica, 2014, 40 (5): 823-829
[33]赖运平,张浙峰,王丽容,等.利用SSR标记筛选DUS测试中甘蓝型油菜近似品种[J].分子植物育种,2013,11(2):174-184
Lai Y P, Zhang Z F, Wang L R, et al. Screening similar varieties of rapeseed (brassicanapusL.)in DUS testing using SSR markers [J]. Molecular Plant Breeding, 2013, 11 (2): 174-184
[34]黄婷,马啸,张新全,等.多花黑麦草DUS测定中SSR标记品种鉴定比较分析[J].中国农业科学,2015,48(2):381-389
Huang T, Ma X, Zhang X Q, et al. Comparation of SSR molecular markers analysis of annual ryegrass varieties in DUS Testing [J]. Scientia Agricultura Sinica, 2015, 48 (2): 381-389
[35]匡猛,王延琴,周大云,等.棉花DUS测试标准品种的SSR指纹数据库构建[J].棉花学报,2015,27(1):46-52
Kuang M, Wang Y Q, Zhou D Y,et al. Construction of SSR fingerprinting database of standard varieties on cotton in DUS Testing [J]. Cotton Science, 2015, 27 (1): 46-52
[36]黄丹娟,马建强,陈亮.茶树PVP申请品种的SSR分子标记鉴定和系谱关系分析[J].茶叶科学,2016,36(1):68-76
Huang D J, Ma J Q, Chen L. SSR identification and pedigree analysis of PVP application cultivars in tea plant [J]. Journal of Tea Science, 2016, 36 (1): 68-76.
Identification of 12 Superior Cultivars ofCamelliaoleiferaby Using Simple Sequence Repeat Feature Indexes
Li Haibo1Ding Hongmei2Chen Youwu1Xu Liang1Li Nan1Hu Chuanjiu1
(Zhejiang Academy of Forestry Zhejiang Provincial Key Laboratory of Biological and Chemical Utilization of Forest Resource1, Hangzhou 310023) (Zhejiang Chinese Medical University2, Hangzhou 310053)
In order to develop a novel molecular recognition method for the identification of oil tea (Camelliaoleifera) superior cultivars and provide technical support for the protection of superior resources, the SSR feature indexes for 12 Changlin series superior cultivars ofC.oleiferawere constructed by using SSR fluorescence labeling in the present study. With 14 pairs of polymorphic SSR primers, a total of 62 polymorphic bands were amplified and 77 genotypes were detected from the 14 SSR loci in the studied 12 superior cultivars ofC.oleifera. For each SSR primer, the average number of polymorphic bands and genotypes were 4.4 and 5.5, respectively. The range of polymorphism information content (PIC) and genetic similarity byDicecoefficients at 14 SSR loci in the 12 cultivars were 0.08~0.84 and 0.39~0.90, respectively. Based on the genotypic difference at the 14 SSR loci, a total of 45 pairs of SSR characteristic primers together with its corresponding genotype (SSR characteristic primer pairs-genotype) were selected as SSR characteristic fingerprints for the molecular recognition of 11 Changlin series superior cultivars ofC.oleifera. This study also provided the technical ideas for establishing DNA fingerprint database ofC.oleiferaon a higher level, for the molecular breeding of superior cultivars ofC.oleifera, and for DUS (distinctness, uniformity and stability) testing ofC.oleifera.
Camelliaoleifera, genotype, cultivar identification, SSR fingerprints, fluorescence detection
S722.3
A
1003-0174(2017)10-0171-08
时间:2017-10-20 13:24:01
网络出版地址:http://kns.cnki.net/kcms/detail/11.2864.TS.20171020.1324.002.html
浙江省科研院所扶持专项(2014F30002,2013F5 0012),浙江省重大科技专项(2010C02005-1)
2017-03-18
李海波,男,1969年出生,研究员,林木遗传育种
胡传久,男,1982年出生,副研究员,经济林栽培

