植物细胞壁组织化学定位染色方法和技术的比较研究
张 霞 胡露洁 周存宇 杨朝东
(长江大学园艺园林学院,荆州 434025)
植物细胞壁组织化学定位染色方法和技术的比较研究
张 霞 胡露洁 周存宇 杨朝东*
(长江大学园艺园林学院,荆州 434025)
利用光学和荧光显微镜比较研究几种植物细胞壁组织化学定位染色方法和技术,结果表明:(1)硫酸消化法和硫酸氢黄连素—苯胺兰对染法研究凯氏带,对取材时间和部位要求高,建议两种方法配合使用,可相互印证是否具凯氏带;(2)苏丹7B染色法,蓝色激发光下不染色和硫酸氢黄连素—苯胺兰对染研究细胞壁栓质层3种方法中,不染色蓝色激发光下结果比苏丹7B染色法敏感显色,但苏丹7B染色法在普通光学显微镜下观察较为便捷;(3)木质化细胞壁染色方法中硫酸氢黄连素—苯胺兰对染法比间苯三酚—盐酸染色法易显色观察;(4)甲苯胺兰快速染色细胞壁取代常规苏丹Ⅲ/Ⅳ法,细胞边界和层次更清楚。
组织化学;凯氏带;栓质层;木质化
植物根表皮外扩散状栓质层[1~5],内、外皮层凯氏带及栓质化和木质化次生壁[2~10],或皮下层‘φ’形木质化增厚[11~12];胚轴、茎叶、花柄表面角质层,内、外皮层和维管束鞘细胞壁凯氏带及栓质化和木质化次生壁[3~4,8~10,13~17],构成植物体与环境之间的质外体屏障结构或称为界面保护组织,能阻碍水、离子和氧气,抵抗病虫害等自由进出植物体,具有保护植物体的重要生理功能[18~20]。近年来随着植物细胞壁组织化学定位研究方法的改进[3,6,8,20~22],高强度荧光显微镜的应用及分子发育机理研究成就,促进了植物界面生物学的迅速发展,如拟南芥不定根中内皮层初生壁的凯氏带由凯氏带膜蛋白质、先沉积木质素后再有木栓质沉积组成,次生壁组织化学显示由木质素和木栓质沉积组成[23~28]。
目前研究植物细胞壁组织化学定位的方法主要有:植物凯氏带经硫酸氢黄连素—苯胺兰对染在荧光显微镜下呈现生动黄色(vivid yellow)[6,21];此外,凯氏带经75%硫酸消化在光学显微镜下呈现波浪线性(wave lines)[6,29]。凯氏带的形态随物种和存在的部位不同而有所差别,横切面上呈点状或条带状等[3,6,7,13~17,19]。细胞壁木质素经间苯三酚—盐酸染色呈现樱桃红色(cherry red)[6,29];经硫酸氢黄连素—苯胺兰对染在荧光显微镜下呈现呆滞黄色(stagnant yellow)[6,21]。细胞壁木栓质和角质层经苏丹7B染色呈红色[6,22];而栓质层不经过任何染色在蓝色激发光下呈现棕色[3~4,6,30]。苏丹7B染色木栓质具有很强的组织特异性,而苏丹Ⅲ或Ⅳ常将细胞内的脂肪也染成红色,特异性差,造成栓质化胞壁不易识别,苏丹Ⅲ或Ⅳ可作为常规细胞壁快速染色。在细胞壁快速染色中,TBO染色切片比苏丹Ⅲ的效果更清晰显示植物解剖结构。
植物细胞壁经凯氏带、栓质化和木质化等修饰,形成植物表面及内部保护组织,使植物个体在生长发育过程中具有很强的抗逆性[18~19],因此胞壁组织化学特征及质外体屏障结构是作物抗性育种等生产实际中的重要解剖结构指标。近年来,人们主要从分子机理角度研究植物抗逆性,而忽略了植物屏障结构的保护作用[2~4,7~9],使得植物解剖学中胞壁组织化学研究方法和技术没有得到足够重视和应用。本文旨在比较不同物种和组织的胞壁组织化学染色方法和技术,为研究植物逆境生理的解剖结构奠定基础。
1 材料与方法
实验材料收集于2010~2014每年春夏季,取自湖北荆州长江大学西校区附近野生湿地环境中,主要物种有虉草(Phalarisarundinacea)、水芹(Oenanthejavanica)、菰草(Zizanialatifolia)、藜蒿(Artemisiaselengensis)、水花生(Alternantheraphiloxeroides)、牛鞭草(Hemerthriaaltissima)、双穗雀稗(Paspalumdistichum)、天胡荽(Hydrocotylesibthorpioides)。取完整不定根用FAA固定,根茎和直立茎用新鲜材料。
徒手切片方法的改进,结合立体解剖镜的放大倍数,可直接用双面刀片在立体解剖镜切片,与传统方法比较可节约时间,而且可用新鲜材料,更真实表现活体研究结果,可切直径大于100 μm根或者较坚硬茎等材料。
1.1 初生壁凯氏带或点检测实验方法
1.1.1硫酸消化法[6,29]
75%硫酸配制:将高浓度硫酸配制为75%硫酸10 mL备用,一般现配现用,因硫酸易吸潮而浓度降低,一星期后需重配。
消化过程:75%硫酸处理纵切幼嫩组织(根尖、茎尖,维管束)切片,盖上盖玻片,5~10 min后,吸掉多余水分,凯氏带呈现点状或波浪线形。
1.1.2硫酸氢黄连素—苯胺兰对染法[6,21]
0.1%(w/v)硫酸氢黄连素溶液的配制:称取0.1 g硫酸氢黄连素溶于100 mL蒸馏水,震荡混匀待用。0.5%(w/v)苯胺兰溶液的配制:称取0.5 g苯胺兰溶于100 mL蒸馏水,震荡混匀待用。FeCl3-甘油缓冲液的配制:0.1%(w/v) FeCl3的配制,称取0.05 g FeCl3溶于50 mL蒸馏水,搅拌混匀过滤,后与甘油等体积混合,室温保存待用。
染色过程:切片浸没于0.1%(w/v)硫酸氢黄连素溶液1 h后,用蒸馏水洗净,滴加0.5%(w/v)苯胺兰溶液0.5 h后,用蒸馏水洗净,后滴加一滴蒸馏水,盖上盖玻片。若等待长时间后才能观察,则滴加一滴FeCl3-甘油缓冲液。
1.2 细胞壁栓质层检测实验方法
1.2.1苏丹7B染色法[6,22]
0.1%(w/v)苏丹7B溶液配制:称取50 mg苏丹7B溶于25 mL PEG-300,后90℃水浴1 h并冷却,加入等体积90%甘油,室温保存待用。
染色过程:切片组织如有后含物用蒸馏水清洗切片,用吸水纸吸净,后浸没于0.1%(w/v)苏丹7B溶液1 h或过夜。切片用蒸馏水洗几次,用吸水纸吸净,后滴加一滴蒸馏水,盖上盖玻片。
1.2.2蓝色激发光检测法或硫酸氢黄连素—苯胺兰对染法[3~4,6,30]
蓝色激发光检测法:将切片滴加一滴蒸馏水,盖上盖玻片。
硫酸氢黄连素—苯胺兰对染法同1.1.2。
1.3细胞壁木质化检测实验方法[3,6,21,29]
1.3.1 盐酸—间苯三酚染色法
5%(w/v)间苯三酚溶液配制:取间苯三酚4~5 g,溶于100毫升95%酒精中,混匀即成间苯三酚—酒精液,现配现用(溶液黄褐色失效)。取10 mL浓盐酸备用。
染色过程:先在材料上滴上1滴浓盐酸,3~5 min后,(可以用吸水纸吸掉多余水分)然后滴上间苯三酚—酒精液1滴,木质化的细胞壁就染上樱红或紫红色。
1.3.2 硫酸氢黄连素—苯胺兰对染法
硫酸氢黄连素—苯胺兰对染法同1.1.2。
1.4 细胞壁快速染色方法
1.4.1苏丹Ⅲ染色法[8]
0.5%(w/v)苏丹Ⅲ染液配制:取0.1 g苏丹Ⅲ,溶于20 mL 95%酒精中,即成0.5%苏丹Ⅲ染液。
染色过程:切片浸没于苏丹Ⅲ溶液5~10 min,用50%酒精洗涤,去浮色,加上甘油后观察。
1.4.2甲苯胺兰(TBO)染色法[3]
0.05%(w/v)TBO染液配制:取0.05 g TBO,溶于100 mL蒸馏水,混匀即成0.05%TBO。
染色过程:切片浸没于0.05% TBO中,染色3~5 min后,蒸馏水洗,盖上盖玻片。
其中,1.1.1硫酸消化法,1.2.1苏丹7B染色法,1.3.1盐酸—间苯三酚染色法,1.4.1苏丹Ⅲ染色法和1.4.2甲苯胺兰染色法在莱卡光学显微镜(Leica DME)下观察,记录实验结果。1.1.2硫酸氢黄连素—苯胺兰对染法和1.2.2蓝色激发光检测法在荧光显微镜(Olympus IX71)蓝色激发光下观察,记录实验结果。图片主要用Photoshop 7.0软件处理,加标尺,调整图片亮度和对比度,以及合成图片等其他操作可参考有关文献[3~5,8~10]。
2 结果与分析
2.1 初生壁凯氏带的组织化学定位
选择春季正在旺盛生长的虉草植株,切取根茎尖第2节间用双面刀片横切,然后把其中一片纵切为多个小片,挑取1~2小片用硫酸处理,根茎内皮层凯氏带成波浪线形(图1:A);若将根茎横切片用硫酸氢黄连素—苯胺兰对染,根茎内皮层凯氏带呈现生动黄色(图1:B)。虉草不定根横切片(距根尖约5 cm)用硫酸氢黄连素—苯胺兰对染,内皮层已有马蹄形木质化增厚且凯氏带呈生动黄色,外皮层有2层细胞具带状凯氏带(图1:C)。水芹不定根(距根尖约10 cm)横切,仅内皮层具点状凯氏带(图1:D)。这说明相同物种不同组织器官以及不同物种间的凯氏带形态有所差别。

图1 初生壁中凯氏带的显微结构 A.虉草幼茎横切,内皮层凯氏带(箭头),SA;B.虉草幼茎横切,内皮层凯氏带(箭头),维管束,皮层,BAB;C.虉草不定根横切,内皮层凯氏带(箭头),外皮层凯氏带(箭),皮层,BAB;D.水芹不定根横切,内皮层凯氏带(箭头),皮层气腔周围栓质层(箭),皮层,BAB SA.浓硫酸消化;BAB.硫酸氢黄连素—苯胺兰对染;co.皮层;vb.维管束Fig.1 Photomicrographs of Casparian bands in primary walls A.Transverse section of a young stolon of P.arundinacea,endodermis Casparian bands(arrowheads),SA; B.Transverse section of a young stolon of P.arundinacea,endodermis Casparian bands(arrowheads),BAB; C.Transverse section of an adventitious root of P.arundinacea,endodermis Casparian bands(arrowheads),exodermis Casparian bands(arrows),cortex,BAB; D.Transverse section of an adventitious root of O.javanica,endodermis Casparian bands(arrowheads),suberized lamellae around walls of aerenchyma,cortex,BAB SA.Concentrated sulphuric acid digestion; BAB.Berberine hemisulfate-aniline blue stained; co.Cortex; vb.Vascular bundle
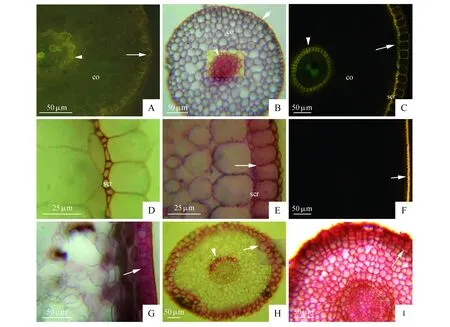
图2 次生壁中栓质层的显微结构 A.水芹不定根横切,内皮层栓质层(箭头),表皮细胞外扩散状栓质层(箭),皮层,BAB;B.水芹不定根横切,内皮层栓质层(箭头),皮层,表皮细胞外扩散状栓质层(箭),SR7B;C.菰草不定根横切,内皮层栓质层(箭头),皮层,外皮层栓质层(箭),厚壁层,不染色;D.菰草不定根横切,木质化厚壁层,Pg;E.菰草不定根横切,外皮层栓质层(箭),SR7B;F.菰草幼茎横切,周缘厚壁组织的栓质层和表皮外角质层(箭),不染色;G.菰草幼茎横切,周缘厚壁组织的栓质层和表皮外角质层(箭),SR7B;H.藜蒿不定根横切,内皮层栓质层(箭头),皮层,外皮层栓质层(箭),SR7B;I.藜蒿不定根横切,皮层,皮层细胞(箭头),外皮层细胞(箭),SRⅢ BAB.硫酸氢黄连素—苯胺兰对染;Pg.盐酸—间苯三酚染色;SR7B.苏丹7B染色;SRⅢ.苏丹Ⅲ染色;co.皮层;scr.厚壁层Fig.2 Photomicrographs of suberin lamellae in secondary walls A.Transverse section of an adventitious root of O.javanica,suberized endodermis(arrowheads),suberin lamellae out of epidermis(arrows),cortex,BAB; B.Transverse section of an adventitious root of O.javanica,suberized endodermis(arrowheads),suberin lamellae out of epidermis(arrows),cortex,SR7B; C.Transverse section of an adventitious root of Z.latifolia,suberized endodermis(arrowheads),cortex,suberized exodermis(arrows),sclerenchyma ring,non-stained; D.Transverse section of an adventitious root of Z.latifolia,lignified sclerenchyma ring,Pg; E.Transverse section of an adventitious root of Z.latifolia,suberized exodermis(arrows),SR7B; F.Transverse section of a young stem of Z.latifolia,suberized peripheral sclerenchyma ring and cuticles(arrows),non-stained; G.Transverse section of a young stem of Z.latifolia,suberized peripheral sclerenchyma ring and cuticles(arrows),SR7B; H.Transverse section of an adventitious root of A.selengensis,suberized endodermis(arrowheads),cortex,suberized exodermis(arrows),SR7B; I.Transverse section of an adventitious root of A.selengensis,cortex,cortical cell(arrowheads),exodermal cell(arrows),SRⅢ BAB.Berberine hemisulfate-aniline blue stained; Pg. Phloroglucinol-HCl; SR7B. Sudan red 7B stained; SRⅢ. Sudan Ⅲ stained; co. Cortex; scr. Sclerenchyma ring

图3 次生壁木质化的显微结构 A.菰草不定根横切,内皮层木质化(箭头),初生木质部,皮层,外皮层木质化(箭头),BAB; B.菰草不定根横切,内皮层木质化(箭头),初生木质部,Pg; C.水芹不定根横切,内皮层凯氏带(箭头),皮层,皮下层木质化(箭),BAB; D.水花生不定根横切,内皮层凯氏带(箭头),初生木质部,皮层,BAB; E.牛鞭草老茎横切,周缘厚壁层中黑色部分为含叶绿体的薄壁细胞,厚角组织部分木质化(箭头),周缘厚壁层(箭),维管束,Pg; F.牛鞭草老茎横切,周缘厚壁层中黑色部分为含叶绿体的薄壁细胞,厚角组织(箭头),周缘厚壁层(箭),维管束,BAB; G.双穗雀稗老茎横切,厚角组织(箭头),周缘厚壁层(箭),厚壁层(中括号),维管束,BAB; H.天胡荽花梗横切,内皮层凯氏带(箭头),皮层,皮下层厚角组织(箭),BAB; I.藜蒿不定根横切,次生木质部,皮层,皮层细胞(箭头),外皮层细胞(箭),TBO BAB.硫酸氢黄连素—苯胺兰对染;Pg.盐酸—间苯三酚染色;SR7B.苏丹7B染色;TBO.甲苯胺兰染色;co.皮层;px.初生木质部;sx.次生木质部;vb.维管束Fig.3 Photomicrographs of lignin in secondary walls A. Transverse section of an adventitious roots of Z.latifolia,lignified endodermis(arrowheads),cortex,lignified exodermis(arrows),BAB; B. Transverse section of an adventitious roots of Z.latifolia,lignified endodermis(arrowheads),primary xylem,Pg; C. Transverse section of an adventitious roots of O.javanica,endodermis Casparian bands(arrowheads),cortex,lignified hypodermis(arrows),BAB; D. Transverse section of an adventitious roots of A.philoxeroides,endodermis Casparian bands(arrowheads),primary xylem,cortex,BAB; E. Transverse section of an aged stem of H.altissima,The black part is choroplast in peripheral sclerenchyma ring,partly collenchymas lignified(arrowheads),peripheral sclerenchyma ring(arrows),vascular bundle,Pg; F. Transverse section of an aged stem of H.altissima,The black part is choroplast in peripheral sclerenchyma ring,collenchymas(arrowheads),peripheral sclerenchyma ring(arrows),vascular bundle,BAB; G. Transverse section of an aged stem of P.distichum,collenchymas(arrowheads),peripheral sclerenchyma ring(arrows),sclerenchyma ring(brackets),vascular bundle,BAB; H. Transverse section of a pedicel of H.sibthorpioides,endodermis Casparian bands(arrowheads),cortex,hypodermal collenchymas(arrows),BAB; I. Transverse section of an adventitious roots of A.selengensis,secondary xylem,cortex,cortical cell(arrowheads),exodermal cell(arrows),TBO BAB.Berberine hemisulfate-aniline blue stained; Pg.Phloroglucinol-HCl; SR7B.Sudan red 7B stained; TBO.toluidine blue O stained; co. Cortex; px. Primary xylem; sx. Secondary xylem; vb. Vascular bundle
2.2 细胞壁栓质层的组织化学定位
水芹不定根(距根尖约1 cm)横切片经硫酸氢黄连素—苯胺兰对染,在蓝色激发光下内皮层栓质层,表皮细胞外扩散状栓质层呈现棕色(图2:A);而用苏丹7B染色这些栓质化细胞壁呈现红色(图2:B),皮层气腔周围细胞壁也具栓质层(图1:D)。菰草不定根(距根尖约5 cm)横切不染色,在蓝色激发光下内皮层、外皮层栓质层呈现棕色(图2:C),厚壁层木质化后有呆滞黄色(图2:C~D),外皮层用苏丹7B染色呈红色(图2:E)。菰草幼茎横切不染色在蓝色激发光下周缘厚壁组织的栓质层和表皮外角质层呈棕色(图2:F),苏丹7B染色这些结构呈红色(图2:G)。藜蒿不定根横切片经苏丹7B染色内皮层、外皮层栓质层呈红色(图2:H);而用常规苏丹Ⅲ染色则不能仅将内、外皮层栓质层染成红色,组织特异性差,常将细胞内的脂肪也染成红色,造成栓质化胞壁不易识别(图2:I)。
水芹不定根内皮层栓质层,表皮扩散状栓质层,气腔周围栓质层在没有木质化条件下,采用硫酸氢黄连素—苯胺兰对染呈棕色。菰草不定根外皮层出现木质化,即使不染色,在蓝色激发光下有呆滞黄色出现,若硫酸氢黄连素—苯胺兰对染,木质化胞壁表现出的黄色直接掩盖栓质层发出的棕色(图3:A)。
2.3 细胞壁木质化的组织化学定位
菰草不定根横切片,初生木质部、内皮层、内皮层外侧一层细胞壁和外皮层木质化呈樱桃红色或呆滞黄色(图3:A~B)。水芹不定根横切片皮下层木质化(图3:C),水花生不定根横切片内皮层具凯氏带,皮层细胞壁显浅黄色荧光(图3:D),菰草、水芹和水花生不定根初生木质部都木质化(图3:A~D)。牛鞭草老茎横切片皮层厚角组织经盐酸—间苯三酚染色呈现樱桃红色(图3:E),而硫酸氢黄连素—苯胺兰对染皮层厚角组织显浅黄色荧光(图3:F),表皮下周缘厚壁层和维管束都木质化;类似的双穗雀稗老茎和天胡荽花梗中厚角组织显浅黄色荧光(图3:G~H),双穗雀稗茎周缘厚壁层、厚壁层和维管束与天胡荽花梗木质部也都木质化(图3:G~H)。提示经过硫酸氢黄连素—苯胺兰对染,水花生不定根皮层、牛鞭草和双穗雀稗老茎和天胡荽花梗中厚角组织显浅黄色荧光,这些细胞壁是否木质化,以及其中所含化学成分尚待进一步分析研究。
2.4 细胞壁快速染色
苏丹Ⅲ或Ⅳ常将细胞壁、细胞内的脂肪也染成红色,组织特异性差,造成栓质化胞壁不易识别;而甲苯胺兰(TBO)染色结果细胞边界更清晰,分生组织细胞层次清楚。藜蒿不定根横切片苏丹Ⅲ染色后,皮层细胞分裂边界、外皮层细胞分裂边界和根的各显微结构层次不太明朗(图2:I);而甲苯胺兰染色结果是皮层,皮层分生组织细胞,外皮层分生组织细胞层次清楚(图3:I)。因此,现在一般用TBO染色方法取代苏丹Ⅲ法。
3 讨论
根据Geldner等研究拟南芥不定根内皮层凯氏带分子发育机理报道,认为初生壁凯氏带由凯氏带膜蛋白质、先有木质素或后有木栓质沉积组成,次生壁组织化学沉积木质素或木栓质组成[23~28,31~32]。凯氏带形成过程中,有凯氏带膜蛋白家族(CASPs)参与指导木质素和木栓质在凯氏带位置的积累,该凯氏带膜蛋白在初生壁上也构成类似于动物上皮组织细胞间仅蛋白质参与的紧密连接,具有保护作用[25,27]。凯氏带的形成应具备凯氏带结构、围绕维管束的拓扑学结构和SCR基因的表达三大要素[26]。
凯氏带经典研究方法是在普通光学显微镜下观察根内皮层径向壁增厚,栓质化和木质化。现已明确凯氏带是由凯氏带膜蛋白质、栓质化和木质化组成,并随物种、所在组织器官不同具有多态性,除了常见于根内、外皮层,也见于茎、花柄和叶柄[4,10,13~16,19],采用单一研究方法常遇到实验结果难以解释的困扰。如本研究中虉草茎内皮层的凯氏带,以前未见类似报道,就需要硫酸消化法和硫酸氢黄连素—苯胺兰对染二种方法确定具凯氏带;此外,虉草不定根内、外皮层凯氏带之间以及与水芹不定根的凯氏带形态有很大差别,如本文(图1:A~D)。
采用硫酸消化法可在内、外皮层还没有形成次生壁之前,硫酸可将初生壁中纤维素消化,把凯氏带暴露出来,呈波浪形。凯氏带经硫酸氢黄连素—苯胺兰对染在荧光显微镜下呈现生动黄色,如果次生壁已形成,次生壁发出强烈黄色荧光常把凯氏带的生动黄色遮盖,不能辨别,因此硫酸消化法和硫酸氢黄连素—苯胺兰对染法都需要在次生壁形成之前易观察到,因此取材时间和部位把握十分重要[3~6,8~10]。建议把硫酸消化法和硫酸氢黄连素—苯胺兰对染法配合研究凯氏带相互印证研究结果,判读是否具凯氏带更确切可靠。根据现有凯氏带分子发育证据,表明凯氏带膜蛋白质在这二种方法中扮演了重要的组织化学作用,推测硫酸不能消化凯氏带膜蛋白而波浪状存留下来,凯氏带膜蛋白能结合黄连素阳离子和苯胺兰阴离子而发出生动黄色荧光,而木质化细胞壁能大量结合黄连素离子发出强烈黄色荧光。
植物栓质层主要分布在根表皮外呈扩散状,气腔周围细胞,内、外皮层[1~5];茎、叶和花柄表皮外角质层,内、外皮层,周缘厚壁层和皮层内侧的厚壁层,维管束细胞[2~10,17~19,22]。栓质常包含芳香族化合物,碳链长16~30,为多聚脂肪族聚合物,化学单体为ω-羟基脂肪酸、α,ω-二羟基脂肪酸、脂肪醇、羟基多聚芳香族等[2,7,20,23,33~37]。现在常用苏丹7B染色细胞壁木栓质和角质层在普通光学显微镜下呈现红色,具有很强的组织特异性,如菰草不定根外皮层,茎角质层和周缘厚壁组织层,藜蒿不定根内、外皮层(图2:E,G~H);而苏丹Ⅲ或Ⅳ常将细胞内的脂肪也染成红色,特异性差,造成藜蒿不定根内、外皮层栓质化胞壁与皮层没有栓质化胞壁不易识别(图2:I)。不经任何染色,栓质层在蓝色激发光下呈现棕色,如菰草不定根内、外皮层和茎的周缘厚壁组织层(图2:C,F)。水芹不定根经硫酸氢黄连素—苯胺兰对染,皮层气腔胞壁、内皮层和表皮细胞外侧在蓝色激发光下也呈现棕色(图1:D,图2:A)。在本研究中,经硫酸氢黄连素—苯胺兰对染或不染色,栓质层在蓝色激发光下呈棕色,比用苏丹7B染色法更敏感易观察到(图2:A~B)。
细胞壁木质素主要分布在根皮下层[11~12],内、外皮层和木质部[3,5~6,8~10,21,29];茎内、外皮层,周缘厚壁层和皮层内侧的厚壁层,木质部[3~4,6,8~10,21,29]。木质素是以3种羟基肉桂醇异构体(对—香豆醇、松柏醇和芥子醇)为单体的聚合过程[38]。水芹不定根皮下层仅木质化(图3:C)。经过硫酸氢黄连素—苯胺兰对染,水花生不定根皮层、牛鞭草和双穗雀稗老茎和天胡荽花梗中厚角组织显浅黄色荧光(图3:D,F~H)[3,8],这些细胞壁是否是否木质化,或者含有能结合黄连素的物质,其中所含化学成分尚待进一步分离分析。
在本研究中,采用硫酸消化法和硫酸氢黄连素—苯胺兰对染法研究凯氏带,对取材时间和部位把握十分重要,若用单一方法没有把握确定有无凯氏带,建议今后把这两种方法配合使用。苏丹7B染色法,蓝色激发光下不染色和硫酸氢黄连素—苯胺兰对染研究细胞壁栓质层3种方法中,若细胞壁也木质化,硫酸氢黄连素—苯胺兰对染法因木质化胞壁发出的黄色荧光遮盖栓质层的棕色荧光而无法分辨失去作用。不染色蓝色激发光下结果比苏丹7B染色法敏感显色易观察。硫酸氢黄连素—苯胺兰对染法比经典间苯三酚—盐酸染色厚角组织更敏感显色,表明厚角组织增厚部分所含的化学成分需要以后分离分析,为研究细胞壁组织化学提供更多理论依据。
1.Schreiber L,Franke R B.Endodermis and exodermis in roots[R].Chichester:John Wiley and Sons Ltd,2011,doi:10.1002/9780470015902.a0002086.pub2.
2.Abiko T,Kotula L,Shiono K,et al.Enhanced formation of aerenchyma and induction of a barrier to radial oxygen loss in adventitious roots ofZeanicaraguensiscontribute to its waterlogging tolerance as compared with maize(Zeamaysssp.mays)[J].Plant,Cell & Environment,2012,35(9):1618-1630.
3.Yang C D,Zhang X,Li J K,et al.Anatomy and histochemistry of roots and shoots in wild Rice(ZizanialatifoliaGriseb.)[J].Journal of Botany,2014:181727.
4.杨朝东,张霞.双穗雀稗(Paspalumdistichum)通透性生理和茎解剖结构补充研究[J].植物研究,2013,33(5):564-568.
Yang C D,Zhang X.Permeability and supplement structures of stems ofPaspalumdistichum[J].Bulletin of Botanical Research,2013,33(5):564-568.
5.张霞,杨朝东,宁国贵.狗牙根和双穗雀稗根中质外体屏障结构发育过程的比较研究[J].湖北农业科学,2013,52(20):4991-4994.
Zhang X,Yang C D,Ning G G.The developmental comparison of apoplastic barriers inCynodondactylonandPaspalumdistichumroots[J].Hubei Agricultural Sciences,2013,52(20):4991-4994.
6.Seago J L Jr.,Peterson C A,Enstone D E,et al.Development of the endodermis and hypodermis ofTyphaglaucaGodr.andT.angustifoliaL. roots[J].Canadian Journal of Botany,1999,77(1):122-134.
7.Soukup A,Armstrong W,Schreiber L,et al.Apoplastic barriers to radial oxygen loss and solute penetration:a chemical and functional comparison of the exodermis of two wetland species,PhragmitesaustralisandGlyceriamaxima[J].New Phytologist,2007,173(2):264-278.
8.Yang C D,Zhang X,Zhou C Y,et al.Root and stem anatomy and histochemistry of four grasses from the Jianghan floodplain along the Yangtze River,China[J].Flora,2011,206(7):653-661.
9.杨朝东,李守峰,邓仕明,等.白茅解剖结构和屏障结构特征研究[J].草业学报,2015,24(3):213-218.
Yang C D,Li S F,Deng S M,et al.Study of the anatomy and apoplastic barrier characteristics ofImperatacylindrica[J].Acta Prataculturae Sinica,2015,24(3):213-218.
10.杨朝东,李守峰,姚兰,等.天胡荽(Hydrocotylesibthorpioides)的解剖和屏障结构特征研究[J].草业学报,2015,24(7):139-145.
Yang C D,Li S F,Yao L,et al.A study of anatomical structure and apoplastic barrier characteristics ofHydrocotylesibthorpioides[J].Acta Prataculturae Sinica,2015,24(7):139-145.
11.López-pérez L,Fernández-garcía N,Olmos E,et al.The phi thickening in roots of broccoli plants:an acclimation mechanism to salinity[J].International Journal of Plant Sciences,2007,168(8):1141-1149.
12.Fernández-garcía N,López-pérez L,Hernandez M,et al.Role of phi cells and the endodermis under salt stress inBrassicaoleracea[J].New Phytologist,2009,181(2):347-360.
13.Meyer C J,Peterson C A.Casparian bands occur in the periderm ofPelargoniumhortorumstem and root[J].Annals of Botany,2011,107(4):591-598.
14.Mcmanus H A,Seago J L,Jr.,Marsh L C.Epifluorescent and histochemical aspects of shoot anatomy ofTyphalatifoliaL.,TyphaangustifoliaL. andTyphaglaucaGodr[J].Annals of Botany,2002,90(4):489-493.
15.Vecchia F D,Cuccato F,Rocca N L,et al.Endodermis-like sheaths in the submerged freshwater macrophyteRanunculustrichophyllusChaix[J].Annals of Botany,1999,83(1):93-97.
16.Watanabe H,Saigusa M,Morita S.Identification of Casparian bands in the mesocotyl and lower internodes of rice(OryzasativaL.) seedlings using fluorescence microscopy[J].Plant Production Science,2006,9(4):390-394.
17.Mertz R A,Brutnell T P.Bundle sheath suberization in grass leaves:multiple barriers to characterization[J].Journal of Experimental Botany,2014,65(13):3371-3380.
18.Enstone D E,Peterson C A,Ma F S.Root endodermis and exodermis:structure,function,and responses to the environment[J].Journal of Plant Growth Regulation,2002,21(4):335-351.
19.杨朝东,张霞,刘国锋,等.植物根中质外体屏障结构和生理功能研究进展[J].植物研究,2013,33(1):114-119.
Yang C D,Zhang X,Liu G F,et al.Progress on the structure and physiological functions of apoplastic barriers in root[J].Bulletin of Botanical Research,2013,33(1):114-119.
20.Fich E A,Segerson N A,Rose J K C.The plant polyester cutin:biosynthesis,structure,and biological roles[J].Annual Review of Plant Biology,2016,67(1):207-233.
21.Brundrett M C,Enstone D E,Peterson C A.A berberine-aniline blue fluorescent staining procedure for suberin,lignin,and callose in plant tissue[J].Protoplasma,1988,146(2):133-142.
22.Brundrett M C,Kendrick B,Peterson C A.Efficient lipid staining in plant material with Sudan red 7B or Fluoral yellow 088 in polyethylene glycol-glycerol[J].Biotechnic & Histochemistry,1991,66(3):111-116.
23.Pauluzzi G,Divol F,Puig J,et al.Surfing along the root ground tissue gene network[J].Developmental Biology,2012,365(1):14-22.
24.Naseer S,Lee Y,Lapierre C,et al.Casparian strip diffusion barrier inArabidopsisis made of a lignin polymer without suberin[J].Proceedings of the National Academy of Science of the United States of America,2012,109(25):10101-10106.
25.Alassimone J,Roppolo D,Geldner N,et al.The endodermis-development and differentiation of the plant’s inner skin[J].Protoplasma,2012,249(3):433-443.
26.Geldner N.The endodermis[J].Annual Review of Plant Biology,2013,64(1):531-558.
27.Roppolo D,De Rybel B,Tendon V D,et al.A novel protein family mediates Casparian strip formation in the endodermis[J].Nature,2011,473(7347):380-383.
28.Lee Y,Rubio M C,Alassimone J,et al.A mechanism for localized lignin deposition in the endodermis[J].Cell,2013,153(2):402-412.
29.Jensen W A.Botanical histochemistry:principles and practice[M].San Francisco,CA:W.H.Freeman,1962.
30.Meyer C J,Seago J L Jr.,Peterson C A.Environmental effects on the maturation of the endodermis and multiseriate exodermis ofIrisgermanicaroots[J].Annals of Botany,2009,103(5):687-702.
31.Roppolo D,Boeckmann B,Pfister A,et al.Functional and evolutionary analysis of the Casparian strip membrane domain protein family[J].Plant Physiology,2014,165(4):1709-1722.
32.Pfister A,Barberon M,Alassimone J,et al.A receptor-like kinase mutant with absent endodermal diffusion barrier displays selective nutrient homeostasis defects[J].eLIFE,2014,3:e03115.
33.Shiono K,Ogawa S,Yamazaki S,et al.Contrasting dynamics of radial O2-loss barrier induction and aerenchyma formation in rice roots of two lengths[J].Annals of Botany,2011,107(1):89-99.
34.Buschhaus C,Jetter R.Composition differences between epicuticular and intracuticular wax substructures:how do plants seal their epidermal surfaces[J]?Journal of Experimental Botany,2011,62(3):841-853.
35.Beisson F,Li-Beisson Y,Pollard M.Solving the puzzles of cutin and suberin polymer biosynthesis[J].Current Opinion in Plant Biology,2012,15(3):329-337.
36.Schreiber L.Transport barriers made of cutin,suberin and associated waxes[J].Trends in Plant Science,2010,15(10):546-553.
37.Watanabe K,Nishiuchi S,Kulichikhin K,et al.Does suberin accumulation in plant roots contribute to waterlogging tolerance[J]?Frontiers in Plant Science,2013,4(2):57-60.
38.张晓民.禾本科植物细胞壁的木质化和阿魏酰化[J].中国野生植物资源,2011,30(6):7-13.
Zhang X M.Lignification and feruloylation in the cell wall of grass family[J].Chinese Wild Plant Resources,2011,30(6):7-13.
Engineering Research Center of Ecology and Agriculture Use of Wetland, Ministry of Education opening fund(KF201603)
introduction:ZHANG Xia(1981—),female,master,Major in Botany Research.
date:2016-07-28
ComparativeStudyonStainingMethodsandTechniquesofCellWallHistochemistry
ZHANG Xia HU Lu-Jie ZHOU Cun-Yu YANG Chao-Dong*
(College of Gardening and Horticulture,Yangtze University,Jingzhou 434025)
We carried out the comparative studies on several methods and techniques for cell wall histochemistry under light and epifluorescence microscope. The results showed that: (1)To study Casparian bands using staining methods of sulphuric acid digestion and berberine hemisulfate-aniline, the requirements of material collecting time and part were high, therefore, it was recommended to use the two methods to mutual confirmation; (2)To study suberin lamellae using Sudan red 7B staining, and none staining and berberine hemisulfate-aniline blue staining under blue excited, none staining was more sensitive than Sudan red 7B, but Sudan red 7B staining is convenient under light microscope; (3)To study lignified walls, berberine hemisulfate-aniline staining was more sensitive than phloroglucinol-HCl; (4)Using TBO fast wall staining to replace Sudan Ⅲ/Ⅳ conventional staining, the wall borders and layers were clearer.
walls histochemistry;Casparian bands;suberin lamellae;lignified walls
湿地生态与农业利用教育部工程研究中心开放基金(KF201603)
张霞(1981—),女,硕士,主要从事植物学研究。
* 通信作者:E-mail:chaodongyang@aliyun.com
2016-07-28
* Corresponding author:E-mail:chaodongyang@aliyun.com
Q93-333
A
10.7525/j.issn.1673-5102.2017.01.019

