一株漫水河百合内生菌的分离、鉴定及代谢产物活性研究
孙传伯,赵 群,陈存武,陈乃富,韩邦兴
(皖西学院 生物与制药工程学院,安徽 六安 237012)
一株漫水河百合内生菌的分离、鉴定及代谢产物活性研究
孙传伯,赵 群,陈存武,陈乃富,韩邦兴
(皖西学院 生物与制药工程学院,安徽 六安 237012)
以安徽省霍山县漫水河百合健康新鲜鳞茎为研究对象,经过分离纯化筛选出一株内生菌株BF2,经菌落形态学和分子生物学鉴定BF2菌株属于散囊菌目踝节菌属Talaromyce;采用正交实验优化组合发酵,代谢产物通过滤纸片法得到对大肠杆菌与金黄色葡萄球菌最大抑制圈分别为3.05 cm和3.26 cm,最佳培养基组合为:NaNO30.6 g;胰蛋白胨2 g;葡萄糖25 g和(NH4)2SO41.5 g。
百合;内生菌;鉴定
百合(Lily)是单子叶植物亚纲,为百合科(Liliaceae)百合属多年生草本球根植物[1]。全世界野生百合有96个种,而原产中国的就有47 个种、18个变种,其中36个种、15个变种更是为中国所特有[2](P3)。百合的花具有观赏价值,其鳞茎又能食用和入药,是一种名贵的药食同源植物[3](P7),[4]。
安徽省霍山县漫水河镇地处大别山腹地深山区,素有“百合之乡”美誉。因此独特地理环境造就其漫水河百合具有极高的药用价值,其鳞茎色白、肉嫩、个大、纯天然,味微甘,对于治疗喉炎、肺结核、肝炎和高血压等病症有较好效果;其多糖含量高,具有抗氧化、清除羟自由基、增强免疫功能的活性功能,是清补保健之佳品[5-11]。
近年来,对植物内生菌的研究表明,植物体的实际生存状态是微生物和植物的共生状态,是微生物在宿主植物体内的协同作用及其所产生的新功能和新物质[12]。同时内生菌对药用植物种子萌发、生长发育、宿主活性代谢物积累、抗逆性、植物生物活性、应对环境气候变化等作用显著[13]。本文以漫水河百合新鲜健康鳞茎为实验材料,分离其可培养内生物微生物,以期为漫水河百合产业健康发展提供理论支持。
1 材料和方法
1.1 材料
1.1.1 百合样品来源
实验对象:漫水河百合球茎(采购于霍山漫水河)
1.1.2 主要试剂
无水乙醇,75%乙醇,琼脂,葡萄糖,牛肉膏,蛋白胨,升汞,胰蛋白胨,KNO3,NH4Cl,NaNO3,(NH4)2SO4,NaOH,HCl,蔗糖等,试剂均为国产分析纯。
1.1.3 供试病原菌
金黄色葡萄球菌、大肠杆菌(皖西学院生物工程教研室提供)
1.1.4 培养基
PDA培养基:马铃薯∶葡萄糖∶琼脂∶水=10 g∶1 g∶1 g∶50 ml。 121 ℃湿热灭菌20 min备用。
1.1.5 主要设备
超净工作台(苏州净化SW-CJ-1B/1BU)、恒温培养箱(太仓市科教器材厂DHP-9162)、恒温摇床(太仓市实验设备厂 TH2-C)、电泳槽(北京六一仪器厂DYCP-31DN)、稳压电泳仪(北京六一仪器厂DYY-5)、 电热恒温水槽(上海一恒科学仪器有限公司DK-8D)、凝胶成像仪(北京百晶AUTO710)、PCR仪(Applied Biosystems 2720 thermal cycler)、冷冻高速离心机(BBI HC-2518R Surf)精密单道可调移液器(eppendorf)。
1.2 内生真菌分离方法
外植体消毒:用清水冲净百合鳞茎表面泥沙后转移至超净工作台→1%升汞浸泡3 min→无菌水洗涤5次→75%乙醇浸泡2 min→无菌水清洗5~8次。
真菌培养:将处理好的样品(将百合瓣切开,然后将切开面放置于培养基上)置于PDA平板上,28 ℃培养,对照组为最后一次无菌洗涤水涂布平板;培养3~4天后切开面有菌丝长出,与对照组进行比较,确认的内生菌转接到斜面试管培养,并于4 ℃保存。
1.3 目标菌株筛选
将带有发酵活性产物直径为8 mm的滤纸圆片放在涂布好供试病原菌的牛肉膏蛋白胨培养基上,在28 ℃恒温培养3天,观察其抑菌圈情况,具体操作方法参考文献[14]。
1.4 内生真菌分子鉴定
纯化备用的试管菌株制备成菌悬液,PCR体系如下:1)基因组DNA提取采用上海生工生物工程公司SK8259(真菌)试剂盒进行提取;2)PCR扩增,上游引物ITS1:TCCGTAGGTGAACCTGCGG下游引物ITS4:TCCTCCGCTTATTGATATGC;3)PCR反应体系:Template(基因组 DNA 20~50 ng/μl)0.5 μl,10×Buffer(with Mg2+)2.5 μl,dNTP(各 2.5 mM) 1 μl,酶0.2 μl,F(10 uM)0.5 μl,R(10 uM)0.5 μl,加双蒸水至25 μl;4)PCR反应体系:a)预变性94 ℃ 4 min;b)变性94 ℃ 45 s;c)复性(退火) 55 ℃ 45 s;d)延伸72 ℃ 1 min;e)步骤b)~d)循环30次;f)修复延伸72 ℃ 10 min后终止反应,4 ℃保温。
把提取到内生真菌DNA序列送至上海生工生物工程有限公司进行测序,获得待确定物种的1条ITS序列,测得的序列数据在 NCBI 上 blast 比对,搜索同源序列,在系统中查出相应微生物,并挑选与靶序列最相近的参考序列,构建反映待确定物种(undetermined species)和相关属之间亲缘关系的系统发育树。
1.5 系统发育树的构建
用软件Clustal X 1.81对内群和外群的ITS序列进行比对和排序,用软件BioEdit 7.0.9.0对相应序列进行编辑。以ITS序列为分子标记,用贝叶斯法(Bayesian inference, BI)和简约法(maximum parsimony, MP)对待确定物种进行分析,并构建系统发育树。
1.6 代谢产物活性研究
试验中固定了发酵温度25 ℃、初始pH为自然,然后设计4因素3水平(见下表1)的培养基(1 000 ml)对分离到的菌株BF2进行发酵实验,活性物质测定采用滤纸片法,具体方法见参考文献[14],每组试验设3组平行,测定结果取平均值。实验对照组采用培养基配置相同,配置完成后不发酵立即进行冷藏,同样用滤纸片法测定抑菌圈。
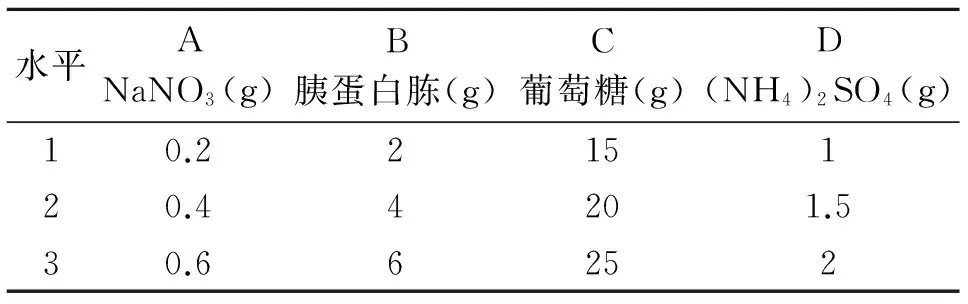
表1 因素水平简表
2 结果
2.1 内生菌平板菌落特征
本次实验共分离真菌类7株,经过对两种指示菌的抑菌活性实验,得到编号为BF2菌株对两种病原菌具有抑菌效果见下图1、图2,表2为BF2菌株平板菌落生物学形态特征。
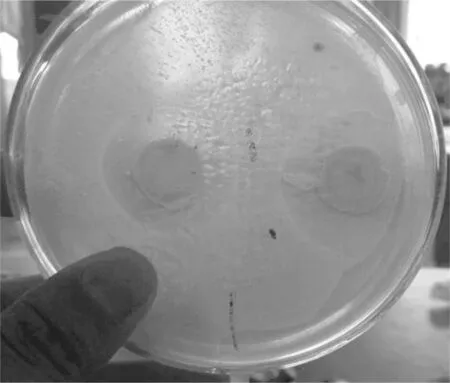
图1 BF2对大肠杆菌抑菌圈

图2 BF2对金黄色葡萄球菌抑菌圈

菌株含水量形态正反差别透明度结合度菌落颜色BF2干燥质地均匀无差别不透明不紧密表面白色,内部浅绿色
2.2 内生菌测序及分子鉴定
提取BF2菌株的DNA送往生工生物工程(上海)股份有限公司进行测序。经过检测得到的碱基对是517bp(Seq1):GCACCTCCCACCCTTGTCTCT ATACACCTGTTGCTTTGGCGGGCCCACCGGGG CCACCTGGTCGCCGGGGGACATCTGTCCCCGG GCCCGCGCCCGCCGAAGCGCTCTGTGAACCCT GATGAAGATGGGCTGTCTGAGTACTATGAAA ATTGTCAAAACTTTCAACAATGGATCTCTTG GTTCCGGCATCGATGAAGAACGCAGCGAAAT GCGATAAGTAATGTGAATTGCAGAATTCCGT GAATCATCGAATCTTTGAACGCACATTGCGC CCCCTGGCATTCCGGGGGGCATGCCTGTCCGA GCGTCATTTCTGCCCTCAAGCACGGCTTGTGT GTTGGGTGCGGTCCCCCCGGGGACCTGCCCGA AAGGCAGCGGCGACGTCCGTCTGGTCCTCGAG CGTATGGGGCTTTGTCACTCGCTCGGGAAGGA CTGGCGGGGGTTGGTCACCACCAAAATTTTAC CACGGTTGACCTCGGATCAGGTAGGAGTTACC CGCTGAACTTAAGCATATCAT。其序列登陆BLAST系统进行比对,结果如下表3。

表3 BF2菌株序列Blast 结果
2.3 BF2菌株系统发育树的构建
2.3.1 序列分析
内群和外群的ITS部分同源片段序列经过比对和编辑后,序列片断的长度为539 bp(包括Gap),有317个变异位点,其中简约性信息位点有229个。所有序列的平均G+C含量为55.8%。
2.3.2 构建系统发育树
通过BI法和MP法构建的系统发育树,其系统树主干部分一致,见下图3。结果表明,待确定分离菌株与散囊菌目Eurotiales的Talaromycespurpureogenus、Penicilliumsp.、Talaromycesamestolkiae、Talaromycesruber和Talaromycespinophilus等物种共享1个单倍型(Hap3);并且与散囊菌目的所有单倍型形成了1个支持度极好的分支(PP=0.99, BS=96),形成单系。
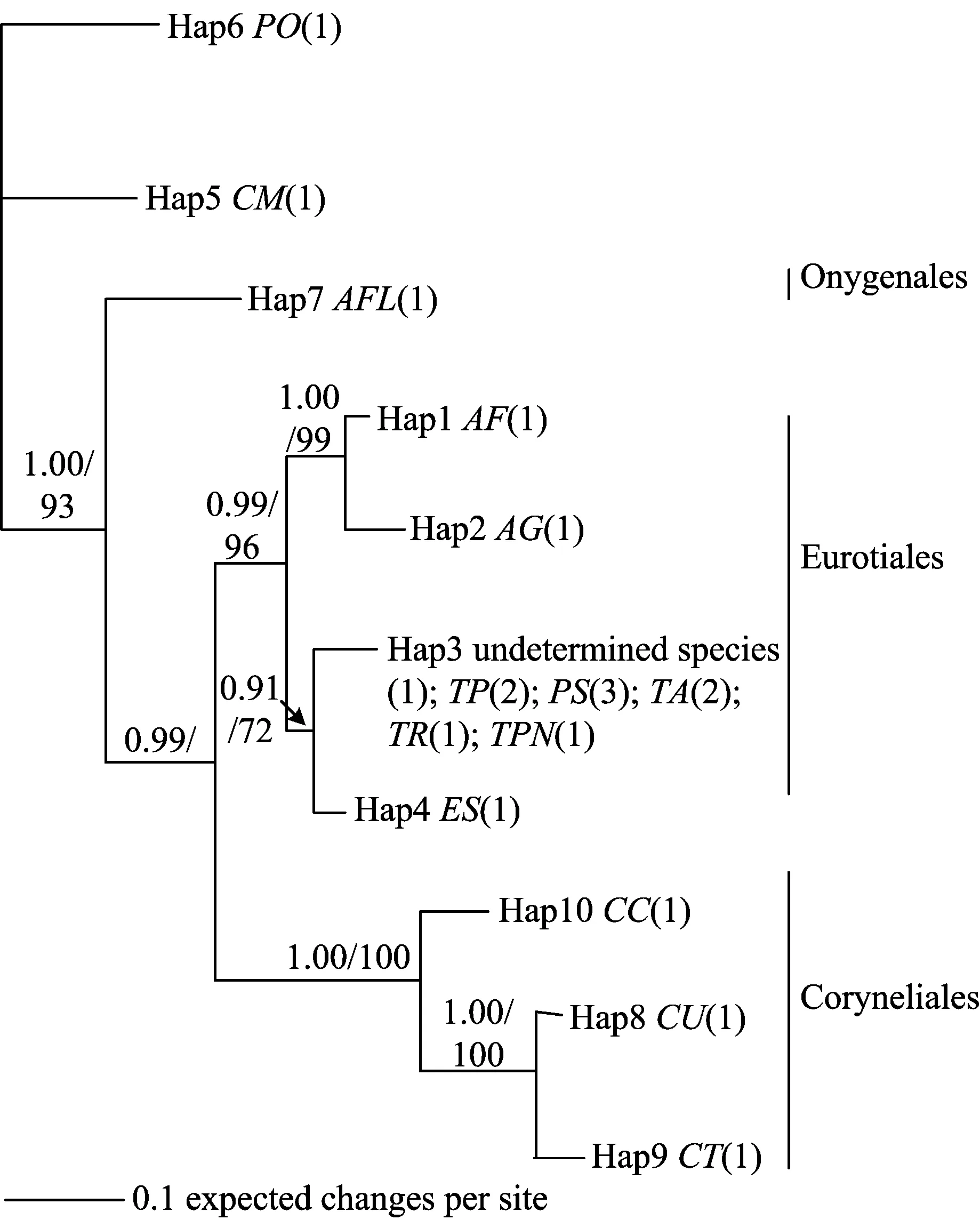
图3 BF2菌株ITS序列系统进化树
又由于待确定分离菌株与散囊菌目中共享1个单倍型物种分别属于踝节菌属Talaromyces和青霉属Penicillium,所以该物种很可能属于踝节菌属或青霉属。考虑到在实验材料是健康的百合鳞茎,并在实验过程中严格去除了青霉属真菌的污染;又根据表2中平板菌落生物学特征,因此可判定该物种属于踝节菌属。从已发表的文献资料[15]表明,从红豆杉中分离的踝节菌属Talaromyces能产功能性活性物质。因此本文针对分离到的踝节菌属目标菌株BF2进行代谢产物活性研究。
2.4 产物活性研究
通过4因素3水平正交发酵实验,通过滤纸片法在平板上形成抑菌圈的直径进行数据统计,其对照组没有形成抑菌圈。从表4中可以看出所有发酵组的纸片在平板上都能形成抑菌圈,说明BF2菌株代谢产物中含有抑菌活性成分;其中序号7的培养基产生的代谢产物活性最高,对金黄色葡萄球菌和大肠杆菌都行产生较强的抑制作用,抑菌圈直径分别为3.26 cm和3.05 cm。其最优实验发酵组配方是A3B1C3D2,即最优活性产物培养基配方(1 000 ml)为:NaNO30.6 g,胰蛋白胨2 g,葡萄糖25 g和(NH4)2SO41.5 g。

表4 产物活性抑菌结果一览表
3 结论与讨论
通过对待定分离菌株与相关类群的ITS分析,可知待定分离菌株与散囊菌目的所有单倍型聚合为支持度极好的分支(PP=0.99, BS=96),形成单系。因此,该待确定分离菌株属于散囊菌目。
从漫水河百合健康鳞茎中分离到一株内生真菌BF2,通过平板生物学特征与分子生物学鉴定BF2菌株属于散囊菌目踝节菌属Talaromyce;通过4因素3水平的正交设计进行发酵实验,可得到其代谢活性产物对金黄色葡萄球菌和大肠杆菌都行产生抑制作用,其中第七组产抑菌圈直径最大分别为3.26 cm和3.05 cm;其最优实验发酵组配方(1000ml)是NaNO30.6 g,胰蛋白胨2 g,葡萄糖25 g和(NH4)2SO41.5 g。
李良群等[15]从云南红豆杉内生真菌TalaromyceSP.T1BF的发酵物中分离到4个功能化合物都具有抗肿瘤成分,说明内生真菌TalaromyceSP.可以产生具有药用价值的活性成分。颜华等[16-20]从药用植物中分离的内生真菌对病原菌具有较强的抑制作用或能产功能性活性物质。本研究分离的漫水河百合内生真菌属于踝节菌属Talaromyce;从代谢活性物质抑菌来看具有显著的效果,目前尚未确定其活性物质成分,有待进一步实验证明;漫水河百合具有较高的药用价值,但其药效与内生菌之间的互作关系得研究鲜有报到,因此对内生真菌与其药用价值之间的关系研究具有较强的理论意义,是下一步研究重点内容。
[1]汪发缕,唐进,梁松筠.中国百合科植物研究[J].云南植物研究,1983(3):261-165.
[2]杨春起.观赏百合实用生产技术[M].北京:中国农业大学出版社,2008.
[3]赵祥云,干树栋,陈新露.中国百合——十年研究进展[M].北京:科技出版社,2000.
[4]吉宏武,丁霄霖.百合化学成分及其淀粉粒结构与一般特性[J].食品研究与开发杂志,2006,(2):33-36.
[5]吴萍,石俊,王瑛,等.百冬止咳丸主要药效学的实验研究[J].中成药,2006,28(2):274-275.
[6]Francisja, Rumbeihawr, Nairmgn.Constituents in Easter Lily Flowers with Medicinal Activity[J].Life Sci,2004,76(6): 671-683.
[7]胡焕萍,张剑,张汉贞.重用鲜品百合治疗肺虚久咳[J].湖北中医杂志,2006,28(8):40-41.
[8]胡焕萍,张剑,甘银凰,等.单味新鲜百合止咳镇静催眠等作用药理实验[J].时珍国医国药,2006,17(9):1704-1705.
[9]胡敏敏,蔡宝昌,张志杰,等.百合多糖的药效学研究[J].中药新药与临床药理,2007,18(2):107-109.
[10]何纯莲,陈腊生,任凤莲.药用百合提取液对羟自由基清除作用的研究[J].理化检验(化学分册),2005,41(8):558-560.
[11]弥曼,李汾,任利君,等.百合多糖的分离纯化及抗肿瘤作用[J].西安交通大学学报(医学版),2009,30(2):177-180.
[12]王志伟,纪燕玲,陈永敢.植物内生菌研究及其科学意义[J].微生物学通报,2015,42(2):349-363.
[13]崔晋龙,郭顺星,肖培根.内生菌与植物的互作关系及对药用植物的影响[J].药学学报,2017,52(2):214-221.
[14]杨冬梅,王慧,李淑君,等.肉桂醛及其衍生物对木材腐朽菌和霉菌的抑制作用[J].林业工程学报,2017,2(1):46-50.
[15]李良群,杨艳光,曾英,等.云南红豆杉内生真菌Talaromyce.spT1BF的化学成分研究[J].广西植物,2011,31(5):699-701.
[16]颜华,何娇,李素俭,等.丹参植株内生菌的分离纯化及其抗病性研究[J].西北植物学报,2016,36(9):1813-1818.
[17]Zheng C.J., Li L., Zou J.P.,et al. Identification of a Quinazoline Alkaloid Produced byPenicilliumvinaceum,an Endophytic Fungus fromCrocussativus[J].Pharm Biol.,2012,50(2): 129-133.
[18]Zhou Z.F., Kurtan T., Yang X.H.,et al.Penibruguieramine A,a Novel Pyrrolizi Dinealkaloid from the Endophytic FungusPenicilliumsp. GD6 Associated with Chinese MangroveBruguieragymnorrhiza[J].Org Lett.,2014,16(5):1390-1393.
[19]Qin J.C., Zhang Y.M., Gao J.M.,et al.Bioactive Metabolites Produced by Chaetomium Globosum,an Endophytic Fungus Isolated from Ginkgo Biloba[J].Bioorg Med Chem Lett.,2009,19(6): 1572-1574.
[20]Aly A.H., Edrada-Ebel R.A., Wray V., et al.Bioactive Metabolites from the Endophytic Fungus Ampelomyces sp.Isolated from the Medicinal Plant Urospermum Picroides[J].Phytochemistry,2008,69(8): 1716-1725.
Isolation,IdentificationandAntimicrobialActivityofMetabolitesofEndophytesfromtheLilyPlantintheManshuihe
SUN Chuanbo, ZHAO Qun, CHEN Cunwu, CHEN Naifu, HAN Bangxing
(CollegeofBiologicalandPharmaceuticalEngineering,WestAnhuiUniversity,Lu’an237012,China)
An endophytic strain named BF2 was isolated and purified from the healthy and fresh bulbs of the lily in the Manshuihe in Huoshan, Anhui province, and the strain was identified to belong to theTalaromycegenus of Eurotiales according to colonial morphology and Molecular biology methods. The optimum combination ferments were adopted using orthogonal experiment, and the maximum inhibition loops formed by the metabolites againstE.coliandStaphylococcusaureuswere 3.05 cm and 3.26 cm, respectively. The optimum medium combination was: NaNO3, Tryptone, Glucose, and (NH4)2SO4were 0.6 g, 2 g, 25 g and 1.5 g, respectively.
lily; endophytes; identification
R284.1
A
1009-9735(2017)05-0010-04
2017-03-27
安徽高校自然科学研究重点项目(KJ2017A403);安徽高校自然科学研究重大项目(KJ2016SD61);皖西学院质量工程项目(wxxy2017110,2016wxxy35,2016wxxy64);皖西学院省级大学生创业创业训练项目(AH201510376027)联合资助。
孙传伯(1978-),男,安徽桐城人,硕士,讲师,研究方向:微生物工程;通信作者:韩邦兴(1978-),男,安徽枞阳人,博士,教授,研究方向:中药学。

