酶添加对酿酒废糟干式厌氧消化产沼气效果的影响
王婷婷, 马诗淳, 孙照勇, 谭 力 , 汤岳琴, 木田建次
(1.四川大学 建筑与环境学院, 成都 610065; 2.农业部可再生能源开发与利用重点实验室, 成都 610041)
项目来源: 泸州市科技支撑计划(2015CDLZ-S06); 农业部农村可再生能源开发利用重点实验室开放研究课题基金资助City (2015CDLZ-S06)
酶添加对酿酒废糟干式厌氧消化产沼气效果的影响
王婷婷1, 马诗淳2, 孙照勇1, 谭 力1, 汤岳琴1, 木田建次1
(1.四川大学 建筑与环境学院, 成都 610065; 2.农业部可再生能源开发与利用重点实验室, 成都 610041)
酿酒废糟是白酒生产过程的主要副产物,其处理及资源化利用是亟待解决的问题。该研究拟采用干式厌氧消化技术处理日益增加的酿酒废糟,同时生产生物能源沼气。为了提高沼气产量,探讨了酶添加对酿酒废糟高温干式厌氧消化效果的影响,并监测了厌氧消化过程中污泥pH值, 有机酸(volatile fatty acids, VFAs),可溶性有机碳(soluble total organic carbon, TOC)等系统参数的变化情况。结果表明,直接利用酿酒废糟进行干式厌氧消化,系统启动初期有有机酸积累,稳定发酵条件下的沼气产量约为270.7 mL·g-1VS。向酿酒废糟厌氧消化过程中添加淀粉酶、糖化酶和纤维素酶能够显著促进沼气产量,沼气产率提高到337.6 mL·g-1VS,有机酸浓度保持在较低的水平。分别对两体系中细菌和古菌16S rRNA基因进行定量PCR,结果表明,酶添加体系同对照相比参与厌氧消化过程的微生物数量显著增加。
酿酒废糟; 厌氧消化; 沼气; 酶添加; 定量PCR
我国白酒的酿造过程是世界上独特的酿酒工艺—采用固态发酵和固态蒸馏操作。酿酒废糟(FGW, fermented grain waste)作为白酒酿造过程的主要副产品,每年的产生量达到2500万吨[1]。酿酒废糟的含水率达50%~60%,残留着许多未被完全利用的淀粉、蛋白质、氨基酸和矿物元素等,其营养物质丰富,极易腐败变质,不易储存[2]。传统的处理方法主要是将其烘干以后同煤炭一起燃烧产生蒸汽,但是由于酿酒废糟的高含水量,直接燃烧的方法能量产出较低,同时燃烧过程中易产生大量灰尘和有毒气体,容易造成二次污染[3]。因此,有必要寻求一种对环境友好的方法处理酿酒废糟。
利用废弃生物质进行厌氧消化产沼气既是一种有效处理有机废弃物的方式,同时还能获得可再生能源沼气,现已在世界范围内被广泛应用[4]。在国务院印发的“十二五”国家战略性新兴发展规划中有关生物质能产业的发展目标中,到2015年生物燃气年利用量要达到300亿立方米,到2020年沼气产量将提高到500亿立方米。相对于湿式厌氧消化,干式厌氧消化技术(固含量≥15%)的优势在于较小的反应器体积以及较少的能量投入[5]。对于含水率相对较低的原料(如酿酒废糟),采用干式厌氧消化能够避免由于过多水的添加导致原料处理量过大的问题。尽管已有一些利用湿式厌氧消化技术将酿酒废糟转化为沼气的实验研究[6,7],目前尚未有直接利用酿酒废糟进行高温干式厌氧消化产沼气的报道。
酿酒废糟成分中含有较高的纤维素、半纤维素以及木质素(总量约占60%),水解步骤是其厌氧消化产甲烷过程的主要限速阶段。通过酶添加可能促进底物的降解便于微生物对底物的利用,例如添加淀粉酶可能促进淀粉的降解,添加纤维素酶和糖化酶则可能促进纤维素和其他多糖类物质的水解[8]。因此,本研究以酿酒废糟为原料,研究其通过高温干式厌氧消化技术产沼气的潜力,对比研究了添加酶对酿酒废糟沼气产量的提升效果,结合发酵过程中的pH值,有机酸(VFAs)及可溶性有机碳(TOC)等参数对发酵系统稳定性进行研究,同时利用荧光定量PCR技术检测了酿酒废糟干式厌氧消化过程中微生物数量的变化,以期为酿酒废糟的资源化利用提供理论依据和技术支撑。
1 材料与方法
1.1 实验材料
1.1.1 原料和接种污泥
酿酒废糟来自四川省内某酒厂,经粉碎机(Masuko Sangyo,Saitama,日本)粉碎至2~3mm,放置于4 ℃冰箱冷藏用于后续实验。酿酒废糟的主要成分含量如表1所示。实验中种子污泥来自使用合成培养基(报纸、狗粮、复印纸和水)长期驯化的实验室规模高温干式厌氧消化体系[9]。

表1 酿酒废糟的基本理化性质
注:DM: 干重。
1.1.2 酶
耐高温α-淀粉酶和糖化酶购自四川山野公司,酶活分别为81,051 U·mL-1和11,681 U·mL1。纤维素酶(CTec-2)由丹麦诺维信公司提供,其滤纸酶活为130 FPU·mL-1。
1.2 实验方法
采用5 L的发酵罐(separable flask,SIBATA,日本)为干式厌氧消化反应器。系统启动时,粉碎的酿酒废糟作为底物加入到3 kg种子污泥中,用手充分混匀后放入发酵罐中,充氮气10分钟以置换反应器上部空气,然后将反应罐密封并放入52 ℃恒温培养箱中静置培养。以1周(7天)为一个周期进行手动取样并补加原料,通过添加自来水来维持反应器内约20%的固含量。沼气产量通过反应罐盖子顶部的胶管连接气体流量计(MGC-1 V3.2 PVDF,Ritter,德国)进行记录,每周补料前取约50 g反应器内的消化污泥进行理化性质及微生物定量分析。
实验分别同时运行了两个反应器R1和R2。R1反应器以酿酒废糟为底物进行干式厌氧消化;R2反应器以酿酒废糟为底物同时添加酶进行干式厌氧消化,其中耐高温α-淀粉酶、糖化酶和纤维素酶的添加量分别为13.4 U·g-1酿酒废糟, 4.9 U·g-1酿酒废糟及0.8 FPU·g-1酿酒废糟(酶添加量根据预实验确定)。两个反应器在有机负荷均为1 gVS·kg-1d-1的条件下共运行了71周。
1.3 微生物荧光定量PCR(qPCR)分析
对R1和R2反应器内消化污泥分别于第21周,第36周,第49周和第69周进行取样,分别命名为A,B,C和D。使用FastDNATMSPIN Kit for Soil(MP Biomedicals,OH,美国)试剂盒抽提基因组总DNA,用分光光度计(NanoDrop 2000,Thermo,日本)检测基因组DNA的浓度和质量。定量PCR使用的仪器为LightCycler(Roche Diagnostics,Mannheim,德国),采用的引物如表2所示,定量PCR操作方法参见Sun等[10]。通过PCR扩增得到的基因片段使用UltraClean PCR-Up试剂盒(MO BIO Laboratories,Carlsbad,美国)进行纯化,然后通过pMD 19-T Vector kit导入质粒;然后将连接产物按操作说明导入Escherichiacoli5α。按照Zeng[11]等的方法提取质粒并且构建标准曲线。微生物的数量用每千克干物质的基因拷贝数来表达(copy numbers·kg-1TS)。
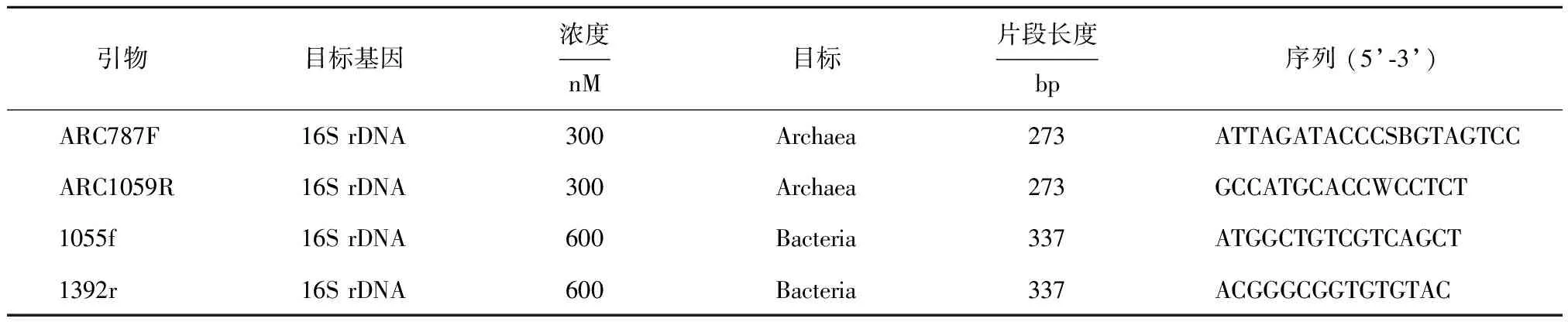
表2 定量PCR引物
1.4 分析方法

2 结果和讨论
2.1 酿酒废糟干式厌氧消化反应器性能评价
2.1.1 干式厌氧消化的产气情况
在厌氧消化过程中,酿酒废糟中的有机物在微生物的作用下降解转化为沼气。因此,沼气的产量可以直接反映系统的运行状态。两个反应器产气情况如图1所示。两反应器分别运行了71周,R1前8周产气量波动较大,这一阶段可能为微生物对酿酒废糟原料的适应期;第9周到39周产气波动逐渐减小,第46周开始产气量趋于稳定,稳定状态下的平均产气量约为270.7 mL·g-1VS,其中甲烷产率为139.4 mL·g-1VS。R2反应器启动初期沼气产量虽然也有小幅波动,但波动相对于R1较小,并于35周产气量开始趋于稳定,从第29周开始,R2的产气量持续高于R1,一直到第71周结束。R2反应器稳定状态下的平均沼气产量约为337.6 mL·g-1VS,其中甲烷产率为190.7 mL·g-1VS。这说明,在52 ℃条件下的干式厌氧消化过程中,添加酶有利于酿酒废糟中有机物的降解,增加了微生物对有机物的利用,最终导致R2的沼气产量比R1增加了24.7%,甲烷产率增加了36.8%。从酿酒废糟成分可知,它是典型的木质纤维素原料,主要成分包括纤维素,半纤维素以及木质素,三者互相缠绕形成了复杂且难降解的结构。结构的复杂性导致酿酒废糟的水解成为厌氧消化过程中的限速步骤,限制了酿酒废糟的沼气产量,因此直接利用酿酒废糟作为干式厌氧消化的底物时产气量相对较低;而添加酶的干式厌氧消化过程中,通过酶的作用(如糖化作用)可将难降解的物质如纤维素、半纤维素转化为易降解的小分子糖类物质以易于发酵微生物利用,从而提高了沼气产量。

图1 酿酒废糟作为底物的干式厌氧消化(R1)及添加酶的干式厌氧消化(R2)沼气产率的变化情况
2.1.2 干式厌氧消化反应器内污泥的理化性质变化
图2~图3显示了反应器内污泥样品的pH值和VFAs(包括乳酸,乙酸和丙酸)的变化;图4显示了污泥样品TOC的变化。反应器内适宜的pH值范围是厌氧消化顺利进行的重要环境条件。从图2和图3可以看出,两个反应器的pH值总体保持稳定,污泥的pH值变化范围在8.2~8.8之间,处于适宜微生物生长的范围。酿酒废糟原料中有较高含量的有机酸,尤其是乳酸[3],因此酿酒废糟pH值较低(pH值约为3.5);而作为干式厌氧消化底物时,这些有机酸被转化,使反应器内pH值维持适宜水平。
从图2可知,R1反应器启动前11周,有机酸浓度维持较高的水平,第6周时达到峰值,约2920 mg·kg-1。随着厌氧消化过程的进行,有机酸浓度迅速降低,到第15周后有机酸浓度降至500 mg·kg-1以下,并一直维持到第71周结束。反应器启动初期有机酸成分主要是丙酸和乙酸,其峰值分别为2261 mg·kg-1和652 mg·kg-1。高浓度的丙酸对厌氧过程有抑制作用,Pullammanappallil[14]等研究认为丙酸浓度在3000 mg-1左右会产生抑制,可知酿酒废糟干式厌氧消化过程中并未受到丙酸抑制。开始阶段有机酸的积累可能和原料本身较高的有机酸含量有关,而且体系在适应酿酒废糟原料时微生物活性相对较低。同R1启动初期较高的有机酸浓度相比,R2反应器的有机酸浓度始终维持在低于1000 mg·kg-1的水平,且波动较小(见图3)。

图2 酿酒废糟作为底物的干式厌氧消化(R1)的pH值及VFA变化

图3 酿酒废糟作为底物添加酶的干式厌氧消化(R2)的pH值及VFA变化


图4 酿酒废糟作为底物的干式厌氧消化(R1)及添加酶的同步糖化干式厌氧消化(R2)的TOC变化
另外,笔者对两个反应器后期稳定状态下的消化污泥残渣进行了成分分析(见表3)。R2反应器消化污泥残渣中的有机物(74.8%)和半纤维素成分(4.6%)均较R1低,纤维素和木质素含量差别不大,两个反应器内均没有检测到淀粉的残留。这一现象说明,同对照组R1相比,添加酶促进了微生物对酿酒废糟中有机物的利用,尤其是促进了半纤维素的降解。另外,从表3可知,R2消化污泥中蛋白质含量较R1高。这可能是微生物将原料中的粗蛋白分解为小分子物质,并进一步利用这些物质合成自身蛋白用于细胞生长[16]。因此在干式厌氧消化过程中,可能更多的菌体细胞蛋白被合成,导致R2消化污泥残渣中蛋白质含量较高。
2.2 干式厌氧消化反应器内微生物的荧光定量PCR分析
选取R1和R2体系的第21(A),36(B),49(C)和69(D)周污泥样品进行荧光定量分析两系统内细菌和古菌的数量,结果如图5~图6所示。对于两个反应器来说,细菌和古菌16S rRNA基因的拷贝数分别在1013~1014和1012~1013数量级范围,这与Huang[17]等在蒸馏残渣的高温干式厌氧消化反应器内检测到的细菌和古菌16S rRNA基因的数量级相近。稳定时期(C和D取样期间),R2样品中细菌和古菌16S rRNA基因的拷贝数分别为5.8~6.9×1013拷贝数·kg-1TS和3.8~6.9×1012拷贝数·kg-1TS,高于同期R1中的微生物数量。系统稳定状态下微生物数量的增加也进一步解释了R2反应器产气量明显高于R1的原因。

表3 干式厌氧消化反应器内消化污泥残渣的基本理化性质
注:ND: 未检测到。

图5 酿酒废糟作为底物的干式厌氧消化(R1)及添加酶的同步糖化干式厌氧消化(R2)细菌定量PCR结果

图6 酿酒废糟作为底物的干式厌氧消化(R1)及添加酶的同步糖化干式厌氧消化(R2)古菌定量PCR结果
3 结论
综上可知,采用高温干式厌氧消化技术处理酿酒废糟且回收能源沼气是可行的。结果表明,利用酿酒废糟为底物进行干式厌氧消化,系统可以稳定运行。干式厌氧消化过程中酶添加能提高甲烷产率达36.8%。同酿酒废糟直接进行干式厌氧消化相比,添加酶对参与厌氧消化过程的微生物数量的增加也有促进作用。
[1] Zhang J, Zhang WX, Wu ZY, Yang J, Liu YH, Zhong X, Deng Y. A Comparison Of Different Dilute Solution Explosions Pretreatment for Conversion Of Distillers' Grains into Ethanol[J].Preparative Biochemistry and Biotechnology,2013,43:1-21.
[2] 李政一, 周 定, 侯文华. 酒糟资源化研究[J].环境科学学报,2000,20(9):145-149.
[3] Tan L, Sun Z, Zhang W, et al. Production of bio-fuel ethanol from distilled grain waste eluted from Chinese spirit making process[J].Bioprocess and biosystems engineering,2014,37(10):2031-2038.
[4] Li Y F, Nelson M C, Chen P H, et al. Comparison of the microbial communities in solid-state anaerobic digestion (SS-AD) reactors operated at mesophilic and thermophilic temperatures[J].Applied microbiology and biotechnology,2015,99(2):969-980.
[5] Guendouz J, Buffiere P, Cacho J, Carrere M, Delgenes JP. High-solids anaerobic digestion: comparison of three pilot scales[J].Water Science and Technology,2008,58:1757-1763.
[6] 付善飞, 许晓晖, 师晓爽,等. 酒糟沼气化利用的基础研发[J].化工学报,2014,65(5):1913-1919
[7] 邢 颖, 李菽琳, 石 艳,等. 酒糟和果渣厌氧发酵产沼气特性研究[J].河南农业科学,2011,40(12):88-90.
[8] Medie F M, Davies G J, Drancourt M, et al. Genome analyses highlight the different biological roles of cellulases[J].Nature Reviews Microbiology,2012,10(3):227-234.
[9] Tang Y Q, Ji P, Hayashi J, et al. Characteristic microbial community of a dry thermophilic methanogenic digester: its long-term stability and change with feeding[J].Applied microbiology and biotechnology,2011,91(5):1447-1461.
[10] Sun Z Y, Zhang J, Zhong X Z, et al. Production of nitrate-rich compost from the solid fraction of dairy manure by a lab-scale composting system[J].Waste Management,2016,51:55-64.
[11] Zeng Y, Guardia A D, Ziebal C, et al. Nitrification and microbiological evolution during aerobic treatment of municipal solid wastes[J].Bioresource Technology,2012,110:144-152.
[12] Van Soest P J, Robertson J, Lewis B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74:3583-3597.
[13] Buswell A, Mueller H. Mechanism of methane fermentation[J].Journal of industrial and engineering chemistry,1952,44:550-552.
[14] Pullammanappallil P C, Chynoweth D P, Lyberatos G, et al. Stable performance of anaerobic digestion in the presence of a high concentration of propionic acid[J].Bioresource technology,2001,78(2):165-169.
[15] Zeshan, Karthikeyan O P, Visvanathan C. Effect of C/N ratio and ammonia-N accumulation in a pilot-scale thermophilic dry anaerobic digester[J].Bioresource technology,2012,113:294-302.
[16] Lin L, Yang L, Xu F, et al. Comparison of solid-state anaerobic digestion and composting of yard trimmings with effluent from liquid anaerobic digestion[J].Bioresource technology,2014,169:439-446.
[17] Huang Y L, Tan L, Wang T T, et al. Thermophilic Dry Methane Fermentation of Distillation Residue Eluted from Ethanol Fermentation of Kitchen Waste and Dynamics of Microbial Communities[J].Applied Biochemistry and Biotechnology,2016:2010-2203.
EffectsofEnzymeAdditiononPerformanceofDryBiogasFermentationofVinasse
/WANGTing-ting1,MAShi-chun2,SUNZhao-yong1,TANLi1,TANGYue-qin1,KIDAKenji1
/(1.CollegeofArchitectureandEnvironment,SichuanUniversity,Chengdu610065,China; 2.KeyLaboratoryofDevelopmentandApplicationofRuralRenewableEnergy,MinistryofAgriculture,Chengdu610041,China)
Vinasse is the major by-products in liquor production. To reduce the negative impact on environment, a process was developed to convert vinasse to biogas via dry methane fermentation. The dry methane fermentation of vinasse with or without enzymes addition were experimented in lab-scale, and the process parameters including pH, VFAs and TOC concentrations were evaluated. The results showed that VFAs accumulation was observed during the starting-up period, The biogas yield of 270.7 mL·g-1VS was obtained with vinasse without enzymes addition. Enzymes addition improved the biogas production to 337.6 mL·g-1VS, and the VFAs concentrations always kept at a low level. The real-time quantitative PCR of 16S rRNA of microbes indicated that enzymes addition could increase the numbers of microorganisms involved in anaerobic digestion process
vinasse; anaerobic digestion; biogas; enzyme addition; quantitative PCR
2016-10-11
王婷婷(1990-),女,汉族,四川内江人,在读博士,主要研究方向为有机废弃物资源化利用,E-mail: wangtingting_scu@foxmail.com
孙照勇,E-mail: szy@scu.edu.cn
S216.4; X703
A
1000-1166(2017)05-0009-06

