标准化营养支持对进展期胃癌患者的影响
吴光理,朱子宜
(衢州市中医医院,浙江 衢州 324002)
标准化营养支持对进展期胃癌患者的影响
吴光理,朱子宜
(衢州市中医医院,浙江 衢州 324002)
目的探讨标准化营养支持对进展期胃癌患者手术期营养指标及康复进展的影响。方法选择进展期胃癌患者68例,分为对照组和观察组各34例,对照组给予常规营养支持,观察组给以标准化营养支持,比较两组营养指标、康复状况。结果术后8天,对照组ALB、PA、TLC水平明显低于术前1天,观察组PA和TLC水平明显低于术前1天,但ALB前后无差异,组间比较观察组ALB明显高于对照组,差异有统计学意义(P<0.05)。术后8天BMI、MAC、MAMC、TSF和非利手握力水平,两组均低于术前1天 (P<0.05),组间比较差异无统计学意义 (P>0.05)。NRS2002评分、QLQ-STO22评分和PG-SGA评分术后8天两组均明显高于术前1天,术后8天PG-SGA评分观察组低于对照组(P<0.05)。结论实施标准化营养支持对患者整体康复效果和营养状况具有积极作用。
标准化营养支持;进展期胃癌;营养指标
2015年全球肿瘤报道,胃癌在所有肿瘤死亡中占第三位,是发病率和致死率较高的消化系统恶性肿瘤,也是我国主要的消化系统恶性肿瘤之一,其发病率呈上升趋势[1-2]。在我国,临床就诊的胃癌患者中约60%~80%已处于进展期,一经发现大多数需要手术治疗,胃癌根治术是首选的治疗手段。但有研究发现[3-4],进展期胃癌患者中约70%存在营养不良或营养风险,此外手术创伤在生理和心理上的双重影响,导致患者的营养状况和生活质量下降,减缓康复进程。目前,术后早期肠内营养已被广泛应用于胃肠道术后治疗,通过较为规范的术后肠内、外营养支持能在一定程度上改善患者的营养状况和康复进程。本文探讨标准化营养支持对进展期胃癌患者手术期营养指标及康复进程的影响,现报道如下。
1 资料与方法
1.1 一般资料 选择2014年6月~2017年3月在本院治疗的68例胃癌患者。纳入标准:(1)经临床、影像学、病理学诊断均为进展期胃癌,无肝脏、肺、脑、骨等器官远端转移;(2)预计生存期≥6个月;(3)入院后查无手术禁忌证直接行根治性胃癌手术;(4)精神状态正常、意识清楚,并自愿配合;(5)患者及其家属知情同意。排除标准:(1)合并严重心、肾、肝等疾病的患者;(2)临终期胃癌患者;(3)姑息性或非治愈性切除手术后患者;(4)存在认知障碍或其他情况无法配合者。经医院伦理委员会批准,共纳入符合标准的患者68例,用随机数表法分为两组,对照组和观察组各34例。两组年龄、性别比、BMI、胃切除术分型构成情况、营养状况等方面差异无统计学意义(P>0.05),详见表1。
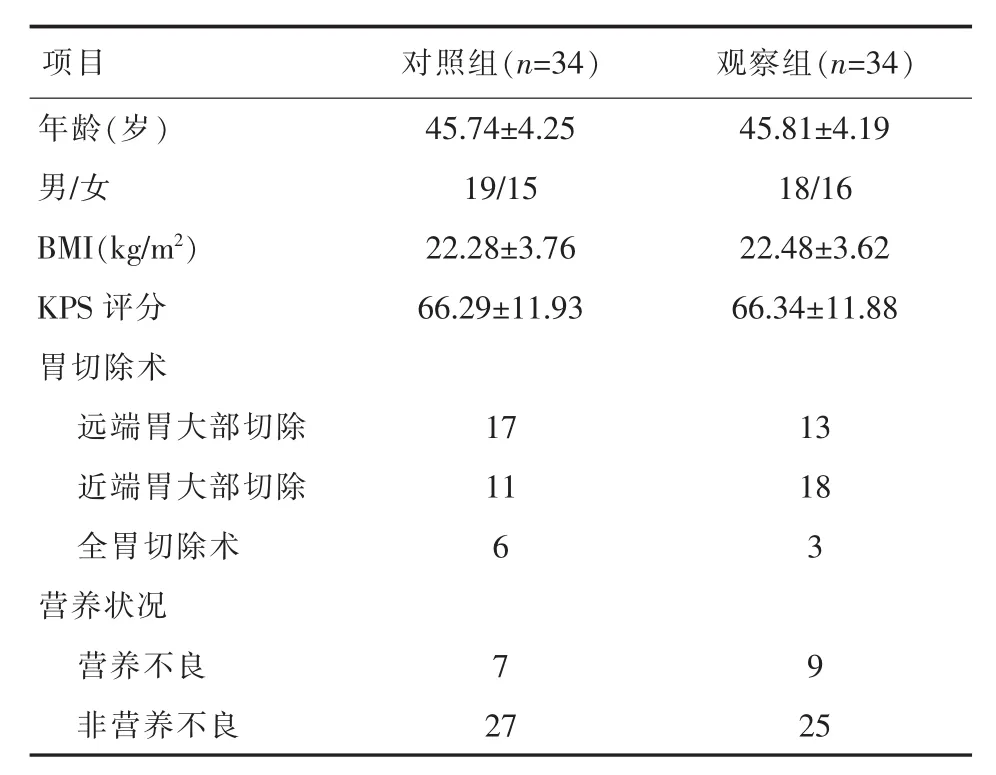
表1 两组一般资料比较
1.2 方法 参照《胃癌患者营养治疗指南》[5]对照组术前常规饮食,在行胃癌根治术中留置鼻空肠营养管,于术后1天给予全胃肠外营养,待肛门排气后给予肠内营养混悬液能全(纽迪希亚制药(无锡)有限公司,规格:1.5kcal/mL)经鼻空肠营养管24小时匀速滴入,滴速为每小时100~125mL/h(开始滴速宜慢,为30mL/h,持续48~72小时后逐渐恢复正常量),对初次胃肠道营养的患者,初始剂量为1000kcal/d,2~3天内逐渐增加至需要量。根据患者术后个体所需能量差异,调节每日入量。一般术后3~5天可过渡到完全肠内营养,维持7~9天可恢复至流质饮食。观察组采用标准化肠道内营养支持,选用“全合一”营养液,营养液的配制严格按照无菌操作要求,且营养液现配现用,特殊情况下需避光40℃保存。患者于术前1周开始在常规饮食外予以肠内营养支持,持续7天,并口服谷氨酰胺(江苏神华药业有限公司生产)15g/d,在行胃癌根治术中留置鼻空肠营养管,于术后1天给予含谷氨酰胺+肠内营养混悬液能全力,经鼻空肠营养管24小时匀速滴入,其余与对照组相同。
1.3 观察指标 (1)观察入院后、术前1天及术后8天白蛋白(ALB)、前白蛋白(PA)和总淋巴细胞计数(TLC)指标;(2)评估术前1天和术后 8天营养状态,指标为体质量指数 (BMI)、上臂中点周径(MAC)、上臂肌肉周径(MAMC)、肱三头肌皮褶厚度(TSF)和非利手握力;(3)整体营养状况主观评估量表(PG-SGA)[6]:对体质量、膳食摄入、症状、活动和功能四项评分,四项评分之和为总分(0~88分),分值越高营养不良状况越严重;(4)营养风险筛选评估表(NRS2002)[7]评分,包括疾病评分、营养评分、年龄三项,三项之和为营养风险总分 (0~7分),评分越高营养状况越低;(5)采用胃癌患者生活质量评估(QLQ-STO22)[8]评价生活质量,包含9个分量表共22个条目,每条目1~4分,评分越高,生活质量越低。
1.4 统计学处理 采用SPSS17.0进行统计学分析,计量资料用(±s)表示,采用 t检验,计数资料采用χ2检验。
2 结果
2.1 ALB、PA、TLC指标 术后8天,对照组ALB、PA、TLC水平明显低于术前1天,差异有统计学意义(P<0.05);观察组PA和TLC水平明显低于术前1天,差异均有统计学意义(均P<0.05),ALB差异无统计学意义(P>0.05)。术后 8 天 ALB、PA、TLC 水平,观察组明显高于对照组,差异有统计学意义(P<0.05),详见表 2。
表2 两组ALB、PA和TLC比较(±s)
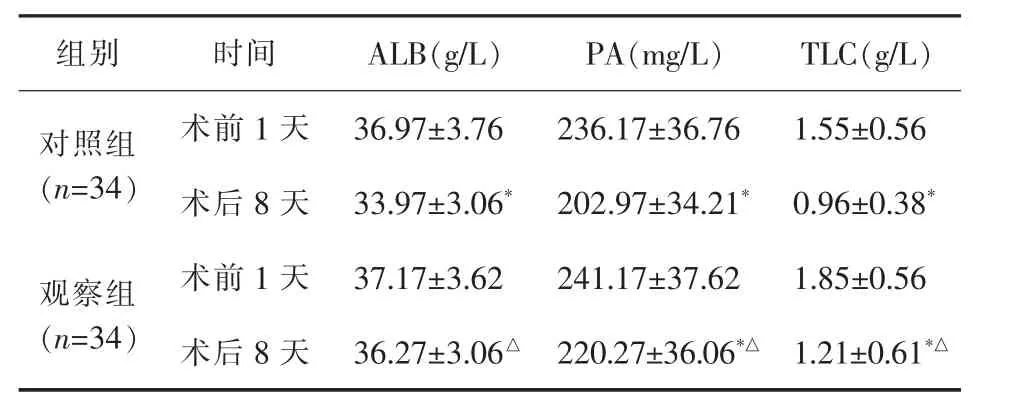
表2 两组ALB、PA和TLC比较(±s)
与术前1天比较 *P<0.05;与对照组比较 △P<0.05
组别 时间 A L B(g/L) P A(m g/L) T L C(g/L)对照组(n=3 4)术前 1天 3 6.9 7±3.7 6 2 3 6.1 7±3 6.7 6 1.5 5±0.5 6术后 8天 3 3.9 7±3.0 6* 2 0 2.9 7±3 4.2 1* 0.9 6±0.3 8*观察组(n=3 4)术前 1天 3 7.1 7±3.6 2 2 4 1.1 7±3 7.6 2 1.8 5±0.5 6术后 8 天 3 6.2 7±3.0 6△ 2 2 0.2 7±3 6.0 6*△ 1.2 1±0.6 1*△
2.2 营养状况评估 BMI、MAC、MAMC、TSF和非利手握力水平方面,两组术后8天低于术前1天,比较差异有统计学意义(P<0.05),两组术后8天上述指标水平相近,差异无统计学意义(P>0.05),详见表3。
表3 两组营养状况评估(±s)
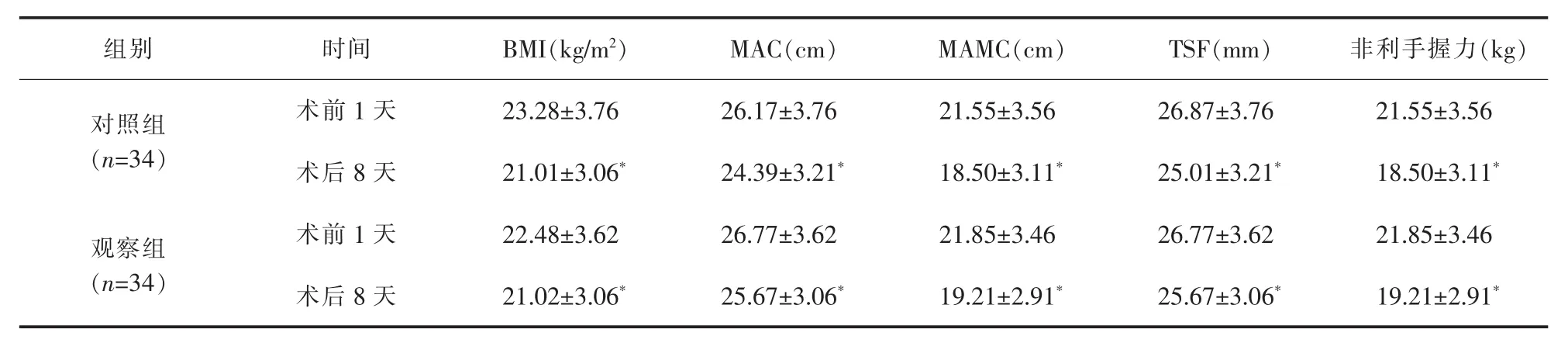
表3 两组营养状况评估(±s)
与术前1天比较 *P<0.05
组别 时间 B M I(k g/m 2) M A C(c m) M A M C(c m) T S F(m m) 非利手握力(k g)对照组(n=3 4)术前 1 天 2 3.2 8±3.7 6 2 6.1 7±3.7 6 2 1.5 5±3.5 6 2 6.8 7±3.7 6 2 1.5 5±3.5 6术后 8 天 2 1.0 1±3.0 6* 2 4.3 9±3.2 1* 1 8.5 0±3.1 1* 2 5.0 1±3.2 1* 1 8.5 0±3.1 1*观察组(n=3 4)术前 1 天 2 2.4 8±3.6 2 2 6.7 7±3.6 2 2 1.8 5±3.4 6 2 6.7 7±3.6 2 2 1.8 5±3.4 6术后 8 天 2 1.0 2±3.0 6* 2 5.6 7±3.0 6* 1 9.2 1±2.9 1* 2 5.6 7±3.0 6* 1 9.2 1±2.9 1*
2.3 PG-SGA、NRS2002和 QLQ-STO22评分 术后8天,两组PG-SGA评分、NRS2002评分和QLQ-STO22评分均明显高于术前1天 (P<0.05)。术后8天的PG-SGA评分,观察组低于对照组,差异有统计学意义(P<0.05),详见表 4。
表4 两组PG-SGA、NRS2002和QLQ-STO22评分比较(±s)
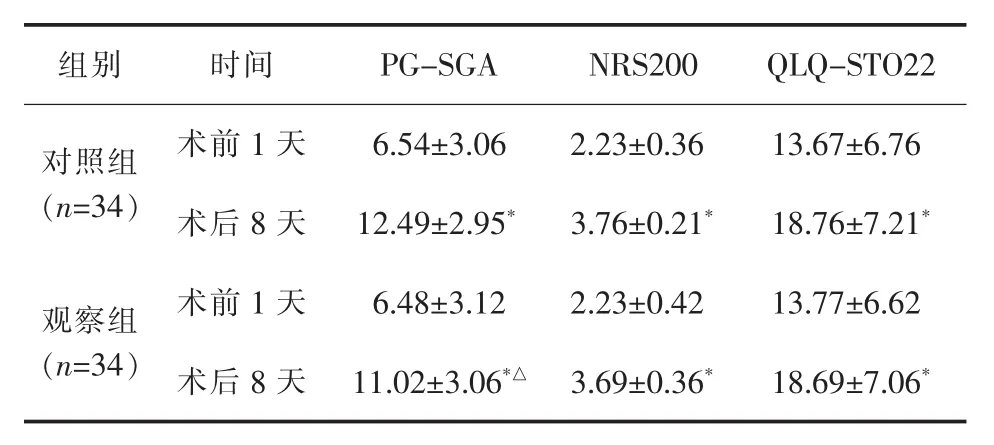
表4 两组PG-SGA、NRS2002和QLQ-STO22评分比较(±s)
与术前1天比较*P<0.05;与对照组比较△P<0.05
组别 时间 P G-S G A N R S 2 0 0 Q L Q-S T O 2 2对照组(n=3 4)术前 1 天 6.5 4±3.0 6 2.2 3±0.3 6 1 3.6 7±6.7 6术后 8天 1 2.4 9±2.9 5* 3.7 6±0.2 1* 1 8.7 6±7.2 1*观察组(n=3 4)术前 1 天 6.4 8±3.1 2 2.2 3±0.4 2 1 3.7 7±6.6 2术后 8 天 1 1.0 2±3.0 6*△ 3.6 9±0.3 6* 1 8.6 9±7.0 6*
3 讨论
我国胃癌患者占世界胃癌发病总人数的42%,胃癌患病率和死亡率均超过世界平均水平的两倍[9-10]。胃癌的综合治疗模式以手术为主,手术治疗虽然在一定程度上改善了胃癌治疗效果,但总体效果仍然不佳。研究报道[11-12],胃癌患者中营养不良的比例占87%,位居肿瘤的第一位。
营养不良是患者发生术后并发症的独立预后因素[13],胃癌根治术术前进行必要的营养支持治疗是加速康复的重要环节。全肠外营养支持静脉补充大量脂肪乳和氨基酸,抑制胃肠动力,而早期肠内营养支持能刺激消化液和内分泌激素的分泌,增加内脏血流,促进肠黏膜的生长和恢复肠蠕动。据报道[14],约有20%以上的肿瘤患者死于营养不良。血清白蛋白是反映人体营养状况的重要指标,同时也反映肝功能;淋巴细胞有回收蛋白质、运输营养物质、调节血浆等多种生理功能[15]。本文结果显示,术后8天ALB、PA、TLC三项指标观察组均高于对照组,观察组恢复较对照组快(P<0.05),更接近于术前水平,表明经过术前1周医源性营养干预肠内营养后,患者营养不良状况得到了显著改善,标准化营养支持可促进整体蛋白质的更新率,改善机体免疫功能。
由于胃癌患者长期消化吸收不足、肿瘤导致的分解代谢增加,大多数患者术前就存在不同程度的营养不良,加上手术时以及术后的禁食,进一步加重了患者自身的负氮平衡,如果不及时给予人工营养干预,将影响患者术后伤口的愈合、康复,导致并发症的发生。观察组在营养液的基础上,增加了谷氨酰胺,进一步增强免疫力。皮褶厚度反应人体体脂量,MAC、MAMC、TSF则体现特定部位体脂含量,BMI也是与体内脂肪总量密切相关的指标,这些指标均有所下降,是由于手术创伤对机体造成的应激影响所致,两组术后8天的MAC、MAMC、TSF、BMI、非利手握力指标无差异(P>0.05),说明两组机体利用皮褶脂肪代谢分解供能的差异性未能明显体现。
PG-SGA评估整体营养状况,两组术前均属于轻度营养不良,术后8天PG-SGA评分提示两组均属于严重营养不良,可见手术对营养状况产生较大影响,但观察组程度较对照组小(P<0.05),反映术前1周的营养干预有利于患者的恢复。术后8天,两组NRS2002评分和QLQ-STO22评分比较相近,无明显差别,与术前1天比较均明显升高 (P<0.05),表明进展期胃癌患者术后的营养状况和生活质量均明显下降。
综上所述,进展期胃癌患者术后营养状况较术前有明显下降,经过标准化营养支持,患者手术期营养指标有所改善,说明实施标准化营养支持对患者整体康复和营养状况有积极作用。
[1] 黄师菊,周雪玲,李慧娟,等.胃癌患者围手术期营养状况对生活质量的影响调查.中华普通外科学文献(电子版),2013,7(5):400
[2] 杜艳平,李玲玲,贺青李,等.胃肠道肿瘤患者的营养风险筛查及营养状况评价.中华胃肠外科杂志杂志,2012,15(5):460
[3] 王菁,丁宁,王爱萍,等.强化营养支持和心理干预对胃癌患者手术后康复和生活质量的影响.中国肿瘤临床与康复,2016,23(10):1249
[4] 李妙仙,张燕芬,吴园芬.标准化营养支持在早产儿生长发育护理中的应用价值研究.中国现代医生,2017,55(2):142
[5] 中国抗癌协会肿瘤营养与支持治疗专业委员会.胃癌患者营养治疗指南.肿瘤代谢与营养电子杂志,2015,2(2):37
[6] Ottery FD.Cancer cachexia:prevention, early diagnosis, and management.Cancer Pract, 1994, 2(2):123
[7] Kondrup J,Rasmussen HH,Hamberg O,et al.Nutritional risk screening (NRS 2002):a new method based on an analysis of controlled clinical trials.Clin Nutr, 2003, 22(3):321
[8] 姜宝法,徐涛,刘春晓,等.胃癌患者生活质量问卷(QLQSTO22)中文版的制定.中国心理卫生杂志, 2005, 19(5):310
[9] Choi WJ,Kim J.Nutritional Care of Gastric Cancer Patients with Clinical Outcomes and Complications:A Review.Clinical Nutrition Research, 2016, 5(2):65
[10]Nakanoko T,Kakeji Y,Ando K, et al.Assessment of surgical treatment and postoperative nutrition in gastric cancer patients older than 80 years.Anticancer Research, 2015, 34(1):511
[11]刘秀霞.标准化肠外营养用于早产儿早期营养支持的临床观察.现代中西医结合杂志,2014,23(2):174
[12]赵群,李勇,乔喜,等.进展期胃癌病人营养状况及生活质量评估的临床研究.肠外与肠内营养,2015,22(4):217
[13]黄国强,于吉人,冯永生,等.老年胃癌患者术后早期肠内与肠外营养的比较.中国老年学杂志,2012,32(9):1839
[14]陈晓曦,陈伟哲,庄成乐,等.营养风险对腹腔镜辅助胃癌根治术后短期临床疗效的影响.中华消化外科杂志,2017,16(3):281
[15]王林,李平.加速康复外科理念下口服营养支持在胃癌病人围手术期的应用.肠外与肠内营养,2016,23(5):300

