乳腺实性乳头状癌临床病理分析
张闻雯,邓再兴,陈莉萍
(湖州市妇幼保健院,浙江 湖州313000)
乳腺实性乳头状癌临床病理分析
张闻雯,邓再兴,陈莉萍
(湖州市妇幼保健院,浙江 湖州313000)
目的探讨乳腺实性乳头状癌的临床病理特征及鉴别诊断。方法对23例乳腺实性乳头状癌的临床表现、组织形态和免疫表型进行回顾性分析并行文献复习。结果镜下导管内肿瘤细胞呈实体型乳头生长,伴神经内分泌分化,部分有粘液分泌,4例伴粘液癌。肿瘤细胞均有ER、PR和E-Cadherin强阳性表达,不表达CerbB-2。Syn和CgA表达率分别为91.30%和82.60%,Calponin和P63仅表达于导管周围和纤维轴心的肌上皮细胞,表达率分别为56.52%和47.82%,且为不连续表达,肿瘤细胞不表达。Ki 67均呈低表达(3%~10%)。结论乳腺SPC比较少见,是一种低度恶性的乳腺导管内癌,好发于老年女性,有其独特的组织形态、免疫组织化学特征,部分SPC与乳腺黏液癌和神经内分泌癌相关,具有良好的预后。
乳腺疾病;乳头状肿瘤;免疫组织化学
乳腺乳头状病变是乳腺病理诊断难点之一,其中乳腺实性乳头状癌 (solid papillary carcinoma,SPC)自Maluf[1]单独命名 20多年来,因其发病率低,诊断标准的不一致性以及组织发生上的争议,导致临床医生对此病认识不足。2012年乳腺肿瘤的WHO分类将SPC定义为“一种特殊类型的乳腺癌”,描述为“以致密排列、膨胀性生长、富于细胞的结节为特征。结节内纤维血管轴心纤细不明显,低倍镜看似实性结构。常有神经内分泌分化,可以出现浸润癌,常伴有粘液和/或神经内分泌特征[2]”。现将本院23例SPC结合文献资料,报道如下。
1 资料与方法
1.1 一般资料 收集2004年1月~2014年1月本院23例乳腺实性乳头状癌,诊断根据2012年乳腺肿瘤的WHO分类中描述的实性乳头状癌组织形态学标准诊断[2],并由两位高级职称的病理医师读片确认。23例均为女性,发病年龄40~72岁,平均(64.70±5.02)岁。2例伴有浸润癌,分别为53岁和66岁。13例有乳头溢液,8例偶然发现乳腺肿块,4例有乳房刺痛。11例原病理诊断为导管原位癌,其中4例伴神经内分泌分化,3例诊断为导管内癌伴黏液癌,2例导管内乳头状瘤,1例诊断为黏液癌,余6例为实性乳头状癌。13例行乳腺根治性切除加同侧腋窝淋巴结清扫,6例做了乳房单纯切除(13例根治标本及6例前哨淋巴结均阴性),4例行乳房扩大切除术。2例肿块不明显,另21例可见肿块。20例随访均未复发,1例肿块扩大切除后淋巴结转移,后根治随访未见复发,2例失访。
1.2 方法 免疫组化采用MaxVision二步法,均为福州迈新生物技术开发公司。所用抗体有抗雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子-2(CerbB-2)、E-钙粘附蛋白(E-Cadherin,E-Ca)、细胞角蛋白5/6(CK5/6)、突触素 (Syn)、嗜铬素A(CgA)、Calponin、P63、Ki67。 每张切片随机选取 10个高倍镜视野(400×),每个视野观察100个肿瘤细胞,计算平均阳性细胞数的比例。ER及PR胞核棕色或黄色的细胞>10%为阳性。CerbB-2依据《乳腺癌HER2检测指南(2014版)》标准判读。0:无染色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色。1+:>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色。2+:有两种情况,第一种为>10%的浸润癌细胞呈现不完整的和/或弱至中等强度的细胞膜染色;第二种为≤10%的浸润癌细胞呈现强而完整的细胞膜染色。3+:>10%的浸润癌细胞呈现强而完整的细胞膜染色[3]。 CK5/6、Calponin、Syn、CgA胞质阳性,≥10%的肿瘤细胞着色则呈阳性。E-Ca胞膜阳性。p63细胞核阳性,Ki67计胞核阳性细胞百分比。
2 结果
2.1 巨检 肿瘤长径1.30~4.50cm,平均 (2.57±0.73)cm,均为灰白实性,质中偏硬,7例切面粘冻感。镜下病变导管膨胀性扩张,内肿瘤细胞实体型增生,形成圆形、卵圆形或不规则结节状团块,可见纤细的纤维血管轴心,轴心周围细胞栅栏状排列,细胞形态较一致,轻-中度异型,卵圆形,多角形(图1),有3例可见梭形细胞。胞浆内可见嗜酸性颗粒或淡染透明。核圆居中,可见核仁,核分裂像可见,3~4/10HP,可见病理性核分裂像。其中4例伴粘液癌。粘液湖内漂浮肿瘤细胞,部分细胞印戒样。4例癌巢周围可见囊性出血,3例病变周围导管内见肿瘤细胞派杰样浸润。
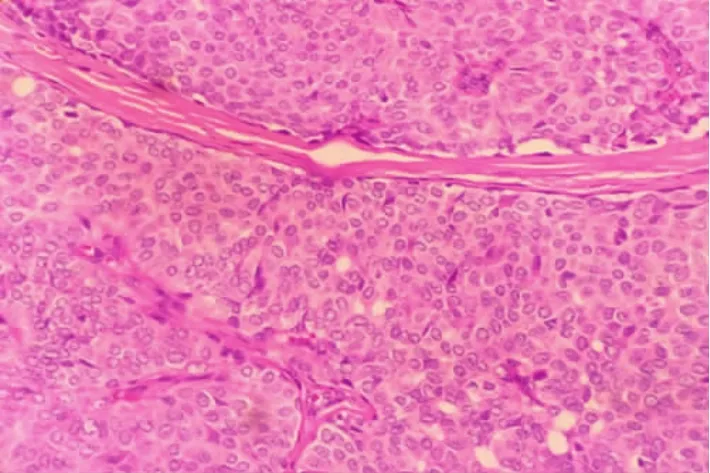
图1 镜下可见纤维血管轴心,轴心周围细胞呈栅栏状排列,细胞形态较温和(HE×100)。
2.2 免疫组化 23例均有ER和PR阳性表达(+),不表达 CerbB-2。E-Cadherin表达 23例(100%),Syn 表达 21 例(91.30%)(图 2),CgA 表达19 例(82.60%),Calponin表达 13例(56.52%),P63表达11例(47.82%),两者仅表达于导管周围和纤维轴心的肌上皮细胞,且为不连续表达。CK5/6不表达,Ki67呈低表达(3%~10%)。
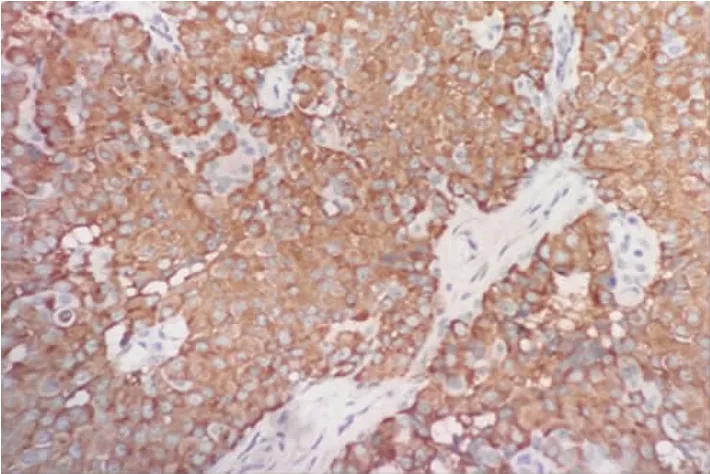
图2 Syn 的表达(Syn×100)
3 讨论
SPC比较少见,以往未被独立分类,命名杂乱。2003年WHO《乳腺和女性生殖系统肿瘤病理学和遗传学》将其归类于“导管内乳头状病变/肿瘤”,命为“导管内乳头状癌的实体变型”[4]。2012年新版WHO《乳腺肿瘤分类》[2]在导管内乳头状病变中将其单独分类,并分成两型,即“原位型和浸润型”。
SPC好发于60岁以上老年妇女[4],本组平均年龄(64.70±5.02)岁,最年轻者为 40 岁,与 Yamada等[5]报道相符。乳头溢液是其突出表现,且常常为血性溢液[5],本组13例(56.52%)有此表现。本组2例肿块不明显,镜下可以见到肿瘤成分,但范围较小,在术中快速冰冻容易漏诊。病理学上SPC具有四个显著的特征[4-7]:实体型乳头、多为导管内肿瘤、常伴有粘液分泌和神经内分泌分化。本组有4例伴发粘液癌,21例伴神经内分泌分化,一些学者认为这可能与神经内分泌癌和粘液腺癌有关。另有报道SPC可伴发浸润性导管癌、小叶癌、小管癌以及混合癌等[6]。肿瘤细胞形态较一致,异型性不明显,未见坏死,免疫组化表型ER、PR和ECadherin强阳性表达,不表达CerbB-2。Ki67均呈低表达(7.5%),这些都提示该肿瘤发展缓慢,预后较好[6]。与本组结果一致。
SPC需与以下疾病相鉴别。(1)导管内乳头状瘤伴旺炽性增生。本病为良性病 变,缺乏细胞异型及核分裂活性,表达肌上皮标记,而不表达神经内分泌标记。(2)小叶原位癌。本病变肿瘤细胞大小较一致,异型性可以不明显,但是细胞较松散,缺乏乳头状结构,E-Cadherin不表达。(3)低级别导管原位癌。本病没有乳头状结构,不表达神经内分泌标记。SPC自身分成原位型和浸润型两型,该两型之间有时鉴别困难,特别是当导管周围肌上皮标记不表达,浸润又不明显时。Nassar等[8]将“呈现地图状,锯齿状边缘,并缺乏肌上皮细胞”,视为浸润性病变。
SPC表现为惰性临床过程,大部分无转移,患者的无瘤生存期比较长[7],本组报道与之相符。SPC的治疗以手术完整切除为主。不伴癌浸润者应该以导管原位癌方式处理,可以行保留乳房手术或改良根治术,术后一般无需化疗;伴癌浸润者需术后化疗,肿瘤组织表达激素受体时,可以采用内分泌治疗,但因其不表达CerbB-2,故不主张靶向治疗。
[1]Maluf HM,Koerner FC.Solid papillary carcinoma ofthe breast.A form of intraducta1 carcinoma with endocrine differentiation frequently associated with mucinous carcinoma.Am J Surg Pathol,1995,19 (11):1237
[2] Sunil R,Elliis IO,Stuait J.WHO classification of tumors.the classification of tumors of the breast.Lyon:IARC Press,2012:92,108
[3] 《乳腺癌HER2检测指南(2014版)》编写组.乳腺癌HER2检测指南(2014 版).中华病理学杂志,2014,43(4):262-
[4] Tavassoli FA,Devilee P.World Health Organization classification of tumors.Pathology and genetics of tumors ofthe breast and female genital organs.Lyon:LARC Press,2003:667
[5] 龚西,丁华野.乳腺病理学.北京:人民卫生出版社,2009,12:287
[6] 杨文涛,许越香,张廷缪.乳腺神经内分泌型导管内癌.中华病理学杂志,2006,35(3):594
[7] 于雨飞,陈建华.乳腺实性乳头状癌.中华乳腺病杂志,2014,8(4):48
[8] Nassar H,Qureshi H,Volkanadsay N,et al.Clinicopathologic analysis of solid papillary carcinoma of the breast and associated invasive carcinomas.Am J Surg Pathol,2006,30(4):501

