急性胰腺炎患者血清SOCS- 3水平的变化及其临床意义
赵振中 谢中华 汪铁军 郑元秀 黄芳芳
急性胰腺炎患者血清SOCS- 3水平的变化及其临床意义
赵振中 谢中华 汪铁军 郑元秀 黄芳芳
目的观察急性胰腺炎(AP)患者血清SOCS-3的变化,探讨其临床意义。方法选择2015年2月至2016年12月杭州余杭区第二人民医院收治的AP患者75例,根据病情严重程度分为轻度AP(MAP)40例,中、重度AP(MSAP+SAP)35例。采用酶联免疫吸附试验法(ELISA)检测患者入院第1、3、5、7天血清SOCS-3、IL-6及TNF-α水平,选择年龄、性别等相匹配的同期30名健康体检者作为对照组。结果AP患者入院后第1天组血清SOCS-3、IL-6、TNF-α水平均较对照组明显升高(P<0.01或<0.05)。随着发病时间延长,AP患者血清SOCS-3、IL-6、TNF-α水平均逐渐升高,至第5天达峰值,第7天开始下降,但仍高于入院第1天。MSAP+SAP组患者血清SOCS-3、IL-6、TNF-α水平均较MAP组显著升高,差异有统计学意义(F=112.80,P=0.001;F=170.21,P=0.000;F=112.82,P=0.000),两组不同时间点的差异亦均有统计学意义(F=258.38,P=0.000;F=4.82,P=0.000;F=5.52,P=0.001)。此外,AP患者血清SOCS-3水平与IL-6、TNF-α水平均呈显著正相关(r值分别为0.785、0.828,P值均<0.01)。结论SOCS-3参与AP患者早期过度的炎症反应,并呈现动态变化。对SOCS-3和IL-6、TNF-α的监测可能有助于AP的临床分型和预后判断。
胰腺炎; SOCS-3; 白细胞介素-6; 肿瘤坏死因子α
急性胰腺炎(AP)起病急、变化快,如早期病情未及时控制,可导致全身炎症反应,出现多器官功能衰竭(MODS)。越来越多的研究[1-3]表明,AP早期即存在多种细胞因子介导的炎症反应,加重胰腺及其他器官损伤,是引发MODS的重要病因。因此,如能在AP早期抑制过度活化的细胞因子,减轻炎症反应,阻断病情进展,则可明显改善AP患者的预后。细胞因子信号转导抑制因子-3(suppressor of cytokine signaling-3, SOCS-3)是炎症负性调节因子,它参与AP早期胰腺损伤及炎症反应过程,在胰腺局部及全身炎症反应的调节中起重要作用[4-5],但其在AP临床研究中的作用鲜有报道。因此,本研究观察AP患者血清SOCS-3的变化,为AP的防治提供新途径和新靶点。
资料与方法
一、一般资料
选择2015年2月至2016年12月杭州市余杭区第二人民医院收治的AP患者78例,其中男性43例,女性35例,年龄25~79岁,平均(52±9)岁。入组标准:(1)符合2013年中华医学会消化病学分会胰腺疾病学组制定的《中国急性胰腺炎诊治指南》的诊断标准[6];(2)发病时间在24 h以内;(3)既往无糖尿病、严重肝肾功能不全、慢性胰腺炎及肿瘤者;(4)近期未出现严重感染,未接受抗炎、抑制胰酶分泌等基础治疗。因1例转至外院,2例病情加重死亡,最终75例患者纳入本研究。本研究经医院伦理委员会审核批准(批准文号201502001),所有患者或家属签署知情同意书。
入组患者根据《中国急性胰腺炎诊治指南》进一步分为轻型AP(MAP) 40例,中度重症AP (MSAP)30例和重症AP(SAP)5例。其中胆源性AP 41例,酒精性AP 23例,代谢性AP 6例,药物性AP 1例,ERCP术后AP 1例,不明原因性AP 3例。选取同期本院健康体检者30名作为对照组,其中男性21名,女性19名,年龄20~80岁,平均(49±9)岁,均无急、慢性胰腺炎病史。两组研究对象的年龄及性别构成比的差异均无统计学意义(P值均>0.05)。
二、血清SOCS-3、IL-6、TNF-α水平检测
患者于入院第1、3、5、7天空腹抽取静脉血,分离取血清,置-70℃冰箱保存。血清SOCS-3、IL-6、TNF-α水平均采用酶联免疫吸附试验法(enzyme-linked immunosorbent assay,ELISA)测定。SOCS-3试剂盒由武汉华美生物工程有限公司提供(CSB-EL022392BO),IL-6试剂盒由上海吉泰依科赛生物科技有限公司提供(EH004),TNF-α试剂盒由上海拜沃生物科技有限公司提供(50R-E1123H)。
三、统计学处理

结 果
一、入院第1天AP组与对照组血清SOCS-3、IL-6、TNF-α水平
入院第1天AP组血清SOCS-3、IL-6、TNF-α含量分别为(321.42±70.11)μg/L、(43.68±7.33)ng/L、(21.49±8.30)ng/L,对照组分别为(178.77±51.47)μg/L、(19.45±5.32)ng/L、(12.26±5.72)ng/L,AP 组显著高于对照组,差异均有统计学意义(t值分别为4.49、7.22、1.96,P值分别为0.009、0.006、0.039)。
二、入院后MAP组、MSAP+SAP组患者血清SOCS-3、IL-6、TNF-α水平变化
MAP组、MSAP+SAP组患者入院第3天血清SOCA 3、IL-6、TNF-α水平均较入院第1天升高,第5天达峰值,第7天下降,但仍高于入院第1天。MSAP+SAP组患者血清SOCS-3、IL-6、TNF-α水平均较MAP组显著升高,差异有统计学意义(F=112.80,P=0.001;F=170.21,P=0.000;F=112.82,P=0.000),两组不同时间点的差异亦均有统计学意义(F=258.38,P=0.000;F=4.82,P=0.000;F=5.52,P=0.001;表1)。
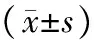
表1 MAP组、MSAP+SAP组患者各时间点血清SOCS-3 、IL-6、TNF-α水平比较
注:与MAP组比较,aP<0.01;与同组前一时间点比较,bP<0.05;与同组入院第1天比较,cP<0.05
三、AP患者血清SOCS-3、IL-6、TNF-α水平的相关性
AP患者血清SOCS-3水平与IL-6、TNF-α水平均呈显著正相关(r值分别为0.785、0.828,P值均<0.01)。
讨 论
尽管目前AP的具体发病机制仍未被完全阐明,但近年来IL-6、TNF-α等促炎因子和IL-10、瘦素等抗炎因子失衡理论已受到越来越多的关注[7]。大量研究[1-3]表明,无论是MAP还是SAP,早期即存在多种细胞因子介导的炎症反应,特别是SAP,其早期强烈的过度炎症反应是其两个死亡高峰之一。Petrov[8]指出,AP患者的预后很大程度上取决于对早期炎症的处理,处理恰当则预后良好。因此,对AP早期炎症中信号转导通路的关键因子进行调控,遏制其触发炎症递质的“瀑布样级联反应”,达到抑制AP病情进展已成为治疗AP的新途径[9]。
SOCS-3是SOCS家族的重要成员,是JAK/STAT信号转导通路的主要负性抑制因子,又被称为“细胞的分子刹车”。炎症细胞因子信号在传入的同时可通过JAK/STAT信号通路诱导SOCS基因表达,其产物又可特异性地反向抑制炎症细胞因子诱导的JAK/STAT信号转导通路,构成一负反馈调节环路,从而使机体处于动态平衡状态[10]。正常情况下细胞SOCS-3水平低下,甚至很难检测到,而炎症反应过程中活化的炎症因子可诱导SOCS-3迅速合成,表达水平明显升高,发挥对包括IL-6、TNF-α在内的多种炎症细胞因子的反馈调节作用。IL-6、TNF-α均是重要的促炎因子,IL-6可与TNF-α协同作用促进AP发生发展,可作为AP严重程度的监测指标[11]。TNF-α由活化的单核细胞产生,可增加血管通透性,导致微循环障碍,在AP从轻型向重型发展的过程中起核心作用[12]。
目前,国内外已有大量基础研究[13-14]发现,SOCS-3通过调节胰腺腺泡细胞表达的细胞因子参与AP早期胰腺损伤及炎症反应,而抑制其活性后各促炎因子表达均明显降低,AP炎症反应减轻。本研究结果显示,AP初期患者血清SOCS-3水平较对照组明显升高,同时其血清IL-6、TNF-α水平也较对照组明显升高,且血清SOCS-3与IL-6、TNF-α均呈正相关,提示AP患者在早期已存在过度炎症反应。随着发病时间的延长,AP患者血清SOCS-3、IL-6、TNF-α水平均呈同步升高趋势,至发病第5天达峰值,约在第7天开始下降,但仍较入院时明显升高,这些规律性动态变化提示SOCS-3在AP炎症反应过程中扮演了重要角色。推测可能的原因是AP发生早期JAK/STAT信号通路被激活,IL-6与TNF-α大量表达释放,再通过JAK/STAT信号通路诱导SOCS-3表达,而SOCS-3又通过该通路反向抑制IL-6与TNF-α的表达,其水平下降。此外,本研究结果还显示,MSAP及SAP患者血清SOCS-3与IL-6、TNF-α水平在各时间点均较MAP组明显升高,提示SOCS-3与AP的病情严重程度有密切关系。
[1] Li ML,Zhu RM,Zhang XH,et al.The role of JAK2/STST 3 signaling pathway in the lung injury rat with severe acute pancreatitis[J].Med J Chin PLA,2011,36(6):611-613.
[2] Singh VK,Wu BU,Bollen TL,et al.Early systemic inflammatory response syndrome is associated with severe acute pancreatitis[J].Clin Gastroenterol Hepatol,2009,7(11):1247-1251.DOI: 10.1016/j.cgh.2009.08.012.
[3] 李敏利,金鑫鑫,许小兵,等. SOCS3在大鼠急性胰腺炎早期炎症反应过程中对NF-KB的影响[J].胃肠病学和肝病学杂,2014,23(8):941-944.DOI:10.3969/j.issn.1006-5709.2014.08.026.
[4] Yu JH,Kim KH,Kim H.SOCS3 and PPAR-gamma ligands inhibit the expression of IL-6 and TGF-betal by regulaling JAK2/STAT3 signaling in pancreas[J].Int J Biochem cell Biol,2008,40(4):677-688.
[5] Saeki K,Kanai T,Nakano M,et al.CCL2-induced migration and SOCS3-mediated activation of macrophages are involved in cerulean-induced pancreatitis in mice[J].Gastroenterology,2012,142(4):1010-1020.DOI: 10.1053/j.gastro.2011.12.054.
[6] 中华医学会消化病学分会胰腺疾病学组,《中华胰腺病杂志》编辑委员,《中华消化杂志》编辑委员会.中国急性胰腺炎诊治指南(2013,上海)[J].中华胰腺病杂志,2013,13(2):73-2-78. DOI:10.3760/cma.j.issn.1674-1935.2013.02.001.
[7] 徐毅晖,陈垦,崔淑兰,等.促炎和抗炎因子在急性胰腺炎发病机制中的研究进展[J].世界华人消化杂志,2010,18(18):1912-1918.DOI:10.3969/j.issn.1009-3079.2010.18.012.
[8] Petrov M.Nutrition, inflammation,and acute pancreatitis[J].ISRN Inflammation,2013,2013(7454):341-410.DOI: 10.1155/2013/341410.
[9] 杨卫振,脱红芳,彭彦辉,等.急性胰腺炎治疗新靶点的研究进展[J].山东医药,2012, 52(40):99-101.
[10] Croker BA,Kiu H,Nicholson SE.Socs regulation of the JAK/STAT signallng pathway[J].Semin Cell Dev Biol,2008,19(4):414-422.DOI: 10.1016/j.semcdb.2008.07.010.
[11] 武永胜,李得溪,赵海平,等.银杏叶提取物对重症急性胰腺炎大鼠脑组织中IL-1 β、IL-6和TNF-α表达水平的影响[J].中国普外基础与临床杂志,2012,19(6):616-621.
[12] Yang YL,Lj JP,Li KZ,et al.Tumor necrosis factor alpha an tibody prevents brain damage of rats with acute necrotizing pancreatitis[J].World J Gastroenterol, 2004, 10(19):2898-2900.
[13] 王彬,张晓华,朱人敏,等.SCOS3在实验性急性胰腺炎急性肺损伤大鼠肺组织中的表达和作用[J].胃肠病学,2012,17(1):14-18.DOI:10.3969/j.issn.1008-7125.2012.01.004
[14] Saeki K, Kanai T, Nakano M, et al.CCL2-induced migration and SOCS3-mediated activation of macrophages are involved in cerulean induced pancreatitis in mice[J].Gastroenterology,2012,142(4):1010-1020.DOI: 10.1053/j.gastro.2011.12.054.
(本文编辑:吕芳萍)
DynamicalchangesandsignificanceofserumSOCS-3inpatientswithacutepancreatitis
ZhaoZhenzhong,XieZhonghua,WangTiejun,ZhengYuanxiu,HuangFangfang.
DepartmentofMedicine,YuhangDistrictSecondPeople′sHospitalofHangzhouCityinZhejiangProvince,Hangzhou311121,China
Correspondingauthor:HuangFangfang,Email:zjz2008001@sina.com
ObjectiveTo investigate the dynamical changes of serum SOCS-3 in patients with acute pancreatitis (AP) and discuss the potential clinical significance.MethodsSeventy-five patients with AP admitted in Yuhang District Second People′s Hospital of Hangzhou City from February 2015 to December 2016 were selected, who were divided into 2 groups according to disease severity: 40 cases in mild AP (MAP) group and 35 cases in moderate and severe AP (MSAP+SAP) group. The levels of serum SOCS-3, IL-6 and TNF-α were determined by enzyme linked immunosorbent assay(ELISA)on the 1, 3, 5 and 7 day after admission. Thirty healthy people who were age and gender matched were included in the normal control group.ResultsThe levels of serum SOCS-3, IL-6 and TNF-α in AP patients on the 1 day after admission were significantly increased than that in the control group (P<0.01 orP<0.05), which were gradually increased with the time, peaked on the 5 day and then started to decrease on 7 day after admission which was still higher than that on the 1 day after admission. The levels of serum SOCS-3, IL-6 and TNF-α in MSAP+SAP group were significantly higher than that in MAP group (P<0.01), and there were significant differences (F=112.80,P=0.001;F=170.21,P=0.000;F=112.82,P=0.000). Significant differences were also found among different time points between two groups (F=258.38,P=0.000;F=4.82,P=0.000;F=5.52,P=0.001). Additionally, the significantly positive correlations of SOCS-3 with IL-6 and TNF-α were found (r=0.785,r=0.828,bothP<0.01).ConclusionsSOCS-3 may participate in early excessive inflammatory reactions in AP. Dynamic detection of SOCS-3 may be helpful for AP clinical classification and prognosis evaluation.
Pancreatitis; SOCS-3; Interleukin-6; Tumor necrosis factor-alpha
10.3760/cma.j.issn.1674-1935.2017.05.002
311121 杭州,杭州市余杭区第二人民医院内二科
黄芳芳,Email: zjz2008001@sina.com
2017-03-24)

