中国典型淡水湖泊沉积物中生物标志物组成特征及源解析*
房吉敦 熊永强 吴丰昌 王书平 杨红军 谢文军 谢 彦
(1.滨州学院山东省黄河三角洲生态环境重点实验室,山东 滨州 256600;2.中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东 广州 510640;3.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
中国典型淡水湖泊沉积物中生物标志物组成特征及源解析*
房吉敦1熊永强2#吴丰昌3王书平1杨红军1谢文军1谢 彦1
(1.滨州学院山东省黄河三角洲生态环境重点实验室,山东 滨州 256600;2.中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东 广州 510640;3.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
分别采集鄱阳湖、太湖和巢湖表层沉积物样品,对沉积物样品的总有机碳(TOC)、TN、总有机碳同位素(δ13Corg)和总氮同位素(δ15Ntotal)等参数以及脂肪烃、脂肪醇、脂肪酸等主要生物标志物进行了分析研究。研究表明,鄱阳湖、太湖和巢湖表层沉积物有机质均呈现出陆源、内源有机质混合来源特征;鄱阳湖、太湖和巢湖表层沉积物中的脂肪烃主要来自藻类源和细菌源,太湖和巢湖沉积物脂肪烃组成受人类活动石油烃影响明显。藻类源是鄱阳湖沉积物中游离态、结合态脂肪醇和巢湖沉积物中游离态脂肪醇的主要来源,太湖沉积物中游离态、结合态脂肪醇和巢湖沉积物中结合态脂肪醇主要来自细菌源。脂肪酸是鄱阳湖、太湖和巢湖表层沉积物样品可溶性有机质的主要组分,主要以结合态脂肪酸形式存在,细菌源是结合态脂肪酸的主要来源。
沉积物TOC脂肪烃 脂肪醇 脂肪酸 源解析
Abstract: In this paper,sediment samples were collected in Lake Poyang,Lake Tai and Lake Chao. TOC,TN,organic carbon isotope (δ13Corg),TN isotope (δ15Ntotal),aliphatic hydrocarbons,alkanols and fatty acids were determined to investigate the composition and sources of biomarkerd in these surface sediments. The results indicated that organic matter in sediment samples came from mixed sources of terrigenous and endogenous sources. The alga and bacteria were the main sources of alphatic hydrocarbons in the sediment from Lake Poyang,Lake Tai and Lake Chao. There was a significant influence of petroleum hydrocarbon from anthropogenic activity to the sediments from Lake Tai and Lake Chao. Alga was the main source of free and bound alkanols in the sediment from Lake Poyang and free alkanols in the sediment from Lake Chao,bound alkanols in the sediments from Lake Tai and Lake Chao were mainly from bacteria. Fatty acids were the main components of soluble organic matter in the sediments from Lake Poyang,Lake Tai and Lake Chao,and fatty acids from bacterial sources were the major components of fatty acids.
Keywords: sediment; TOC; aliphatic hydrocarbons; alcohols; fatty acids; sources identification
湖泊沉积物有机质在区域性生态环境重建中具有不可替代的作用。与海洋环境相比,湖泊具有更高的沉积速率和生产率,湖泊及周围流域短期的气候和环境变化都会记录在沉积物有机质的含量及组成中[1]261。湖泊沉积物有机质主要来自湖泊内生物源、周围流域和入湖泊河流携带的陆源有机质[2]。脂类生物标志物是沉积物有机质的重要组成部分,从中可获得丰富的有机质来源、湖泊生产率、周围流域人类活动和有机质成岩过程等信息。湖泊古环境重建中,不同生物标志物可以提供不同方面的信息,某些生物标志物对成岩变化有较好的抵抗作用,古环境重建中能提供更可靠的数据,而易发生成岩变化的生物标志物可作为有机质成岩蚀变的指标[3],如脂肪烃可作为可靠的沉积物有机质来源指标,而脂肪酸可用作沉积物有机质发生成岩变化的指标[4]。尽管如此,记录古环境变化信息的生物标志物在不同环境背景下也会有所改变,脂肪烃一般用作湖泊古环境重建指标,但沉积物中脂肪烃的含量及组成会受人类活动石油烃的影响[5]。脂肪酸和脂肪醇对成岩变化有不同的敏感性,导致它们在不同环境中发生成岩蚀变的程度也不同,研究发现缺氧条件下的脂肪酸成岩蚀变程度小于脂肪醇,而有氧条件下脂肪酸发生成岩蚀变的程度大于脂肪醇[6]。
沉积物有机质用于重建古环境的指标包含在有机质的含量和组成中,有机质在沉积过程中,来自各生物源的有机质超过90%(质量分数)会发生成岩变化[7]。因成岩变化的难易不同,来自各生物源的有机质在沉积过程的初期阶段虽会发生组成改变,但有机质还是保留了其来源、运输及沉积过程等方面的信息。湖泊水体、沉积物和流域土壤中的微生物是有机质成岩变化的制造者,这些微生物再造或降解水体和陆源有机质,减少有机质数量的同时生成新的有机质混入沉积物有机质组成中[8]413。水体源有机质比陆源有机质更容易发生微生物再造或降解,湖泊沉积物含有相对更多的陆源有机质组分[9]。脂肪烃广泛存在于湖泊沉积物中,相比其他生物标志物,脂肪烃稳定性更好,降解速率约为沉积物总有机质降解速率的1/4,脂肪烃的含量及组成能较准确地反映沉积物中有机质的来源[10]。湖泊沉积物脂肪酸来源较多,短链脂肪酸主要来自水体藻类和细菌,长链脂肪酸是陆源植物有机质的主要组分,常被用作沉积物中陆源有机质的生物标志物[11]。湖泊古环境重建中,脂肪醇的应用虽不及脂肪烃和脂肪酸广泛,但脂肪醇也包含大量有机质来源信息,陆源植物的角质蜡质中含有大量C22~C30的偶数碳脂肪醇,藻类和细菌源脂肪醇的碳数为C16~C22[12]。
鄱阳湖、太湖和巢湖是我国淡水型湖泊的典型代表,同属于我国五大淡水湖的范畴。鄱阳湖地处江西省北部,长江中下游南岸,湖泊面积3 583 km2,是我国第一大淡水湖。太湖地处长江三角洲的南缘,湖泊面积2 428 km2,是我国第三大淡水湖。巢湖地处安徽省中部,湖泊面积775 km2,是我国第五大淡水湖。本研究通过对比鄱阳湖、太湖和巢湖表层沉积物中主要生物标志物的含量及组成特征,探寻淡水型湖泊沉积物中主要生物标志物的来源,探讨人类活动对湖泊水体环境的影响,揭示湖泊周围流域生态环境特点。
1 试验与方法
1.1 样品采集和预处理
2014年9月份,用重力采样器分别在鄱阳湖、太湖和巢湖的湖心位置采集沉积物柱状样各4根,按1 cm间隔对柱状样进行分割,将样品装入100 mL离心管后用封口膜密封,带回实验室于-4 ℃保存至分析。沉积物样品经冷冻干燥后,在玛瑙研钵中磨细,过100目筛,为增加表层样品对湖泊环境的代表性,对4个柱状样的表层样品等量均匀混合后备用。
1.2 样品前处理
分别取5.0 g混合后的沉积物表层样品进行可溶性有机质测定。用二氯甲烷和甲醇(体积比9∶1)混合溶剂100 mL对沉积物表层样品进行索氏抽提72 h,底瓶加铜片脱硫,抽提液浓缩至恒质量,得游离态有机质。抽提后的残渣再用100 mL 1 mol/L的KOH甲醇溶液在80 ℃下皂化12 h后过滤,用正己烷和乙醚(体积比9∶1,下同)混合溶液萃取滤液中的中性组分,剩余水相用盐酸酸化至pH=1,再用正己烷和乙醚混合溶液萃取产物中的酸性组分。游离态有机质采用长30 cm硅胶色谱柱(填充2/3)进行分离,分别用60 mL正己烷、正己烷和乙酸乙酯的混合溶液(体积比4∶1)、甲醇洗脱其中的饱和烃、中性组分和脂肪酸组分。提取的各组分分别用乙酸酐和甲醇进行酯化处理,用氘代正二十烷作内标对正构烷烃、脂肪醇和脂肪酸进行定量分析。
1.3 仪器分析
1.3.1 脂肪烃、脂肪醇和脂肪酸的分析
色谱分析采用Finnigan trace GC 2000气相色谱(GC)仪(美国菲尼根公司),色谱柱为DB-1MS硅熔融毛细管柱(60 m×0.32 mm×0.25 m)。柱温采用程序升温:初温80 ℃,保持5 min后,以3 ℃/min速度升至290 ℃,恒温20 min,载气为高纯氦气,流速为1.0 mL/min。气质联用色谱(GC—MS)分析条件为:HP6890Ⅱ型气相色谱与PlatformⅡ型质谱联用仪,离子源为电子轰击源(70 eV),色谱柱为DB-5硅熔融毛细管柱(30 m×0.25 mm×0.25 μm)。无分流进样1 μm,进样口温度为290 ℃,升温程序为:初温80 ℃,保留2 min,4 ℃/min 升至290 ℃,290 ℃恒温保持20 min。载气为高纯氦气,流速为1.0 mL/min。
1.3.2 总有机质参数的测定
分别取混合后的沉积物表层样品2.0 g放入小烧杯中,加入过量6 mol/L的HC1溶液,充分反应24 h去除其中碳酸盐,然后用去离子水清洗3次。将清洗后的样品置于烘箱内烘干(60 ℃),并放于干燥器中冷却平衡至恒质量。取少量样品用锡纸包裹称重后,用CHNS Vario E1Ⅲ型元素分析仪(德国Elementar公司)测定沉积物样品的总有机碳(TOC)和TN,采用Delta Plus XL型同位素比值质谱仪(美国菲尼根公司)对沉积物样品的总有机碳同位素(δ13Corg)和总氮同位素(δ15Ntotal)进行测定。
2 结果和讨论
2.1 沉积物有机质总参数
鄱阳湖、太湖和巢湖水体及沉积物有机质参数见表1。
湖泊沉积物TOC是描述沉积物有机质含量的最基本参数。由表1可见,鄱阳湖、太湖和巢湖表层沉积物中TOC分别为0.4%、1.1%、1.8%,太湖和巢湖表层沉积物中有机质含量明显高于鄱阳湖表层沉积物中的有机质含量。研究表明,藻类富含蛋白质,纤维素含量较低,有机质的C/N在4~10;陆源植物富含纤维素,蛋白质含量低,有机质的C/N一般高于20[13]。鄱阳湖、太湖和巢湖表层沉积物有机质的C/N分别为6.2、9.4、15.1,说明巢湖表层沉积物比鄱阳湖和太湖表层沉积物有更高比例的陆源有机质。陆源C4植物有机质的δ13Corg值为-20.0‰~-18.0‰,C3植物有机质的δ13Corg值为-34.0‰~-27.0‰,湖泊内源有机质的δ13Corg值为-22.0‰~-19.0‰[14],鄱阳湖、太湖和巢湖表层沉积物有机质的δ13Corg值分别为-25.5‰、-25.7‰和-24.5‰。藻类源有机质的δ15Ntotal平均值约为8.5‰,而陆源高等植物有机质的δ15Ntotal平均值约为3.0‰[15],鄱阳湖、太湖和巢湖表层沉积物的δ15Ntotal分别为2.2‰、7.3‰、6.8‰。综上可知,鄱阳湖、太湖和巢湖等淡水湖泊表层沉积物中有机质均呈现出陆源、内源混合源特征。
2.2 沉积物生物标志物
2.2.1 脂肪烃
关于沉积物中烃类有机质的研究主要集中在多环芳烃上,关于脂肪烃的研究相对较少。相比其他生物标志物,脂肪烃降解速率更慢,脂肪烃的含量和组成能更准确地反映沉积物有机质来源。脂肪烃广泛存在于湖泊沉积物中,主要来自藻类、细菌、湖泊内的维管植物和陆源植物源。藻类和光合菌源的脂肪烃以C17为主,C17脂肪烃在沉积物中的含量可反映出湖泊的古生产率。C21、C23、C25等脂肪烃在挺水和沉水/漂浮等大型水体植物中含量较高,而陆源植物的表皮蜡质中含有较多的C27、C29、C31等脂肪烃。鄱阳湖、太湖和巢湖表层沉积物有机质中脂肪烃分布情况见图1。由图1可见,鄱阳湖、太湖和巢湖沉积物中脂肪烃的碳数分布在C15~C31,分布特征具有一定相似性,藻类、细菌源脂肪烃(碳数≤C20)含量明显高于挺水植物、陆源植物源脂肪烃(碳数≥C21)含量。沉积物脂肪烃的TARHC=(C27+C29+C31)/(C15+C17+C19)和CPI25-31=(C25+C27+C29+C31)/(C26+2C28+C30)可用于研究有机质的来源。TARHC值越高表示沉积物中陆源有机质的含量越高,反之则沉积物中内源有机质含量高[16]。陆源高等植物源脂肪烃奇偶优势明显,CPI25-31介于5~10,而水体浮游生物源脂肪烃或石油烃CPI25-31约为1[8]413。经计算,鄱阳湖、太湖和巢湖沉积物脂肪烃的TARHC分别为1.3、1.0、1.1,CPI25-31分别为2.5、1.6、2.7,可见鄱阳湖、太湖和巢湖沉积物脂肪烃均以水体藻类、细菌源为主要来源。沉积物中C27、C29可以用来指示陆源木本植物源脂肪烃的输入量,而C31用来指示陆源草本植物源脂肪烃的输入量,沉积物中脂肪烃的(C27+C29)/2C31可用来指示陆源木本植物和草本植物源脂肪烃的相对输入比[17],鄱阳湖、太湖和巢湖沉积物脂肪烃的(C27+C29)/2C31分别为0.8、1.0、0.8,可见草本植物和木本植物源脂肪烃均无明显优势来源。采用总脂肪烃与C16的比值(C16ratio)表征湖泊沉积物被人类活动石油烃污染的程度,当C16ratio小于15时表明湖泊沉积物被人类活动石油烃污染明显,而当C16ratio>50时,可推断该湖泊沉积物受人类活动石油烃的污染较小[18]。经计算,鄱阳湖、太湖和巢湖表层沉积物脂肪烃的C16ratio分别为138.0、18.8、15.7,表明鄱阳湖来自人类活动石油烃的影响最小,太湖和巢湖受到了一定程度人类活动石油烃的影响。水体浮游动物能把摄取的植醇转变成姥鲛烷(Pr)[19],甲烷细菌是沉积物中植烷(Ph)的主要来源,太湖和巢湖表层沉积物中姥鲛烷和植烷含量均较高,而鄱阳湖表层沉积物中有明显突出的植烷含量,预示了鄱阳湖、太湖和巢湖水体中都存在高浓度的浮游生物活动。
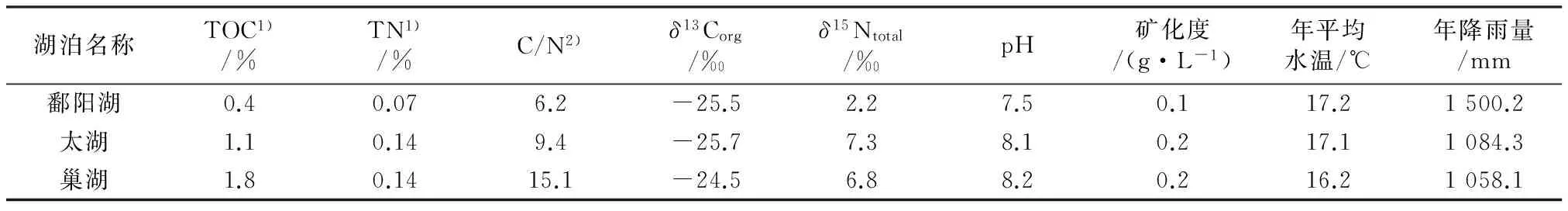
表1 鄱阳湖、太湖和巢湖水体及沉积物有机质总参数
注:1)以质量分数计;2)指摩尔比。
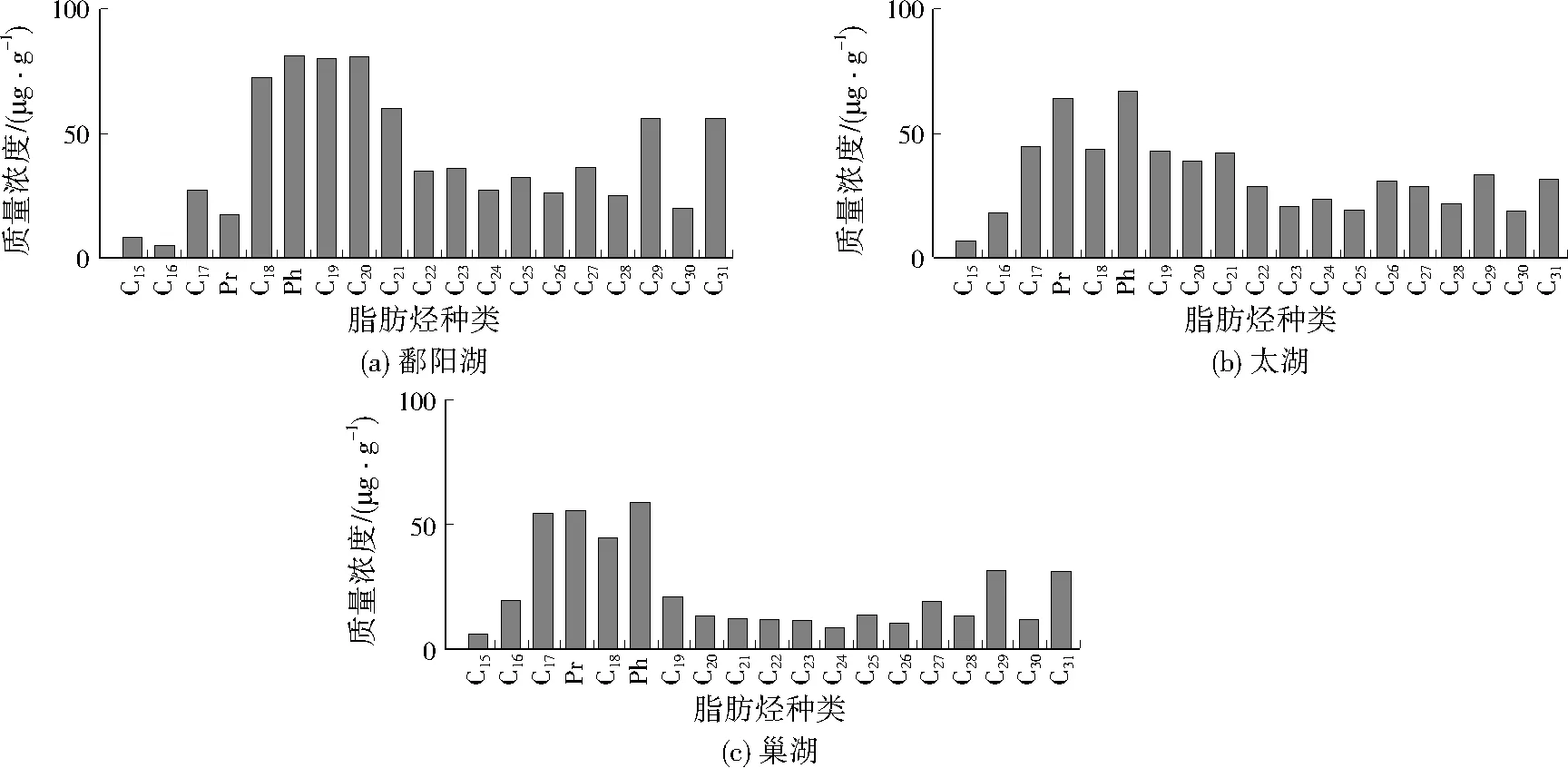
图1 鄱阳湖、太湖和巢湖表层沉积物有机质中脂肪烃分布Fig.1 Distributions of alkanes in surface sediments from Lake Poyang,Lake Tai and Lake Chao

图2 鄱阳湖、太湖和巢湖表层沉积物有机质中脂肪醇分布Fig.2 The distributions of alkanols in the surface sediments from Lake Poyang,Lake Tai and Lake Chao
2.2.2 脂肪醇
在湖泊古环境重建中,脂肪醇的使用虽不及脂肪烃和脂肪酸广泛,但脂肪醇中也包含大量的有机质来源信息,陆源植物的角质蜡质中含有大量C22~C30的偶数碳脂肪醇,常以C26、C28脂肪醇为主峰碳,而C22、C24脂肪醇也可来自大型挺水、沉水/漂浮植物,生物体微生物降解可形成一个C22为主峰的脂肪醇分布,藻类和细菌源脂肪醇的碳数范围为C16~C22,藻类来源的脂肪醇多以C16、C18为主峰碳,C18脂肪醇也可来源于水体浮游动物。鄱阳湖、太湖和巢湖沉积物有机质中,游离态和结合态脂肪醇均表现出C18脂肪醇为主峰的偶数碳优势分布(见图2),鄱阳湖、太湖和巢湖沉积物游离态CPI16-28=(C16+2C18+2C20+2C22+2C24+2C26+C28)/2(C17+C19+C21+C23+C25+C27)分别为136.9、4.1、19.1,结合态脂肪醇的CPI16-28分别为44.9、1.1、1.3,可见鄱阳湖沉积物游离、结合态脂肪醇具有非常明显的偶数碳优势,表明鄱阳湖沉积物游离态、结合态脂肪醇和巢湖沉积物游离态脂肪醇有更多的藻类源组分,而太湖沉积物游离态、结合态脂肪醇和巢湖沉积物结合态脂肪醇均无明显的偶数碳优势,细菌源脂肪醇含量较高。巢湖沉积物中游离态脂肪醇C18为主峰碳,同时巢湖沉积物姥鲛烷含量也较高,可推测巢湖水体存在丰富的浮游动物。碳数>C22的脂肪醇主要来源于高等植物表皮蜡质,具有强的偶碳数优势,脂肪醇的C26/C16和TARAK=(C24+C26+C28)/(C14+C16+C18)可用来评估沉积物中陆源和内源脂肪醇的相对贡献,鄱阳湖、太湖和巢湖沉积物游离态脂肪醇C26/C16分别为0.6、0.7、0.5,TARAK分别为0.3、0.6、0.2;结合态脂肪醇C26/C16分别为0、0.1、0,TARAK分别为0、0.1、0,两指标值均较低,说明鄱阳湖、太湖和巢湖沉积物脂肪醇主要来自内源生物源。
2.2.3 脂肪酸
脂肪酸是生物体类脂物的重要组成部分,脂肪酸单体化合物有其特定的生物源,可用来示踪沉积物有机质的来源及成岩变化过程。脂肪酸分别占鄱阳湖、太湖和巢湖沉积物可溶性有机质总量的81.4%(质量分数,下同)、79.9%、79.9%,是沉积物有机质的主要组分。鄱阳湖、太湖和巢湖沉积物有机质中游离态脂肪酸分别为0.2、0.1、0.1 mg/g,结合态脂肪酸分别为4.3、3.9、3.1 mg/g,结合态脂肪酸是沉积物脂肪酸的主要组分。湖泊沉积物脂肪酸来源较多,脂肪酸C16∶0、C18∶0普遍存在于生物体中,脂肪酸C18∶1W9主要来自浮游植物,而异构(i-)C15∶0、反异构(a-)C15∶0、i-C17∶0、a-C17∶0和C18∶1W7等都是细菌源脂肪酸的典型标志物[1]267。湖泊水体沉积物中碳数为C16、C18的不饱和脂肪酸在沉积过程中很快被细菌再造或降解,细菌贡献具有自身特点的i-C15∶0、a-C15∶0脂肪酸进入沉积物[1]267。
鄱阳湖、太湖和巢湖沉积物中脂肪酸含量情况见表2。由表2可见,鄱阳湖、太湖和巢湖沉积物游离态和结合态脂肪酸的偶数碳优势明显,结合态脂肪酸含有大量的不饱和脂肪酸及支链脂肪酸(BRFA)组分。藻类和浮游动物源脂肪酸的碳数一般在C14~C20,脂肪酸C16∶0为主峰碳[20],且BRFA和不饱和脂肪酸含量高,陆源高等植物含有丰富的碳数在C24~C30的饱和脂肪酸(SSFA)[1]267。脂肪酸的TARFA=(C24∶0+C26∶0+C28∶0)/(C14∶0+C16∶0+C18∶0)可以用来评估沉积物中陆源和湖泊内源脂肪酸的相对贡献,TARFA越高反映陆源脂肪酸输入越多,相反TARFA越低则指示湖泊内源脂肪酸输入越多[8]418。鄱阳湖、太湖和巢湖沉积物的长链脂肪酸含量多数在检测线以下,因此TARFA多为0,表明鄱阳湖、太湖和巢湖沉积物中的游离态和结合态脂肪酸都主要来自湖泊内源生物。脂肪酸的(i-C15∶0+a-C15∶0)/C15∶0能够反映沉积物中细菌的数量及活动情况[21],鄱阳湖、太湖和巢湖沉积物中游离态脂肪酸(i-C15∶0+a-C15∶0)/C15∶0分别为0、2.8、3.4,结合态脂肪酸该指标分别为6.6、6.8、8.5,说明沉积物结合态脂肪酸均以细菌源为主要来源。RAJENDRAN等[22]研究发现,单不饱和脂肪酸(MUFA)是好氧细菌有机酸的主要组分(质量分数约占60.5%),而BRFA是厌氧细菌、硫酸盐还原菌和革兰氏阳性细菌脂肪酸的主要组分(质量分数约占74.0%)。好氧菌的MUFA/BRFA、MUFA/SSFA、BRFA/SSFA的比值分别为9.3、1.8、0.2,而厌氧菌、硫酸盐还原菌和革兰氏阳性细菌中MUFA/BRFA、MUFA/SSFA、BRFA/SSFA分别为0.2、1.4、6.8[23]。本研究采集的沉积物样品中,游离态脂肪酸中仅检测到BRFA和SSFA,MUFA含量低于检测线,而结合态脂肪酸中MUFA、BRFA、SSFA均有检出。鄱阳湖、太湖和巢湖沉积物中游离态脂肪酸的BRFA/SSFA分别为0.1、0.2、0.2,结合态脂肪酸的MUFA/BRFA分别为1.9、0.6、0.4,结合态脂肪酸的MUFA/SSFA分别为0.8、0.2、0.2,结合态脂肪酸的BRFA/SSFA分别为0.4、0.4、0.6,表明鄱阳湖、太湖和巢湖沉积物中游离态脂肪酸主要来自水体藻类,而结合态脂肪酸表现为好氧菌和厌氧菌源脂肪酸的混合源特征。
3 结 论
通过对比分析鄱阳湖、太湖和巢湖沉积物有机质总参数和脂肪烃、脂肪酸、脂肪醇等主要生物标志物,可得到如下主要结论:
(1) 鄱阳湖、太湖和巢湖沉积物中的脂肪烃主要来自湖泊水体的藻类源和细菌源,陆源植物源贡献的长链脂肪烃含量较低。鄱阳湖沉积物受人类活动石油烃的影响最轻,太湖和巢湖沉积物明显受到了人类活动石油烃的影响。
(2) 鄱阳湖沉积物游离态、结合态脂肪醇和巢湖沉积物游离态脂肪醇中藻类源组分含量较高,而太湖沉积物游离态、结合态脂肪醇和巢湖沉积物结合态脂肪醇细菌源脂肪醇含量较高。
(3) 结合态脂肪酸为鄱阳湖、太湖和巢湖沉积物脂肪酸的主要组分,鄱阳湖、太湖和巢湖沉积物中游离态脂肪酸主要来自水体藻类,而结合态脂肪酸表现为好氧菌和厌氧菌源脂肪酸的混合源特征。
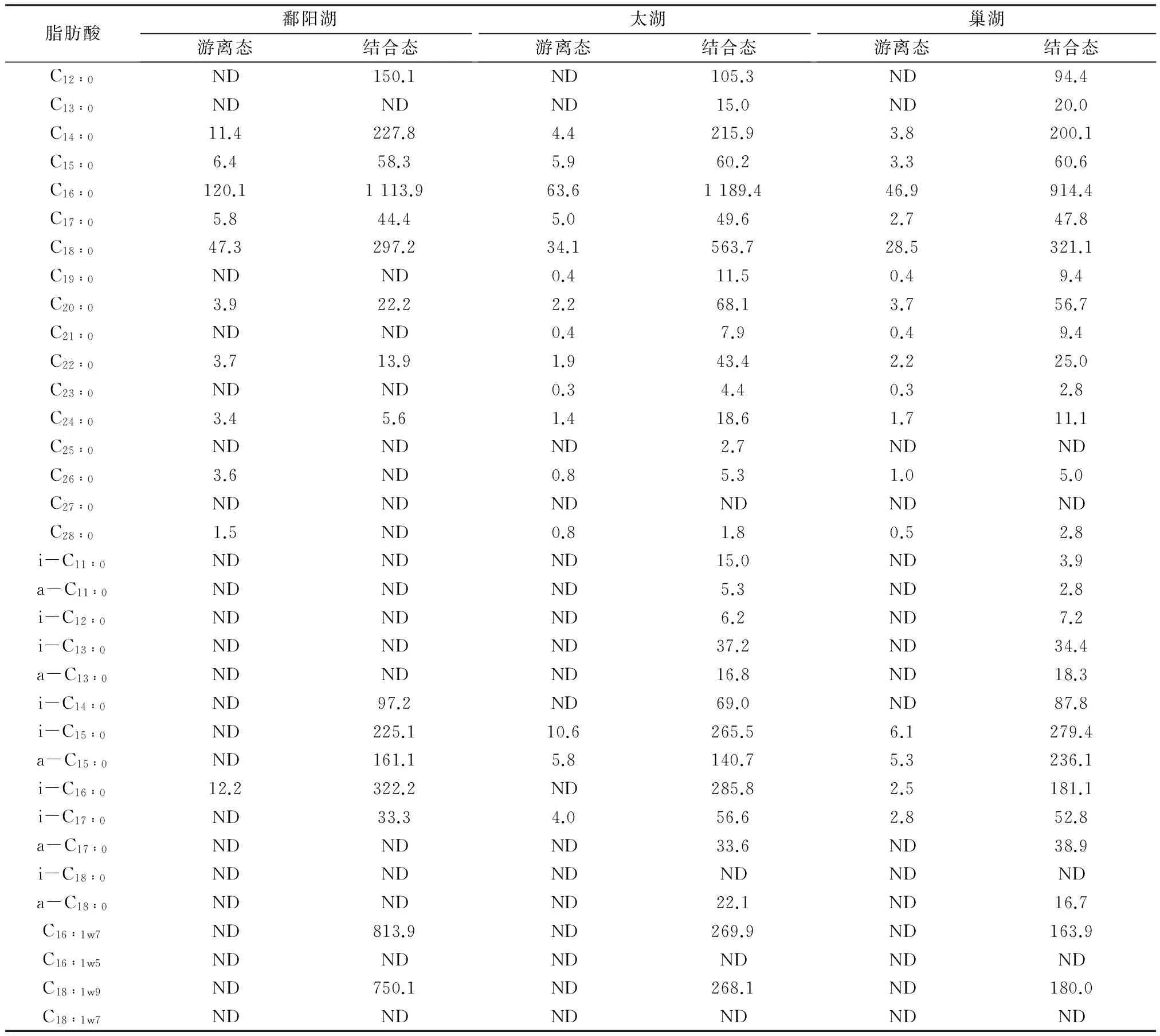
表2 鄱阳湖、太湖和巢湖表层沉积物有机质中脂肪酸分布1)
注:1)“ND”表示低于检出限。
[1] MEYERS P A.Applications of organic geochemistry to paleolimnolocal reconstructions:a summary of examples from the Laurentian Great Lakes[J].Organic Geochemistry,2003,34(2).
[2] MEYERS P A,ISHIWATARI R.Lacustrine organic geochemistry:an overview of indicators of organic-matter sources and diagenesis in lake-sediments[J].Organic Geochemistry,1993,20(7):867-900.
[3] MEYERS P A,LEENHEER M J,EADIE B J,et al.Organic geochemistry of suspended and settling particulate matter in Lake-Michigan[J].Geochimica et Cosmochimica Acta,1984,48(3):443-452.
[4] MEYERS P A,EADIE B J.Sources,degradation and recycling of organic-matter associated with sinking particles in Lake-Michigan[J].Organic Geochemistry,1993,20(1):47-56.
[5] POND K L,HUANG Yongsong,WANG Yi,et al.Hydrogen isotopic composition of individual n-alkanes as an intrinsic tracer for bioremediation and source identification of petroleum contamination[J].Environmental Science and Technology,2002,36(4):724-728.
[6] HOEFS M J L,RIJPSTRA W I C,DAMSTE J S S.The influence of oxic degradation on the sedimentary biomarker record Ⅰ:evidence from Madeira Abyssal Plain turbidites[J].Geochimica et Cosmochimica Acta,2002,66(15):2719-2735.
[7] EADIE B J,CHAMBERS R L,GARDNER W S,et al.Sediment trap studies in Lake Michigan:resuspension and chemical fluxes in the southern basin[J].Journal of Great Lakes Research,1984,10(3):307-321.
[8] FANG Jidun,WU Fengchang,XIONG Yongqiang,et al.Source characterization of sedimentary organic matter using molecular and stable carbon isotopic composition of n-alkanes and fatty acids in sediment core from Lake Dianchi,China[J].Science of the Total Environment,2014,473/474.
[9] HOCKUN K,MOLLENHAUER G,HO S L,et al.Using distributions and stable isotopes of n-alkanes to disentangle organic matter contributions to sediments of Laguna Potrok Aike,Argentina[J].Organic Geochemistry,2016,102:110-119.
[10] SCHOENINGER M J,DENIRO M J.Nitrogen and carbon isotope composition of bone collagen from marine and terrestrial animals[J].Geochimica et Cosmochimica Acta,1984,48(4):625-639.
[11] KENNICUTT M C,BARKER C,BROOKS J M,et al.Selected organic matter source indicators in the Orinoco,Nile and Changjiang deltas[J].Organic Geochemistry,1987,11(1):41-51.
[12] DIDYK B M,SIMONEIT B R T,BRASSELL S C,et al.Organic geochemical indicators of paleo environmental conditions of sedimentation[J].Nature,1978,272(5650):216-222.
[13] MEYERS P A.Preservation of elemental and isotopic source identification of sedimentary organic matter[J].Chemical Geology,1994,114(3/4):289-302.
[14] FONTUGNE M R,JOUANNEAU J M.Modulation of the particulate organic carbon flux to the ocean by a macrotidal estuary:evidence from measurements of carbon isotopes in organic matter from the Gironde system[J].Estuarine,Coastal and Shelf Science,1987,24(3):377-387.
[15] PETERSON B J,HOWARTH R W.Sulfur,carbon,and nitrogen isotopes used to trace organic matter flow in the salt-marsh estuaries of Sapelo Island,Georgia[J].Limnology and Oceanography,1987,32(6):1195-1213.
[16] PETERS K E,WALTERS C C,MOLDOWAN J M.The biomarker guide[M].Cambridge:Cambridge University Press,2005.
[17] XIONG Yongqiang,WU Fengchang,FANG Jidun,et al.Organic geochemical record of environmental changes in lake Dianchi,China[J].Journal of Paleolimnology,2010,44(1):217-231.
[18] COLOMBO J C,PELLETIER E,BROCHU C,et al.Determination of hydrocarbon sources using n-alkanes and polyaromatic hydrocarbon distribution indices [J].Environmental Science and Technology,1989,23(7):888-894.
[19] WAKEHAM S G,CARPENTER R.Aliphatic hydrocarbons in sediments of Lake Washington[J].Limnology and Oceanography,1976,21(5):711-723.
[20] MATSUDA H,KOYAMA T.Early diagenesis of fatty acids in lacustrine sediments Ⅱ.A statiatical approach to changes in fatty acis compositions from recent sediments and some source materials[J].Geochimica et Cosmochimica Acta,1977,41(12):1825-1834.
[21] WAKEHAM S G,BEIER J A.Fatty acid and sterol biomarkers as indicators of particulate matter source and alteration processes in the Black Sea[J].Deep-Sea Research,1991,38(2):943-968.
[22] RAJENDRAN N,MATSUDA O,RAJENDRAN R,et al.Comparative description of microbial community structure in surface sediments of eutrophic bays[J].Marine Pollution Bulletin,1997,34(1):26-33.
[23] ISHIWATARI R,YAMAMOTO S,SHINOVAMA S.Lignin and fatty acid records in Lake Baikal sediments over the last 130 kyr:a comparison with pollen records[J].Organic Geochemistry,2006,37(12):1787-1802.
CompositionandsourceidentificationofbiomarkersinsurfacesedimentsfromtypicalfreshwaterlakesinChina
FANGJidun1,XIONGYongqiang2,WUFengchang3,WANGShuping1,YANGHongjun1,XIEWenjun1,XIEYan1.
(1.ShandongKeyLaboratoryofEco-EnvironmentalScienceforYellowRiverDelta,BinzhouUniversity,BinzhouShandong256600;2.StateKeyLaboratoryofOrganicGeochemistry,GuangzhouInstituteofGeochemistry,ChineseAcademyofSciences,GuangzhouGuangdong510640;3.StateKeyLaboratoryofEnvironmentalCriteriaandRiskAssessment,ChineseResearchAcademyofEnvironmentalSciences,Beijing100012)
2017-01-10)
房吉敦,男,1971年生,博士,讲师,主要从事湖泊污染过程风险评估及污染控制技术管理等方面的研究。#
。
*山东省自然科学基金资助项目(No.ZR2014DM002);山东省高校科技计划项目(No.J14LD03)。
10.15985/j.cnki.1001-3865.2017.08.003

