原发性肝血管肉瘤多层螺旋CT表现与病理对照分析
湖南省永州市中心医院放射科 (湖南 永州 425000)
李 磊 胡小丽 杨民正 唐晓明 邓 雪
原发性肝血管肉瘤多层螺旋CT表现与病理对照分析
湖南省永州市中心医院放射科 (湖南 永州 425000)
李 磊 胡小丽 杨民正 唐晓明 邓 雪
目的分析原发性肝血管肉瘤(PHA)的多层螺旋CT(MSCT)表现,以提高对本病的认识。方法回顾性分析6例经病理证实的PHA的 MSCT表现并复习相关文献,各例均行平扫及多期增强扫描,对病灶的部位、数目、大小、形态、边缘、密度及强化特征等进行观察分析。结果6例PHA中,单发巨块型4例,混合型2例。6例CT平扫均呈低密度,均匀或不均匀;4例巨块型动脉期病灶边缘呈中度或明显不均匀环状或结节状强化,中心区见不规则条索状或斑片状明显强化;门脉期及延迟期呈持续强化,呈向心状和(或)离心状扩展,中心区均未完全填充。2例混合型为1枚较大主灶伴数目不等子灶,边界清晰,呈类圆形或分叶状。巨块主灶强化特点与单发巨块型相似,子灶增强后可无强化,也可呈向心性强化、均匀强化或中心强化。结论PHA的MSCT表现具有一定特征性,结合临床病史及体征,应考虑到PHA的可能性,最终确诊还需依靠病理及免疫组织化学。
肝脏;血管肉瘤;计算机体层成像
原发性肝血管肉瘤(primary hepatic angiosarcoma,PHA)是一种极为罕见起源于肝脏间叶组织的恶性肿瘤[1],但却是肝脏肉瘤中最多见的,约占36%,其恶性程度很高,目前国内有关PHA影像诊断的报道较少,多为散在个案报道,误诊率非常高。本文收集经手术、病理证实6例肝血管肉瘤,分析病变CT影像学表现、病理组织特征,对指导临床治疗具有重要价值。
1 资料与方法
1.1 一般资料回顾性分析本院2005年1月~2014年12月间6例肝血管肉瘤患者,其中男4例,女2例,年龄2~65岁,中位年龄52.5岁,临床表现:腹部胀痛不适3例,均无呕吐、腹泻、腹胀、皮肤黄染等异常;腹部肿块1例,体检发现肝占位2例。1例伴有慢性肝炎病史,5例无肝炎、肝硬化病史。所有患者行多层螺旋CT平扫及三期增强扫描,患者经手术或穿刺病理证实诊断为肝血管肉瘤。
1.2 检查方法采用Siemens16层或GE hightspeed 64层CT扫描仪,扫描条件:管电压120KV,管电流250mAs,扫描层厚及层间距5mm,准直5~10mm,螺距为1;扫描前4~6h禁食、禁水, 扫描前口服温开水1000mL充盈胃肠道。扫描方式为1次屏气螺旋扫描。扫描范围自膈顶到脾下缘水平。增强扫描于肘前静脉内团注对比剂碘普胺或碘海醇(300mgI/mL),剂量1.5~2.0 ml/kg,注射流率3ml/s。动脉期延时20~30s扫描,门静脉延时60~70s扫描,120s行平衡期扫描。
1.3 病理学检查2例局麻行B超引导肝脏占位病变穿剌活检术,4例行气管插管全麻下行肝段切除;病理组织分别用HE染色和免疫组织化学染色证实。
1.4 CT图像分析对原始图像数据进行薄层2mm重建后再行冠状位、矢状位重组,结合手术、病理对照,由两名高年资影像诊断医师独立对病变MSCT进行分析,并进行影像表现与病理对照,意见不一致时协商达成一致意见,主要观察征象有:(1)病灶部位、数目、大小、边缘、内部结构等;(2)动态增强扫描病灶强化方式、肿瘤边界等。
2 结 果
6例病例中4例肿块型,位于肝左叶1例,肝右叶3例,肿瘤直径范围约4.2~6.5cm,2例混合型(巨块伴结节状子灶),均位于肝左右叶,较大主灶直径约12.2cm。肿块均呈类圆形,边界清晰或欠清,部分病灶呈分叶或结节状。
2.1 MSCT表现6例病灶平扫呈低密度或略低密度影,密度欠均匀,部分较大病灶内见液化坏死更低密度区,CT值约30~59HU,边界清晰。1例巨块型病灶及1例混合型主灶中心见片状或斑片状略高密度影;所有病灶内部均无钙化。三期增强扫描后,4例单发巨块型,动脉期呈边缘不规则环状、瘤中央网格状及条片状明显强化,强化CT值约50~75HU,类似血管瘤,门静脉期持续强化,但范围未见明显扩大,延迟期持续强化且呈渐进性中心填充式强化,中央液化坏死区一直未强化,边界模糊(图1-4)。2例混合型PHA,动脉期巨块主灶表现与单发巨块型相似,动脉期病灶边缘呈中度或明显不均匀环状或结节状强化,门静脉期中央部分强化呈网格状、条索状及斑片状,强化加强并范围扩大,延迟期病灶持续强化且呈渐进性中心填充式强化,相对肝实质三期均呈略高密度, 且部分病灶完全填充,子灶强化呈多样性,多数与主灶强化相近,少部分较小病灶各期仅见边缘轻度环状强化,门静脉期肿块持续强化;范围未见明显扩大(图5-8)。本组3例病灶外缘在门静脉期发现“假包膜”样相对低密度带。6 例病灶均无肝内外胆管扩张,无侵犯门静脉及肝静脉,无肝门区及腹膜后淋巴结肿大。

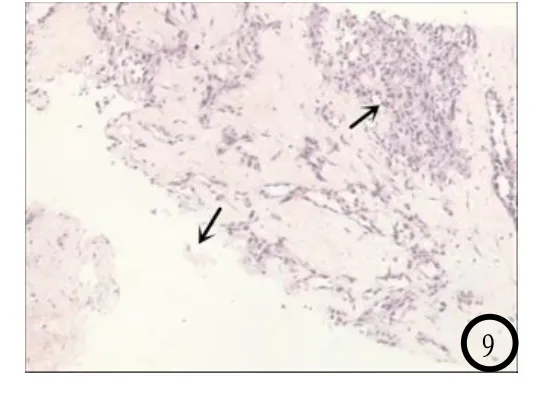
图1-4 肝右叶巨块型PHA。图1 CT平扫肝右叶低密度灶, 边界尚清;图2 CT增强动脉期病灶边缘呈不规则条片状、中心区呈网格状及斑片状明显强化,图3 CT增强门脉期肿瘤强化程度增高,强化范围扩大;图4 CT增强延迟期病灶呈稍高密度,对比剂继续填充,中心去未完全充填,中央液化坏死区一直未强化,边界模糊。图5-9肝混合型PHA。图5 CT平扫肝左右叶散在大小不等低密度结节灶,边缘不清;图6 CT增强动脉期巨块主灶边缘呈中度结节状强化;图7 CT增强门脉期肿瘤中央部分强化呈条索状及斑片状强化;图8 CT增强延迟期病灶呈稍高密度或等密度,并向中间填充;图6-8 CT增强示子灶少部分较小病灶各期仅见周缘轻度环状强化,门静脉期肿块持续强化,范围未见明显扩大。图9 光镜下(HE×200)示异常增生肿瘤细胞呈覆盖性生长,使肝细胞萎缩,肝窦变宽,瘤细胞突入血管腔。呈梭形、圆形或不规则形,边界不清,核仁大小不等,见核分裂。
2.2 病理学所见本组6例均行病理学及免疫组化检测,其中2例行局麻下行B超引导肿瘤穿刺活检术,4例行气管插管全麻下行肝肿瘤切除术,术中肿瘤切面实性或合并出血、坏死和囊变,并呈现大小不等的出血性结节和蜂窝状血管腔,肿瘤无明显包膜。显微镜下肿瘤细胞弥漫性增生,呈梭形或不规则形,胞质较少,嗜酸性,淡染,胞核呈短杆状或多边形,核仁大小不等,见核分裂,异常增生肿瘤细胞呈覆盖性生长,使肝细胞萎缩,肝窦变宽,瘤细胞突入血管腔(图9)。2例穿刺活检组织镜下所见同上。6例免疫组化:CD31阳性、CD34阳性、上皮细胞角蛋白(CK)阴性、甲胎蛋白(AFP)阴性。其中2例波形蛋白(Vim)阳性,2例Ⅷ因子阳性。
3 讨 论
3.1 临床特点PHA是由肝窦血管内皮细胞异型增生所发生的一种较为罕见的间叶组织恶性肿瘤,又称血管内皮肉瘤、恶性血管内皮瘤、间皮肉瘤和枯否氏细胞肉瘤等,近年来趋于一致用肝血管肉瘤这一名称,仅占肝脏原发肿瘤的0.5%~2%[2]。国内PHA多为个案报道。PHA传统认为好发于成年男性,以50~70岁多见,儿童或青少年罕见,男女比例为3~5.5∶1,本组男女之比约4:2,中位年龄52.5岁,与文献报道相符。目前,PHA的病因尚不明确,Locker研究表明40%的病例可能与接触某些致癌物质(如氯乙烯,二氧化钍,砷剂或放射性镭等)或酒精性肝硬化,血色沉着症所致的肝硬化有关[3]。但本组病例均无上述好发因素。PHA患者大多数无特异的临床特征,临床上患者可无症状,或早期仅有上腹部不适、腹部隐痛、发热、体弱或体重减轻等,肝功能可有不同程度损害,实验室检查亦无特异性,晚期可出现肝功能衰竭、腹水、DIC、肿瘤破裂出血引发的急腹症。据文献报道PHA缺乏特异性的肿瘤标记物,血清AFP多正常或轻度升高[4],本组6例病例均无血清AFP增高,与文献报道符合一致。PHA易发生肺、脾转移,其次为骨、腹膜、淋巴结等远处转移[5],本组病例无远处转移征象,与文献报道不一致,主要与病例数偏少有关。
3.2 PHA的MSCT表现与病理基础PHA属富血供肿瘤,因肿瘤细胞形成不成熟的血管样结构,同时存在内源性凝血因子消耗[6],因此极易出现肿瘤内部出血,故不主张经皮肝穿刺活检。因此,影像学检查对PHA的诊断具有重要作用。
PHA常为多发性,也可单发,病灶常较大。据文献报道[7]肿瘤大体形态分为4种类型:弥漫微小结节型、弥漫多发结节型、巨块型和混合型。Rademaker等国外学者报道[8]以弥漫多结节型及混合型居多,另外国内学者[9]将PHA分为单发巨块型、单发结节型、多发结节型和混合型,以单发巨块型报道居多,本组6例中4例为巨块型,2例为混合型,无弥漫结节型,与文献报价基本相符。CT平扫多表现为不均匀低密度影, 边缘尚清或模糊,伴中心区片状液化坏死更低密度区, 部分新鲜出血表现为高密度影,主要多见于巨块型,本组6例病例中,其中巨块型及混合型各1例瘤内均可见不规则更低密度液化坏死区及小片状高密度出血灶,经病理证实为坏死及出血,笔者认为具有一定提示意义,虽然不具有特异性,且出血时间不同,仅少数病灶表现出来。
PHA在组织学上主要包含实性部分和充满血液的海绵状、裂隙状囊腔结构,夹杂肿瘤血管、纤维组织、坏死及出血区,各种成分可按不同比例交替分布。
PHA典型CT增强表现为早期边缘明显环状或结节状强化,随时间延伸,病变呈向心性充填式强化,中心呈轻度强化,但仍为低密度,增强扫描后期仍呈低密度,坏死囊变区始终不强化[10]。本组中有6例呈现此种强化方式,动脉期仅边缘明显强化,中心无明显强化,门静脉期呈持续强化,强化程度高于肝实质,强化区呈扩展趋势,可呈由外向内的“向心状”或由内向外的“离心状”,多数病灶两者兼有,类似于血管瘤内的血窦强化,与文献报道相符。
PHA常见的典型表现为延迟期病灶强化不均匀,病灶中心大片低密度常提示肿瘤坏死。当血管肉瘤表现为多结节时,动脉期可局灶性强化,形态不规则,部分结节可边缘环形强化[11]。本组2例混合型的卫星灶强化方式与此类似。肿瘤增强周边出现毛发状环形低密度影,此为假包膜所致[12]。本组3例病灶外缘在门静脉期发现相对低密度带,类似肝癌假包膜,考虑其病理基础为肿瘤压迫周围肝窦扩张、水肿所致。与文献报道一致。本研究样本量较小,且未进行多病例分析,有待于今后积累更多病例加以总结。
3.3 鉴别诊断PHA影像诊断需与肝脏富血供肿瘤鉴别:(1)海绵状血管瘤∶血管瘤边界清楚,增强扫描为“快进慢出”,延时期瘤内强化较均匀,且以边缘结节强化并中间充填为特点,血管瘤患者一般情况良好,肝功能多正常;而且PHA肿块体积多较大,边界不清,常有出血坏死,密度不均匀,增强后分布和形态均不规则强化,与肝海绵状血管瘤强化方式有差异,可以与之鉴别;(2)原发性肝细胞癌:多伴有乙型肝炎、肝硬化病史,实验室检查AFP升高,易侵犯肝内脉管系统形成门静脉瘤栓,主要由肝动脉供血,血供丰富,动脉期肿块呈不同程度明显强化,多呈特征性的“快进快出”表现,但不及PHA出血灶常见。肝血管肉瘤AFP阴性,典型CT增强扫描表现为渐进式强化。(3)上皮样血管内皮瘤∶多发于成年女性,可能与口服避孕药有关。而PHA以中老年男性多见。其肿瘤多发生与肝脏周边,但包膜无膨隆改变,CT平扫表现为不规则低密度区,边界欠清,瘤中央可有更低密度区,部分病灶可伴有钙化,增强后动脉期病灶边缘强化,延迟扫描强化区不扩大,瘤中央更低密度区始终无强化,呈靶征[13]。
总之,PHA高度恶性,治疗不及时则进展迅速,预后较差,但MSCT表现具有一定的特征性,临床工作中遇到肝脏巨大占位,有致癌物接触史、病情进展快而血清AFP阴性,瘤内易出血、坏死,CT增强扫描具有重要诊断价值,典型表现动脉期肿瘤边缘呈中度或明显不均匀环状或结节状强化,门静脉期及延迟期持续填充式强化,但多不能完全充填,应高度怀疑PHA可能,但最终确诊还需依靠病理活检证实。
[1] 武忠弼,杨光华.中华外科病理学[J].北京∶人民卫生出版社.2002∶830.
[2] Molina E,Hernandez A.Clinical manifestations of primary hepatic angiosarcoma[J]. Did Dis Sci,2003,48(4)∶677-682.
[3] Locker GY,Doroshow,JH,Zwelling LA,et al.The clinical features of hepatic angiosarcoma∶ a report of four cases and a review of the English literature. Medicine(Baltimore),1979,58(1)∶48-64.
[4] 王健,李强,崔云龙,等.肝血管肉瘤∶16例回顾. 中华肝胆外科杂志,2006,12(8)∶532-535.
[5] Kim TO,Kim GH,Heo,J,et al.Metastasis of hepatic angiosarcoma to the stomach[J].J Gastroentero1,2005,40(10)∶1003-1004.
[6] 李若坤,曾蒙苏,强金伟,等.原发性肝血管肉瘤的MRI表现与病理对照研究.中国医学计算机成像杂志,2011,17∶420.
[7] Kojiro N O Recurrence of hepatocellular carcinoma∶multicentric occurrence or intrahepatic metastasis∶aviewpoint in terms of pathology[J]. HepatobiliaryPancreat Surg,2001.8∶404.
[8] Rademaker,J,Widjaia A,Galanski M.Hepatic hemangiosarcoma imaging finaings and differential diagnosis[J].Eur Radiol,2000,10(1)∶129-133.
[9] 王春,章顺壮,马周鹏,等.肝脏血管肉瘤的多层螺旋CT表现及其相关病理基础[J].中华放射学杂志,2011,45(2)∶203.
[10]李建丁,郭建,孙华平.肝脏少见恶性肿瘤的CT表现.中华放射学杂志,2003,37(6)∶532-536.
[11]Koyama T,Fletcher JG,Johnson CD,et a1.Primary hepatic angiosarcoma∶findings at CT and MR imaging[J].Radiology,2002,222(3)∶667-673.
[12]冯亮,陈臂坤,卢光明.CT读片指南.南京∶江苏科学技术出版社,2000∶296.
[13]缪建良,刘淼, 陈达伟.肝脏上皮样血管内皮瘤的影像学特征[J]. 放射学实践,2011,26(7)∶736-738.
Comparative Analysis of MSCT Features and Pathological Characteritics of Primary Hepatic Angiosarcoma
LI Lei. HU Xiao-li, YANG Min-zheng,et al., Department of Radiology, The Central Hospital of Yongzhou City, Yongzhou 425000, Hunan Province, China
ObjecliveTo explore the multislice spiral CT (MSCT)performence of primary hepatic angiosarcoma.MethodsIn this retrospective studies, 6 patients with pathologically confirmed primary hepatic angiosarcoma under went preoperative MSCT and lobectomy. To analyz the tumor location, number, size, contour, periphery, density, and contrast enhancement patten. Both plain and multi-phase enhanced CT examinations were performed in all the 6 patients.ResultsAmong the 6 cases,solitary huge mass type was seen in four and mixed type in two. On plain CT scan,the PHA lesions appeared as heterogeneous or homogeneous hypodense area. 4 cases of massive type of arterial lesions were moderately or significantly uneven edges cyclic or nodular enhancement, the central area with irregular or patchy streak significantly enhanced; which remained in portal and delayed phase and the central area of the lesion was not completely filled with contrast. Two cases of mixed type dominant masses with multiple satellite nodules and the dominant mass demonstrated lobular or round in shape. Huge mass of dominant mass strengthening characteristics and single huge mass of similar type. The satellite lesions showed showed variable enhancement patterns, such as nonenhancement, homogoneous, focal,rim-enhancement or progressive opcification from periphery to center.ConclusionPHA have some characteristic MSCT features, however the diagnosis depends on clinical characters.The ultimate diagnosis relies on the pathological and immunohistochemical examination.
Liver; Angiosarcoma; Computed Tomography
R322.4+7
A
10.3969/j.issn.1009-3257.2017.05.012
李 磊,男,医学影像诊断专业,主治医生,主要研究方向:消化系统影像诊断
胡小丽
2017-09-18

