银杏酮酯对急性血瘀证大鼠血流动力学及心肌组织肿瘤坏死因子-α通路的影响
姜丽,杨子平,包怡敏
银杏酮酯对急性血瘀证大鼠血流动力学及心肌组织肿瘤坏死因子-α通路的影响
姜丽,杨子平,包怡敏
上海中医药大学基础医学院,上海 201203
观察银杏酮酯(GBE50)对急性血瘀证大鼠血流动力学和心肌组织肿瘤坏死因子(TNF)-α通路的影响,探讨其作用机制。采用皮下注射盐酸肾上腺素复合冰水浴法制作大鼠急性血瘀证模型。将雄性SD大鼠随机分为正常组、模型组和GBE50组,灌胃相应药物干预11 d后造模。次日观察各组血流动力学变化,RT-PCR检测心肌组织TNF-α、TNFR1、TNFR2 mRNA表达,放免法检测心肌组织TNF-α蛋白表达,免疫组化检测心肌组织TNFR1和TNFR2蛋白表达。模型组血流动力学指标呈现低于正常组的趋势;与模型组比较,GBE50组左心室收缩峰压平均值、左室发展压明显增大,室内压最大上升速率时间明显减少(<0.05),GBE50组心肌组织TNF-α、TNFR1、TNFR2蛋白表达明显升高,TNFR2 mRNA表达明显升高(<0.05)。GBE50能改善急性血瘀证大鼠血流动力学指标,并对心肌组织TNF-α通路具有调控作用,增加保护性受体TNFR2表达可能是其保护心功能的机制之一。
银杏酮酯;血瘀证;血流动力学;肿瘤坏死因子-α;肿瘤坏死因子受体;大鼠
血瘀证是临床常见证型,与心脑血管疾病、肿瘤发生等密切相关。目前研究认为,血瘀证生物学病理变化多反映在血液流变学方面,包括全血黏度、血浆黏度、血小板聚集性增强,体外血栓形成的干湿量及长度增加,纤维蛋白原增高等[1],但对血瘀证血流动力学变化报道较少。临床研究表明,血瘀证患者存在过度的炎症反应,且炎症与血瘀证的病理、病机和治疗等方面关系密切[2]。作为血瘀证发展过程中的炎症反应和心功能的桥梁因子,肿瘤坏死因子(TNF)-α在一定程度上决定血瘀证内在病理机制的发展变化与转归[3];而TNF-α主要通过与细胞表面的2种TNF受体(TNFR1、TNFR2)的结合,发挥其生物学效应[4]。银杏酮酯(Ginkgo biloba extract 50,GBE50)是一种新型银杏叶提取物制剂,具有活血化瘀、通脉舒络的功效,临床上主要用于各种疾病的血瘀证。我们前期实验研究显示,GBE50能够抗心肌缺血[5]、抗心律失常[6]、抗心肌缺血再灌注损伤[7]和抗衰老[8]等;对于急性血瘀证大鼠,GBE50能改善血液黏、浓、凝、聚状态,降低血清TNF-α含量,调节免疫功能[9]。GBE50的作用机制与抗氧化应激[10]、抑制炎症反应[11]和抗凋亡[12]等有关。本实验观察GBE50对急性血瘀大鼠血流动力学和心肌组织TNF-α及其受体(TNFR1、TNFR2)的影响,探讨GBE50改善血瘀证心功能和TNF-α通路在其中的作用。
1 实验材料
1.1 动物
清洁级健康雄性SD大鼠72只,38~40日龄,体质量180~200 g,上海中医药大学动物实验中心。动物许可证号SCXK(沪)2008-0016。饲养于温度(23±2)℃、相对湿度(55±10)%环境,自由摄食饮水。
1.2 药物
GBE50,上海上药杏灵科技药业股份有限公司,批号071008。其有效成分中银杏总黄酮含量≥44%,黄酮醇苷≥24%,游离黄酮≥20%,银杏内酯≥6%,银杏酸含量≤1 PPM;盐酸肾上腺素注射液,天津金耀氨基酸有限公司,批号1107161。
1.3 主要试剂与仪器
焦碳酸二乙酯(DEPC,上海生物工程技术公司),羧甲基纤维素钠(CMC-Na,国药集团化学试剂有限公司),cDNA合成试剂盒(Fermentas公司),Trizol(Invitrogen公司),SYBRGreen PCR试剂盒(上海捷瑞生物工程公司),TNF-α放射免疫分析试剂盒(北京普尔伟业生物科技有限公司),rabbit anti-TNFR1(Gene Tex,Irvine,CA),rabbit anti-TNFR2(CST,Danvers,MA)。RM6240BD生物信号采集系统(成都仪器厂),GC-911型放射免疫计数器(科大创新股份有限公司中佳分公司),BH2显微镜(日本OLYMPUS),E4500数码相机(日本NIKON),7500型RT-PCR检测仪(美国ABI)。
2 实验方法
2.1 分组和给药
大鼠随机分为正常组(21只)、模型组(28只)和GBE50组(23只)。正常组和模型组给予1%CMC-Na蒸馏水溶液灌胃,GBE50组给予GBE50混悬液100 mg/(kg•d)灌胃。每只大鼠灌胃剂量为10 mL/(kg•d),1次/d,连续12 d。
2.2 造模
参照文献[13]方法。第11日灌胃1 h后,皮下注射0.1%盐酸肾上腺素0.8 mg/kg,间隔4 h再给予等剂量盐酸肾上腺素,2次皮下注射期间将大鼠置于冰水浴中浸泡5 min,造成急性血瘀证模型。造模结束后禁食不禁水,次日灌胃1 h后腹腔注射20%乌拉坦麻醉,右颈总动脉插管至左心室,记录左心室内压(LVP)曲线,最后摘取心脏。
2.3 血流动力学指标测定
右颈总动脉插管记录动脉血压,之后插管至左心室,记录LVP曲线,测量心率(HR)、左心室收缩峰压平均值(mLVSP)、左心室舒张压平均值(mLVDP)、左室内压最大变化速率(±dp/dtmax)、左心室开始收缩至达到室内压最大上升速率时间(t-dp/dtmax),计算左室发展压(DP),DP=mLVSP-mLVDP。
2.4 放免法检测心肌组织肿瘤坏死因子-α蛋白表达
10%心肌组织匀浆,4 ℃、3000 r/min离心15 min,取上清液按试剂盒说明操作,测定各管沉淀的放射性计数(cpm)。由自动γ计数器直接给出有关参数、标准曲线及样品浓度,再根据称取的组织量,计算出每1 mg组织中的量。
2.5 免疫组化检测心肌组织肿瘤坏死因子受体1、2蛋白表达
所取心肌甲醛固定,石蜡包埋,切片,EnVision法免疫组化测定。棕黄色或棕褐色区域为阳性表达,每张切片随机选取3个视野。通过IMS细胞图像分析系统进行数据分析,计算阳性区域面积与光密度(OD)。显微镜、图像采集卡和数码相机采集图像。
2.6 RT-PCR检测心肌组织肿瘤坏死因子-α及其相关受体mRNA表达
各组心肌样本进行总RNA提取,浓度测定,反转录为cDNA,Real-time PCR反应。引物序列见表1。以GAPDH为管家基因,校正每个样本Ct值。采用2-ΔΔCt法计算目的基因的相对表达量。

表1 RT-PCR反应基因序列
3 统计学方法

4 结果
4.1 大鼠死亡率
造模过程中由于应激损伤,模型组死亡率较高,而GBE50组死亡率明显低于模型组,见表2。提示GBE50具有提高模型动物存活率的作用。

表2 实验过程各组大鼠死亡情况(只)
4.2 GBE50对血瘀证大鼠血流动力学的影响
模型组大鼠HR显著低于正常组(<0.05),提示心脏活动降低,GBE50可在一定程度上改善HR的减慢,但差异无统计学意义(>0.05),见表3。模型组和GBE50组收缩压与舒张压皆呈现低于正常组的趋势,但差异无统计学意义(>0.05)。GBE50组脉压差显著低于正常组(<0.05),见表4。GBE50组mLVSP和DP显著高于正常组和模型组(<0.05),提示GBE50可增强心肌收缩力,见表5。与正常组比较,模型组±dp/dtmax有减小的趋势,提示心脏的收缩与舒张功能下降。GBE50能稳定大鼠±dp/dtmax,且t-dp/dtmax显著低于正常组和模型组(<0.05),见表6,提示GBE50治疗后血瘀证大鼠的心肌收缩性能增强。

表3 各组大鼠HR比较(±s,次/min)
注:与正常组比较,*<0.05
表4 各组大鼠动脉血压比较(±s,mm Hg)
注:与正常组比较,*<0.05
表5 各组大鼠左心室内压比较(±s,mm Hg)
注:与正常组比较,*<0.05;与模型组比较,#<0.05
表6 各组大鼠心肌力学指标比较(±s)
注:与正常组比较,*<0.05;与模型组比较,#<0.05
4.3 GBE50对血瘀证大鼠心肌组织肿瘤坏死因子-α及其2种受体表达的影响
模型组和GBE50组心肌组织TNF-α蛋白表达高于正常组,且GBE50组升高显著,与正常组和模型组比较差异均有统计学意义(<0.05,<0.01),见表7。免疫组化检测显示,正常组心肌组织TNFR1、TNFR2少量表达,模型组和GBE50组TNFR1、TNFR2的表达均有所增加。从数值看,GBE50组TNFR1蛋白表达明显高于正常组和模型组(<0.05),结合切片观察,阳性面积主要在血管周围,心肌阳性表达少;模型组显示心肌组织TNFR1蛋白的阳性表达较少,故GBE50对心肌组织TNFR1的蛋白表达变化尚不明确。GBE50组心肌组织TNFR2的蛋白表达明显增加,与模型组比较OD值差异有统计学意义(<0.05,<0.001),见图1、图2、表8。TNF-α mRNA表达结果与蛋白变化一致,模型组和GBE50组均表现为TNF-α mRNA表达升高;模型组TNFR1基因表达较正常组略增加,但差异无统计学意义(>0.05),TNFR2基因表达明显减少(<0.05),GBE50组TNFR2基因表达较模型组明显升高(<0.05),见表9。
表7 各组大鼠心肌组织TNF-α含量比较(±s,pg/mg)
注:与正常组比较,**<0.01;与模型组比较,#<0.05
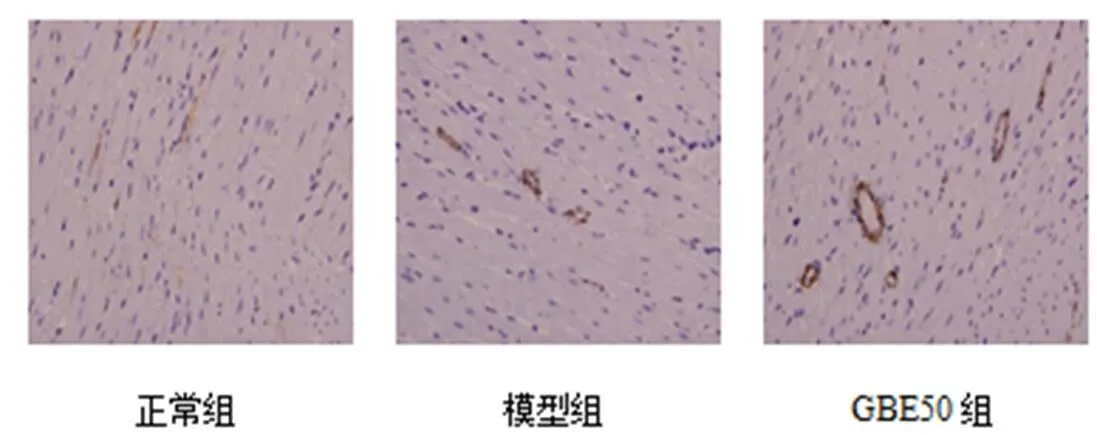
图1 各组大鼠心肌组织TNFR1蛋白表达(免疫组化染色,×100)

图2 各组大鼠心肌组织TNFR2蛋白表达(免疫组化染色,×100)
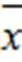
表8 各组大鼠心肌组织TNFR1、TNFR2蛋白表达比较(±s)
注:与正常组比较,*<0.05;与模型组比较,#<0.05,###<0.001
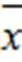
表9 各组大鼠心肌组织TNF-α、TNFR1和TNFR2 mRNA表达比较(±s,%)
注:与正常组比较,*<0.05;与模型组比较,#<0.05
5 讨论
本研究采用皮下注射大剂量肾上腺素复合冰水浴刺激,模拟暴怒与寒凝2个重要病因,造成急性血瘀证模型[14]。结果显示,该模型能够造成动物全血黏度、血浆黏度、红细胞聚集指数等血液流变学指标发生变化,在一定程度上体现了血瘀证的部分临床表征,而GBE50能够改善上述变化[9]。有研究显示,冠脉缩窄复制的慢性心肌缺血血瘀证模型和高脂饮食模拟的痰浊血瘀证模型都表现出心功能水平的降低[3,15]。本实验也观察到,急性血瘀证大鼠血流动力学各指标呈现低于正常组的趋势,左室收缩和舒张功能都受影响,而GBE50能够改善血瘀证大鼠的心肌收缩性能。同时,还观察到GBE50可降低血瘀证模型大鼠的死亡率。
随着血瘀证炎症反应学说的提出,TNF-α作为炎症反应的启动因子和关键促炎因子日益受到重视。有学者认为TNF-α可视为血瘀证发展过程中炎症反应和心功能之间的桥梁因子[3];血清TNF-α表达水平与左室舒张末容积、左室收缩末容积呈负相关,随心功能的恶化,其表达量升高[16]。本实验结果表明,血瘀证大鼠心肌组织TNF-α表达增加,但是GBE50组TNF-α水平增加更明显,基因表达也有所升高。有研究表明,TNF-α在心肌缺血/再灌注损伤中具有“双刃剑”作用,即TNF-α可通过与不同的受体结合,介导不同的信号转导通路,对心肌具有损伤或保护作用[17]。
TNF-α通过与细胞表面的受体结合实现生物学功能,其受体有TNFR1(55 kD)和TNFR2(75 kD)2种类型[18]。TNFR1含有一个约80个氨基酸残基组成的死亡结构域(DD),DD是介导抗病毒活性和细胞死亡以及激活核因子-κB所必需的,TNFR1及其下游信号转导通路激活将引起细胞应激与炎性反应,导致细胞凋亡甚至死亡;而TNFR2不含DD,其激活引起的细胞内生存信号转导通路的激活可对细胞产生保护作用,包括促进心肌细胞钙转运而增强其收缩功能、抑制心肌细胞凋亡、减缓再灌注心肌的纤维化、激活心肌中干细胞以修复心肌损伤等[19]。故TNFR1和TNFR2激活不同的信号通路,对心肌产生不同的生物学效应[20]。本实验观察到GBE50增加心肌组织TNF-α表达后,进一步检测其2种受体的基因与蛋白表达,结果显示,GBE50能明显增加血瘀证大鼠心肌组织TNFR2的基因与蛋白表达,结合血流动力学指标变化,提示GBE50通过调控TNF-α-TNFR2通路对血瘀证大鼠起心肌保护作用。免疫组化结果显示,GBE50组TNFR1蛋白表达也明显高于正常组和模型组,但阳性面积主要在血管周围,心肌的阳性表达少,故GBE50对TNFR1的作用仍有待明确。
综上所述,本实验观察到,GBE50可改善急性血瘀证大鼠血流动力学,降低动物死亡率,并且可能是通过上调TNFR2表达,及TNF-α-TNFR2通路发挥保护心肌作用。
[1] 李林森,田金洲,蔡艺灵,等.血瘀证生物学基础研究进展[J].山东中医杂志,2010,29(12):863-865.
[2] 龙卫平,石磊,韦爱欢,等.冠心病中医辨证分型与内皮损伤、炎症反应及血小板活化的相关性研究[J].广州中医药大学学报,2008,25(5):457-460.
[3] 王勇,郭淑贞,李春,等.小型猪血瘀证模型炎症因子与心功能[J].中华中医药杂志,2010,25(10):1563-1565.
[4] 丘创华,侯敢,黄迪南.TNF-α信号传导通路的分子机理[J].中国生物化学与分子生物学报,2007,23(6):430-435.
[5] LIU A H, AO Y M, WANG X Y, et al. Cardio-protection by Ginkgo biloba extract 50 in rats with acute myocardial infarction is related to Na+-Ca2+exchanger[J]. Am J Chin Med,2013,41(4):789-800.
[6] 王星禹,张志雄,刘爱华.银杏酮酯(GBE50)抗心律失常作用研究[J]. 中国中药杂志,2010,35(2):199-203.
[7] 包怡敏,张志雄.从心肌力学观察银杏酮酯抗心肌缺血再灌注损伤的作用[J].北京中医药大学学报,2010,33(1):28-32.
[8] 郝莉,贺改英,张志雄.银杏酮酯对小鼠学习记忆能力及海马神经炎症反应的影响[J].中国中医药信息杂志,2014,21(8):49-53.
[9] 包怡敏,赵妍,李梅,等.银杏酮酯对急性血瘀证大鼠血液流变学和免疫功能调控[J].中国中医基础医学杂志,2013,8(4):904-906.
[10] 夏趁意,董献文,赵妍,等.银杏酮酯对β-淀粉样蛋白诱导大鼠海马神经元氧化应激致细胞损伤影响的实验研究[J].中国中西医结合杂志, 2014,34(7):833-838.
[11] 包怡敏,刘爱华,张志雄,等.银杏酮酯预处理对心肌缺血再灌注大鼠心肌组织炎症相关细胞因子含量的影响[J].中西医结合学报,2010, 8(4):373-378.
[12] 夏趁意,赵妍,徐颖,等.银杏酮酯抑制β-淀粉样蛋白诱导海马神经元细胞凋亡的研究[J].中华中医药杂志,2014,29(6):2030-2034.
[13] 李伟霞,唐于平,郭建明,等.比较评价当归川芎配伍对急性血瘀大鼠血液流变学及凝血功能的影响[J].中国中西医结合杂志,2012,32(6):806-811.
[14] 何少玲,张荣,赵威,等.陈皮、姜提取物对血瘀证大鼠血液流变学和血小板聚集率的影响[J].中药药理与临床,2012,28(1):11-13.
[15] 梁耀月,李佳佳,董世芬,等.三种不同血瘀证动物模型的建立与评价[J].中国药理学通报,2016,32(10):1468-1473.
[16] 许文玉,王伟,刘蕾,等.慢性心肌缺血血瘀证模型小型猪TXB2、6-K-PGF1α与心功能的变化及其相关性研究[J].吉林中医药,2008, 28(1):62-64.
[17] SCHULZ R, HEUSCH G. Tumor necrosis factor-α and its receptors 1 and 2:yin and yang in myocardial infarction?[J]. Circulation, 2009,119(10):1355-1357.
[18] 徐洁,姚红兵.TNF-α信号传导通路的研究现状[J].泸州医学院学报,2007,30(2):156-158.
[19] 王艺璇,余志斌.TNFα在心肌缺血/再灌注重塑期的保护作用[J]. 心脏杂志,2014,26(3):357-360,365.
[20]KISHORE R, TKEBUCHAVA T, SASI S P, et al. Tumor necrosis factor-α signaling via TNFR1/p55 is deleterious whereas TNFR2/ p75 signaling is protective in adult infarct myocardium[J]. Adv Exp Med Biol,2011,691:433-448.
Effects of GBE50 on Hemodynamics and TNF-α Pathway in Myocardial Tissue of Rats with Acute Blood Stasis Syndrome
JIANG Li, YANG Zi-ping, BAO Yi-min
To observe the effects of Ginkgo biloba extract 50 (GBE50) on hemodynamics and myocardial tissue TNF-α pathway in rats with acute blood stasis syndrome; To discuss its mechanism of action.A model of acute blood stasis syndrome was established by subcutaneous injection of epinephrine hydrochloride and ice bath. Male SD rats were divided randomly into normal group, model group and GBE50 group. After medicine was administrated by gavage for 11 days, the acute blood stasis model was established. The hemodynamic changes were observed in the next day. The expressions of TNF-α, TNFR1 and TNFR2 mRNA were detected by RT-PCR. The expressions of TNF-α, TNFR1 and TNFR2 protein were tested by radioimmunoassay and immunohistochemistry.The hemodynamics of the model group was lower than that of the normal group. Compared with model group, GBE50 could increase mLVSP, DP and decrease t-dp/dtmax(<0.05). The protein expressions of TNF-α, TNFR1, and TNFR2 in GBE50 group were higher than those in model group, and TNFR2 mRNA expression increased significantly in GBE50 group (<0.05).GBE50 can ameliorate the decline of hemodynamics of rats with acute blood stasis syndrome, and regulate the myocardial TNF-α pathway. Increasing the expression of protective receptor TNFR2 may be one of the mechanisms of protecting cardiac function.
Ginkgo biloba extract 50; blood stasis syndrome; hemodynamics; TNF-α; TNF receptor; rats
10.3969/j.issn.1005-5304.2017.11.009
R285.5
A
1005-5304(2017)11-0034-05
(2017-04-12)
(2017-04-28;编辑:华强)
国家自然科学基金(81303256)
包怡敏,E-mail:yiminbao@163.com

