藤三七皂苷组分对代谢综合征小鼠及其肠道菌群的调节作用
刘 敏,陈奇超,李玲铭,张彩华,王君德,李华军
(1.大连医科大学 2013级七年制,辽宁 大连 116044;2.大连医科大学,辽宁 大连 116044;3.大连医科大学 微生态学教研室,辽宁 大连 116044)
辽宁省科学技术计划项目(2015020271);大连市科技计划项目(2015E12SF171)
刘 敏(1993-),女,本科生。E-mail:DMUliumin@163.com
李华军,副教授。E-mail:lhjcmu@hotmail.com
论著
10.11724/jdmu.2017.05.03
藤三七皂苷组分对代谢综合征小鼠及其肠道菌群的调节作用
刘 敏1,陈奇超2,李玲铭2,张彩华2,王君德2,李华军3
(1.大连医科大学 2013级七年制,辽宁 大连 116044;2.大连医科大学,辽宁 大连 116044;3.大连医科大学 微生态学教研室,辽宁 大连 116044)
目的研究藤三七皂苷组分对代谢综合征小鼠及其肠道菌群的调节作用。方法45只雄性BALB/c小鼠随机分为对照组、模型组和藤三七皂苷组(n=15)。采用高脂饮食建立代谢综合征小鼠模型,对照组小鼠用普通饲料喂养,模型组小鼠饲以高脂饲料,藤三七皂苷组高脂饲料饲喂同时用100 mg/(kg·d)藤三七皂苷灌胃液灌胃。每周测体重,第2、4、6周每组随机处理3只小鼠,第8周每组处理6只小鼠。以体重、肝脏与附睾脂肪系数、血脂等指标,观察皂苷的作用。并采用16S rRNA高通量测序法分析小鼠肠道菌群。结果第8周,模型组体重(36.36±2.44)g明显高于对照组(29.33±1.89)g(P<0.05);模型组体重增量(14.86±3.66)g明显高于对照组(8.41±1.83)g和藤三七皂苷组(9.70±1.55)g(均P<0.05)。第8周,模型组附睾脂肪系数(4.18±0.97)%明显高于对照组(2.29±0.69)%(P<0.05),也高于藤三七皂苷组(3.65±0.81)%,但差异无统计学意义(P>0.05)。第6周,模型组血清总胆固醇(TC)(7.13±0.67)mmol/L明显高于对照组(4.81±0.55)mmol/L(P<0.05),也高于藤三七皂苷组(5.38±0.15)mmol/L,但差异无统计学意义(P>0.05);第8周,模型组TC(7.20±0.35)mmol/L明显高于对照组(4.23±0.46)mmol/L和藤三七皂苷组TC(6.12±0.33)mmol/L(均P<0.05)。第6周,模型组血清低密度脂蛋白(LDL)(1.62±0.19)mmol/L明显高于对照组(1.03±0.32)mmol/L和藤三七皂苷组(1.06±0.18)mmol/L(均P<0.05);第8周模型组LDL(1.56±0.67)mmol/L显著高于对照组(0.57±0.30)mmol/L和藤三七皂苷组LDL(0.68±0.07)mmol/L(均P<0.05)。藤三七皂苷组与模型组相比,肠道嗜胆菌(Bilophila)、葡萄球菌(Staphlococcus)、乳球菌(Lactococcus)、Ruminococcaceae、Anaerotruncus丰度降低,Allobaculum、Alloprevotella丰度升高。结论藤三七皂苷组分对代谢综合征小鼠有一定的减肥及降脂作用,并能改善肠道菌群。
藤三七;皂苷;代谢综合征;肠道菌群
由于生活方式、饮食结构的改变,代谢综合征已成为世界范围的公共卫生问题。从1992年到2002年,我国代谢综合征患者迅速增多,10年间代谢综合征率增加了80.6%[1]。代谢综合征是高血压、冠心病、脑卒中、糖尿病、血脂异常等多种疾病的危险因素。人体胃肠道中微生物种类繁多且数量巨大,达到1014个,重量约1.27 kg,相当于人体肝脏的重量,人体正常微生物群的数量大约是人体体细胞数(1013)的10倍[2]。在机体微生态平衡状态下,人体肠道正常微生物对机体的营养代谢、免疫等发挥重要生理学作用。肠道微生物与宿主代谢有密切联系[3]。
近年来,植物来源天然化合物因其高效、低毒的特点而备受研究者的青睐。藤三七又名豆腐菜,为多年生藤本植物。块茎口味好,含有丰富维生素A和维生素C。有滋补、消散痰、活血、健胃保肝等作用。皂苷对反刍动物瘤胃发酵有一定的调控能力,同时可调节血糖,并对瘤胃内的发酵活性和微生物群有调整作用。我们的前期研究发现藤三七皂苷组分对高糖饮食小鼠肠道菌群和血糖有恢复作用。本课题从微生态学理论出发,检测藤三七皂苷组分对代谢综合征小鼠的血脂及其肠道菌群的调节作用,为代谢综合征防治方法提供新的科学依据。
1 材料和方法
1.1 动物与材料
18~22 g SPF级健康雄性BALB/c小鼠45只,由大连医科大学实验动物中心提供。高脂饲料(D12492, Research Diets Inc, New Brunswick, 美国)。藤三七皂苷提取物(西安斯诺特生物技术有限公司);总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)试剂盒(南京建成生物工程研究所)。粪便DNA提取试剂盒(OMEGA)。
1.2 实验仪器
冷冻离心机(Sorvall Legend Micro-21R,美国,Thermo);酶标仪(Multiskan Ascen,美国,Thermo);-80 ℃冰箱(美国,Thermo);制冰机(日本,SANYO)。
1.3 动物处理
小鼠在实验环境(实验室温度为22~25 ℃,湿度50%~60%,光照为12 h明/12 h暗)下适应7 d。随后将小鼠随机分为对照组、模型组和藤三七皂苷组,每组15只。3组体重差异无统计学意义,P>0.05。对照组小鼠用普通饲料喂养,模型组小鼠饲以高脂饲料,藤三七皂苷组高脂饲料饲喂同时用100 mg/(kg·d)藤三七皂苷灌胃液灌胃。每周测体重,第2、4、6周每组随机处理3只小鼠,第8周每组处理6只小鼠。
1.4 血清采集
第2、4、6、8周小鼠禁食14 h,摘取眼球法采血约2 mL,37 ℃孵箱中孵育30 min,冷冻离心机3000 r/min离心10 min获取血清,分装并保存于-80 ℃冰箱,用于后续检测TC、TG、HDL-C和LDL-C。
1.5 肝脏脏器系数与附睾脂肪系数检测
第8周,小鼠处死后取出肝脏和两侧附睾脂肪称重,计算小鼠肝脏脏器系数与附睾脂肪系数[4]。附睾脂肪系数(%)=附睾脂肪重量(g)/小鼠体重(g)×100%;肝脏系数(%)=肝脏重量(g)/小鼠体重(g)×100%。
1.6 血脂分析
酶标仪比色法测定血清TG、TC、HDL-C和LDL-C含量,按照试剂盒说明书进行操作。
1.7 16s rRNA高通量测序分析小鼠肠道菌群
第8周处死小鼠后,收集肠内容物,保存于-80 ℃冰箱。用E.Z.N.A®Stool DNA Kit(OMEGA)试剂盒提取粪便细菌基因组DNA,于-80 ℃保存备用。模板 DNA 各40 μL,干冰条件下运送至检测机构(北京诺禾致源生物信息科技有限公司)。利用特异性引物进行PCR扩增,该实验过程及后续检测分析过程均委托公司。根据PCR产物浓度进行等量混样,充分混匀后检测 PCR产物,对目的条带进行胶回收纯化。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500 PE250进行上机测序。基于Illumina HiSeq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。通过对Reads拼接过滤,OTUs(Operational Taxonomic Units)聚类,并进行物种注释及丰度分析,α多样性分析(Alpha Diversity),β多样性分析(Beta Diversity)。
1.8 统计学方法
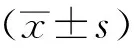
2 结 果
2.1 体重和脏器系数
第8周,模型组体重显著高于对照组(P<0.05),藤三七皂苷组体重低于模型组,差异无统计学意义(P>0.05)。模型组体重增量显著高于对照组(P<0.05),藤三七皂苷组体重增量显著低于模型组(P<0.05)。见图1。
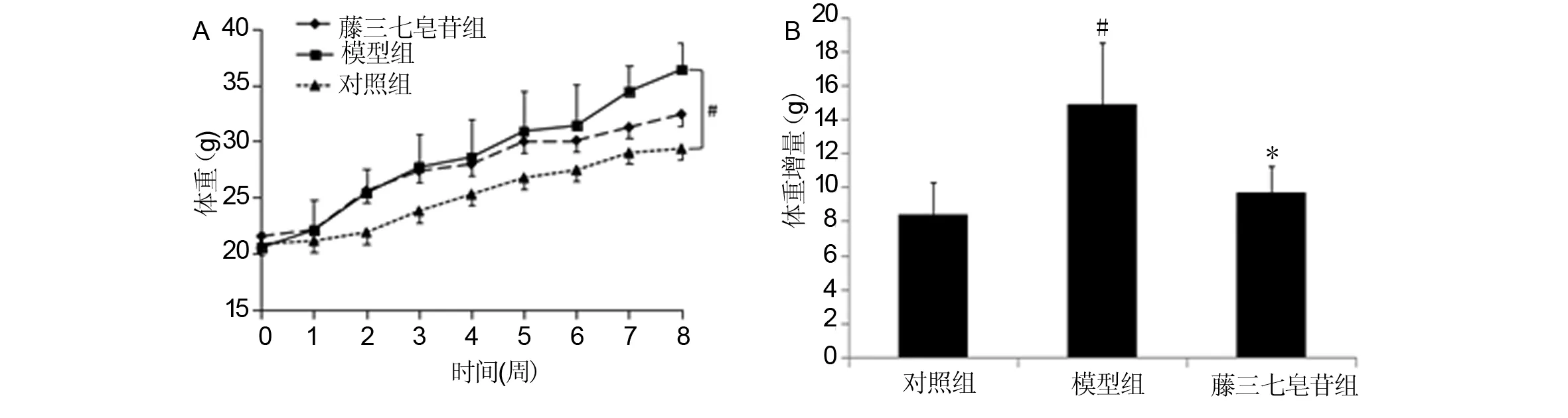
A:体重;B:体重增量#与对照组比较,P<0.05;*与模型组比较,P<0.05图1 小鼠体重与体重增量 Fig 1 Body weight and body weight gain
第8周,模型组肝脏系数高于对照组(P>0.05),藤三七皂苷组肝脏系数低于模型组,差异无统计学意义(P>0.05)。模型组附睾脂肪系数显著高于对照组(P<0.05),藤三七皂苷组附睾脂肪系数低于模型组,差异无统计学意义(P>0.05)。见表1。

表1 小鼠脏器系数
1)与对照组比较,P<0.05
2.2 血脂分析
TG结果显示:第2、4、6周组间差别不显著(P>0.05);第8周模型组TG低于对照组(P>0.05),藤三七皂苷组TG显著低于模型组(P<0.05)。TC结果显示:第2、4周组间差别不显著(P>0.05);第6周模型组TC明显高于对照组(P<0.05),也高于藤三七皂苷组,但差异无统计学意义(P>0.05);第8周模型组TC明显高于对照组和藤三七皂苷组(均P<0.05)。HDL结果显示:第2、4、6、8周组间差别不显著(P>0.05)。LDL结果显示:第2、4周组间差别不显著(P>0.05);第6、8周模型组LDL明显高于对照组和藤三七皂苷组(均P<0.05)。见表2。
2.3 小鼠肠道菌群属水平分析
第8周,在属水平,与对照组比较,模型组小鼠肠道菌群中嗜胆菌(Bilophila)、葡萄球菌(Staphlococcus)、乳球菌(Lactococcus)、Ruminococcaceae、Anaerotruncus丰度增加,藤三七皂苷组较模型组丰度降低;与对照组相比,模型组Allobaculum、Alloprevotella丰度降低,而藤三七皂苷组则较模型组升高。见图2。
3 讨 论
代谢综合征及与之相关的疾病发病率在全球日益攀升,已经成为严重影响人类健康的重要危险因素。研究表明饮食习惯和生活方式与代谢综合征密切相关[5]。高脂饮食是导致代谢综合征发生的重要因素,代谢综合征者一般都伴有脂代谢紊乱,易诱发心血管疾病[6]。目前研究普遍认为血浆TC、TG和LDL-C水平升高是动脉粥样硬化的危险因素,而血浆HDL-C水平升高则是其保护因素[7]。本研究结果表明采用高脂饲料饲喂BALB/c小鼠制造代谢综合征模型,模型组小鼠较正常饮食对照组TC和LDL水平升高。
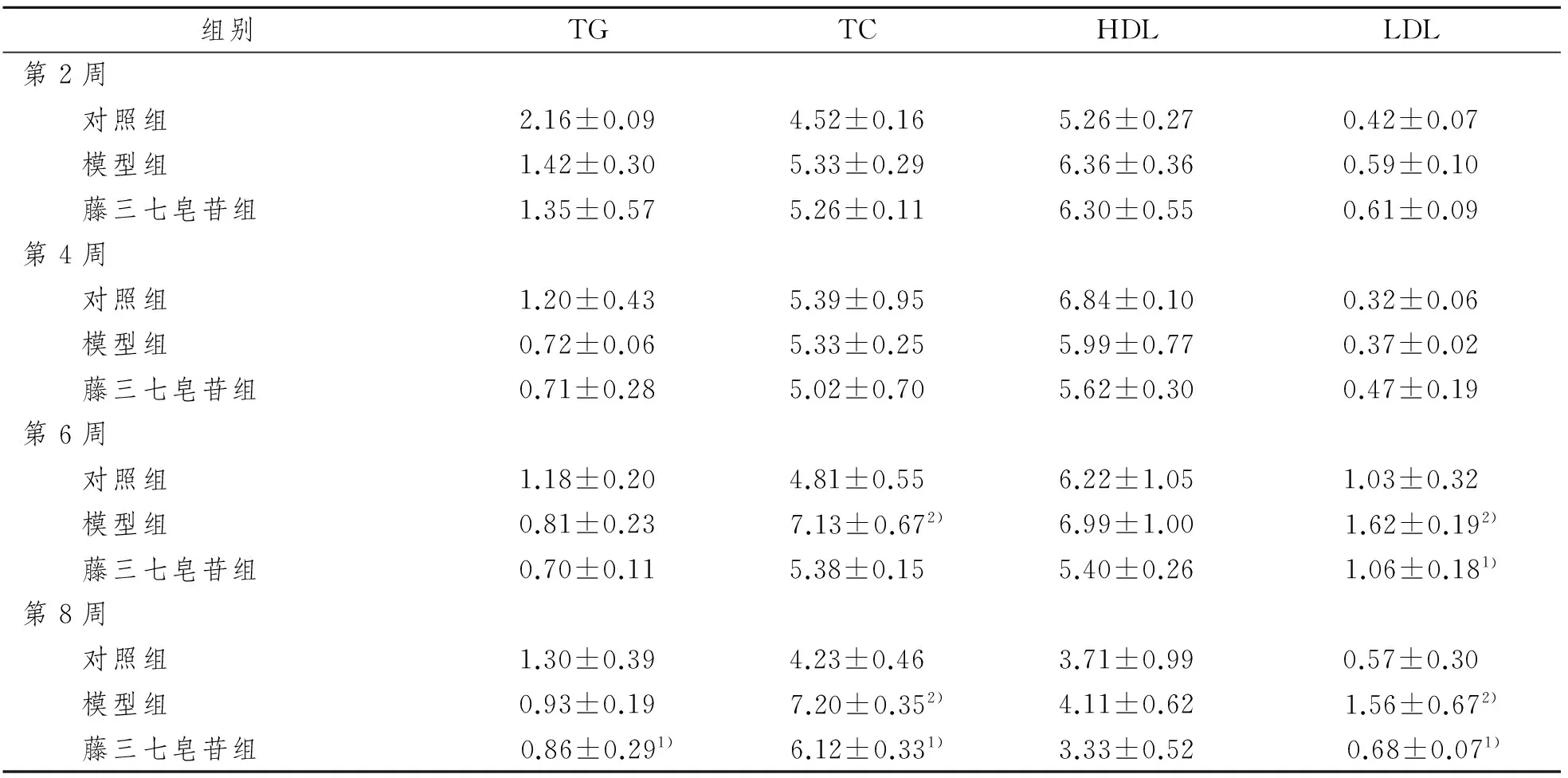
表2 小鼠血清生化指标
1)与模型组比较,P<0.05;2)与对照组比较,P<0.05
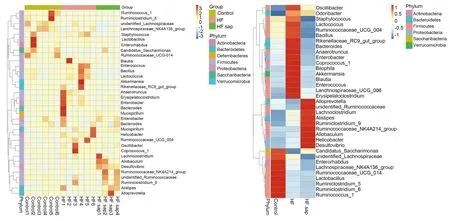
Control: 对照组;HF: 模型组;HF.sap: 藤三七皂苷组图2 小鼠肠道菌群属水平热图Fig 2 Heat map of RDA-identified key OTUs responding to gut microbiota at the genus level
皂苷作为一种天然化合物广泛存在于多种植物中,具有抗炎镇痛[8]、心血管保护[9]、抗癌等生理活性作用。本研究利用药食植物藤三七中皂苷有效成分,检测其对代谢综合征小鼠代谢及肠道菌群的调节作用。研究结果显示与模型组比,藤三七皂苷组小鼠体重、体重增量、肝脏指数、血清总胆固醇及血清低密度脂蛋白胆固醇(LDL-C)均降低。
肠道菌群对人体健康发挥重要作用,疾病状态下肠道菌群发生变化。Bilophila wadsworthia在正常人群肠道中保持低丰度,在某些病理情况如结肠炎和其他炎症性疾病中增加[10]。Zhang X等[11]研究发现,高脂饮食降低大鼠肠道菌群多样性和葡萄球菌(Staphlococcus)、 Allobaculum的丰度。有研究表明,Allobaculum改善代谢综合征并可以预防硫酸葡聚糖所致炎症反应[12-13]。Alloprevotella是可以产短链挥发性脂肪酸(SCFA)菌,其丰度与代谢综合征、糖尿病和代谢综合征负相关[14-15]。本研究表明,藤三七皂苷处理组与高脂饮食模型组相比,小鼠肠道菌群分析显示皂苷改善了高脂饮食造成的小鼠肠道细菌紊乱。肠道菌群中嗜胆菌(Bilophila)、Staphylococcus丰度降低, Allobaculum、Alloprevotella丰度增加。
综上所述,藤三七皂苷组分可以降低小鼠代谢综合征模型体重、体重增量、肝脏指数,改善血脂,并能调节肠道菌群,从而有利于代谢综合征的防治。
[1] 马冠生.中国学龄儿童少年营养与健康状况调查报告[M].中国人口出版社,2006.
[2] 康白,李华军. 微生态学现代原理与应用[M].上海科学技术出版社,2013.
[3] Nicholson JK HE, Holmes E,Kinross J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336(6086): 1262-1267.
[4] 陈粉粉,郭爱伟,周杰珑,等. ICR小鼠代谢综合征模型的建立以及代谢综合征指标和脂肪组织形态学比较 [J].安徽农业科学,2012,40(5): 2720-2723.
[5] Conlon MA, Bird AR. The Impact of Diet and Lifestyle on Gut Microbiota and Human Health[J]. Nutrients, 2015,7(1): 17-44.
[6] 陈永红,邹志飞,许崇飞,等.消脂纤维减肥作用的动物实验研究 [J].中国实验动物学杂志,2001,11(3):149-152.
[7] 储智勇,毛俊琴,李铁军,等.贻贝多糖对大鼠高脂血症的影响[J].解放军药学学报,2008,24(3):78-80.
[8] 焦爱军,李振彬,李广,等.三七总皂苷联合雷公藤多苷对关节炎大鼠外周血 TNF-α、IL-6、MCP-1 以及胸主动脉 MCP-1 表达的影响 [J].现代中西医结合杂志,2016,(7): 712-715.
[9] 李振彬,焦爱军,刘文萍,等.三七总皂苷配伍雷公藤多苷对胶原诱导关节炎大鼠心血管损伤的保护作用 [J].解放军医药杂志,2015, 27(1): 52-55.
[10] Zinkevich V, Beech IB.Screening of sulfate-reducing bacteria in colonoscopy samples from healthy and colitic human gut mucosa[J]. FEMS Microbiol Ecol, 2000, 34(2): 147-155.
[11] Zhang X,Zhao Y,Zhang M,et al. Structural Changes of Gut Microbiota during Berberine-Mediated Prevention of Obesity and Insulin Resistance in high-fat Diet-fed rats[J]. PLoS One, 2012, 7(8): e42529.
[12] Zhang C,Zhang M,Wang S,et al. Interactions between gut microbiota, host genetics and diet relevant to development of metabolic syndromes in mice[J]. ISME J, 2010, 4(2): 232-241.
[13] Le Roy T,Llopis M,Lepage P,et al. Intestinal microbiota determines development of non-alcoholic fatty liver disease in mice[J]. Gut,2012, 62(12): 1787-1794.
[14] Schwiertz A,Taras D,Schäfer K,et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obesity, 2010, 18(1): 190-195.
[15] Zhang X,Zhao Y,Xu J,et al. Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats[J]. Sci Reports, 2015, 5(6): 14405.
EffectsofBoussingaultiaSaponinsonmetabolicsyndromeandgutmicrobiotainmice
LIU Min1,CHEN Qichao2,LI Lingming2,ZHANG Caihua2,WANG Junde2,LI Huajun3
(1.SevenYearSystem2013,DalianMedicalUniversity,Dalian116044,China;2.DalianMedicalUniversity,Dalian116044,China;3.DepartmentofMicroecology,DalianMedicalUniversity,Dalian116044,China)
ObjectiveTo study the effects of saponins on metabolic syndrome and gut microbiota in mice.MethodsForty-five male BALB/c mice were evenly divided into the model group, saponins group and control group. Mice in the model group and saponins group were fed with high-fat diet, and mice in the saponins group was simultaneously gavaged with saponins [100 mg/(kg·d)]. Three mice from each group were sacrificed every two weeks (six mice per group at the end of the eighth week). The effects of saponins were observed by weight, liver coefficient, epididymal fat tissue coefficient and blood lipids. And the gut microbiota was analyzed by 16S rRNA high throughput sequencing.ResultsAt the end of week 8, the weight of mice in model group increased more than that in saponins group and control group (P<0.05). The epididymal fat tissue coefficient in model group (4.18±0.97) % increased more than the control group (2.29±0.69) % (P<0.05), while decreased in saponins group (3.65±0.81) % (P>0.05). At the end of week 6, blood TC and LDL in saponins group increased significantly less than those in model group, though more than those in control group. The abundance of Bilophila, Staphlococcus, Lactococcus, Ruminococcaceae and Anaerotruncus decreased in saponins group compared with model group, but the abundance of Allobaculum and Alloprevotella increased.ConclusionSaponins could play a role in lower the levels of weight gain and blood lipids in metabolic syndrome mice by adjusting the gut microbiota.
Boussingaultia; Saponins; metabolic syndrome; gut microbiota
R378
A
1671-7295(2017)05-0428-05
刘敏,陈奇超,李玲铭,等.藤三七皂苷组分对代谢综合征小鼠及其肠道菌群的调节作用[J].大连医科大学学报,2017,39(5):428-432.
2017-05-31;
2017-09-25)

