仿生矿化PLGA/MWNTs/HA引导组织再生膜的细胞相容性研究
张华林 王凯戎 马海绒
(宁夏医科大学口腔医学院,宁夏银川750004)
·论 著·
仿生矿化PLGA/MWNTs/HA引导组织再生膜的细胞相容性研究
张华林 王凯戎 马海绒
(宁夏医科大学口腔医学院,宁夏银川750004)
目的 通过仿生矿化的方法制备PLGA/MWNTs/HA牙周引导组织再生膜并对其细胞相容性进行表征。方法 先将聚乳酸-羟基乙酸共聚物[Poly(lactic-co-glycolic acid),PLGA]与多壁碳纳米管(Multi-walled carbon nanotubes,MWNTs)复合,采用溶液浇铸法制备PLGA/MWNTs复合膜;再将其仿生矿化,制得PLGA/MWNTs/羟基磷灰石(Hydroxyapatite,HA)复合膜,再将人牙周膜干细胞接种于PLGA/MWNTs/HA复合膜上培养,采用扫描电子显微镜(Scanning electron microscope,SEM)观察细胞在复合膜上的形貌,四甲基偶氮唑蓝(MTT)法分析细胞的增殖情况。结果 PLGA/MWNTs复合膜表面比较均匀、致密;矿化7天后,PLGA/MWNTs复合膜表面有磷灰石晶体形成;人牙周膜干细胞在PLGA/MWNTs/HA复合膜表面生长、增殖良好,HA的加入有利于细胞的粘附和生长。结论 通过仿生矿化法制得的PLGA/MWNTs/HA复合膜具有良好的细胞相容性,有望在牙周引导组织再生领域发挥作用。
仿生矿化;PLGA/MWNTs/HA;引导组织再生膜;细胞相容性
目前,牙周病在世界范围内患病率较高,严重影响人的口腔健康和生活质量[1]。传统的牙周病治疗方法包括刮治术、根面平整、翻瓣术等,主要目的是去除感染、阻止病变进展,却无法实现牙周组织的再生[2]。因此,重建已丧失的牙周组织的结构和功能是目前口腔医学领域所面临的热点、难点问题。
20世纪80年代初由Nyman等提出的引导组织再生(Guided tissue regeneration,GTR)为牙周组织的再生提供了可能。它是指在龈瓣与根骨面之间放置一种屏障膜,以阻挡牙龈上皮、结缔组织与根面接触,而使具有形成新附着能力的牙周膜前体细胞在愈合过程中沿着根面生长,重新形成牙骨质、牙槽骨以及牙周纤维,建立新附着,进而达到牙周组织再生[3]。在GTR中,GTR膜是决定其手术效果的关键因素之一。
聚乳酸-羟基乙酸共聚物[Poly(lactic-co-glycolic acid),PLGA]和多壁碳纳米管(Multi-walled carbon nanotubes,MWNTs)这两种生物材料目前在组织工程领域被广泛应用。可降解高分子聚合物PLGA,具备很好的组织相容性、力学性能和降解性能。MWNTs同时具备高强度、高弹性和高刚度,其超强的力学性能可以极大地改善复合材料的强度和韧性;另一方面,MWNTs在与血液、骨、软骨和软组织接触时,表现出了良好的生物相容性[4]。但这两种材料均缺乏骨诱导性,而仿生矿化法可以改善此缺点。
本研究将溶液浇铸法制得的PLGA/MWNTs复合膜进行仿生矿化,制备一种PLGA/MWNTs/HA引导组织再生膜,并研究其细胞相容性,可望得到一种新型的引导组织再生膜,为牙周引导组织再生膜的开发提供基础研究。
1 材料与方法
1.1 PLGA/MWNTs复合膜的制备:取PLGA 2 g,溶于20 mL的三氯甲烷和N,N-二甲基甲酰胺的混合溶剂中,待PLGA完全溶解后加入0.2 gMWNTs,充分搅拌30 min后,超声震荡60 min使MWNTs分散均匀,然后将混合溶液倒入聚四氟乙烯皿后静置于通风橱中,48 h后揭膜。
1.2 过饱和矿化液(SCS)的配置:过饱和矿化溶液按 Li F 的配方由 CaC12、NaH2PO4、NaHCO3配制[5]。三种化合物使用前按比例混合,配成SCS矿化液,pH值为5.96。
1.3 PLGA/MWNTs复合膜的仿生矿化:将干燥的PLGA/MWNTs复合膜浸泡于37℃的恒温SCS矿化液中,矿化时间为7 d,得到PLGA/MWNTs/HA复合膜。矿化结束后,样品用蒸馏水漂洗,自然干燥。
1.4 PLGA/MWNTs/HA复合膜的表征:采用扫描电子显微镜(SEM)观察膜及沉积物的表面形貌;采用X射线能量色散谱仪(EDX)检测沉积物的元素种类和比例。
1.5 人牙周膜干细胞的分离与培养:收集临床正畸拔除的双尖牙,年龄12~16岁,所选牙齿均无龋坏、根尖周疾病及牙周炎。拔牙前彻底消毒术区。拔除后将牙齿立即投入DMEM培养液中,用生理盐水(含青霉素 500 μ/mL,链霉素 500 μg/mL)反复浸洗灭菌后,将牙齿移入另一无菌培养皿中,仔细刮取根中1/3的牙周膜组织。将组织块以均匀间距接种于25 mL培养瓶中,加入5 mLDMEM培养液(含20%胎牛血清,青霉素100 μ/mL,链霉素100 μg/mL),将培养瓶置于37℃含5%CO2饱和湿度的培养箱中恒温培养,观察细胞游出情况,待细胞爬满瓶底时,更换液体去除组织块,每3 d更换一次培养基。待贴壁细胞接近铺满瓶底时,0.5%胰蛋白酶消化,按1:2或1:3比例传代培养。
1.6 细胞形貌观察:将实验组(PLGA/MWNTs/HA复合膜)和对照组(PLGA/MWNTs复合膜)的样品置于6孔板内,加入DMEM培养基,然后将培养的细胞以1×105个/mL的密度接种于放有样品的培养板内,在倒置相差显微镜下观察样本侧壁及周边细胞的生长,在培养48h后,从各组分别取出一块材料,PBS漂洗3遍,2.5%戊二醛固定过夜,乙醇梯度脱水,干燥、喷金后扫描电镜观察细胞形态。
1.7 细胞增殖情况测定:将培养的细胞以1×105个/mL的密度接种于放有样品的培养板内,分别在第 1、3、5、7 天取每组试样加入 MTT5 mg/mL 溶液40 μL,37℃下继续培养 4 h,终止培养,小心吸弃孔内的上清液,每孔加入420 μL的二甲基亚砜(DMSO),振荡10 min,使结晶物充分溶解。吸取每孔中液体100 mL到96孔板内,492 nm波长,在酶联免疫检测仪上测定各孔吸光度值,记录结果。
1.8 统计学处理:采用SPSS 17.0统计软件进行分析,计量资料用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 PLGA/MWNTs复合膜、PLGA/MWNTs/HA复合膜的SEM观察:PLGA/MWNTs复合膜上方有均匀分布的成簇的结晶矿化物出现,覆盖复合膜面积的40%~50%。高倍镜下,可以看到有的矿化物为小球形;有的为盛开的花朵状。“花朵”中的单个晶体呈叶片状,错落有致,相互交织成丛,详见图1。

图1 PLGA/MWNTs复合膜、PLGA/MWNTs/HA复合膜的SEM图注:(a)PLGA/MWNTs复合膜(×5000);(b)PLGA/MWNTs复合膜(×100000;(c)矿化后的 PLGA/MWNTs/HA 复合膜(×50);(d)矿化后的 PLGA/MWNTs/HA复合膜(×500)
2.2 矿化膜的EDX分析采用EDX对矿化的沉积物进行检测:沉积物以钙、磷元素为主,Ca/P=1.58,接近羟基磷灰石的Ca/P理论值1.67,详见图2。
2.3 人牙周膜成纤维细胞的生长和形态观察:细胞多呈长梭形,间隙狭窄,紧密排列成束,呈漩涡状外观,详见图3。
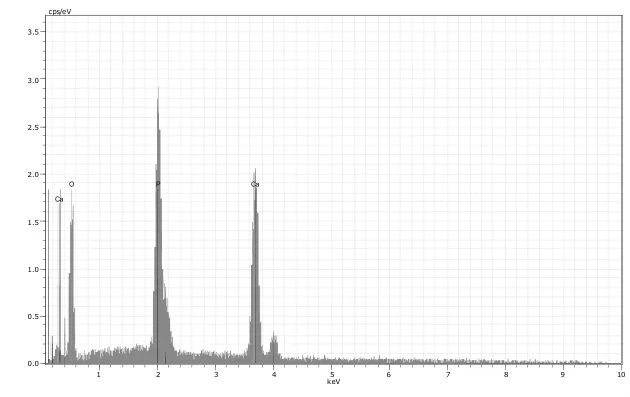
图2 PLGA/MWNTs复合膜矿化7 d后矿化物的EDX图
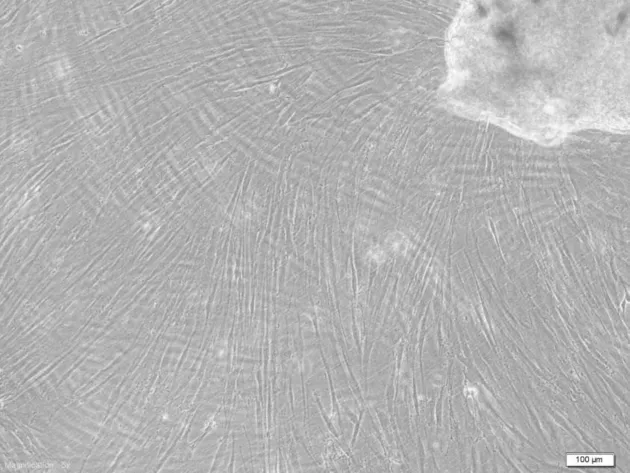
图3 组织块法培养21 d的牙周膜干细胞的生长情况(×50)
2.4 细胞与复合膜共培养SEM观察:培养48 h后,在PLGA/MWNTs复合膜表面,黏附细胞数量较少,部分细胞体呈多边形,部分细胞体呈细长梭形,面积较小,表明部分细胞尚未发生铺展。在PLGA/MWNTs/HA复合膜表面,细胞数量明显较PLGA/MWNTs组多,细胞分布均匀,大部分细胞己经铺展呈多边形,部分细胞黏附于矿化物表面。结果表明,矿化后的PLGA/MWNTs/HA复合膜更有利于细胞的初始黏附与生长,详见图4。

图4 人牙周膜干细胞在复合膜上培养48 h的SEM图注:(a)PLGA/MWNTs复合膜;(b)PLGA/MWNTs/HA 复合膜
2.5 细胞的增殖活性:两组细胞的数量都随培养时间的增加而增加。第1天、第3天、第5天和第7天,实验组细胞的数量比对照组都有显著的增加,均具有统计学意义(P<0.05)。这说明实验组细胞增殖的速度和活性明显高于对照组。这可能是因为实验组磷灰石矿化物增加了复合膜的亲水性和生物活性,因此,也促进了牙周膜干细胞早期的黏附和增殖,详见图5。
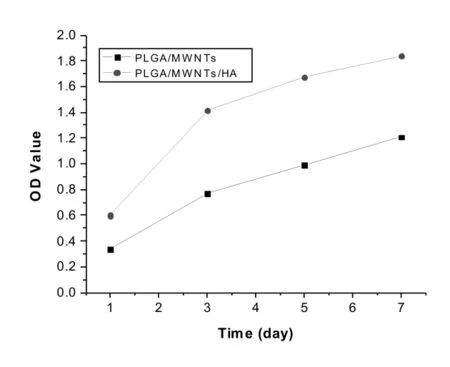
图5 牙周膜干细胞接种于实验组和对照组表面培养7 d的MTT图
3 讨论
本研究通过仿生矿化法对利用溶液浇铸法制得的PLGA/MWNTs复合膜进行仿生矿化,可制备得到PLGA/MWNTs/HA复合膜。其表面有均匀分布的成簇的结晶矿化物出现,矿化物以钙、磷元素为主,Ca/P=1.58。PLGA/MWNTs/HA复合膜对人牙周膜干细胞的黏附和增殖具有良好的作用。该矿化复合膜有可能作为牙周引导组织再生膜材料应用于牙周组织再生领域。
[1] Ramseier CA,Duong HY,Schmid E.Natural history of periodontitis[J].Current Oral Health Reports,2014,1(4):286-294.
[2] Kamoi K,Iino M,Ishiguro H.Regeneration therapy for oral disease[J].Human Cell,2006,19(2):76-82.
[3] Pontoriero R,Nyman S,Ericsson I,et al.Guided tissue regeneration in surgically-produced furcation defects.An experimental study in the beagle dog[J].Journal of Clinical Periodontology,1992,19(3):159-163.
[4] Zhang HL.Biomimetic synthesis ofpoly(lactic-co-glycolic acid)/multi-walled carbonnanotubes/apatitecomposite membranes[J].Express Polymer Letters,2012,6(8):620-628.
[5] Li F,Feng QL,Cui FZ,et al.Schubert H.A simple biomimetic method for calcium phosphate coating[J].Surface and Coatings Technology,2002,154(2):88-93.
Study on Cell Compatibility of BiomineralizedPLGA/MWNTs/HAGuided Tissue Regeneration Membrane
Zhang Hualin Wang Kairong Ma Hairong
(College of Stomatology,Ningxia Medical University,Yinchuan 750004,China)
Objective To prepare the PLGA/MWNTs/HA guided tissue regeneration membrane by biomimetic mineralization and study its cell biocompatibility.Methods The PLGA/MWNTs composite membrane was prepared by solvent casting method;then,the PLGA/MWNTs composite membrane was immersed in the biomimetic mineralization solution to prepare the PLGA/MWNTs/HA membrane;the human periodontal ligament stem cells were cultured on the PLGA/MWNTs/HA composite membrane.The morphology of the cells was observed by SEM and the proliferation of the cells was analyzed by MTT method.Results The surface of PLGA/MWNTs composite membranewas uniformand dense;after 7 days of mineralization,apatite crystals were formed on the surface of PLGA/MWNTs composite membrane;human periodontal ligament stem cells grew well on the surface of PLGA/MWNTs/HA composite membrane,and the addition of HA crystals was beneficial to cell adhesion and growth.Conclusion The PLGA/MWNTs/HA composite membrane prepared by biomimetic mineralization has good biocompatibility,which is expected to play a role in periodontal guided tissue regeneration.
Biomimetic mineralization;PLGA/MWNTs/HA;Guided tissue regeneration membrane;Cell compatibility
R781.4
A 学科分类代码: 32044
1001-8131(2017)05-0401-03
宁夏自然科学基金项目(NZ14063)
2017-05-18

