甲氰菊酯联合多巴胺对小鼠多巴胺能神经通路的影响
熊婧 胡丹 张振涛 张兆辉
国家自然科学基金青年基金项目(项目编号为81501107)
430060 武汉大学人民医院神经内一科[熊婧 胡丹 张振涛 张兆辉(通信作者)]
甲氰菊酯联合多巴胺对小鼠多巴胺能神经通路的影响
熊婧 胡丹 张振涛 张兆辉
目的观察甲氰菊酯(Fenpropathrin,Fen)单独腹腔注射及与多巴胺(Dopamine,DA)立体定向注射联合使用对C57BL小鼠黑质纹状体多巴胺能神经通路的影响。方法分别采用Fen腹腔注射、DA立体定向注射至纹状体及DA预处理联合Fen注射建立C57BL小鼠模型,观察小鼠行为学变化,HPLC检测脑组织内Fen的含量;激光共聚焦显微镜观察小鼠的黑质多巴胺能神经元及纹状体的TH染色。结果Fen及DA分别单独使用及DA预处理联合Fen注射均造成小鼠自主活动能力减少,HPLC检测显示小鼠脑组织中Fen的浓度与腹腔Fen给药浓度成正比,TH染色发现Fen连续使用7 d和DA立体定向注射后第7 d的小鼠黑质均出现神经元中TH表达不均一,并且纹状体出现斑片状的TH染色丢失,其中DA预处理后使用Fen注射7 d组改变最明显。结论Fen能够透过小鼠血脑屏障,可以直接作用于小鼠黑质纹状体多巴胺能系统,并且可以明显增强DA对黑质纹状体的损伤作用。
甲氰菊酯 帕金森病 多巴胺 酪氨酸羟化酶
甲氰菊酯(Fenpropathrin,Fen)是一种常用的拟除虫菊酯类农药,具有高效能、杀虫谱广、低残留等特点,近年来被广泛应用于家庭防蚊和农业除虫。Fen对高等动物的毒性中等,但在鱼类等水产生物中毒性可以蓄积,由于其在环境中半衰期较长,在河塘底泥中不易降解,因此Fen在我国已被禁用于水产业,然而仍有一些渔民将Fen用于池塘毒鱼。我们曾收治了1例42岁的帕金森病(Parkinson’s disease,PD)患者,该患者曾在发病前约1年有间断捡食鱼塘中Fen毒杀的濒死的鱼,该过程长达半年之久,后来逐渐表现出PD样症状。根据该患者独特的既往史,我们推测Fen很可能与其发病有关。前期研究发现Fen可以在体外模型中模拟PD的部分发病机制及病理学特点[1],本研究将进一步观察Fen对C57BL小鼠行为学及黑质纹状体多巴胺能神经通路的影响,以探明Fen与PD发病的相关性,为寻找PD新的病因提供依据。
1 材料与方法
1.1 主要的仪器与试剂
甲氰菊酯(Fenpropathrin,Fen)购于浙江省东阳市金鑫化学工业公司,纯度为92%;DA为盐酸多巴胺注射液,20 mg/2 mL,购自广州白云山明兴药业;兔抗酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体购自美国Abcam公司;异硫氰酸荧光素(FITC)标记羊抗兔荧光二抗、Hoechst 33258染料购自ProteinTech Group 公司;高效液相色谱仪(Agilent 120,美国),激光共聚焦显微镜(Zeiss公司,德国),大鼠脑立体定向仪购自瑞沃德生命科技有限公司;实验动物为健康雄性C57BL/6小鼠,体重18-22克,购自武汉大学动物实验中心。
1.2 实验分组与给药
本实验共分为7组,随机分为对照组、Fen 1 d组,Fen 7 d组, DA立体定向注射后2 d组,DA 预处理+Fen 1 d组,DA立体定向注射后8 d组和DA 预处理+Fen 7 d组。Fen给药方式为每日定时腹腔注射给药,给药剂量为47.8 mg·kg-1·d-1(0.2 LD50);DA给药方式为立体定向注射,剂量为20 μg,注射部位为小鼠右侧纹状体;DA预处理+Fen组为DA立体定向注射24 h后开始给予Fen腹腔注射。
1.3 HPLC检测脑组织中Fen含量
检测Fen 47.8 mg·kg-1·d-1(0.2 LD50)1 d组和Fen 95.6 mg·kg-1·d-1(0.4 LD50)1 d组中脑组织中Fen含量。小鼠于给药后24 h断头取脑、称重,并加入丙酮充分匀浆,随后加入石油醚、2%硫酸钠水溶液提取,之后干燥、吹干、净化后使用Agilent 1260检测仪检测,检测仪器类型为紫外(205 nm),色谱柱为Hypersil 4.6×200 mm(5 μm),柱温为25 ℃,流动相为85%甲醇+15%水,流量为1 mL/min,检测室温为17 ℃。计算方法:外标法定量,保留时间定性。当标准品与样品进样体积相同时,计算公式为R=(C*V)/W,R为组织中Fen含量(μg/g),C为样品浓度(μg/mL),W为标本重量(g)。
1.4 小鼠体重及行为学检测
小鼠于给药前及给药后每日相同时间测量体重,行为学检测包括小鼠总体行为学观察、爬杆实验及直立实验。爬杆实验:将小鼠放置于一根垂直于地面的长50 cm,粗1 cm的木杆顶上,其中杆顶固定有一个泡沫塑料小球,将小鼠双后肢置于球上,呈尾部向上、头部向下的姿势,让其爬下,然后记录小鼠从杆顶向下爬至两侧前肢均触及木杆底部平台的时间,如小鼠3 min内未爬下,时间记录为最长时间180 s。直立实验:将小鼠放入一个30 cm×30 cm×15 cm的有机玻璃盒,安静环境下让小鼠适应10 min,随后记录小鼠5 mim内自发站立的次数,分别记录5次,计算均值。
1.5 免疫荧光染色观察TH表达水平
用10%苯巴比妥钠麻醉小鼠后4%的多聚甲醛灌注固定,断头取脑后脑组织置于4%多聚甲醛中固定,随后使用蔗糖梯度脱水沉底,标本速冻后切片。冰冻切片使用0.1% Triton破膜,10%BSA室温封闭2 h,再滴加TH(1∶500)抗体4 ℃孵育过夜,常温下复温30 min,滴加相应FITC标记的羊抗兔抗体,37 ℃避光孵育1 h,Hoechst 33258室温染色,随后封片、固定,激光共聚焦显微镜下观察。
1.6 统计学处理
2 结 果
2.1 HPLC检测到小鼠脑组织中有Fen残留
HPLC检测发现Fen 47.8 mg/kg和Fen95.6 mg/kg腹腔注射24 h后小鼠脑组织中均有Fen残留,残留量分别为0.97 μ/g和1.63 μ/g,残留量与注射量成正比。
2.2 小鼠体重改变
Fen腹腔注射1 d及7 d组小鼠均未出现异常行为学变化,注射后小鼠摄食减少,体重进行性减轻,在前3 d明显,后来体重缓慢增加,与对照组体重增长速度比较有明显差异(P<0.05)。DA立体定向组,小鼠第2 d体重一过性下降,第3 d开始增长正常,与对照组比较无明显差异,而Fen+DA共同作用7 d组小鼠体重进行性下降,约到第4 d出现体重稳定,此后缓慢增长,体重增长速度与对照组比较,有明显差异(P<0.05)(图1)。
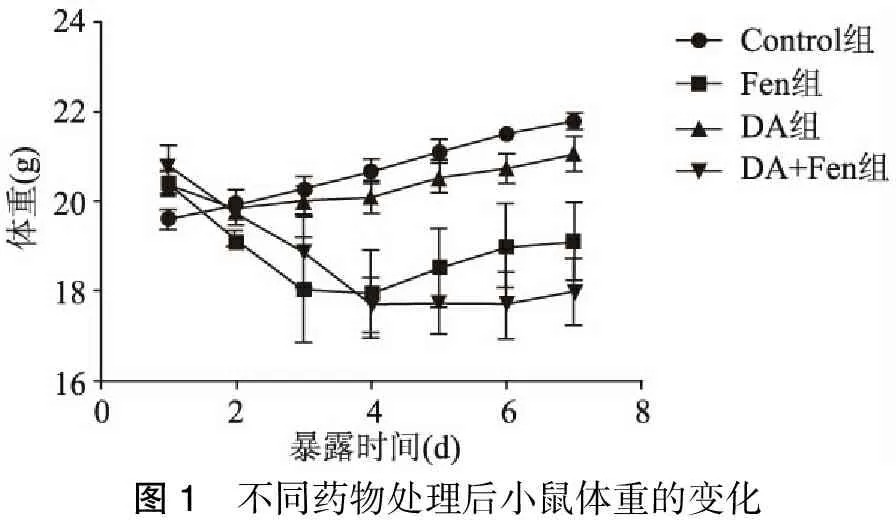
图1 不同药物处理后小鼠体重的变化
2.3 小鼠行为学改变
爬竿实验中Fen 7 d组,DA 立体定向注射后8 d组及DA 预处理+Fen 7 d组爬竿时间均延长,与对照组比较有明显差异(P<0.05)(图2),但是在爬杆实验过程中药物注射组的小鼠缺乏下杆的动作及部分小鼠停留在杆顶,从而检测时间异常延长。在直立实验中Fen 7 d组及DA预处理+Fen 7 d组5 min内直立次数分别减少至对照组的38.34%和32.33%,与对照组比较有明显差异(P<0.05)(图2)。

图2 小鼠行为学变化 A为爬竿实验;B为直立实验;Control组为对照组;Fen组为Fen7d组;DA组为DA立体定向注射后8d组;Fen+DA组为DA预处理+Fen7d组。与Control组比较,∗P<0.05
2.4 小鼠黑质TH染色
对照组小鼠黑质神经元中TH染色均匀分布于胞浆及突起中,神经元胞体饱满,突起染色明显(图3),Fen 1 d组(图3)、DA立体定向注射2 d组(图3)及DA预处理+Fen1 d组(图3)TH染色显示黑质神经元TH分布均一,细胞形态改变不大,与对照组比较无明显差异,而Fen7 d组(图3)、DA注射后8 d组(图3)及DA预处理+Fen7 d组(图3)TH染色显示黑质神经元胞浆TH染色不均匀,形态欠饱满,尤其是在DA预处理+Fen7 d组小鼠黑质TH染色阳性细胞较对照组明显变少,并且细胞中TH染色不均。

图3 黑质神经元TH染色(×20倍) A为对照组;B为Fen1d组;C为DA立体定向注射后2d组;D为DA预处理+Fen1d组;E为Fen7d组;F为DA立体定向注射后8d组;G为DA预处理+Fen7d组
2.5 小鼠纹状体TH染色
对照组小鼠纹状体TH染色较均一(图4),然而DA立体定向注射后2 d组TH染色显示纹状体中存在斑片状TH染色缺失(图4),并且DA预处理+Fen 1 d组(图4),Fen 7 d组(图4),DA立体定向注射后8 d组(图4)及DA预处理+Fen7 d组(图4)纹状体TH染色的荧光强度较对照组均减弱。
3 讨 论
PD病因不明,目前认为散发型PD是遗传因素、年龄老化以及环境毒素等多因素共同作用的结果。农药是一种常见的环境毒素,在生产生活中广泛应用,与PD发病的关联性已在部分农药中得到证实[2-3]。Fen作为一种上个世纪中期才研发出来的一种新型的拟除虫菊酯类农药,它与PD的相关性研究尚很少。本课题组在前期研究中发现Fen
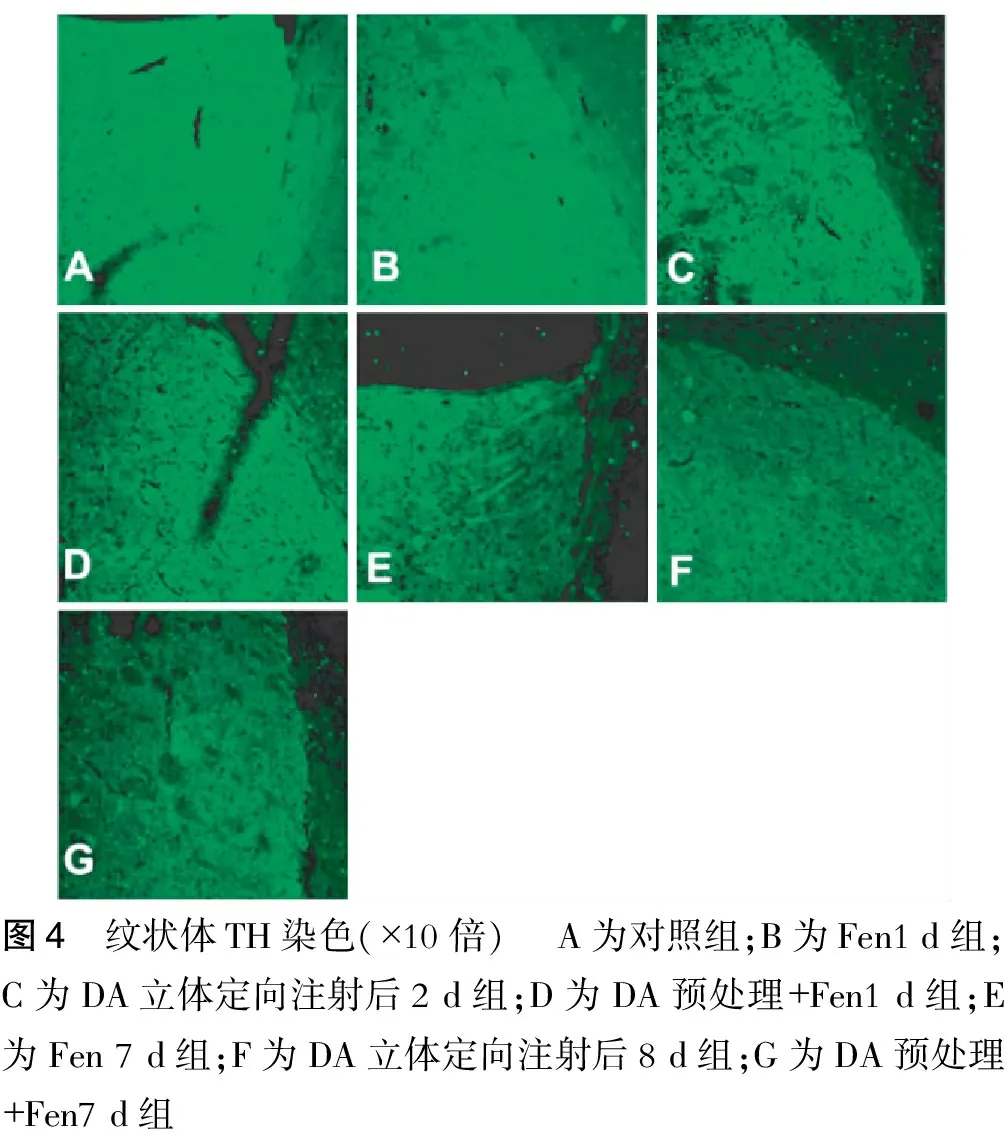
图4 纹状体TH染色(×10倍) A为对照组;B为Fen1d组;C为DA立体定向注射后2d组;D为DA预处理+Fen1d组;E为Fen7d组;F为DA立体定向注射后8d组;G为DA预处理+Fen7d组
在体外模型中可以模拟PD的部分发病机制及病理学改变[1],而体内环境是多种因素共同作用的结果,远比单一的体外环境复杂,因此本研究进一步探讨Fen单独及联合高DA水平对小鼠黑质纹状体系统的作用。
血脑屏障是机体中枢神经系统的一个特殊结构,可以阻止外周血液中的有害物质进入颅内,是中枢神经系统的特殊防御结构。本研究使用HPLC检测腹腔注射Fen的小鼠脑组织中Fen的含量,证实Fen可以透过血脑屏障,直接作用于中枢神经系统,且颅内Fen的浓度与外周Fen给药浓度呈正比。Fen等拟除虫菊酯类农药不溶于水或难溶于水,但可溶于有机溶剂,具有很强的脂溶性,可经消化道、呼吸道及皮肤黏膜进入人体,可以改变细胞表面各种离子通道的电位,影响各种细胞功能,有研究发现氯氰菊酯[4]和溴氰菊酯[5]等农药可以透过血脑屏障,干扰中枢神经系统功能,尤其长期氯氰菊酯暴露可以减少大鼠黑质纹状体系统中DA的含量,造成多巴胺能神经元死亡[6]。预实验中我们观察DA预处理后的小鼠在24 h后加用Fen 95.6 mg·kg-1·d-1腹腔注射时小鼠很快出现抽动,随后死亡,考虑2个药物连用明显增加了对小鼠的毒性作用,因此后续试验中使用Fen 47.8 mg·kg-1·d-1为Fen腹腔注射浓度。
帕金森病典型的病理改变是黑质多巴胺能神经元的进行性丢失和路易小体的形成。黑质纹状体多巴胺能神经通路相对于别的脑区还有更高浓度的DA水平。DA作为一种内源性神经递质,在PD及某些神经精神疾病中发挥重要作用,然而DA也是一种内源性神经毒素,它能够诱导神经细胞内生成活性氧(ROS),加重氧化应激反应,并可以诱导蛋白质构象异常[7],选择性增加DA能神经细胞死亡[8]。本研究通过立体定向注射DA到小鼠纹状体,增加黑质纹状体DA含量,观察Fen与DA分别作用及DA预处理后联合Fen使用对黑质纹状体的影响,结果显示DA预处理+Fen7 d组的小鼠与单独Fen 7 d组的小鼠比较,体重持续下降,且不可恢复,而DA立体定向组只有短暂的体重下降,并且行为学检测发现Fen7 d组和DA预处理+Fen7 d组小鼠的自由活动能力明显低于对照组,并且DA预处理+Fen7 d组低于Fen7 d组,而DA单独使用组无明显异常。Fen7 d组小鼠的黑质神经元中TH染色没有明显的改变,而DA 8 d组和DA预处理+Fen7 d组均看到黑质神经元胞浆和纹状体TH染色减弱,并且DA预处理+Fen7 d组中TH染色较对照组改变最明显。这提示Fen对动物存在毒性作用,与DA联合使用时可以加重DA对黑质神经元的损伤。
Fen诱导黑质多巴胺能神经元损伤的机制未明。一方面Fen可以降解为氰化物和醛,氰化物可以干扰线粒体呼吸链,加重细胞氧化应激损伤。有研究发现拟除虫菊酯类农药能够抑制动物线粒体呼吸链复合体Ⅰ的活性[9]及细胞色素C氧化酶的活性,从而增加ROS的生成和线粒体损伤。在富含DA的黑质纹状体系统中氧化应激反应尤为明显,DA可以氧化NADH,加重线粒体损伤,增加活性氧释放,参与PD的发病[7],由此本研究推测氧化应激反应在Fen诱导的神经细胞损伤中有重要作用。在溴氰菊酯[10]及氯氰菊酯[11]的大鼠模型中均证实该类农药可以增加神经系统脂质过氧化水平,增加氧化应激反应;另一方面Fen可以作用于昆虫或动物细胞膜上的钠离子通道,增加Na+内流,从而延长钠离子通道开放的时间[12]。多巴胺转运体(Dopamine transporter,DAT)是多巴胺能细胞表面的重要蛋白,它可以将突触间隙的DA再摄取至细胞内,它受Na+/Cl-离子依赖型转运蛋白基因家族编码[13],因此Fen可能作用于DAT蛋白,增加DA的再摄取,加重多巴胺能神经元内DA的毒性反应,从而使Fen与DA联用的黑质纹状体系统的损伤尤为明显。
综上所述,Fen与DA联用可以增加DA对DA能神经通路的损伤,但具体机制还需进一步探讨。由于本研究采取的是Fen及DA急性短期作用模型,在研究中未检测到黑质多巴胺能神经元数目的明显减少及典型的PD样行为学改变,很多神经系统改变可能是对环境毒素的延迟反应,因此Fen对黑质多巴胺神经系统的长期毒性作用仍需进一步观察。
[1] Xiong J,Zhang X,Huang J,et al.Fenpropathrin,a widely used pesticide,causes dopaminergic degeneration[J].Mol Neurobiol,2016,53(2):995-1008.
[2] Nandipati S,Litvan I.Environmental exposures and parkinson's disease[J].Int J Environ Res Public Health,2016,13(9):881-900.
[3] Tanner CM,Kamel F,Ross GW,et al.Rotenone,paraquat,and Parkinson's disease[J].Environ Health Perspect,2011,119(6):866-872.
[4] Singh AK,Tiwari MN,Upadhyay G,et al.Long term exposure to cypermethrin induces nigrostriatal dopaminergic neurodegeneration in adult rats:postnatal exposure enhances the susceptibility during adulthood[J].Neurobiol Aging,2012,33(2):404-415.
[5] Anadón A,Martinez-Larraaga MR,Fernandez-Cruz ML,et al.Toxicokinetics of deltamethrin and its 4'-HO-metabolite in the rat[J].Toxicol Appl Pharmacol,1996,141(1):8-16.
[6] Tiwari MN,Singh AK,Ahmad I,et al.Effects of cypermethrin on monoamine transporters,xenobiotic metabolizing enzymes and lipid peroxidation in the rat nigrostriatal system[J].Free Radic Res,2010,44(12):1416-1424.
[7] Bisaglia M,Soriano ME,Arduini I,et al.Molecular characterization of dopamine-derived quinones reactivity toward NADH and glutathione:implications for mitochondrial dysfunction in Parkinson disease[J].Biochim Biophys Acta,2010,1802(9):699-706.
[8] Jeon SM,Cheon SM,Bae HR,et al.Selective susceptibility of human dopaminergic neural stem cells to dopamine-induced apoptosis[J].Exp Neurobiol,2010,19(3):155-164.
[9] Gassner B,W thrich A,Scholtysik G,et al.The pyrethroids permethrin and cyhalothrin are potent inhibitors of the mitochondrial complex I[J].J Pharmacol Exp Ther,1997,281(2):855-860.
[10] Tayebati SK,Di Tullio MA,Ricci A,et al.Influence of dermal exposure to the pyrethroid insecticide deltamethrin on rat brain microanatomy and cholinergic/dopaminergic neurochemistry[J].Brain Res,2009,1301:180-188.
[11] Giray B,Gürbay A,Hincal F.Cypermethrin-induced oxidative stress in rat brain and liver is prevented by vitamin E or allopurinol[J].Toxicol Lett,2001,118(3):139-146.
[12] Cao Z,Shafer TJ,Crofton KM,et al.Additivity of pyrethroid actions on Sodium influx in cerebrocortical neurons in primary culture[J].Environ Health Perspect,2011,119(9):1239-1246.
[13] Pramod AB,Foster J,Carvelli L,et al.SLC6 transporters:structure,function,regulation,disease association and therapeutics[J].Mol Aspects Med,2013,34(2/3):197-219.
Thetoxiceffectoffenpropathrinanddopamineondopaminergicsystemofmice
XiongJing,HuDan,ZhangZhentao,etal.
DepartmentofNeurology,RenminHospitalofWuhanUniversity,Wuhan430060
ObjectiveTo explore and compare the effects of fenpropathrin intraperitoneal injection or combined with DA stereotacical injection on dopamine system of mice.MethodsFenpropathrin was injected intraperitoneally or combined with the DA stereotactically injected at the striatum of the mouse brain.The behaviors features of animals were investigated using pole jumping test and head up test.HLPC was used to detect the fenpropathrin in the mice brain after fenpropathrin intraperitoneal injection. The immunoreactivity of tyrosine hydroxylase in the brains were observed by immunohistochemistry.ResultsBehavior investigation indicated that both fenpropathrin intraperitoneal injection or combined with the DA stereotactically injection could decrease the mice's activity.Fenpropathrin was dectected in the brain by HPLC.Immunohistochemistry study suggested that the tyrosine hydroxylase immunoreactivity were decreased in striatum of fenpropathrin combined with the DA group.DAT immunoreactivity were increased in the striatum after fenpropathrin exposure.ConclusionFenpropathrin could cross the blood brain barrier,enhanced the toxicity of DA on dopamine system.
Fenpropathrin Parkinson's disease Dopamine Tyrosine hydroxylase
R742.5
A
1007-0478(2017)05-0393-05
10.3969/j.issn.1007-0478.2017.05.003
(2017-03-04收稿)

