酪氨酸酶催化乳清蛋白聚合耦联超滤的效果研究
王文琼,张兰威,2*,韩雪*
1(哈尔滨工业大学 化工与化学学院,食品科学与工程系,黑龙江 哈尔滨,150090) 2(中国海洋大学 食品科学与工程学院,山东 青岛,266100)
酪氨酸酶催化乳清蛋白聚合耦联超滤的效果研究
王文琼1,张兰威1,2*,韩雪1*
1(哈尔滨工业大学 化工与化学学院,食品科学与工程系,黑龙江 哈尔滨,150090) 2(中国海洋大学 食品科学与工程学院,山东 青岛,266100)
采用酪氨酸酶催化乳清蛋白聚合,酪氨酸酶催化蛋白的条件为pH 7.0,温度50 ℃,时间为3 h,酶活添加量为1 000 U/g蛋白时,相对于没有通过酶处理的样品,蛋白的膜回收效率和膜通量明显提高。膜通量与对照组相比提高20%。蛋白回收率与对照组相比提高27%左右。乳糖的截留率降低8%左右。此时,膜总阻力Rt和膜孔阻力Rp与对照组相比分别降低16%和33%。膜污染模型分析结果显示,酪氨酸酶催化蛋白膜过滤符合标准堵塞模型和饼层过滤模型。
酪氨酸酶;乳清蛋白;聚合;超滤
乳清是干酪生产的副产物,干酪乳清中含有牛乳干物质质量的一半,乳清中蛋白质的含量为0.6%~1%。目前有一半多干酪乳清经处理用作动物饲料和食物,但仍然有40%~50%乳清作为废水排放,这不仅浪费了食物资源,还会造成严重的环境污染。传统的乳清蛋白处理方式有加热沉淀、酸碱沉淀、壳聚糖和海藻吸附沉淀以及化学试剂(如聚丙烯和三氯乙酸)沉淀等,在处理过程中消耗大量的能量,而且无法实现蛋白的回收再利用[1]。膜技术的出现给乳清蛋白的回收开辟了新的途径,利用膜回收乳清蛋白不会改变蛋白的性状和营养价值,回收的过程没有相变的发生,能耗小,没有有害物质的参与[2-4]。乳品厂加工废水的回收利用已经不仅仅局限在传统化学方法和单一膜技术的回收,多种技术的联合应用是未来食品产业的发展方向。由于乳清蛋白经过酶催化聚合后,聚合蛋白的表面电荷和粒径的变化会改变蛋白与蛋白、蛋白与膜之间的相互作用,进而影响蛋白的膜回收效果[5]。
酪氨酸酶(tyrosinase,E.C. 1.14.18.1) 是一种单加氧酶,同时也是多酚氧化酶的一种,催化一元酚邻位羟基化生成二元酚,进一步氧化生成苯醌,苯醌具有较高的活性可以进一步和巯基、氨基发生反应,在蛋白质中形成二酪氨酸、酪氨酸-半胱氨酸、酪氨酸-赖氨酸,导致蛋白质之间发生交联。因此酪氨酸酶催化β-乳球蛋白发生交联主要是依赖于其中的酪氨酸。ERCILI-CURA[6]采用酪氨酸酶和转谷氨酰胺酶交联β-乳球蛋白,通过SDS-PAGE、CD、界面流动性和表面压力对交联后蛋白进行了分析。在没有任何热处理的条件下,酪氨酸酶对β-乳球蛋白没有作用,当进行40 ℃热处理时,酪氨酸酶可以交联β-乳球蛋白。THALMANN[7]采用酪氨酸酶交联乳清蛋白,在咖啡酸的存在下,α-乳白蛋白和β-乳球蛋白分别发生聚合,根据聚合条件的不同所发生的聚合度不同。但当咖啡酸不存在时,只有α-乳白蛋白发生聚合,聚合体大于300 kDa。酶催化蛋白聚合可产生具有一定功能性的蛋白添加剂,改善产品特定功能。目前,对于蛋白酶催化后耦联膜超滤效果的相关研究尚未见到,本研究考察了酪氨酸酶在一定条件下催化乳清蛋白聚合后的过滤效果,并且通过膜阻力分析和膜污染模型分析,初步阐述了酶催化聚合蛋白耦联超滤的效果和机制。
1 材料与方法
1.1材料与试剂
酪氨酸酶(570 U/g,CAS:78830)和福林酚购自Solarbio;酒石酸钾钠和硫酸铜购自天津市科密欧化学试剂有限公司;聚醚砜超滤膜(10 kDa),购自美国Sepro公司。
1.2仪器与设备
紫外分光光度计,SPECORD200,Analytikjena;美国Millpore 超滤设备。
1.3方法
1.3.1 酪氨酸酶催化蛋白聚合超滤蛋白含量的测定
采用Lowery法测定蛋白含量[8-9]。
① 1 mL 1% CuSO4·5H2O,1 mL 2%酒石酸钾钠和100 mL 2% Na2CO3试剂混合备用。② 将标准蛋白BSA溶解于1 mol/L NaOH,配制成1 mg/mL的蛋白溶液。③ 取0.5 mL不同浓度的蛋白至10 mL离心管中。④ 向蛋白溶液中加入5 mL上述混合液,搅动10 min。⑤ 加入0.5 mL 1 mol/L福林酚试剂反应30 min后,于660 nm处测定吸光值,绘制标准曲线。同时采用浓缩因子(VCF)来衡量蛋白质回收效率。
(1)
式中:Cp和Cf分别表示透过液和原液中蛋白含量(mg/mL)。
1.3.2 酶催化蛋白聚合超滤乳糖量测定
采用Luff schoorl 法测定截留液和透过液中乳糖含量。
① 柠檬酸50 g溶解于50 mL去离子水中;② 碳酸钠143.7 g,溶解于400~500 mL去离子水中;③ 将上述两种溶液混合冷却备用;④ 25 g硫酸铜溶解于100 mL 蒸馏水中,然后加入上述溶液中,定容至1 000 mL。制成Luff试剂;⑤ 乙酸0.4 mol/L:取乙酸24 mL定容至1 000 mL;⑥ 碘0.1 mol/L:1.27 g碘+3 g碘化钾溶于100 mL水中。⑦ 盐酸0.75 mol/L:73 g盐酸蒸馏水定容至1 000 mL;⑧ 硫代硫酸钠0.1 mol/L;⑨ 可溶性淀粉指示剂:2 g可溶性淀粉溶于100 mL蒸馏水中;⑩ 移取25 mL Luff试剂于300 mL平底烧瓶中,加入25 mL样品,加热冷凝回流10 min,迅速冷却;冷却后加入50 mL乙酸,再加入25 mL碘,再加入55 mL盐酸,充分混合后加入6~8滴淀粉指示剂,然后采用0.1 mol/L硫代硫酸钠溶液滴定至淡蓝色为终点。采用乳糖作为标准物绘制标准曲线:配制乳糖溶液质量浓度分别为:1、2、3、4、5 mg/mL;样品乳糖含量测定:取样品0.5 mL加入24.5 mL蒸馏水,即稀释50倍。按照上述步骤测定代入标准曲线计算乳糖含量。
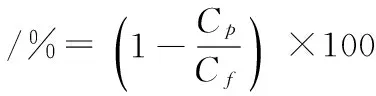
(2)
式中:Cp和Cf(mg/mL) 分别表示透过液和原液中乳糖含量。
1.3.3 酶催化蛋白聚合超滤回收乳清膜通量变化的测定
膜通量变化按式(3)计算:
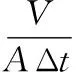
(3)
式中:J,膜通量;V,透过液体积,mL;A,有效膜面积,cm2;Δt,时间变化,min。
1.3.4 酪氨酸酶催化蛋白聚合回收乳清蛋白膜的阻力分析
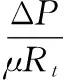
(4)
Rt=Rm+Rc+Rp
(5)
式中:J,膜通量,L/(m2·h);Δp,膜两侧压力差,kPa;μ,滤液动力学黏度,Pa·s;Rt,膜过滤总阻力,m-1;Rm,膜自身阻力,m-1;Rc,泥饼层阻力,m-1;Rp,膜孔污染阻力,m-1。
1.3.5 酶催化乳清蛋白膜过滤模型分析
(6)
式中:n=0,滤饼过滤;n=1,中间堵塞;n=3/2,标准堵塞;n=2,完全堵塞;t,过滤时间,s;V,滤液体积;K为过滤常数。

表1 死端过滤过程中不同污染机理的经验公式
注:J,通量;J0, 初始通量;V,过滤体积;t过滤时间;A,B,C和D是常数。
2 结果与分析
2.1酪氨酸酶催化乳清蛋白聚合耦联超滤膜通量变化研究
由于酪氨酸酶催化乳清蛋白聚合效果已有相关研究,因此在文献研究的最佳酶催化条件基础上,进行乳清蛋白的酪氨酸酶催化聚合后超滤,考察膜过滤过程中,膜通量的变化。分组和酶催化条件为:对照组为无酶处理乳清超滤;实验组为酪氨酸酶催化乳清蛋白聚合超滤,酶催化条件为:酶活添加量为1 000 U/g蛋白,同时加入咖啡酸1 mmol/L,pH 7.0水浴50 ℃,3 h。
由于检验统计量为-4.748639,小于显著性水平(5%)的临界值-3.6736,可认为估计残差序列E为平稳序列,进而变量LTTL和LGDP具有协整关系,即具有长期均衡关系。
图1可知,随着膜超滤时间的增加,膜通量逐渐降低。说明随着超滤时间的增加,蛋白质吸附在膜表面形成膜阻,导致膜通量降低。酶对乳清蛋白聚合后的过滤膜通量高于对照组。研究显示,膜过滤过程中粒径和形状对过滤的效果影响显著,当滤液中的物质为方块或者针型,过滤的速率会大大增加,当滤液中的物质为圆形时,过滤速率会减小,主要是因为方形和针型两种形状所形成的饼层可以增加过滤速度[10]。由于乳清蛋白中的α-乳白蛋白和β-乳球蛋白两个蛋白为球型蛋白,在蛋白聚合酶的作用下聚合形成不规则形状,在膜表面形成疏松的饼层,增加了过滤的速度,膜通量增加。因此,酪氨酸酶催化聚合乳清蛋白后膜过滤,可以提高膜通量。但是随着过滤时间的延长,尤其是60 min后,酶聚合蛋白过滤组和对照组膜通量小差异不显著,主要是因为随着过滤时间的增加,在一定的跨膜压力下,粒径较大的蛋白在膜孔表面形成的疏松饼层的塌缩效应引起蛋白分子间的孔隙率降低,蛋白在膜表面形成饼层阻力,降低了膜通量。而对照组,低分子蛋白在过滤的初期,迅速形成膜孔堵塞,降低膜通量,之后蛋白在膜表面堆积,疏松饼层的形成和部分膜孔中的蛋白进入透过液中使其在30 min 时,膜通量增加,之后由于低分子量蛋白的塌缩速度高于大分子蛋白,因此使得蛋白膜通量迅速下降[11]。
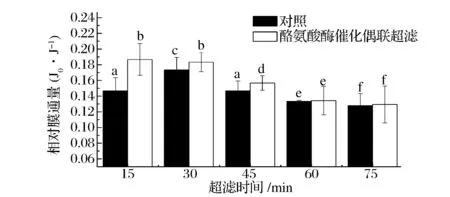
图1 酶催化乳清蛋白聚合耦联超滤膜通量变化结果Fig.1 Flux changes of enzyme catalysis whey protein aggregation coupling ultrafiltration
2.2酪氨酸酶催化乳清蛋白过滤效果的研究
超滤75 min结束后,采用Lowery法测定透过液和浓缩液中蛋白含量,计算出蛋白回收率和蛋白截留率,同时通过浓缩体积比计算浓缩因子VCF,考察膜浓缩蛋白效果。

(a)蛋白回收率和蛋白截留率;(b)浓缩因子(VCF);(c)乳糖截留率图2 酪氨酸酶催化聚合乳清蛋白膜过滤效果Fig.2 Tyrosine catalytic whey protein polymerization coupling membrane filtration effect
由图2(a)所示,以没有进行酶催化处理的乳清作为对照组,对照组的具有较高的蛋白截留率,但其蛋白回收率较低,主要是因为,对照组中大量低分子量乳清蛋白堵塞在膜孔,以及形成较为坚固的饼层所导致膜通量下降,大量蛋白堵塞和吸附在膜表面,导致蛋白回收率降低,酪氨酸酶催化蛋白聚合后蛋白回收率高于对照组。由于蛋白与膜的相互作用影响因素复杂,除了粒径大小,粒径的形状以还有聚合后蛋白的表面电荷的多少,也会影响过滤速率。不同酶催化蛋白聚合形成的蛋白聚合物表面电荷不同,形状不同,在膜表面形成的饼层疏松情况不同,最终影响蛋白的回收率和浓缩因子VCF。由图2(b)可知,酶催化聚合蛋白超滤浓缩因子VCF也相对较高,即在此浓度下,蛋白的截留率增加的同时,蛋白的回收率也提高,说明在此浓度下催化过滤,在膜表面沉积的蛋白量少,大部分进入到截流液中,也间接说明了膜污染的降低。乳清蛋白的聚合程度不同,所形成的蛋白聚合物的表面电荷,聚合体的形状,以及表面电荷的变化都会影响蛋白与膜表面的相互作用,随着超滤时间的增加,聚合后的大分子蛋白在膜表面形成疏松的饼层,增加了低分子蛋白的截留,同时提高膜通量,降低乳糖分子的截留率。由图2(c)可知,酪氨酸酶催化聚合后超滤,与对照组相比溶液中的乳糖截留率减低,主要是蛋白聚合物的体积增加,在膜表面形成疏松的饼层,导致部分蛋白流入透过液中,乳糖留率降低。另外,随着超滤时间的增加,跨膜压力的不断作用,部分蛋白被压入透过液中,导致蛋白截留率下降。因此,适当的蛋白酶催化聚合在膜表面形成的饼层可以增加蛋白的回收率。
2.3酪氨酸酶催化蛋白膜过滤阻力分析
根据 Darcy 公式,测定不同通量条件下的过膜压力并进行回归,计算出膜自身阻力Rm;膜过滤结束时,结合此刻的过膜压力,通量以及滤液黏度,计算膜的总阻力Rt;将膜组件从反应器中,用自来水冲洗掉表面泥饼层,测定清水通量及相应的过膜的压力,获得Rm和Rp阻力之和;在此基础上,减去阻力Rm,得到膜孔污染阻力Rp;将总阻力Rt减去Rm和Rp得到泥饼层阻力Rc[12-13]。
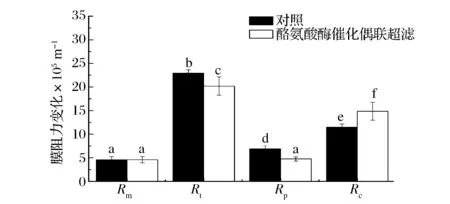
图3 酪氨酸酶催化蛋白聚合膜过滤阻力分析Fig.3 Membrane filtration resistance analysis of tyrosine catalysis protein cross-linking coupling ultrafiltration
由图3可知,酶催化乳清蛋白聚合后超滤过程中,与对照组相比酪氨酸酶催化蛋白聚合后过滤,膜总阻力Rt下降,膜孔阻力与对照组差异不显著,膜饼层阻力降低,低于对照组,主要是疏松的膜饼层阻力的形成使大部分蛋白截流的同时,也加快了膜过滤的速度,对照组由于蛋白堵塞膜孔以及坚硬的膜饼层的形成,导致膜通量迅速下降,膜阻力增加。饼层阻力的增加也说明,部分蛋白保留在膜表面,这也是为什么酪氨酸酶催化后过滤膜通量增加,但是蛋白的回收率降低的原因,由酪氨酸酶催化乳清蛋白聚合偶联超滤,膜总阻力和膜孔阻力降低,膜饼层阻力增加,说明酪氨酸酶催化乳清蛋白过滤过程中蛋白质分子聚合,粒径增加,导致膜饼层阻力增加,饼层阻力的增加,增加了低分子量蛋白的截留,同时也降低了低分子量蛋白在膜孔的堵塞。因此大部分蛋白被回收,蛋白回收率和膜通量同时提高。经过酪氨酸酶催化聚合的乳清蛋白在超滤过程中对超滤膜的污染显著降低,没有经过酶催化聚合的乳清蛋白的膜孔阻力明显高于酶催化后过滤时的膜孔阻力,是由于没有经过酶催化后的低分子量的乳清蛋白在膜堵塞膜孔,导致膜通量迅速下降,由图3也可以看出膜孔阻力相对酶聚合后蛋白过滤时较低,主要是饼层的形成导致膜孔阻力较低与DACRY和CARMAN-KOZENY所提出的方程理论是一致的[14]。
2.4酪氨酸酶催化蛋白膜过滤模型研究
膜污染的发生是由于颗粒物在膜表面或者膜孔内的沉积,涉及4种不同的堵塞机理:完全堵塞模型,中间堵塞模型,滤饼层过滤模型及标准过滤模型如图4所示。完全堵塞模型是假设经典的过滤模型,用来表征颗粒物完全堵塞孔道阻止水流的通过,颗粒不是在膜表面成层分布的,而是只沉积了一层。中间堵塞模型跟完全堵塞是相似的,但是中间过滤模型假设一部分颗粒堵塞膜孔,另一部分颗粒在膜表面聚集。滤饼层过滤模型是指均一的滤饼层在膜表面形成,污染层是可渗透的允许水流通过。标准过滤模型是指颗粒物在膜孔内聚集粘附到膜孔的内壁上,膜孔体积的减少跟滤液的体积成比例。
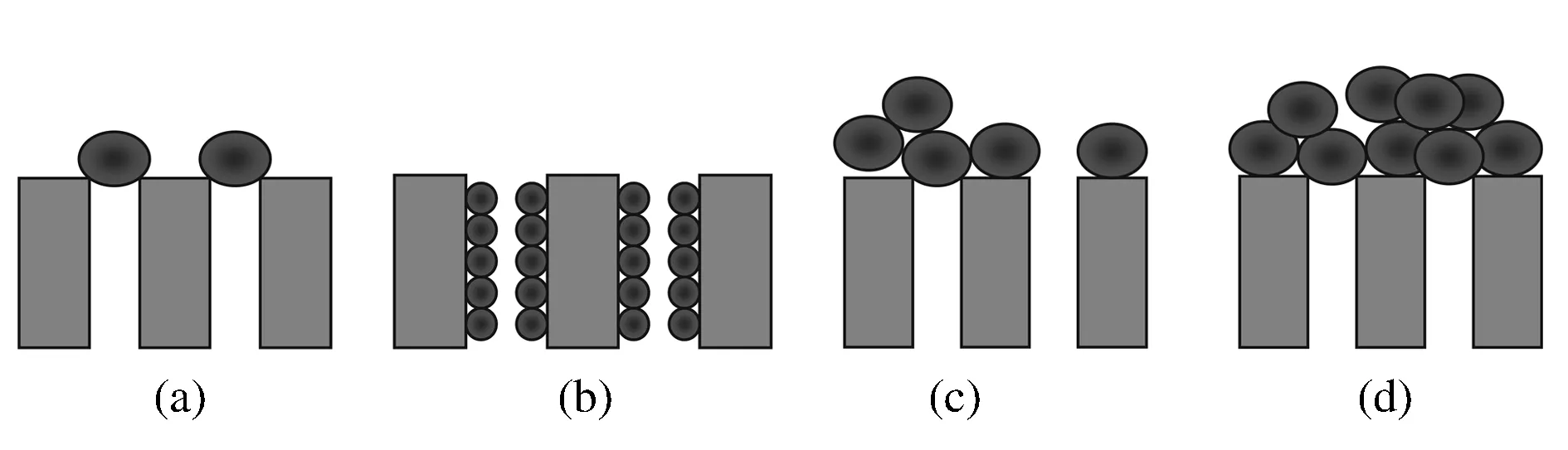
(a)完全堵塞模型;(b)标准堵塞模型;(c)中间堵塞模型; (d)饼层过滤模型图4 膜污染机理示意图 Fig.4 Membrane filtration models
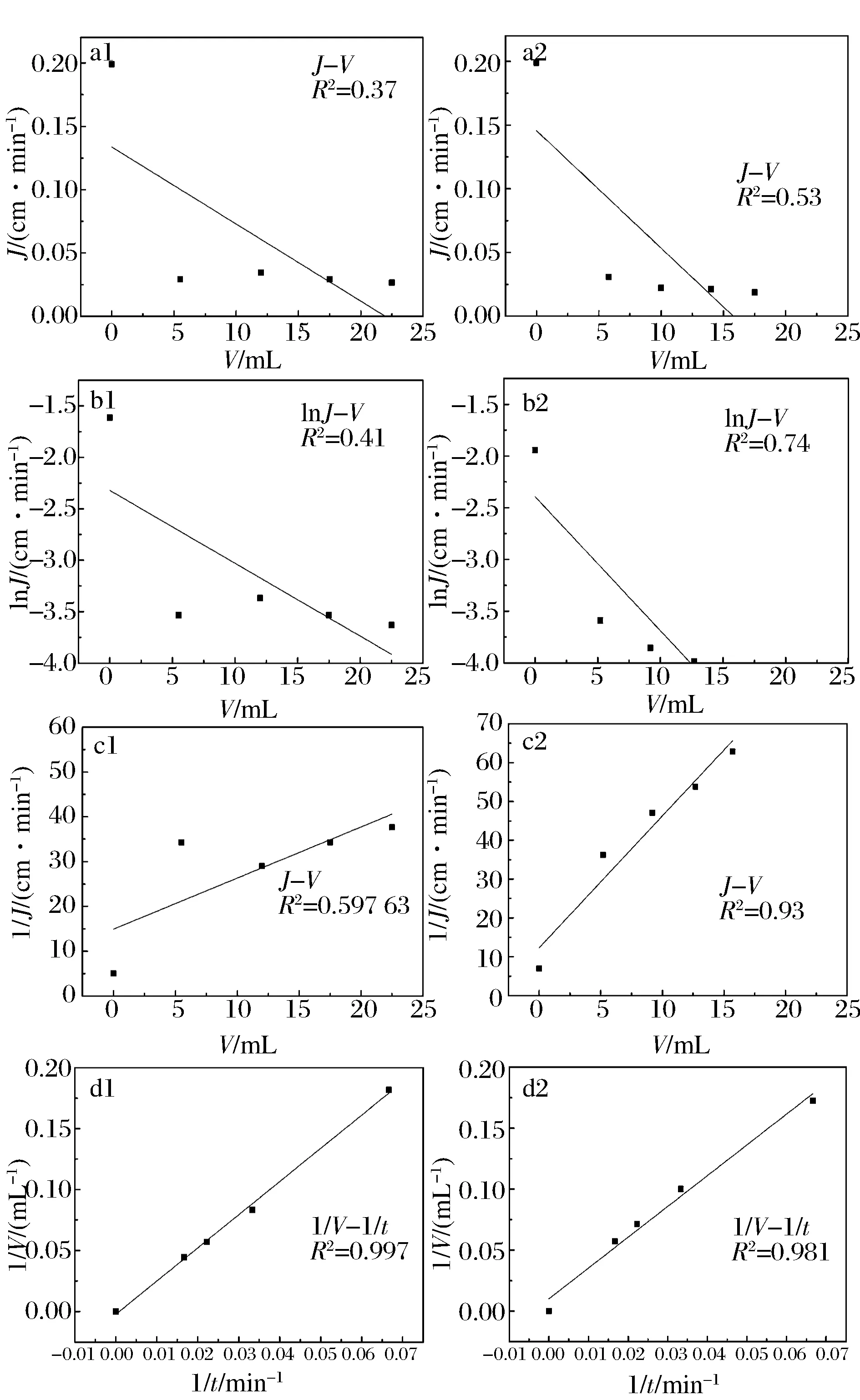
图5 采用(a)完全堵塞模型、(b)中间堵塞模型、(c)饼层过滤模型、(d)标准堵塞模型拟合比较对照组原乳清过滤(1)和酪氨酸酶催化耦联膜过滤通量下降曲线(2)Fig.5 Four fouling models:(1) Cake filtration (2) Complete blocking (3) Intermediate blocking and (4) Standard blocking,respectively
采用4种过滤模型模拟乳清蛋白在酶膜反应器中的过滤过程。由于PES膜表面固定化酶以后,膜表面的亲水性增强,为排除固定化酶膜本身对乳清过滤效果的影响,采用双对照的方式,两个对照组分别为PES膜过滤乳清蛋白和固定化酶膜未催化蛋白直接过滤过程。比较酶膜反应器催化乳清蛋白聚合过滤过程。由图5可知,标准过滤模型可以较好地拟合PES膜过滤乳清和固定化酶膜未催化蛋白过滤过程,说明大量的蛋白堵塞在膜孔,形成不可逆转的污染,膜通量迅速下降。而饼层过滤模型和标准过滤模型都可以较好的拟合酶膜反应器中的乳清蛋白过滤过程,因此,可知酶膜反应器催化蛋白聚合后过滤在膜表面形成了疏松的饼层,因此膜空堵塞减少,由于疏松的饼层比较容易清理,在一定的流体冲刷下会进入截流液中,整个固定化酶膜的污染降低。在BOURCIER等人的研究中发现立方体和针型结构即圆柱形结构在过滤的过程中形成多孔的饼层,使过滤速度增加,而片状和球形结构过滤速度比较慢,另外,就是粒径大的物质过滤速度大于粒径小的溶液[10]。因此经过酶膜催化聚合后形成的类似针型的聚合物增加了过滤速度,同时酶聚合物使蛋白的粒径增加,也会增加整体溶液的过滤速度。
3 结论
研究了酶催化低浓度蛋白聚合耦联超滤回收废水中的蛋白,改变蛋白质分子与膜之间的相互作用,降低膜污染,提高蛋白回收率。采用酪氨酸酶催化乳清蛋白聚合,酪氨酸酶催化蛋白的条件为pH 7.0,温度50 ℃,时间为3 h以及酶活添加量为1 000 U/g蛋白时,相对于没有通过酶处理的样品,蛋白的膜回收效率和膜通量明显提高。膜通量与对照组相比提高20%。蛋白回收率与对照组相比提高27%左右。乳糖的截留率降低8%左右。此时,膜总阻力Rt和膜孔阻力Rp显著降低。膜污染模型分析结果显示,酪氨酸酶催化蛋白膜过滤符合标准堵塞模型和饼层过滤模型。
本研究实现了蛋白催化与膜分离回收的同时进行,不仅仅回收了废水中的蛋白还降低了膜污染,提高了膜运行周期,同时产生的酶聚合蛋白具有一定的功能特性可以应用于食品和化工领域。此外,还深入研究了酶聚合蛋白在过滤过程中蛋白与膜,蛋白与蛋白之间的相互作用能,分析蛋白过滤机理,为蛋白膜过滤提供理论基础。因此,该项研究成果具有推广应用前景。
[1] CARVALHO F,PRAZERES A R,RIVAS J.Cheese whey wastewater:characterization and treatment[J].Science of the Total Environment,2013,445:385-396.
[2] POULIOT Y.Membrane processes in dairy technology—from a simple idea to worldwide panacea[J].International Dairy Journal,2008,18(7):735-740.
[3] PRAZERES A R,CARVALHO F,RIVAS J.Cheese whey management:a review[J].Journal of environmental management,2012,110(10):48-68.
[4] SAXENA A,TRIPATHI B P,KUMAR M,et al.Membrane-based techniques for the separation and purification of proteins:an overview[J].Advances in Colloid and Interface Science,2009,145(1-2):1-22.
[5] WEN-QIONG W,LAN-WEI Z,XUE H,et al.Cheese whey protein recovery by ultrafiltration through transglutaminase (Tg) catalysis whey protein cross-linking[J].Food Chemistry,2017,215(1):31-40.
[6] ERCILI-CURA D,PARTANEN R,HUSBAND F,et al.Enzymatic cross-linking of Β-lactoglobulin in solution and at air-water interface:structural constraints[J].Food Hydrocolloids,2012,28(1):1-9.
[7] THALMANN C,LöTZBEYER T.Enzymatic cross-linking of proteins with tyrosinase[J].European Food Research and Technology,2002,214(4):276-281.
[8] POMORY C M.Color development time of the lowry protein assay[J].Analytical Biochemistry,2008,378(2):216-217.
[10] BOURCIER D,FéRAUD J P,COLSON D,et al.Influence of particle size and shape properties on cake resistance and compressibility during pressure filtration[J].Chemical Engineering Science,2016,144(4):176-187.
[11] PARK P K,LEE C H,LEE S.Permeability of collapsed cakes formed by deposition of fractal aggregates upon membrane filtration[J].Environmental Science & Technology,2006,40(8):2 699-2 705.
[12] MOUROUZIDIS-MOUROUZIS S,KARABELAS A.Whey protein fouling of large pore-size ceramic microfiltration membranes at small cross-flow velocity[J].Journal of Membrane Science,2008,323(1):17-27.
[13] ZHAO C,XU X,CHEN J,et al.Effect of graphene oxide concentration on the morphologies and antifouling properties of pvdf ultrafiltration membranes[J].Journal of Environmental Chemical Engineering,2013,1(3):349-354.
[14] LEE S,FANE A,AMAL R,et al.The effect of floc size and structure on specific cake resistance and compressibility in dead-end microfiltration[J].Separation Science and Technology,2003,38(4):869-887.
Tyrosinasecatalyzewheyproteincross-linkingcouplingultrafiltration
WANG Wen-qiong1,ZHANG Lan-wei1,2*,HAN Xue1*
1(Department of Food Science and Engineering,School of Chemistry and Chemical Engineering, Harbin Institute of Technology,Harbin 150090,China) 2(College of Food Science and Engineering,Ocean Univerisity of China,Qingdao 266100,China)
Changing the interactions between protein and membrane for reducing membrane fouling and increasing protein recovery rate becomes a new challenge in low concentration of protein recovery field. Tyrosinase was used to catalyze whey protein polymerization. The enzyme catalysis condition was incubated at 40 ℃, pH 7.0 for 3 h. The enzyme content was 1 000 U/g protein. At this condition, protein recovery rate and membrane flux were obviously increased compared with sample without enzyme treatment. The membrane flux increased 20% compared with control. Protein recovery rate increased about 27% compared with control. The retention rate of Lactose was reduced about 8%. At this time, the total membrane resistanceRtand membrane pore resistanceRpwere reduced 16% and 33%, respectively. The results of membrane fouling model showed that tyrosinase catalysis on protein cross-linking coupling ultrafiltration conformed to standard block model and the cake filtration model.
tyrosinase; whey protein; cross-linking; ultrafiltration
博士研究生(张兰威教授、韩雪副教授为通讯作者,E-mail:zhanglw@hit.edu.cn,xhan@hit.edu.cn)。
“十二五”农村领域国家科技计划课题:乳制品加工膜技术应用研究与产业化示范——乳品加工厂废水的回收利用(2013BAD18B05-05)
2017-03-15,改回日期:2017-05-23
10.13995/j.cnki.11-1802/ts.014320

