RT-LAMP及RT-PCR方法快速检测玉米褪绿斑驳病毒的比较与应用
单长林,周 圆,李孝军,杨赛军,邵炜冬
(舟山出入境检验检疫局,浙江 舟山 316021)
RT-LAMP及RT-PCR方法快速检测玉米褪绿斑驳病毒的比较与应用
单长林,周 圆,李孝军,杨赛军,邵炜冬
(舟山出入境检验检疫局,浙江 舟山 316021)
利用玉米褪绿斑驳病毒外壳蛋白基因为靶标序列设计引物,通过优化反应温度、引物浓度、反应时间以及评价环引物效果,建立了检测玉米褪绿斑驳病毒反转录环介导等温扩增 (RT-LAMP) 方法,并与RT-PCR方法比较。结果表明,RT-LAMP在64℃等温条件下反应45 min,最低可检测到280 fg的目的片段,灵敏度是RT-PCR的100倍。以甘蔗花叶病毒、玉米矮花叶病毒、小麦线条花叶病毒、玉米白线花叶病毒及玉米褪绿斑驳病毒等5种病毒为检测对象,证明该方法针对玉米褪绿斑驳病毒具有很强的特异性。利用RT-LAMP方法对100份模拟病毒感染的玉米种子进行检测,病毒检出率为100%。
玉米褪绿斑驳病毒;反转录环介导等温扩增方法;RT-PCR;检测
玉米褪绿斑驳病毒(MCMV)是侵染玉米的重要病毒,主要通过种子远距离传送等方式传播[1-3],可侵染玉米、高粱等多达15~19种植物[4],目前主要分布在墨西哥、美国部分地区、秘鲁、阿根廷、法国、希腊、意大利、罗马尼亚、西班牙、瑞士、澳大利亚、厄瓜多尔、南非、尼日利亚、肯尼亚、埃塞俄比亚、刚果、卢旺达及泰国等地[5-12]。有研究表明,该病毒既可以单独侵染玉米,也可与小麦线条花叶病毒(WSMV)[13]、甘蔗花叶病毒(SCMV)[14-15]、玉米矮花叶病毒(MDMV)[15]复合侵染,导致玉米致死性坏死病。
2007年我国将MCMV列为进境检疫性有害生物。2010年我国首次从进口玉米种子中检出MCMV[16],1年之后,Xie L等在我国云南的玉米植株上发现了MCMV[17],到2015年,Deng等又在台湾省甜玉米上检测出MCMV[18]。饶玉燕等通过构建MCMV损失评判指标体系,对其在我国潜在经济损失作出评估,高达140.95亿元[19]。加强进境粮食检验检疫监管,防范玉米褪绿斑驳病毒的入侵与扩散迫在眉睫。
目前针对MCMV的检测方法主要有酶联免疫法(ELISA)、RT-PCR、实时荧光RT-PCR方法、表面等离子生物传感器法等[20-22]。酶联免疫法对快速检测意义重大,但由于包被抗体特异性不强及保存不当等原因,易出现假阳性等问题;实时荧光RT-PCR技术,存在需大型仪器设备支持且运行成本高等问题,不利于基层检测现场推广。环介导等温扩增技术(LAMP)是由日本学者Notomi研发的一种恒温扩增反应,可在恒温条件下1 h内完成反应,结果清晰肉眼可辨,反应灵敏度高,准确性和特异性好且不需要大型仪器支持[23]。RT-LAMP 是在 LAMP 基础上,加入反转录酶,使反转率和核酸扩增同时进行,其独有的检测优势迅速得到广大科研工作者的偏爱,广泛应用于动植物病原微生物检测[24-26]。
本研究主要利用RT-LAMP技术,并与RTPCR比较,分析其特异性和灵敏性,建立一种简便易操作、特异性强、灵敏度高的方法快速检测玉米褪绿斑驳病毒,为该病毒的田间诊断、口岸现场检疫等提供更好的技术支持。
1 材料与方法
1.1 试验材料
玉米褪绿斑驳病毒、甘蔗花叶病毒由浙江大学农业与生物技术研究所吴建祥教授提供,玉米矮花叶病毒、小麦线条花叶病毒及玉米白线花叶病毒(MWLMV)阳性质控物购自美国Agdia公司。
试剂、仪器:RNAprep Pure Plant Kit(天根生化科技有限公司),PrimeScriptTM II 1stStrand cDNA Synthesis Kit(大连宝生物公司),Fluorescent Detection Reagent、RNA Amplification Kit (日本荣研公司);
LA-320C实时浊度仪(日本荣研公司),PCR仪(ABI),NANODROP2000分光光度计(Thermo),凝胶成像系统(Bio-Rad)
1.2 试验方法
1.2.1 引物设计合成 根据GenBank 发布的MCMV 外壳蛋白cDNA序列(登录号分别为 AM490793.1,JQ943666.1,GU594293.1,JF422772.1,AY587605.1),通过 MEGA 6 软件进行比对分析,找出外壳蛋白基因3′端保守序列,以此为模板,使用在线软件Primer3 Input(http://bioinfo.ut.ee/primer3-0.4.0/primer3/),设计5条引物(表1),由生工生物工程(上海)股份有限公司合成。序列比对结果及靶序列结合区域见图1。
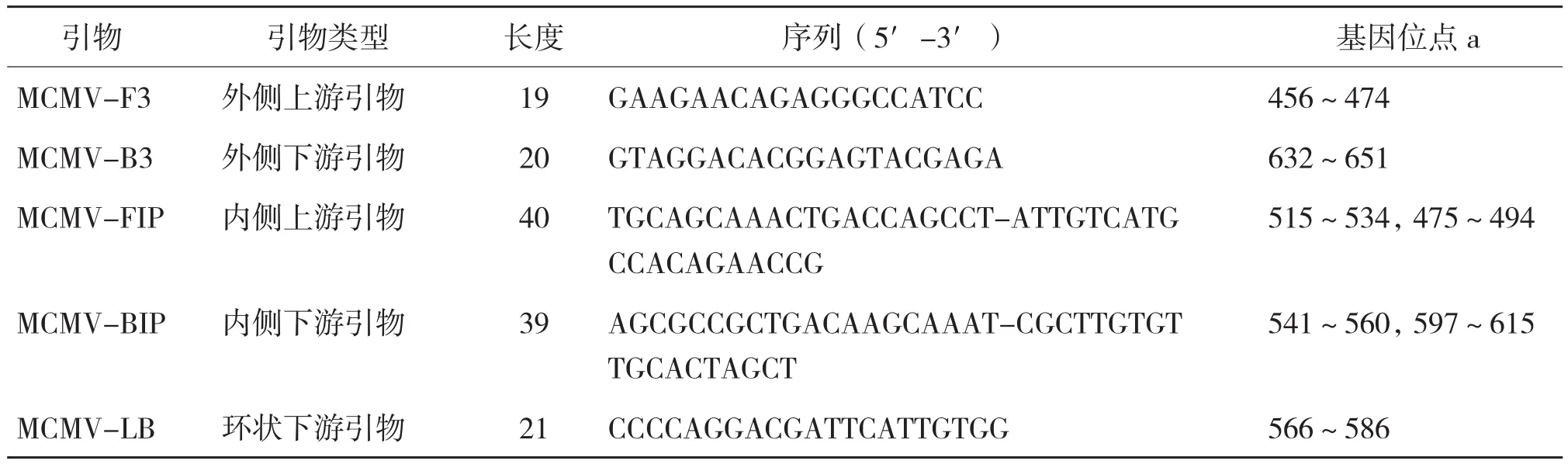
表1 玉米褪绿斑驳病毒RT-LAMP 检测引物

图 1 序列比对分析结果及各引物在基因组中对应的位置
1.2.2 总RNA 提取 取病毒样品和健康玉米叶片,利用植物总RNA提取试剂盒分别提取RNA,用NANODROP 2000分光光度计测定核酸浓度(表2)与纯度,-80℃下保存备用。

表 2 测定的几种病毒的 RNA 浓度
1.2.3 RT-PCR 检测 利用反转录试剂盒PrimeScript TM II 1stStrand cDNA Synthesis Kit将提取的RNA反转录成 cDNA ,-20℃保存备用。
采用 Primer Premier 5.0 设计 RTPCR 引物:F-MCMV:TTATGCCACAAAA CCGCACTGT;R-MCMV:TAGGATTGCTGCT CCACGGT。扩增片段大小为190 bp。反应体系为 10μL 2×Taq PCR StarMix,1μL 引物F-MCMV / R-MCMV(10 umol/L),1μL模板cDNA,加水至20μL。PCR反应条件为94℃预变性 3 min;94℃变性 30 s,53℃退火 40 s,72℃延长1 min,进行35次循环;72℃延伸5 min。反应结束后,取5μL反应产物,1.6 %琼脂糖凝胶电泳 30 min(100 V),紫外成像检测。
1.2.4 RT-LAMP 检测体系的优化 基本检测体系为:12.5μL 反应缓冲液 RM,1.0μL 酶溶液EM,1.0μL 荧光目视检测试剂钙黄素,1.0μL 模板 RNA,终浓度为 1.6μmol/L的MCMV-FIP/MCMV-BIP和终浓度为0.2μmol/L的MCMV-F3/MCMV-B3,最后加水至25μL。RT-LAMP反应条件为 63℃ 1 h,80℃ 5 min。LA-32℃实时浊度仪检测浊度变化,并在反应结束后观察荧光目视染料是否由橙色变为绿色。
分别对反应温度、引物浓度设置不同梯度进行优化。将反应温度设置为62、63、64、65℃,保持其他因素不变以筛选出最佳反应温度;再将MCMV-FIP/MCMV-BIP(MCMV-F3/MCMV-B3)引物终浓度设置为1.0(0.125)、1.2(0.15)、1.4(0.175)、1.6(0.2)、1.8(0.225) μmol/L,保持其他因素不变以筛选出最佳引物浓度;最后以(FIP/BIP)∶(LB)∶(F3/B3)=8∶4∶1加入环引物MCMV-LB以验证环引物效果。试验中用灭菌水为模板,以基本检测体系进行阴性对照。
1.2.5 RT-LAMP 与 RT-PCR特异性比较 以MCMV、SCMV、MDMV、WSMV和MWLMV的RNA为模板,进行RT-LAMP检测,观察浊度及目视试剂颜色变化;同时进行RT-PCR检测,凝胶电泳验证。比较分析两种方法的特异性。
1.2.6 RT-LAMP 与 RT-PCR灵敏度测定 以提取的MCMV RNA为原液,用RNase Free dH2O将RNA进行10倍梯度稀释,分别获得原液(280 ng/μL)、10倍稀释液(28 ng/μL)、102倍稀释液(2.8 ng/μL)、103倍稀释液(280 pg/μL)、104倍稀释液(28 pg/μL)、105倍稀释液(2.8 pg/μL)、106倍稀释液(280 fg/μL)、107倍稀释液(28 fg/μL)、108倍稀释液(2.8 fg/μL)。根据建立的RT-LAMP 反应体系进行扩增,观察浊度及目视试剂颜色变化;同时进行RT-PCR反应,凝胶电泳验证。比较分析两种方法的灵敏性。
1.2.7 RT-LAMP检测玉米种子样本的应用 选取三叶期玉米幼苗(品种为农大108),摩擦接种,15 d后表现典型症状,采集新鲜叶片,-20℃保存备用。
将收集到的叶片与PBS缓冲液按照质量比1∶1等比例研磨,纱布过滤获取病毒液,备用。选取健康玉米种子研磨成粉末,与10倍梯度稀释病毒液混匀,模拟种子带毒,作为待测样本(100个)。利用植物总RNA 提取试剂盒提取模拟待测样本RNA,同时进行RT-LAMP和RT-PCR检测。
2 结果与分析
2.1 RT-LAMP 检测体系优化
2.1.1 最适反应温度的选择 试验设62、63、64、65℃4个反应温度梯度,结果(图2)显示,在64℃条件下,反应浊度超出检出限(浊度AABs=0.2)仅需要 24 min,到达平台期(浊度AABs=0.8)仅需要37 min;而65℃则分别需要 26、39 min,62℃需要 33、47 min ,63℃需要35、54 min。因比当反应温度为64℃时,反应进行最为迅速。

图2 RT-LAMP 不同反应温度试验
2.1.2 引物浓度优化 将引物MCMV-FIP/MCMV-BIP(MCMV-F3/MCMV-B3)反应浓度设置为1.0(0.125)、1.2(0.15)、1.4(0.175)、1.6(0.2)、1.8(0.225)μmol/L等5个浓度梯度,结果(图 3)显示,在引物浓度为1.8(0.225)μmol/L条件下,反应浊度超出检出限(浊度AABs=0.2)仅需要 27 min,到达平台期(浊度AABs=0.8)只需要39 min,其他浓度条件下到达检测限和反应平台期的时间(分别为54、>60 min,45、57 min,43、53 min,35、54 min)均有所延迟。因此最佳引物浓度为1.8(0.225)μmol/L。

图3 RT-LAMP 反应不同引物浓度试验

图4 RT-LAMP中环引物效果试验
2.1.3 环引物效果 由图 4可知,未加入环引物反应在27 min 时浊度达到检测线(AABs=0.2),且达到平台期(AABs=0.8)需要长达39 min;加入环引物后,浊度达到检测线时间提前到21 min,反应进行到平台期所用时间减少6 min。由此可见,环引物可加速反应,效果明显。
2.1.4 RT-LAMP 检测体系的确定 经过以上对RT-LAMP反应温度、引物浓度及环引物加入与否等条件的优化,确定RT-LAMP检测体系为:12.5 μL 反应缓冲液 RM,1.0 μL 酶溶液EM,1.0 μL 荧光目视检测试剂钙黄素,1.0 μL 模板RNA,终浓度为1.8μmol/L的MCMVFIP/MCMV-BIP,终浓度为 0.225μmol/L 的MCMV-F3/MCMV-B3和终浓度为0.45μmol/L的MCMV-LB,最后加水至25 μL。由图5可知,整个反应在45 min内可以完成,故RT-LAMP反应条件为64℃ 45 min。
2.2 特异性检测
以 SCMV、WSMV、MDMV、MWLMV及MCMV的RNA为模板进行RT-LAMP检测,结果(图5)显示仅有MCMV进行扩增反应,反应在45 min内完成且目视试剂颜色由橙黄色变为绿色;RT-PCR反应结果(图6)显示仅有以MCMV为模板的反应扩增出190 bp大小的条带。由此可知,RT-LAMP与RT-PCR均能特异性检测MCMV。

图5 RT-LAMP 特异性验证

图6 RT-PCR特异性验证
2.3 灵敏度检测
将 RNA 原液、101、102、103、104、105、106、107、108倍稀释液分别作为模板,利用所建立的RT-LAMP 反应体系和RT-PCR检测方法进行灵敏度比对。从图7可以看出,RT-PCR 以103倍稀释液为模板可以检测到显著的条带;以104倍稀释液为模板,电泳检测的条带模糊不清;以105倍稀释液为模板,电泳没有检测到任何条带。而RT-LAMP 检测时,如图8所示,以106稀释液为模板,浊度仍可以在45 min内达到检测线(AABs=0.2)。因此,RT-LAMP检测MCMV的灵敏性比普通RT-PCR至少高100倍,并且RT-LAMP比RT-PCR节省时间,非常有利于MCMV的检测应用。

图7 RT-PCR灵敏度试验电泳结果
2.4 RT-LAMP检测玉米评价
利用植物总RNA提取试剂盒,提取100个模拟带毒玉米种子样本RNA,分别进行RTLAMP和RT-PCR 检测。结果表明,RT-LAMP方法对100个待测样本的病毒检出率为100%(100/100);RT-PCR方法对100个待测样本的病毒检出率为78%(78/100),针对部分低病毒浓度模拟样本,由于灵敏度限制无法检出。

图8 RT-LAMP 灵敏度试验
3 结论与讨论
玉米在我国粮食生产中占据重要的地位,2012—2014年间,我国玉米进口总量超过1 000万t。玉米褪绿斑驳病毒随进口玉米传入我国的风险很高。为更好地服务口岸检疫部门,本研究利用RT-LAMP技术,建立针对MCMV的RTLAMP检测方法,并与普通RT-PCR方法进行比较,证实RT-LAMP检测方法具有特异性强、灵敏度高等优点。
实验中RT-LAMP反应中环引物的加入使反应达到检测线(AABs=0.2)及进入平台期(AABs=0.8)时间提前6 min,整个反应效率大大提高,确保RT-LAMP 检测在64℃等温条件下反应进行45 min即可完成,比RT-PCR反应过程节省约1 h 。在RT-LAMP反应中,利用浊度仪实时监测反应过程中浊度变化,将反应结果数据化,更加理性、客观。通过加入可视试剂钙黄素,使反应结果一目了然,避免传统凝胶电泳等过程,简化整个检测流程,节约时间且有效避免反应产物交叉污染等问题,且整个反应过程不需要大型仪器设备的支持,方便口岸现场实验室检疫。
本实验建立的RT-LAMP检测方法,快速、灵敏且特异性强,能满足针对玉米褪绿斑驳病毒的田间诊断、口岸现场检疫的要求。
[1]Jensen S G,Wysong D S,Ball E M,et al. Seed transmission of maize chlorotic mottle virus[J].Plant disease,1991,75(5):497-498.
[2]Delgadillo Sánchez F,Pons Hernández J L,Torreón Ibarra A D. Seed transmission of maize chlorotic mottle virus[J]. Revista Mexicana de Fitopatolog í a,1994,12(1):7-10.
[3]Jiang X Q,Meinke L J,Wright R J,et al. Maize chlorotic mottle virus in Hawaiian-grown maize:vector relations,host range and associated viruses[J]. Crop Protection,1992,11(3):248-254.
[4]Nault L R,Styer W P,Coffey M E,et al.Transmission of maize chlorotic mottle virus by chrysomelid beetles[J]. Phytopathology,1978,68(7):1071-1074.
[5]Goldberg K B,Brakke M K. Concentration of maize chlorotic mottle virus increased in mixed infections with maize dwarf mosaic virus,strain B[J]. Papers in Plant Pathology,1987,72(2):162-167.
[6]Nault L R,Styer W P,Coffey M E,et al.Transmission of maize chlorotic mottle virus by chrysomelid beetles[J]. Phytopathology,1978,68(7):1071-1074.
[7]Scheets K. Maize chlorotic mottle machlomovirus and wheat streak mosaic rymovirus concentrations increase in the synergistic disease corn lethal necrosis[J]. Virology,1998,242(1):28-38.
[8]Quito-Avila D F,Alvarez R A,Mendoza A A.Occurrence of maize lethal necrosis in Ecuador:a disease without boundaries[J]. European Journal of Plant Pathology,2016,146(3):705-710.
[9]Thottappilly G,Qiu W P,Batten J S,et al. A new virus on maize in Nigeria:maize mild mottle virus[J]. Plant Disease,1999,83(3):302.
[10]Kusia E S,Subramanian S,Nyasani J O,et al.First report of lethal necrosis disease associated with co-infection of finger millet with Maize chlorotic mottle virus and Sugarcane mosaic virus in Kenya[J]. Plant Disease,2015,99(6):899-900.
[11]Lukanda M,Owati A,Ogunsanya P,et al. First report of Maize chlorotic mottle virus infecting maize in the Democratic Republic of the Congo[J]. Plant Disease,2014,98(10):1448.
[12]Adams I P,Harju V A,Hodges T,et al. First report of maize lethal necrosis disease in Rwanda[J]. New Disease Reports,2014,29:22.
[13]Scheets K. Maize chlorotic mottle machlomovirus and wheat streak mosaic rymovirus concentrations increase in the synergistic disease corn lethal necrosis[J]. Virology,1998,242(1):28-38.
[14]Adams I P,Miano D W,Kinyua Z M,et al. Use of next‐generation sequencing for the identification and characterization of Maize chlorotic mottle virus and Sugarcane mosaic virus causing maize lethal necrosis in Kenya[J]. Plant Pathology,2013,62(4):741-749.
[15]Wangai A W,Redinbaugh M G,Kinyua Z M,et al. First report of maize chlorotic mottle virus and maize lethal necrosis in Kenya[J]. Journal of Virological Methods,2017,240:49-53.
[16]赵明富,黄菁,吴毅歆,等. 玉米褪绿斑驳病毒及传播介体研究进展[J]. 中国农业科技导报,2014,16(5):78-82.
[17]Xie L,Zhang J,Wang Q,et al. Characterization of maize chlorotic mottle virus associated with maize lethal necrosis disease in China[J]. Journal of Phytopathology,2011,159(3):191-193.
[18]Deng T C,Chou C M,Chen C T,et al. First report of Maize chlorotic mottle virus on sweet corn in Taiwan[J]. Phytopathology,2015,105(7):956-965.
[19]饶玉燕,尤扬,朱水芳,等. 玉米褪绿斑驳病毒入侵损失指标体系及直接经济损失评估[J].植物检疫,2010,24(2):5-8.
[20]桂芬,马洁,张永江,等. 玉米褪绿斑驳病毒抗体及 TAS-ELISA 试剂盒的研制[J]. 检验检疫学刊,2014 (6):42-45.
[21]闻伟刚,张建成,崔俊霞,等. 玉米褪绿斑驳病毒实时荧光 RT—PCR 检测方法研究[J]. 植物检疫,2011,25(1):39-42
[22]曾倡. 利用表面等离子共振生物传感器检测玉米褪绿斑驳病毒和 Cry1F 蛋白的研究[D]. 北京:北京化工大学,2012.
[23]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J]. Nucleic acids research,2000,28(12):63-63.
[24]王永江,周彦,李中安,等. 柑橘衰退病毒 RTLAMP 快速检测方法的建立[J]. 中国农业科学,2012,46(3):517-524.
[25]汤亚飞,何自福,佘小漫,等. 辣椒黄脉病毒RT-LAMP 快速检测方法的建立[J]. 植物保护,2016,42(6):100-104.
[26]Keizerweerd A T,Chandra A,Grisham M P.Development of a reverse transcription loopmediated isothermal amplification (RT-LAMP)assay for the detection of Sugarcane mosaic virus and Sorghum mosaic virus in sugarcane[J].Journal of virological methods,2015,212:23-29.
Comparison and application of RT-LAMP and RT-PCR methods for MCMV detection
SHAN Chang-lin,ZHOU Yuan,LI Xiao-jun,YANG Sai-jun,SHAO Wei-dong
(Zhoushan Entry-exit Inspection and Quarantine Bureau,Zhoushan 316021,China)
For the detection of Maize chlorotic mottle virus(MCMV),a reverse-transcription,loop mediated isothermal amplification( RT-LAMP) assay with high sensitivity and specificity was established. A set of five primers were designed,based on the coat-protein sequence of MCMV. By optimizing the concentration of primers,the best temperature,the suitable reaction time,and loop primer,the RT-LAMP was built by incubation at 64℃ for only 45 min with loop primer. The detection limit of RT-LAMP assay was 280 fg of MCMV RNA,which was 100 times more sensitive than that of RT- PCR assay. High species-specificity of RT- LAMP method was confirmed by the assay of 5 pathogens such as MCMV,SCMV,MDMV, WSMV and MWLMV. In addition,all the simulated samples were detected by LAMP assay,detection rate was 100%.
MCMV;RT-LAMP;RT-PCR;detection
S435.131.4
A
1004-874X(2017)07-0083-08
单长林,周圆,李孝军,等. RT-LAMP及RT-PCR方法快速检测玉米褪绿斑驳病毒的比较与应用[J].广东农业科学,2017,44(7):83-90.
2017-04-26
舟山市科技计划项目(2015C31051)
单长林(1987-),男,硕士,助理农艺师,E-mail:changlin_shan@163.com
(责任编辑 杨贤智)

