绿豆皮黄酮的提取纯化及其抗氧化研究
罗 磊 姬青华 焦昆鹏 朱文学 关宁宁 薛依涵(河南科技大学食品与生物工程学院;河南省农产品干燥装备工程技术研究中心,洛阳 471023)
绿豆皮黄酮的提取纯化及其抗氧化研究
罗 磊 姬青华 焦昆鹏 朱文学 关宁宁 薛依涵
(河南科技大学食品与生物工程学院;河南省农产品干燥装备工程技术研究中心,洛阳 471023)
本研究对绿豆皮黄酮微波辅助提取、大孔吸附树脂纯化及其体外抗氧化活性进行研究。结果表明,当绿豆皮黄酮的微波辅助提取条件为液料比35:1,微波时间80 s,微波功率540 W,乙醇体积分数70%时,绿豆皮黄酮的提取量达到8.467 mg/g。15种树脂的吸附和解吸动力学研究结果表明,NKA-9型大孔吸附树脂对绿豆皮黄酮有较好的纯化效果,纯化后黄酮的纯度由37.14%提高到71.08%,黄酮回收率可达82.8%。抗氧化活性试验表明,绿豆皮黄酮清除超氧阴离子自由基的能力与作用时间成反比,与提取液质量浓度成正比;绿豆皮黄酮对1,1-二苯基-2-三硝基苯肼自由基和·OH自由基有较好的清除能力,经NKA-9树脂初步纯化后,其抗氧化能力显著提高。
绿豆皮 黄酮 提取 纯化 抗氧化
绿豆(PhaseolusradiatusL.)为豆科草本植物绿豆的种子[1]。绿豆皮是绿豆经泡发后的种皮,中医称为绿豆衣,其本身清热的效果比绿豆更强,研究表明绿豆皮中含有丰富的黄酮类化合物、鞣质、皂甙生物碱、强心甙、蒽醌类化合物等成分[2],其中黄酮类化合物占50%左右。黄酮类化合物具有抗氧化、抗肿瘤、清热解毒、止泻利尿、防治心血管疾病等保健功效[3-5]。绿豆皮占绿豆总质量的7%~10%,绿豆芽在加工过程中,由于采用“去皮”或“去渣”等工序,将产生大量绿豆皮下脚料,而这些绿豆皮或被丢弃或作为廉价饲料,造成资源的极大浪费。
近年来研究者对绿豆皮黄酮的提取进行了初步研究,张燕等[6]采用水浴回流提取绿豆皮黄酮,120 min后提取量达到3.879 mg/g;朱文学等[7]对绿豆皮黄酮超声水提工艺进行研究,75 min后提取量可达10.18 mg/g。微波提取技术利用微波场的生物效应,直接作用于提取物中的分子,会加速活性成分的溶出,溶剂用量少,节省时间,提取率高[8];在我国,微波提取技术已经用于上百种中草药,例如,葛根、茶叶等;国外微波提取技术主要是通过设置微波条件使目标物的纯度得以提高,它广泛应用于食用油、香料等方面。大孔吸附树脂具有选择性好、吸附速度快、解吸容易、再生方便的特点[9-10],适于黄酮类物质的纯化。
因此,本研究采用微波辅助提取绿豆皮黄酮,通过比较15种大孔吸附树脂对绿豆皮黄酮的吸附和解吸性能,筛选出适合绿豆皮黄酮分离纯化的大孔吸附树脂,并对纯化后的黄酮进行体外抗氧化分析,对充分利用绿豆资源,实现绿豆皮的“变废为宝”,开发具有高附加值和保健功效的绿豆产品具有重要的参考价值。
1 材料与方法
1.1 材料与试剂
绿豆皮:采购于洛阳市新农村蔬菜食品有限公司。于45 ℃恒温干燥箱中干燥至质量恒定,粉碎过80目筛后备用。
15种大孔吸附树脂:HPD450型、S-8型、NKA-9型、D301型、AB-8型、X-5型、DM130型、HPD100型、HPD300型、NKA-2型、DM301型、D101型、AB-7型、D141型、ADS-17型,均购于沧州宝恩吸附材料科技有限公司。
试验试剂:芦丁(CAS号:153-18-4):上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):上海伊卡生物技术有限公司;无水乙醇、醋酸、醋酸钠、三氯化铝等均为国产分析纯,购于洛阳奥科化玻公司。
1.2 仪器与设备
HC-1000Y型高速粉碎机:北京市永光明医疗仪器厂;WD900B型微波炉:顺德市格兰仕微波炉电器有限公司;UV2400紫外-可见分光光度计:上海舜宇恒平科学仪器有限公司;湘仪TDZ5-WS型离心机:上海圣科仪器设备有限公司;THZ-82气浴恒温振荡器:金坛市鸿科仪器厂;Re-52A旋转蒸发器:上海亚荣生化仪器厂。
1.3 试验内容与方法
1.3.1 标准曲线绘制
采用醋酸-醋酸钠-三氯化铝显色法[11],对样品进行全波长扫描,确定最大吸收峰在270 nm,以芦丁为标准品,得到线性回归方程为:y=25.405x+0.128 5,其中x为黄酮质量浓度/mg·mL-1,y为吸光度,相关系数R2=0.996 3。
1.3.2 绿豆皮黄酮提取液的制备
一定量的绿豆皮粉末和乙醇溶液按一定液料比(mL/g)混合均匀后进行微波提取,提取液4 800 r/min离心10 min,在40 ℃下旋蒸至无醇味,再加入4倍体积无水乙醇除去蛋白质和多糖,经过滤、离心、浓缩之后定容,于270 nm测吸光度。
1.3.3 绿豆皮黄酮含量的测定
吸取黄酮粗提液0.4 mL,以醋酸-醋酸钠-三氯化铝显色法,在270 nm处测吸光度并利用回归方程计算得到绿豆皮黄酮提取液中总黄酮的含量,计算公式如下:
(1)
式中:C为提取液黄酮的浓度/mg·mL-1;V为提取液体积/mL;N为稀释倍数;m为原料质量/g。
1.3.4 微波提取的单因素试验设计
在微波时间为80 s,微波功率为540 W,液料比为10:1,乙醇体积分数为70%的条件下,进行单因素试验。分别考察微波时间(60、80、100、120、140、160 s),微波功率(180、360、540、720、900 W),液料比(10:1、20:1、30:1、40:1、50:1、60:1 mL/g),乙醇体积分数(40%、50%、60%、70%、80%、90%)对绿豆皮黄酮提取量的影响。
1.3.5 绿豆皮黄酮微波提取工艺的优化
根据单因素试验结果,对微波时间(A)、微波功率(B)、液料比(C)和乙醇体积分数(D)4个因素进行L9(34)正交试验设计,因素水平见表1。
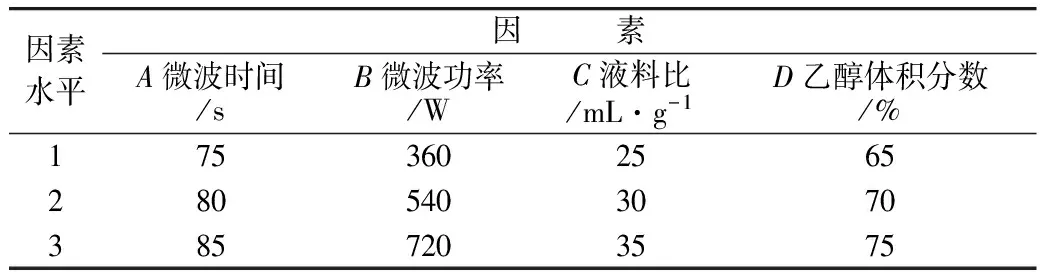
表1 正交设计试验因素水平表
1.3.6 大孔吸附树脂的筛选
1.3.6.1 大孔吸附树脂的预处理
根据参考文献[12]作适当修改,即15种大孔树脂各称取一定量,用无水乙醇浸泡24 h后蒸馏水洗至无醇味,然后用4% HCl溶液浸泡5 h,蒸馏水洗至中性;再用4% NaOH溶液浸泡5 h,蒸馏水洗至中性,备用。
1.3.6.2评价指标的测定[13]及吸附-解吸动力学[14]
分别称取15种大孔树脂各1.00 g,置于100 mL具塞锥形瓶中,各加入30 mL质量浓度为0.46 mg/mL的绿豆皮黄酮溶液,于恒温振荡器(25 ℃,120 r/min)振荡吸附24 h,之后取出抽滤,测定滤液中黄酮含量。将充分吸附后的15种树脂分别置于100 mL具塞锥形瓶中,各加入30 mL体积分数为80%的乙醇,于恒温振荡器(25 ℃,120 r/min)振荡解吸24 h,之后抽滤并测定滤液中黄酮含量。
选取上述15种型号树脂中吸附和解吸效果最好的6种树脂,按照上述操作,于恒温振荡器(25 ℃,120 r/min)振荡吸附和解吸12 h,每隔一定时间吸取上清液测吸光度,计算吸附率和解吸率,绘制大孔树脂的静态吸附和解吸曲线。按下列公式计算15种树脂的吸附率和解吸率。
(2)

(3)
式中:A为吸附率/%;D为解吸率/%;C0为吸附前黄酮质量浓度/mg·mL-1;C1为吸附后黄酮质量浓度/mg·mL-1;C2为解吸后黄酮质量浓度/mg·mL-1。
1.3.7 绿豆皮黄酮的纯化
根据静态吸附和解吸曲线筛选出最佳树脂[15]。称取该树脂1.00 g,置于100 mL具塞锥形瓶中,加入质量浓度为C1的绿豆皮黄酮提取液V1,于恒温振荡器(25 ℃,120 r/min)振荡吸附12 h,然后取出吸附后的树脂,加入30 mL体积分数为95%的乙醇溶液,于恒温振荡器(25 ℃,120 r/min)振荡解吸12 h。所得解吸液于50 ℃减压浓缩至无醇味,定容至一定体积V2,测定黄酮浓度C2。按下式计算其纯度和回收率。
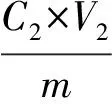
(4)

(5)
式中:P为黄酮的纯度/%;Q为黄酮的回收率/%;C1为纯化前黄酮质量浓度/mg·mL-1;V1为纯化前黄酮总体积/mL;C2为纯化后黄酮质量浓度/mg·mL-1;V2为纯化后黄酮定容体积/mL;m为冻干后样品质量/mg。
1.3.8 绿豆皮黄酮抗氧化活性的研究
参照连苯三酚法[16],配制纯化前后不同浓度的绿豆皮黄酮提取液,按表2加样,迅速摇匀后每隔30 s以10 mmol/L HCl溶液为参比液,于320 nm处测定相应吸光度值,至3 min止,按下面公式计算清除率。

(6)表2 连苯三酚试验加样表
1.3.8.2 清除DPPH自由基
根据参考文献[17-18]作部分修改,将不同质量浓度的绿豆皮黄酮和VC阳性对照溶液各2 mL与2 mL DPPH(10-4mol/L,95%乙醇)溶液混匀后,避光反应20 min,于波长517 nm处测定吸光度Ai;2 mL空白样品(蒸馏水)与2 mL DPPH溶液混匀,避光反应20 min后测定吸光值为Ac,将2 mL不同质量浓度的样品溶液和VC阳性对照溶液与2 mL 95%乙醇混匀后测定吸光度值为Aj,按下式计算DPPH自由基清除率。
(7)
1.3.8.3 清除·OH自由基
根据参考文献[19],采用水杨酸法对绿豆皮黄酮进行·OH自由基清除试验。
1.3.8.4 还原能力
根据参考文献[20],采用铁氰化钾还原法对绿豆皮黄酮进行还原能力的测定。
2 结果与分析
2.1 微波辅助提取绿豆皮黄酮研究
2.1.1 单因素试验结果
由图1可知,黄酮提取量随微波时间的增加先上升后下降。当微波时间为80 s时,黄酮提取量达到6.71 mg/g,80 s之后黄酮提取量缓慢下降。当微波功率从180 W上升到540 W时,黄酮提取量从3.98 mg/g上升到6.96 mg/g,微波功率继续上升时,黄酮提取量显著下降。黄酮提取量随液料比的增加先增加后减少,当液料比在10:1~30:1时,黄酮提取量逐渐增加,当液料比在30:1时,黄酮提取量达到最大7.49 mg/g,当液料比高于30:1时,黄酮提取量逐渐下降。当乙醇体积分数在40%~70%时,黄酮提取量逐渐增加,当到达70%时,提取量最高,为5.21 mg/mL,当乙醇的体积分数大于70%时,黄酮提取量呈下降趋势。综上所述,选择微波时间80 s,微波功率为540 W,液料比为30:1,乙醇体积分数为70%。

图1 四因素对绿豆皮黄酮提取量的影响
2.1.2 正交试验结果分析
以绿豆皮黄酮提取量为评价指标,进行正交试验。结果与分析见表3,其方差分析见表4。
试验数据采用DPS数据处理软件进行统计分析,并采用Duncan新复极差法对数据进行差异显著性检验[21]。由表3可知,影响黄酮提取量的因素大小依次为液料比>乙醇体积分数>微波时间>微波功率。较优组合:微波时间80 s,微波功率540 W,液料比35:1,乙醇体积分数70%,此时黄酮提取量最高,但是最优搭配A2B2C3D2在正交试验中未出现,因此进行验证试验,结果见表5,由表可知,在最优搭配条件下,绿豆皮黄酮的提取量达到8.467 mg/g,高于正交表中其他组合的提取量,由此证明正交试验结果准确可靠。
由方差分析表可知,微波功率、微波时间、液料比和乙醇体积分数在α=0.01下对绿豆皮黄酮提取量影响极其显著。

表3 正交试验极差分析表
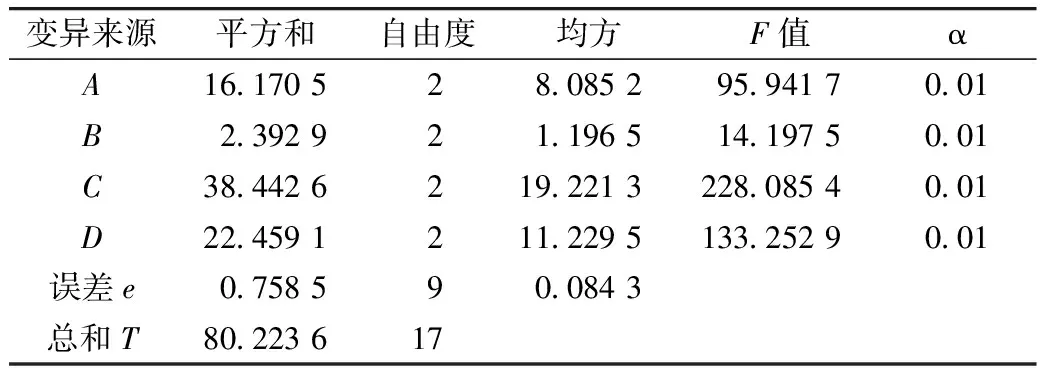
表4 正交试验方差分析表
注:F0.01(2,9)=8.0,F0.05(2,9)=4.26。
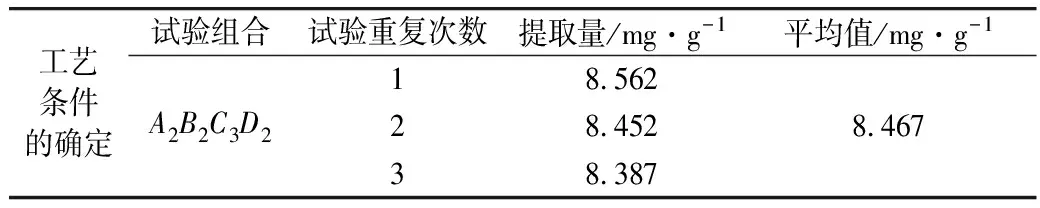
表5 验证试验结果
2.2 绿豆皮黄酮大孔吸附树脂纯化研究
2.2.1 大孔吸附树脂的筛选
按照1.3.6.2方法对15种树脂进行静态吸附和解吸试验,并结合树脂的极性、比表面积分析15种大孔吸附树脂的吸附和解吸性能,结果见表6。
大孔吸附树脂的极性和比表面积对绿豆皮黄酮吸附和解吸有很大的影响,比表面积越大,其吸附量就越大[22],黄酮类物质的极性比较大,因此极性越大的树脂对黄酮的吸附效果会越好。
由表6可知,大孔吸附树脂对绿豆皮黄酮的吸附和解吸有较强的选择性。其中,NKA-9、D301、AB-8、DM130、HPD300、D101树脂的吸附率要明显高于其他树脂,而NKA-9、AB-8、DM130、NKA-2、D101、DM301树脂的解吸率要高于其他树脂。原因可能是NKA-9、D301、DM130是极性树脂,与绿豆皮黄酮通过静电作用吸附;绿豆皮黄酮中可能含有酚羟基和糖苷键,具有一定的极性和亲水性,有利于AB-8弱极性树脂的吸附;而HPD300、D101树脂比表面积较大,对绿豆皮黄酮的吸附率高,但解吸率较低。综合考虑吸附率和解吸率这2个指标,选择NKA-9、AB-8、NKA-2、DM130、DM301、D101这6种树脂通过静态吸附和解吸动力曲线进行进一步筛选。

表6 不同大孔树脂对黄酮的静态吸附和解吸结果
2.2.2 静态吸附和解吸动力学曲线
由图2可知,6种树脂对绿豆皮黄酮的吸附为快速平衡型。在0~2 h之间,树脂吸附速度较快,2~5 h之间,吸附趋于平缓,6 h之后吸附基本平衡,D101、DM301和NKA-9树脂的吸附率明显高于NKA-2、DM130和AB-8。在2~5 h之间随着时间的增加,解吸率逐渐上升,6 h后,解吸率基本达到平衡,AB-8、NKA-9和NKA-2树脂的解吸率显著高于DM130、DM301和D101。综合考虑6种树脂的吸附和解吸效果,选取NKA-9型大孔树脂作为纯化绿豆皮黄酮的最佳树脂。
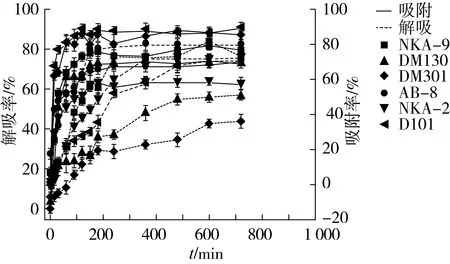
图2 不同型号树脂静态吸附和解吸动力学曲线
2.2.3 NKA-9树脂对绿豆皮黄酮的纯化
按照1.3.7对绿豆皮黄酮进行纯化,结果表明,每使用1.00 g树脂纯化绿豆皮黄酮,可得总黄酮回收率为82.8%,说明NKA-9树脂吸附量大,黄酮回收率高,结果见表7。

表7 NKA-9树脂纯化绿豆皮黄酮的纯度和回收率
2.3 绿豆皮黄酮抗氧化活性研究
由图3可知,当质量浓度不变时,纯化前后绿豆皮黄酮提取液清除超氧阴离子自由基的能力与作用时间成反比;在相同反应时间时,其清除超氧阴离子自由基的能力大致与提取液的质量浓度成正比,纯化后绿豆皮黄酮清除超氧阴离子自由基的能力显著高于纯化前的。在反应时间为30 s,质量浓度为0.5和1 mg/mL时,纯化前的清除率达到70.8%和86%,纯化后的清除率达到85.8%和97%。当反应时间在120 s后,其清除率变化较小。
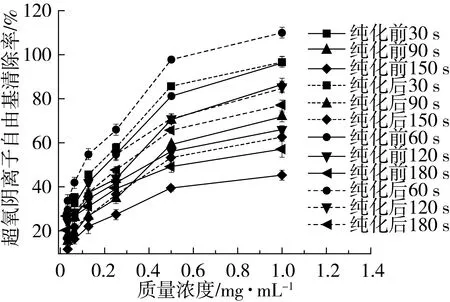
图3 绿豆皮黄酮纯化前后的清除效果
2.3.2 清除DPPH自由基
从图4可知,随着绿豆皮黄酮和VC质量浓度的增加,DPPH自由基清除率逐渐上升。在质量浓度较低时,绿豆皮黄酮和VC对DPPH自由基清除差异不显著,随着质量浓度增加,其DPPH自由基清除率低于同一质量浓度的VC,当质量浓度为62.5 μg/mL时,VC和纯化前后绿豆皮黄酮DPPH自由基清除率分别达到87.1%、75.54%和80.6%。
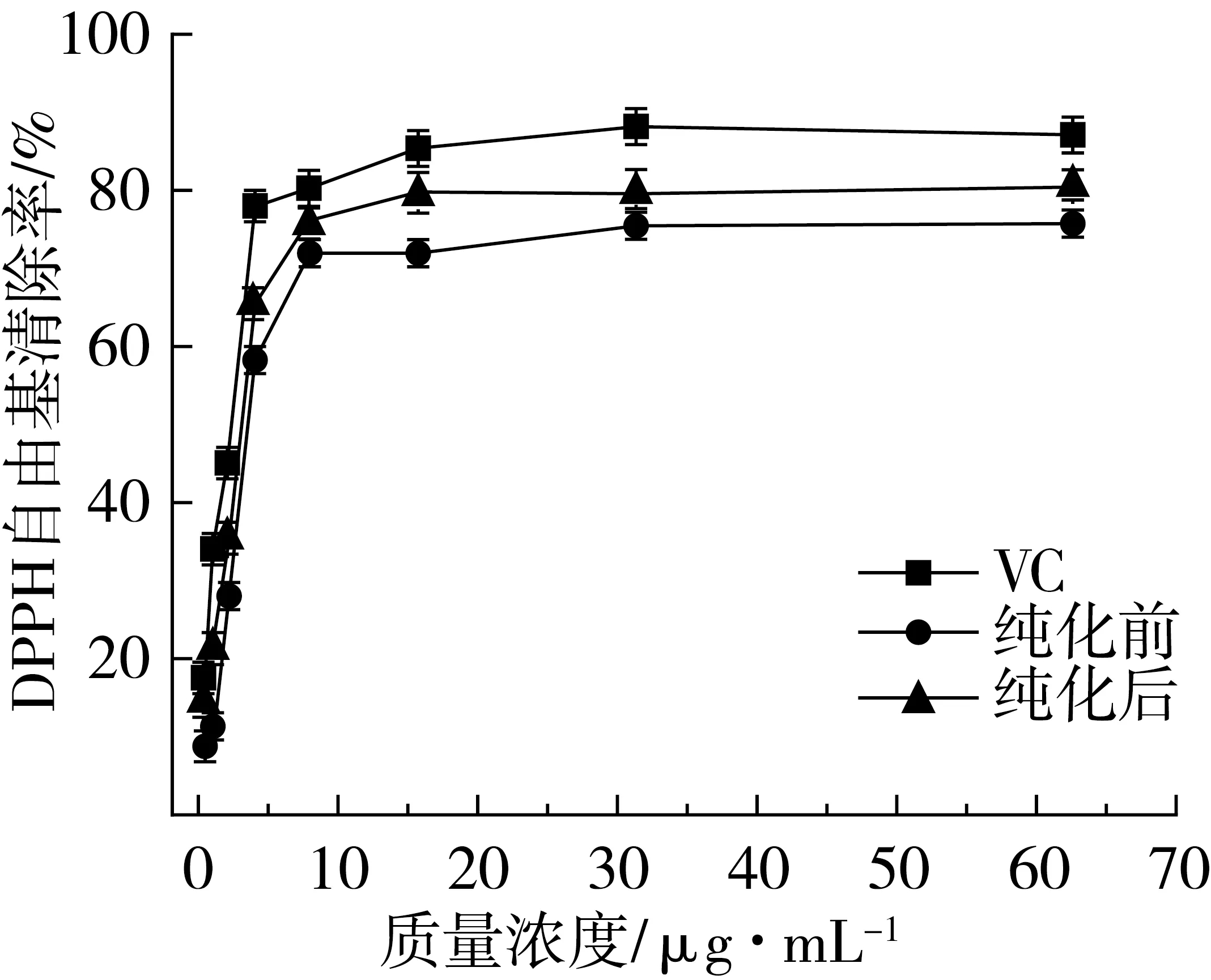
图4 绿豆皮黄酮DPPH自由基清除效果
2.3.3 清除·OH自由基
从图5可知,绿豆皮黄酮和VC对·OH自由基清除能力与质量浓度呈正相关。在同一质量浓度下,绿豆皮黄酮的清除能力低于VC,当质量浓度从31.25 μg/mL上升到125 μg/mL时,VC的清除率从51.3%上升到75.1%,绿豆皮黄酮清除率从20.49%上升到58.56%。当质量浓度在500 μg/mL和1 000 μg/mL时,纯化前黄酮的清除率分别达到89.04%和92.78%,纯化后黄酮的清除率分别达到94.55%和96.27%。
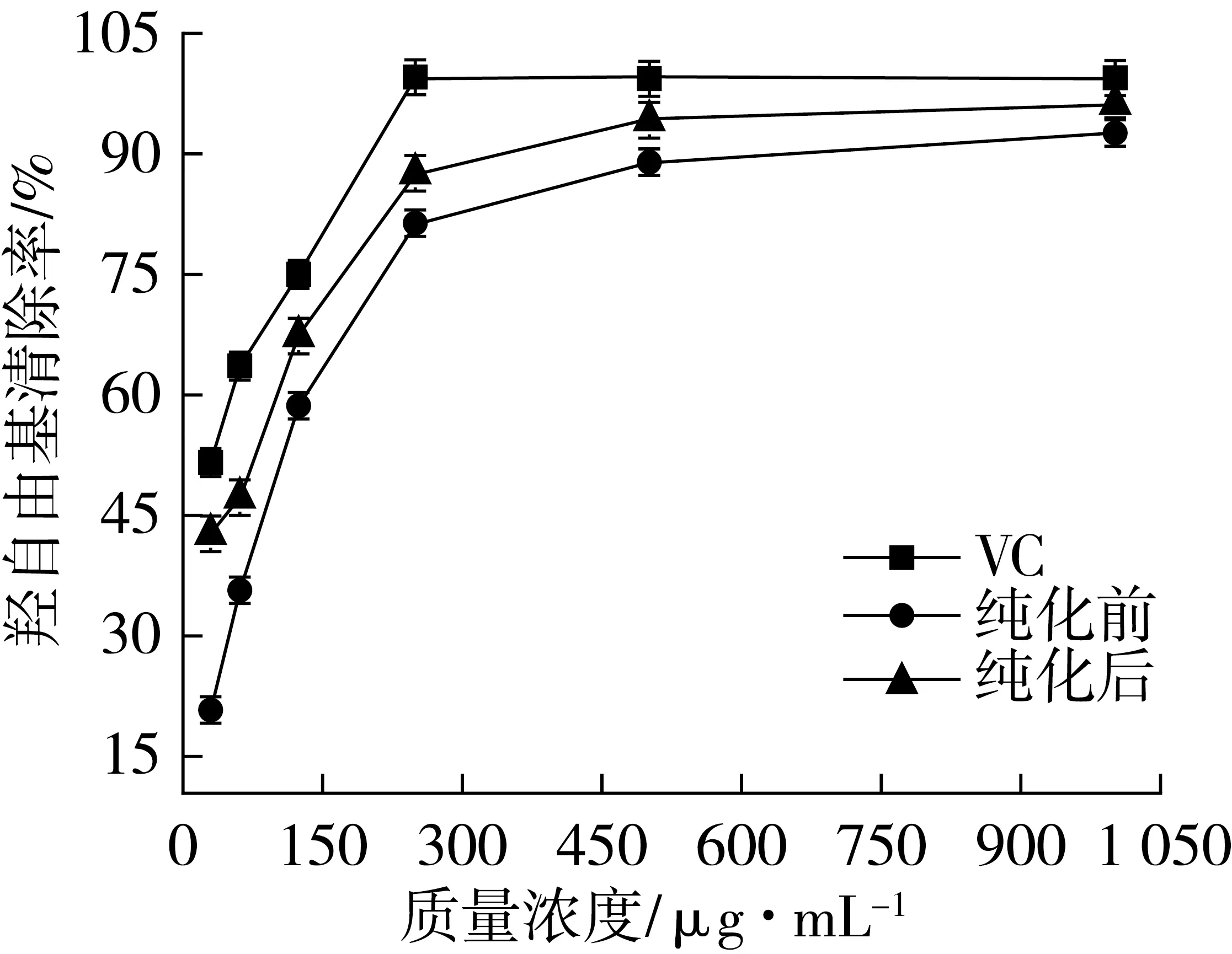
图5 绿豆皮黄酮羟自由基清除效果
2.3.4 还原能力
在还原能力的分析中,所测样品中的黄酮会使反应体系中的Fe3+还原成Fe2+,在700 nm的吸光度变化反应出还原能力的高低,吸光度越高说明还原能力越强[23]。由图6可知,随质量浓度的增加,VC和绿豆皮黄酮物质的还原能力逐渐加强,质量浓度在1 000 μg/mL以下时,还原能力上升趋势显著,当质量浓度为4 000 μg/mL时,VC和黄酮的还原力分别为1.87和1.38,纯化后黄酮的还原力达到1.957。

图6 绿豆皮黄酮还原能力
3 结论
3.1 通过正交试验得到微波辅助提取绿豆皮黄酮的最佳工艺参数,在液料比为35:1,微波时间80 s,微波功率540 W,乙醇浓度为70%时,绿豆皮黄酮的提取量达到8.452 mg/g。
3.2 通过比较15种大孔吸附树脂对绿豆皮黄酮的静态吸附和解吸性能,选择NKA-9大孔树脂作为理想树脂,对绿豆皮黄酮进行纯化,经纯化后黄酮纯度由原来的37.14%上升到71.08%,纯度提高2倍,黄酮回收率可达82.8%。

[1]钟葵,曾志红,林伟静,等.绿豆多糖制备及抗氧化特性研究[J].中国粮油学报,2013,28(2):93-98
Zhong K,Zheng Z H,Lin W J,et al.Study on the preparation of polysaccharides from mung bean seed and anti-oxidant activity[J].Journal of the Chinese Cereals and Oils Association,2013,28(2):93-98
[2]Ravishankar D,Rajora A K,Greco F,et a1.Flavonoids as prospective compounds for anti-cancer therapy[J].International Journal of Biochemistry and Cell Biology,2013,45(12):2821-2831
[3]Okoth D A,Chenia H Y,Koorbanally N A.Antibacterial and antioxidant activities of flavonoids from Lannea alata(Engl.)Engl.(Anacardiaceae)[J].Phytochemistry Letters,2013,6(3):476-481
[4]Fu Yu,Chen Jun,Li Yanjing,et al.Antioxidant and anti-inflammatory activities of six flavonoids separated from licorice[J].Food Chemistry,2013,141(2):1063-1071
[5]Maras J E,Talegawkar S A,Qiao N,et al.Flavonoid intakes in the baltimore longitudinal study of aging[J].Journal of Food Composition and Analysis,2011,24(8):1103-1109
[6]张燕,么杨,潘国清,等.绿豆皮中总黄酮的提取工艺研究[J].中国粮油学报,2009,24(10):124-127
Zhang Y,Yao Y,Pan G Q,et al.Extraction conditions for flavonoids from mung bean coat[J].Journal of the Chinese Cereals and Oils Association,2009,24(10):124-127
[7]朱文学,焦鲲鹏,罗磊,等.绿豆皮黄酮的超声波辅助水提工艺优化及抗氧化活性[J].食品科学,2015,36(16):12-17
Zhu W X,Jiao K P,Luo L,et al.Optimization of ultrasonic-assisted extraction and antioxidative activities of total flavonoids from mung bean(phaseolus radiatus)hull[J].Food Science,2015,36(16):12-17
[8]Pare J R J,Pbelanger J M R,Stafford S S.Microwave-assisted process(MAPTM)a:a new tool for the analytical laboratory[J].Trend Anal Chem,1994,13(4):176-184
[9]顾采琴,谢琳琳,张织芬,等.香蕉皮黄酮的分离纯化及抑菌活性研究[J].食品科学,2013,34(16):98-102
Gu C Q,Xie L L,Zhang Z F,et al.Purification and antimicrobial activity of total flavonoid from banana peel[J].Food Science,2013,34(16):98-102
[10]Soto M L,Moure A,Dominguez H,el al.Recovery,concentration and purification of phenolic compounds by adsorption:a review[J].Journal of Food Engineering,2011,105(1):1-27
[11]李新华,付莲.响应面分析法优化绿豆皮黄酮类物质提取工艺[J].粮食加工,2013,38(3):59-61
Li X H,Fu L.Optimization of extraction technology of flavonoids from mung bean by response surface method[J].Food Processing,2013,38(3):59-61
[12]安晓婷,周涛,李春阳,等.大孔树脂纯化蓝莓果渣多酚及其组成分析[J].食品科学,2013,34(20):1-6
An X T,Zhou T,Li C Y,el al.Macroporous resin purification of polyphenols from blueberry pomace and its composition analysis[J].Food Science,2013,34(20):1-6
[13]陈晓侠,宋渊,张纪柏,等.吸附树脂对蛹虫草黄酮纯化工艺条件优化[J].食品科学,2015,36(4):68-73
Chen X X,Song Y,Zhang J B,el al.Purification of flavonoids from cordyceps militaris by macroporous adsorption resin[J].Food Science,2015,36(4):68-73
[14]叶伶菊.Diaion HP-20 大孔吸附树脂分离纯化含羞草种子中的黄酮类物质[D].保定:河北大学,2015
Ye L J.Separation and puriifcation of flavonoids from mimosa pudica using Diaion HP-20 macroporous adsorption resin[D].Baoding:Hebei University,2015
[15]孙京沙,张朝辉.大叶藻总黄酮的大孔树脂纯化工艺[J].食品科学,2014,35(14):5-10
Sun J S,Zhang C H.Purification of flavonoids from zostera marina L.by macroporous resin adsorption[J].Food Science,2014,35(14):5-10
[16]陈旭丹,于晓莹,郝晓萌,等.三种黄酮类化合物抗自由基的研究[J].食品研究与开发,2007,28(6):20-22
Chen X D,Yu X Y,Hao X M,el al.The study of many flavonoids in anti-free radicals[J].Food Research and Development,2007,28(6):20-22
[17]刘帅涛,陶慧林,李锦艳.4种黄酮小分子对DPPH自由基的清除作用及构效关系研究[J].分析测试学报,2013,31(1):71-75
Liu S T,Tao H L,Li J Y.Structure-activity relationship of four flavonoids on scavenging activities to DPPH free radical[J].Journal of Instrumental Analysis,2013,31(1):71-75
[18]Liu L X,Sun Y,Laura T,et al.Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J.Tseng[J].Food Chemistry,2009,112(1):35-41
[19]熊双丽,李安林.夏枯草总黄酮的提取分离与自由基清除活性研究[J].食品科学,2010,31(22):194-197
Xiong S L,Li A L.Extraction,isolation and free radical-scavenging activity of flavonoids from prunella vulgaris linn[J].Food Science,2010,31(22):194-197
[20]Wan Pengfei,Sheng Zunlai,Han Qiang,et al.Enrichment and purification of total flavonoids from flos populi extracts with macroporous resins and evaluation of antioxidant activities in vitro[J].Journal of Chromatography B Analytical Technologies in the Biomedical and life Sciences,2013,945-946(2):68-74
[21]张仲欣,杜双奎.食品实验设计与数据处理[M].郑州:郑州大学出版社,2011:217-229
Zhang Zhongxin,Du Shuangkui.Food experimental design and data processing[M].Zhengzhou:Zhengzhou University Press,2011:217-229
[22]杨喆,万山,张乔会,等.大孔树脂纯化山杏核壳总黄酮的工艺优化[J].食品科学,2015,36(10):38-42
Yang Z,Wan S,Zhang Q H,et al.Purification of total flavonoids from shells of wild apricot with macroreticular resin[J].Food Science,2015,36(10):38-42
[23]陈红梅,谢翎.响应面法优化半枝莲黄酮提取工艺及体外抗氧化分析[J].食品科学,2016,37(2):45-50
Chen H M,Xie L.The response surface method to optimize these flavonoids extraction technology and antioxidant activity in vitro analysis[J].Food Science,2016,37(2):45-50.
Extraction Purification and Antioxidation of Flavonoids from Mung Bean Hull
Luo Lei Ji Qinghua Jiao Kunpeng Zhu Wenxue Guan Ningning Xue Yihan
(College of Food & Bioengineering,Henan University of Science and Technology;Henan Agricultural Products Drying Equipment Engineering Technology Research Center,Luoyang 471023)
Study on microwave-assisted extraction,macroporous resin purification and in vitro antioxidant activity of flavonoids from mung bean hull.The results showed that the optinal extraction parameters were as follow:liquid-to-solid ratio,35:1,microwave time,80 s,microwave power,540 W,ethanol volume fraction,70%,leading to the maximum extraction yield of 8.467 mg/g.The results of the 15 kinds of resin adsorption and desorption kinetics studies showed that NKA-9 resin revealed a good ability to purification flavonoids from mung bean hull.After the purification,the purity of flavonoids from mung bean hull was increased from 37.14% to 71.08%,the recovery of flavonoids reached up to 82.8%.Antioxidant activity tests of the flavonoids from mung bean hull showed that its ability of scavenging effects on superoxide action free radical was inversely proportional to the time,while it become direct ratio get along with consistence.It had a better scavenging activity of 1,1-diphenyl-2-picrylhydrazyl(DPPH)radical and the hydroxyl radical.After purification,antioxidant activities were improved significantly than before.
mung bean hull,flavonoids,extraction,purification,antioxidant activities
TS214.9
A
1003-0174(2017)09-0109-07
国家自然科学基金(U1304330),河南省高校创新团队计划(17IRSTHN016)
2016-08-18
罗磊,男,1976年出生,博士,食品干燥品质控制、食品营养成分与活性
朱文学,男,1967年出生,教授,农产品加工研究

