固体碱催化剂Ru-MgZr催化制备共轭亚油酸的研究
陈新香 陈杰博 苏金为 祁建民
(福建农林大学生命科学学院,福州 350002)
固体碱催化剂Ru-MgZr催化制备共轭亚油酸的研究
陈新香 陈杰博 苏金为 祁建民
(福建农林大学生命科学学院,福州 350002)
采用水热法制备了Ru-MgZr固体碱催化剂,通过XRD、XRF和CO2-TPD等方法对催化剂进行表征。结果显示,镁离子进入ZrO2晶格中形成固溶体,生成了新的碱性位点。试验结果表明,Ru-MgZr固体碱作为多相催化剂在亚油酸异构化反应中表现出良好的催化性能。在镁锆摩尔比为4∶1,催化剂用量为0.2 g,反应温度为180 ℃,反应时间为1.5 h的条件下,亚油酸的转化率达到65.09%。此外,催化剂重复使用5次后,没有明显的活性损失。通过气相色谱分析表明,产物主要为共轭亚油酸,其中以具有生物活性的9c,11t-CLA、10t,12c-CLA和9t, 11t-CLA 3种异构体为主。
固体碱催化剂 多相催化剂 亚油酸 异构化反应 共轭亚油酸
共轭亚油酸(Conjugated Linoleic Acid,简称CLA)是一系列含有共轭双键、具有位置和空间异构的十八碳二烯酸。国内外大量的研究表明[1-6],在共轭亚油酸的多种异构体中,9c,11t-CLA、 10t, 12c-CLA和9t, 11t-CLA被证实具有很多重要的生物活性作用,如促进细胞分裂、促进生长、提高机体免疫能力、抑制肿瘤、减少脂肪沉积,降低胆固醇和抗动脉硬化作用等,共轭亚油酸的应用价值受到广泛关注,成为药物和功能食品等研究领域中的热点之一[2,7-10]。
近年来,随着对CLA生理活性的深入了解,人们对CLA的需求不断增多,然而,自然界中CLA主要存在于反刍动物牛和羊等的肉及乳制品中,但人们难以从这些天然产物中大量提取CLA。人工合成CLA有望解决这一需求。目前,传统的工业生产方法大多采用均相碱异构法,该法采用强碱(KOH、NaOH和乙醇钾等)作为均相催化剂催化合成共轭亚油酸[11-13],虽然催化效果较好,但是均相碱异构法存在催化剂无法回收再利用,污水排放量大以及设备腐蚀严重等问题。而采用固体碱催化剂来代替均相催化剂,能有效避免传统方法的弊端,是一种环境友好型的催化剂。本课题组前期研究发现,采用共沉淀法制得Ru-MgAl催化剂可应用于合成共轭亚油酸的异构化体系中,并取得较好的效果[14]。在此基础上,本试验采用水热法制得Ru-MgZr固体碱催化剂,研究了该催化剂对亚油酸异构化反应的催化性能,并考察了镁锆摩尔比、催化剂用量、反应温度、反应时间等对亚油酸转化率的影响,确定最佳工艺条件。
1 材料与方法
1.1 材料与仪器
3种共轭亚油酸异构体甲酯(9c, 11t、10t, 12c和9c, 11t) 标样和内标物十七烷酸甲酯标样:NU-CHEK有限公司;95%亚油酸、亚油酸甲酯标准品、98%十一烷、正己烷及50%~52%三氟化硼甲醇络合物:阿拉丁化学试剂有限公司。
SZCL-2型恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;Philip X’pert-MPD型X射线衍射仪:荷兰Philip公司;Axios型X射线荧光元素分析仪(XRF):荷兰Panalytical公司;AutoChemⅡ2920全自动化学吸附仪:美国Micromeritics公司;GC-7890A型气相色谱仪:美国安捷伦科技公司。
1.2 试验方法
1.2.1 催化剂的制备
取4.29 g的Zr(NO3)4·5H2O、10.25 g的MgCl2·6H2O和0.109 g的RuCl3·xH2O溶解于40 mL蒸馏水中配成混合盐溶液,与2 mol/L的NaOH溶液缓慢并流滴加至带搅拌的预加有30 mL蒸水馏的三颈烧瓶中,滴加过程中维持溶液的pH值在10左右。溶液滴加完毕后,将所得混合物转移到带有聚四氟乙烯内衬的不锈钢水热反应釜中,在150 ℃下加热8 h,所得沉淀用热蒸馏水反复洗涤至无氯离子(用AgNO3检验)后,100 ℃下干燥12 h,经研磨,500 ℃空气气氛中煅烧4 h,即得镁锆摩尔比为4∶1的Ru-MgZr复合氧化物,标记为Ru-MgZr,X射线荧光分析测试结果表明所制得复合氧化物中Ru的实际质量分数为0.7%。
1.2.2 催化剂的表征
催化剂晶相结构测定在X射线衍射仪[CuKα辐射,波长λ=0.154 06 nm,扫描范围2θ介于10°~80°, 扫描速率5(°)/min]上进行。
采用X射线荧光元素分析仪(XRF)测定催化剂中各元素的相对含量。
二氧化碳程序升温脱附(CO2-TPD)测定在AutoChemⅡ2920全自动化学吸附仪上进行,采用TCD进行测量。具体过程如下:将100 mg催化剂置于U型石英管中,从室温起,在He气气氛中,以10℃/min的升温速率加热到450 ℃,并在此温度下保持4 h,进行预处理,除去催化剂表面的吸附物;然后在He气的保护下降温至70 ℃,将He气气氛切换为10% CO2+He气氛,进行CO2吸附处理,1 h后再切换为He气吹扫1 h,待TCD基线平稳后,以10 ℃/min的升温速率从70 ℃加热到750 ℃,获得催化剂的CO2-TPD数据。所用气体流速均为50 mL/min。
1.2.3 催化反应及产品分析
1.2.3.1 催化反应
将一定量的催化剂,4 mL 0.5 mol/L的亚油酸溶液(溶剂为正十一烷,纯度98%)一次性加入到三颈烧瓶中,搅拌,通氮气,加热至设定温度,整个反应过程中都用氮气保护。反应结束后,体系冷却至室温,离心分离催化剂,上层清液即为反应产物。
1.2.3.2 产品分析
反应产物加入三氟化硼甲醇溶液进行甲酯化[15]。取20 μL甲酯化样品溶于1 mL异辛烷,溶液经0.32 μm滤膜过滤后直接进行GC分析。 GC-7890A型气相色谱仪(Agilent),配备HP-88毛细管柱(100 m×0.25 mm×0.25 μm)、FID检测器和自动进样器。进样口及检测器温度 240 ℃。柱温120 ℃保持1 min,以10 ℃/min上升到175 ℃保持15 min,接着以5 ℃/min上升到210 ℃保持5 min,然后以5 ℃/min上升到230 ℃,保持5 min。将试样与标样在相同的色谱条件下检测,根据保留时间对比来定性。采用内标法进行定量分析, 以十七烷酸甲酯为内标物。
2 结果与讨论
2.1 催化剂的表征
2.1.1 Ru-MgZr催化剂的XRD分析
Ru-MgZr催化剂的XRD衍射图如图1所示。从图1可知,该催化剂的XRD衍射图中含有四方晶相ZrO2的特征峰,并未发现单斜的ZrO2特征衍射峰,这可能是由于部分镁离子进入ZrO2的晶格中形成固溶体造成的,这与Balmer等[16]MgO可以固溶在ZrO2晶格中,能稳定其四方晶相的结论一致[16];同时,该衍射图还出现MgO的特征衍射峰,说明还有部分未形成固溶体的MgO存在。此外,该催化剂未检测到钌的氧化物的特征衍射峰,这一方面是因为钌的含量较低,另一方面也说明钌的氧化物没有出现聚集的状态,在复合氧化物中分散得较好。

图1 Ru-MgZr催化剂的XRD 衍射图
2.1.2 Ru-MgZr催化剂的CO2-TPD分析
通过CO2-TPD对Ru-MgZr催化剂的碱性进行测试,结果见图2。由图2可知,Ru-MgZr催化剂在105、204、570 ℃出现了CO2脱附峰,105 ℃处的脱附峰归属于ZrO2自身的弱碱性位;570 ℃处的脱附峰归属于催化剂表面聚集的MgO的强碱性位;此外,结合上述XRD的表征结果,可以推测204 ℃处的脱附峰应归属于MgO与ZrO2之间的相互作用,即由镁锆固溶体氧化物产生的,且该脱附峰面积较大,由此说明表面暴露的中强碱中心数目较多。
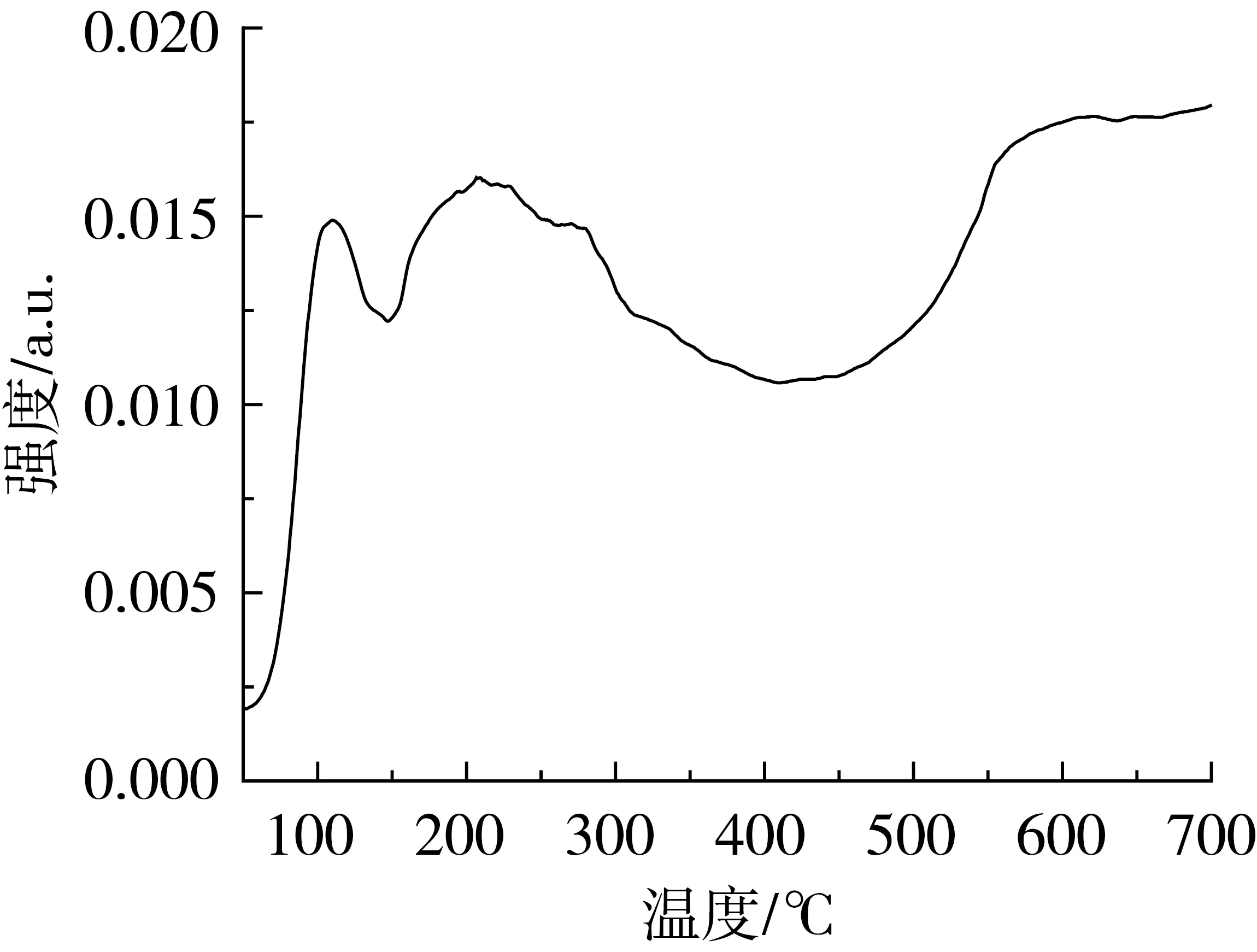
图2 Ru-MgZr催化剂的CO2-TPD谱图
2.2 反应条件对亚油酸转化率的影响
2.2.1 镁锆摩尔比对亚油酸异构化反应的影响
镁锆摩尔比会对Ru-MgZr催化剂的碱性强度产生影响[17],进而影响催化剂的活性。在反应温度为180 ℃,催化剂用量为0.2 g,反应时间为2 h条件下,不同镁锆摩尔比的催化剂对亚油酸转化率的影响见图3。由图3可以看出,随着镁锆摩尔比的增大,亚油酸转化率逐渐增大;当镁锆摩尔比为4∶1时,转化率达到最高(65.05%);继续提高镁锆摩尔比,转化率反而下降。这可能是因为随着镁含量的增加,增强了催化剂表面的碱性强度,有助于提高催化剂的活性;但当镁锆摩尔比过大时,体系出现了过量的MgO,其覆盖了部分活性位,导致催化剂活性的降低。因此,本研究中镁锆摩尔比为4∶1的Ru-MgZr复合氧化物是最理想的亚油酸异构化催化剂。

图3 不同因素对亚油酸异构化反应的影响
2.2.2 催化剂用量对亚油酸异构化反应的影响
以镁锆摩尔比为4∶1的Ru-MgZr为催化剂,考察催化剂用量对亚油酸异构化反应的影响,反应条件为:反应温度180 ℃,反应时间2 h。由图3可见,当催化剂用量为0.1 g时,亚油酸转化率较低。随着催化剂用量的增加,亚油酸的转化率不断提高,当催化剂用量为0.2 g时,亚油酸转化率达最高。随着催化剂用量的继续增加,亚油酸转化率变化不大。故选取0.2 g为最佳催化剂用量。
2.2.3 反应时间对亚油酸异构化反应的影响
以镁锆摩尔比为4∶1的Ru-MgZr为催化剂,考察反应时间对亚油酸异构化反应的影响,反应条件为:反应温度180 ℃,催化剂用量为0.2 g。由图3可见,亚油酸的转化率随反应时间的延长而迅速提高,当反应时间为1.5 h时,亚油酸的转化率达最高,为65.09%;继续延长反应时间,转化率不再增加,而逐渐趋于稳定。说明刚开始异构化反应速率很快,当反应接近平衡点时,转化率不再增加。因此,从经济和效率的角度考虑,适宜的反应时间为1.5 h。
2.2.4 反应温度对亚油酸异构化反应的影响
以镁锆摩尔比为4∶1的Ru-MgZr为催化剂,考察反应温度对亚油酸异构化反应的影响,反应条件为:催化剂用量为0.2 g,反应时间为1.5 h。由图3可知,亚油酸的转化率随反应温度的升高而增大,当反应温度为180 ℃时转化率最高;反应温度超过180 ℃后,转化率不再增加。由于溶剂十一烷的沸点约为196 ℃,故反应温度为180 ℃较为适宜。
2.2.5 催化剂的重复使用性能
催化剂的稳定性对工业化生产具有重要意义,因此,本试验还考察了催化剂在最优反应条件下的重复使用性能。将反应产物过滤分离出催化剂、经正己烷洗涤、干燥后,用于下次催化反应,结果见图4。
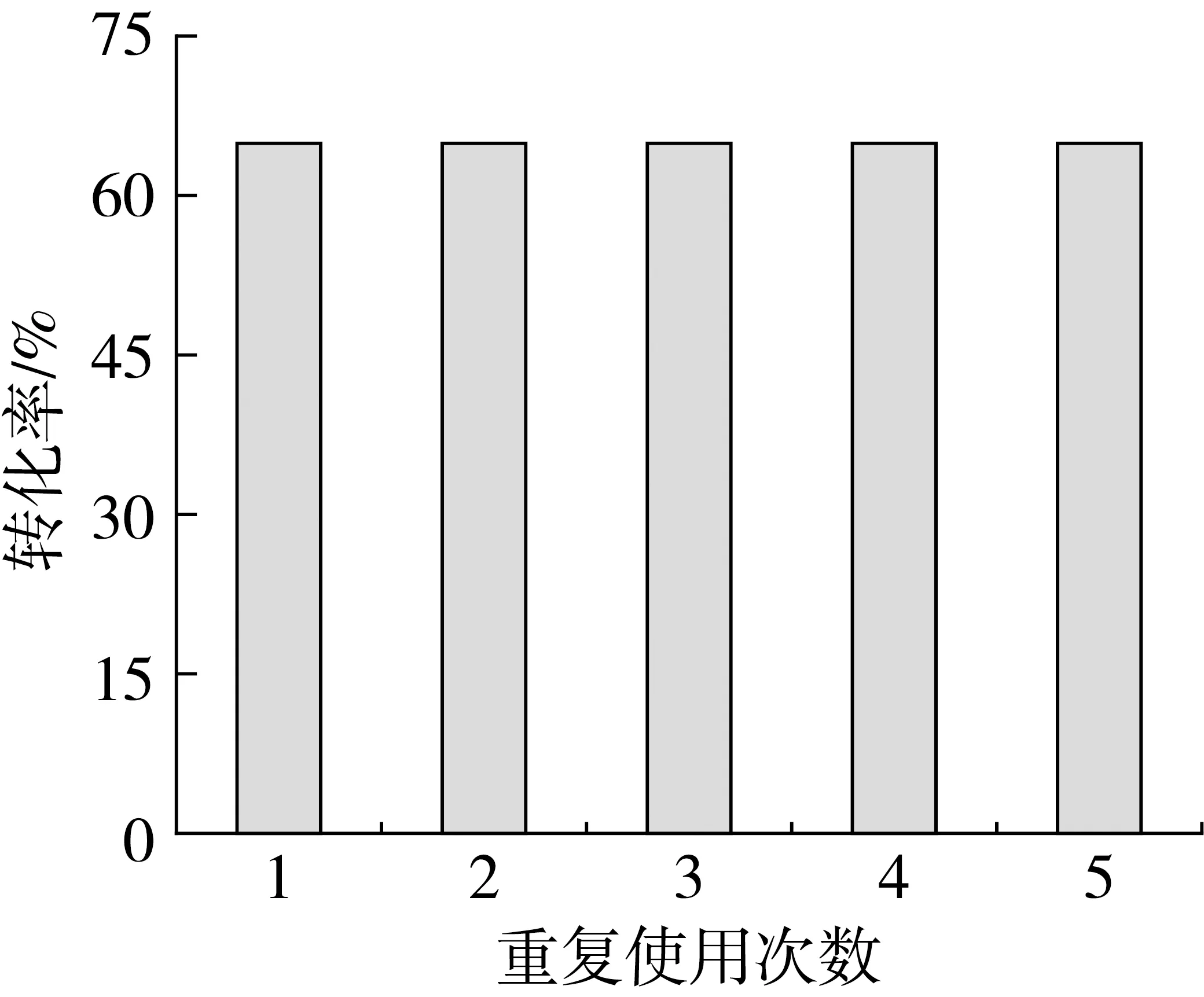
图4 催化剂的重复使用性能
由图4可见,Ru-MgZr催化剂在重复使用5次以后,亚油酸的转化率变化不大。催化剂第一次使用时,亚油酸的转化率为65.09%,催化剂重复使用5次后,亚油酸的转化率仍保持在64.89%,说明该催化剂具有较好的催化稳定性。
2.3 异构化产物的色谱分析
采用气相色谱分析甲酯化后的产物,将甲酯化后产物的保留时间与标样进行比较,确定异构化产物中的组分,结果见图5。
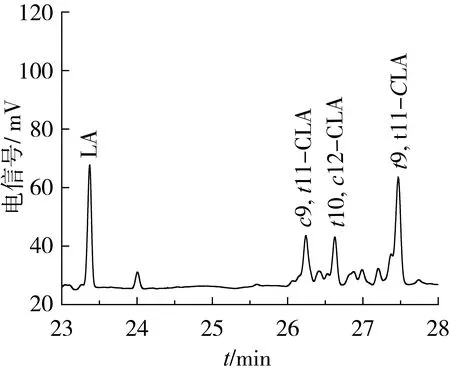
图5 产物甲酯化后的气相色谱图
由图5可见,亚油酸异构化产物主要为9c, 11t-CLA(13.30%)、10t, 12c-CLA(13.34%)和9t, 11t-CLA (33.45%),保留时间分别为26.239、26.632、27.457 min,此外,还含有其他CLA异构体,但数量很少,说明Ru-MgZr催化剂具有较高的选择性。在最优条件下,共轭亚油酸的转化率高达65.09%。
3 结论
3.1 采用水热法制备了Ru-MgZr固体碱催化剂。催化剂表征结果说明,镁离子进入ZrO2晶格中形成固溶体,生成了新的碱性位点。
3.2 Ru-MgZr固体碱作为多相催化剂在亚油酸异构化反应中具有较好的催化活性。在镁锆摩尔比4∶1,催化剂用量0.2 g,反应温度180 ℃,反应时间1.5 h条件下,亚油酸转化率可达65.09%。另外,Ru-MgZr催化剂重复使用五次后,没有明显的活性损失。
3.3 CLA产品经气相色谱分析表明,产物主要为共轭亚油酸,其中以具有生物活性的9c, 11t-CLA、10t, 12c-CLA和9t, 11t-CLA3种异构体为主,此外,还含有其他CLA异构体,但数量很少,说明Ru-MgZr催化剂具有较高的选择性。
3.4 本研究所采用的Ru-MgZr固体碱催化剂不仅具有高活性、高选择性和高稳定性,同时还兼具催化剂易分离回收,可重复使用等优点,适用于亚油酸异构化反应合成共轭亚油酸,因此具有较好的工业应用前景。
[1]Lin H, Boylston T D, Chang M J, et al. Survey of the conjugated linoleic acid contents of dairy products [J]. Journal of Dairy Science, 1995, 78(11): 2358-2365
[2]Park Y, Storkson J M, Albright K J, et al. Evidence that thetrans-l0,cis-12 isomer of conjugated linoleic acid induces body composition changes in mice [J]. Lipids, 1999, 34(3): 235-241
[3]Fritsche J, Rickert R, Steinhart H, et al. Conjugated linoleic acid isomers: formation, analysis, amounts in foods, and dietary intake [J]. European Journal of Lipid Science and Technology, 1999, 101 (8):272-276
[4]Kramer J K G, Parodi P W, Jensen R G, et al. Rumenic acid: a proposed common name for the major conjugated linoleic acid isomer found in nature products [J]. Lipids, 1998, 33(8): 835
[5]Delany J P, Blohm F, Truett A A, et al. Conjugated linoleic acid rapidly reduces body fat content in mice without affecting energy intake [J]. The American Journal of Physiology, 1999, 276: l172-1179
[6]Park Y, Albright K J, Storkson J M, et al. Changes in body composition in mice during feeding and withdrawal of conjugated linoleic acid [J]. Lipids, 1999, 34(3): 243-248
[7]Gavino V C, Gavino G, Leblanc M J, et al. An isomeric mixture of conjugated linoleic acids but not purecis-9,trans-11-octadecadienoic acid affects body weight gain and plasma lipids in hamsters [J]. Journal of Nutrition, 2000, 130(1): 27-29
[8]Cook M, Miller C C, Park Y, et al. Immune modulation by altered nutrient metabolism: Nutritional control of immune-induced growth depression [J]. Poultry Science, 1993, 72(7): 1301-1305
[9]Brodie A E, Manning V A, Ferguson K R, et al. Conjugated linoleic acid inhibits differentiation of pre and post-confluent 3T3-L1 pre-adipocytes but inhibits cell proliferation only in preconfluent cells [J]. Journal of Nutrition, 1999, 129(3): 602-606
[10]Palombo J D, Ganguly A, Bistrian B R, et al. The antiproliferative effects of biologically active isomers of conjugated linoleic acid on human colorectal and prostatic cancer cells [J]. Cancer Letters, 2002, 177(2): 163-172
[11]姜伟, 万梓龙, 衣丹, 等. 乙醇钾催化共轭化反应合成共轭亚油酸乙酯的研究[J]. 中国粮油学报, 2007, 22(3): 77-79
Jiang W, Wan Z L, Yi D, et al. Synthesizing ethyl ester of conjugated linoleic acid with kalium alcoholate [J]. Journal of the Chinese Cereals and Oils Association, 2007, 22(3): 77-79
[12]潘群文, 陈美珍, 吴演. 海篷子籽油制备共轭亚油酸及其组分分析[J]. 中国粮油学报, 2012, 27(2): 42-46
Pan Q W, Chen M Z, Wu Y. Study on the preparation of conjugated linoleic acid with salicornia herbacea seed oil and the analysis of composition [J]. Journal of the Chinese Cereals and Oils Association, 2012, 27(2): 42-46
[13]石红旗, 姜伟, 衣丹, 等. 盐地碱蓬共轭亚油酸的制备及结构分析[J]. 食品科学, 2005, 26(5): 80-84
Shi H Q, Jiang W, Yi D, et al.Study on the preparation of conjugated linoleic acid with S. salsa seed oil and the determination of molecule structures[J]. Food Science, 2005, 26(5): 80-84
[14]Chen J B, Chen X X, Zheng Y, et al. Synergetic effect of ruthenium and basicity sites in the Ru-MgAl catalyst for hydrogen-free production of conjugated linoleic acids [J]. Royal Society of Chemistry Advances, 2015, 5: 20248-20255
[15]Basile F, Fornasari G, Gazzano M, et a1. Rh, Ru and Ir catalysts obtained by HT precursors: effect of the thermal evolution and composition on the material structure and use [J]. Materials Chemistry, 2002, 12(11): 3296-3303
[16]Balmer M L, Lange F F, Levi C G. Metastable phase selection and partitioning in ZrO2-MgO processed from liquid precursors [J]. Journal of the American Ceramic Society, 1992, 75(4): 946-952
[17]Liu S G, Zhang X L, Li J P, et al. Preparation and application of stabilized mesoporous MgO-ZrO2solid base [J]. Catalysis Communications, 2008, 9(7): 1527-1532.
Preparation of Conjugated Linoleic Acid over Ru-MgZr Solid Base Catalysts
Chen Xinxiang Chen Jiebo Su Jinwei Qi Jianmin
(College of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002)
Ru-MgZr solid base catalyst was prepared by hydrothermal method. The catalyst was characterized by XRD, XRF and CO2-TPD. The characterization reveals that the Ru-MgZr catalysts generated new basic sites, which may be due to magnesium entering ZrO2lattice to form a solid solution. Results showed that Ru-MgZr solid base as a heterogeneous catalyst exhibited excellent catalytic activity in the isomerization reaction of linoleic acid. Optimal conditions were as follows: the Mg/Zr molar ratio was 4∶1, catalyst dosage was 0.2 g, reaction temperature was 180 ℃ and reaction time was 1.5 h. At these conditions, the conversion of linoleic acid could reach 65.09%. Additionally, the catalyst can be recycled and reused for 5 times without a significant loss of catalytic activity. The molecular structures of CLA preparations were determined by GC, the biologically active isomers 9c,11t-CLA, 10t, 12c-CLA and 9t, 11t-CLA, were the main products.
solid base catalyst, heterogeneous catalyst, linoleic acid, isomerization reaction, conjugated linoleic acid
TQ641
A
1003-0174(2017)09-0099-05
福建省教育厅科技项目(JB14007)
2016-07-04
陈新香,女,1982年出生,实验师,化学
苏金为,男,1952年出生,教授,化学

