连接蛋白connexin在动脉粥样硬化中的作用
陈丽娜 张伟光 吕进 秦丰明
●综 述
连接蛋白connexin在动脉粥样硬化中的作用
陈丽娜 张伟光 吕进 秦丰明
动脉粥样硬化是一个具有多种细胞参与的复杂病理过程,connexin蛋白的主要生物学功能是联系相邻细胞并传递信号。作为细胞间信号传递的分子基础,connexin蛋白与血管内皮细胞功能紊乱,血管平滑肌细胞与炎症相关细胞关系密切,在维持细胞和组织的稳态,以及疾病的发生、发展过程中发挥重要作用。
连接蛋白 动脉粥样硬化 作用
动脉粥样硬化是发生于大、中动脉的炎症性疾病,同时也是导致心血管疾病的重要诱因[1-2]。现有研究表明,血管中的内皮细胞(endothelial cells,ECs)、平滑肌细胞(smooth muscle cells,SMCs)和炎症细胞(inflammatory cells)是参与动脉粥样硬化过程的主要细胞种类,而这些细胞间的相互作用和信号转导对动脉粥样硬化的发生、发展和进一步发展为血栓形成过程中发挥重要作用[3-5]。
细胞间间隙连接(gap junctions,GJ)在细胞间的相互作用和信号转导过程中具有重要作用。包括离子、小分子代谢物、小多肽甚至分子量<1 000Da的RNA等均可通过GJ通道在细胞间传递信息[6]。GJ由两个紧密相邻细胞的连接蛋白半通道(connexin hemichannels)或连接子(connexon)组成,而6个相同的连接蛋白(connexin,Cx)形成的六聚体构成了连接蛋白半通道或连接子(图1)[7],因此,Cx蛋白被认为是构成GJ的蛋白基础[8]。Cx蛋白家族包括5种亚型,包括GJA、GJB、GJC、GJD和GJE,共计21种蛋白,并且常以其分子量命名(如:Cx43 分子量约为 43kDa)(表 1)[9]。Cx蛋白在内质网合成后,在高尔基体折叠形成六聚体,并通过微管结构转运至细胞膜和线粒体膜,在相邻细胞间发挥连接和信号传递功能[7]。易于降解是Cx蛋白的重要特点之一,其半衰期仅有1~5h。Cx蛋白具有4个α螺旋跨膜结构,形成2个细胞外环状结构和1个细胞内环状结构,而其氨基端和羧基端均位于细胞质内。与氨基端相比,羧基端更容易与其他蛋白发生相互作用,在Cx蛋白的生物学功能以及相邻细胞间信号传递功能中起到决定性作用[10-11]。作为细胞间信号传递的分子基础,Cx蛋白在维持细胞和组织的稳态,以及疾病的发生、发展过程中发挥重要作用。
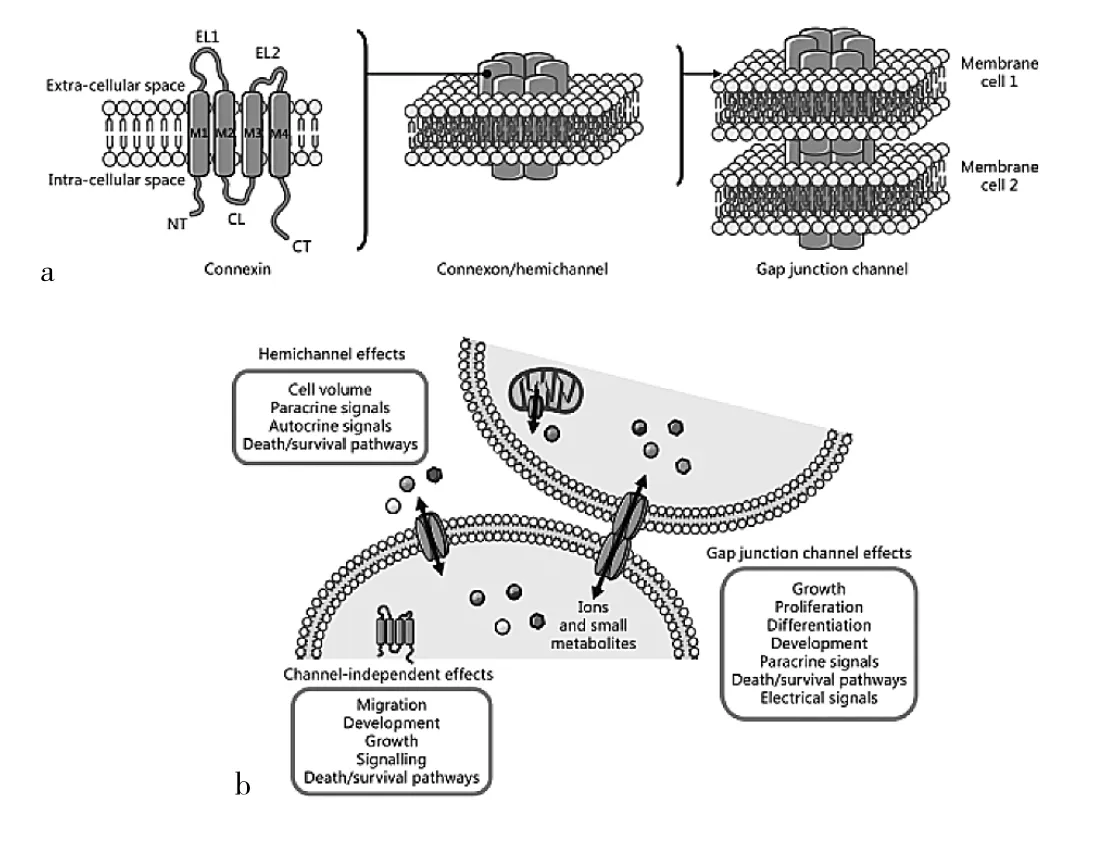
图1 连接蛋白通道示意图[7][a:连结蛋白有4个跨膜结构域(M1、M2、M3 和 M4),肽链构成两个胞外环(EL1 和 EL2)和一个胞内环(CL),羧基端(CT)和氨基端(NT)位于胞内。连接子由 6个连结蛋白构成,相邻两个细胞膜上的连接子对接共同组成缝隙连接。b:连结蛋白通过通道依赖性的和非通道依赖性的作用参与重要细胞过程的调解]
由于Cx蛋白的主要生物学功能是联系相邻细胞并传递信号,而动脉粥样硬化又是一个具有多种细胞参与的复杂病理过程,本文通过对参与动脉粥样硬化形成的各种细胞与Cx蛋白间的联系作一综述,来阐述Cx蛋白在动脉粥样硬化中的作用。

表1 人类间隙连接蛋白列表
1 Cx蛋白与血管内皮细胞(vascularendothelialcells,VECs)功能紊乱
代谢紊乱、吸烟、高血脂等诱因条件下,VECs将经受一系列的氧化应激和炎症性损伤,因此VECs功能紊乱是动脉粥样硬化过程中的重要一环。健康人的VECs主要表达Cx37和Cx40,然而,这两种Cx蛋白在动脉粥样硬化斑块中均出现表达缺失。VECs中Cx37表达下降不影响内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达,却能够导致活性一氧化氮(NO)释放增加,而NO在动脉粥样硬化过程中,起到对抗活性氧(reactive oxygen species,ROS)、减轻炎症、减少白细胞黏附和减少血小板聚集等作用。有研究证实,eNOS的模拟物能够调节VECs中Cx37的功能。Cx40表达缺陷小鼠的ECs中eNOS表达水平明显降低,同时,血管舒张功能也有所减弱[12],说明Cx40表达水平与动脉粥样硬化过程中氧化应激有关。Cx43在许多器官的损伤过程中起到保护器官的作用[13]。在正常动脉ECs中,Cx43表达水平很低,而在动脉粥样硬化过程中,Cx43可在动脉斑块好发区域(如血管分叉部)的VECs中出现高表达,但是ECs中Cx43异常表达在动脉粥样硬化形成过程中起到何种作用尚未存在争议。尽管VECs中的Cx蛋白在动脉粥样硬化过程中表达改变的具体机制尚未完全明确,炎性细胞因子已被证实在期间发挥重要作用。在TNF-α的刺激下,体外培养的VECs可失去Cx37和Cx40的表达,而Cx43受到的影响却不大。与此相类似的是,促炎细胞因子(如IL-6、IL-1β等)可以调控其他种类细胞中的Cx蛋白表达水平[14]。作为一种慢性炎症性病变,出现大量炎性细胞的浸润和促炎细胞因子产生是动脉粥样硬化发生、发展过程中的重要基础[15-17],继而导致的Cx37和Cx40表达不足可能是导致ECs功能紊乱的重要分子基础,也是推动动脉粥样硬化进程的重要因素。另外,近来研究认为,抑制内皮细胞Cx32表达可增加组织因子的表达水平,起到炎症调控和干预细胞间黏附的功能,在动脉粥样硬化过程中起到一定的作用[18]。
2 Cx蛋白与血管平滑肌细胞(vascularsmoothmuscle cells,VSMCs)
血管内膜中的VSMCs能够合成并分泌大分子细胞外基质,包括胶原、弹性蛋白等,并形成动脉斑块表面的纤维帽,同时还为循环系统中的炎性细胞提供附着位置。由于VSMCs在动脉斑块大量形成后,将可能出现凋亡,进而发展成为坏死核心,而另一方面,其形成的纤维帽又有利于斑块的稳定,因此,VSMCs不仅在动脉粥样硬化动脉斑块形成过程中发挥作用,对动脉斑块的稳定性及转归有着更为重要的影响。转化生长因子β(transforming growth factor,TGFβ)能够显著增高 VSMCs的Cx43表达水平,同时促进SMCs的合成分泌能力、强化其收缩分化[19]。现有研究认为,不同的VSMCs之间表型是有所差异的,增殖和迁移更强的VSMCs往往高表达Cx43,而不表达Cx40。而以血小板源性生长因子(platelet derived growth factor,PDGF) 刺激静息状态下的VSMCs,能够使其活化,出现高表达Cx43、不表达Cx40的表型[20]。更重要的是,血管内膜VSMCs中Cx43的表达水平与血管内壁形成早期的动脉粥样硬化病灶密切相关,但是Cx43表达增高却与动脉粥样硬化病灶的预后无关。在VSMCs中,Cx43的表达水平受到炎症相关信号通路的条件。NF-κB,作为细胞炎性应激的重要信号通路,被发现可结合Cx43的启动子,促进Cx43的表达上调[21]。通过研究Cx43基因敲减小鼠的动脉粥样硬化过程,研究者发现Cx43表达减少有利于减少动脉斑块的形成,而形成的动脉斑块含有更为丰富的VSMCs和胶原,将有利于斑块的稳定。因此,针对Cx43寻求动脉粥样硬化新的治疗药物,不仅有利于减少动脉斑块的形成,更可能能够起到稳定动脉斑块的作用。另外,Cx45在血管平滑肌细胞中也有表达,Cx45缺陷小鼠往往存在血管成熟障碍而难以存活。
3 Cx蛋白与炎症相关细胞
动脉粥样硬化实质是发生于大、中动脉的炎症性疾病。作为血液中不可缺少的成分,包括单核/巨噬细胞、血小板、淋巴细胞、树突状细胞和中性粒细胞等炎症相关细胞必然在这一过程中发挥重要作用。
首先,循环单核细胞仅表达低水平的Cx37,但在炎性细胞因子刺激后,循环单核细胞可表达Cx43[22]。而在动脉斑块中,单核细胞和泡沫细胞不仅高表达Cx37,也可表达Cx43。Cx37是构成单核/巨噬细胞间连接蛋白半通道的重要连接蛋白,而缺乏Cx37表达的单核细胞能够具有更强的黏附能力。进一步的研究发现,与正常表达Cx37的单核细胞相比,Cx37缺乏的单核细胞具有更强的浸润动脉斑块的能力,而Cx37缺陷小鼠也更容易出现动脉粥样硬化。对于人类,在Cx37蛋白319位氨基酸存在脯氨酸/丝氨酸的基因多态性,而丝氨酸亚型的Cx37蛋白比脯氨酸亚型的Cx37蛋白具有更强的黏附能力[23]。因此,单核/巨噬细胞中的Cx37蛋白表达具有抗动脉粥样硬化、减少细胞黏附的作用,而单核/巨噬细胞中的Cx43蛋白尽管也参与动脉粥样硬化的疾病进程,而其具体功能仍有待进一步研究。
作为直接影响和参与凝血过程的细胞成分,血小板在血栓形成、血管内皮损伤、炎症和稳态维持过程中发挥至关重要的作用。动脉粥样硬化过程往往伴随着血小板的激活,而激活后的血小板具有黏附其他炎症细胞(例如中性粒细胞)的能力,血小板-中性粒细胞的互作对急性冠脉综合征的疾病进程具有重要的促进作用[24]。与正常野生型小鼠相比,Cx37缺陷小鼠出血后的凝血时间明显缩短,血栓形成的倾向也更为明显,说明Cx37缺乏导致凝血功能亢进,而这种凝血功能亢进与血小板中缺乏Cx37蛋白导致易于聚集有关[25]。而对于正常表达Cx37蛋白的人或者小鼠血小板,使用相应的缝隙连接阻断剂,能够使血小板的聚集能力加强,达到类似Cx37蛋白缺乏血小板的效果。不仅如此,Cx37蛋白的基因多态性对血小板的功能也有影响。人类Cx37蛋白319位氨基酸存在脯氨酸/丝氨酸的基因多态性(1019 C>T)。在体外聚集实验中,具有丝氨酸亚型的血小板比具有脯氨酸亚型的血小板具有更强的聚集能力;而这一基因多态性也与高血压、颈动脉狭窄、冠状动脉狭窄和心肌梗死等关系密切[26-30]。结合前文所述,Cx37表达水平对单核/巨噬细胞系统的影响在动脉粥样硬化过程中发挥的作用尤为突出。
不仅单核/巨噬细胞介导的固有免疫参与动脉粥样硬化发病过程,淋巴细胞介导的获得性免疫也在这一过程中发挥重要作用[31]。尽管在动脉斑块中,T细胞数量明显少于单核/巨噬细胞,但淋巴细胞的激活对动脉斑块进一步增大具有促进作用[32-33]。作为介导炎症反应的重要细胞种类,大多数T细胞表达可表达Cx43,而少数T细胞可表达Cx40。在不同分化的T细胞亚型中,Th1细胞中的Cx43表达水平明显高于Th0和Th2。通过对Cx43基因敲除动物的研究,研究者发现Cx43缺失并不影响T细胞的分化[34]。然而,进一步的研究发现,Cx43在T细胞介导的抗原呈递过程中具有重要作用。缺乏Cx43能够减小活化后T细胞细胞内的钙离子变化幅度,并减少INFγ的分泌。Th1细胞在抗原呈递过程中发挥主导作用,结合Cx43在Th1细胞中的高表达,Cx43可能在动脉粥样硬化的抗原呈递过程中发挥重要作用。B细胞在动脉粥样硬化发病过程中存在较大争议,有研究认为B细胞可通过产生针对氧化脂质体的特异性抗体,在动脉粥样硬化发病过程中发挥保护性作用;而另有研究认为:B细胞的某些亚型能够促进动脉粥样硬化的进程[35-37]。尽管不直接影响B细胞的分化,Cx43在B细胞分化的不同时期均有表达。并且,Cx43能够协助激活B细胞受体(BCR),并介导细胞黏附,而激活后的B细胞产生的抗体具有对抗动脉斑块形成的作用,对抑制动脉斑块的进一步扩大有积极作用。总之,Cx43可通过影响淋巴细胞的活化、抗原呈递和黏附等影响动脉粥样硬化的进程,但其在动脉粥样硬化进程究竟发挥有益或有害的作用,则取决于其作用的细胞类型。
作为重要的抗原呈递细胞,树突状细胞在动脉粥样硬化过程中,同样发挥抗原呈递的作用。在动脉粥样硬化发病过程中,树突状细胞能够摄取脂质,在氧化脂质体的作用下,能够激活T细胞,导致促炎细胞因子分泌[38]。Cx43在树突状细胞中也有表达,并且其表达水平同样与树突状细胞的激活和抗原呈递有关,有可能起到促进动脉粥样硬化进程的作用[39]。
中性粒细胞是参与固有免疫的重要细胞。虽然目前缺乏中性粒细胞直接参与构成动脉粥样硬化病灶的证据,但是血液中中性粒细胞计数与动脉粥样硬化斑块的大小确实存在联系[40]。高胆固醇血症是动脉粥样硬化的重要诱因,其不仅能够促进粒细胞的生成和释放,同时能够促进血管内皮细胞产生趋化因子,将循环系统中的中性粒细胞聚集于动脉粥样硬化病灶周围,继而产生的炎性细胞因子、细胞外基质等在动脉粥样硬化发病过程中起到重要作用[41]。目前,Cx37、Cx40和Cx43已被证实在中性粒细胞中有表达,其中,以Cx43的功能最为突出。作为固有免疫的重要参与细胞,中性粒细胞可在脂多糖(lipopolysaccharide,LPS)刺激后活化,而活化后的中性粒细胞表达的Cx43明显增高。不仅如此,Cx43还能够转移到活化后的中性粒细胞细胞膜表面,并促进中性粒细胞的聚集。更有趣的是,以活化后的血管内皮细胞培养上清液刺激聚集后的中性粒细胞,能够使后者产生明显的细胞间信号联系[42]。
4 展望
尽管Cx蛋白多达21种,目前研究证实与动脉粥样硬化密切相关的主要为Cx37、Cx40和Cx43等,而且,它们对动脉粥样硬化疾病进程的影响还取决于表达它们的细胞类型。将来的研究应注重探索干预各个Cx蛋白表达水平在多种细胞环境下对动脉粥样硬化疾病过程的影响。关于Cx蛋白相关治疗手段的研究,不仅可能提供有效的抑制动脉粥样硬化进程的途径,还可能为稳定动脉斑块、减少血管成型和支架植入后的不良并发症提供新的治疗思路。
[1] Yla-Herttuala S,Bentzon J F,Daemen M,et al.Stabilisation of atherosclerotic plaques.Position paper of the European Society of Cardiology(ESC)Working Group on atherosclerosis and vascular biology[J].Thromb Haemost,2011,106(1):1-19.doi:10.1160/TH10-12-0784.
[2] Da Silva R M.Influence of Inflammation and Atherosclerosis in A-trialFibrillation[J].CurrAtherosclerRep,2017,19(1):2.doi:10.1007/s11883-017-0639-0.
[3] Libby P,Ridker P M,Hansson G K.Progress and challenges in translating the biology of atherosclerosis[J].Nature,2011,473(7347):317-325.doi:10.1038/nature10146.
[4] Weber C,Noels H.Atherosclerosis:current pathogenesis and therapeutic options[J].Nat Med,2011,17(11):1410-422.doi:10.1038/nm.2538.
[5] Niculescu F,Rus H.The role of complement activation in atherosclerosis[J].ImmunolRes,2004,30(1):73-80.
[6] Herve J C,Derangeon M.Gap-junction-mediated cell-to-cell communication[J].Cell Tissue Res,2013,352(1):21-31.doi:10.1007/s00441-012-1485-6.
[7] Laird D W.Life cycle of connexins in health and disease[J].Biochem J,2006,394(Pt 3):527-543.doi:10.1042/BJ20051922.
[8] Morel S.Multiple roles of connexins in atherosclerosis-and restenosis-induced vascular remodelling[J].J Vasc Res,2014,51:149-161.doi:1159/000362122.
[9] Apweiler R,Bairoch A,Wu C H,et al.UniProt:the Universal Proteinknowledgebase[J].Nucleic Acids Research,2004,32(Database issue):D115.doi:10.1093/nar/gkh131.
[10] Herve J C,Derangeon M,Sarrouilhe D,etal.Gap junctionalchannels are parts of multiprotein complexes[J].Biochim Biophys Acta,2012,1818(8):1844-1865.doi:10.1016/j.bbamem.2011.12.009.
[11] Palatinus J A,Rhett J M,Gourdie R G.The connexin43 carboxyl terminus and cardiac gap junction organization[J].Biochim Biophys Acta,2012,1818(8):1831-1843.doi:10.1016/j.bbamem.2011.08.006.
[12] Alonso F,Boittin F X,Beny J L,et al.Loss of connexin40 is associated with decreased endothelium-dependent relaxations and eNOS levels in the mouse aorta[J].Am J Physiol Heart Circ Physiol,2010,299(5):H1365-1373.doi:10.1152/ajpheart.00029.2010.
[13] Balasubramaniyan V,Dhar D K,Warner A E,et al.Importance of Connexin-43 based gap junction in cirrhosisand acuteon-chronic liver failure[J].J Hepatol,2013,58(6):1194-1200.doi:10.1016/j.jhep.2013.01.023.
[14] Yang X,Chang Y,Wei W.Endothelial Dysfunction and Inflammation:Immunity in Rheumatoid Arthritis[J].Mediators Inflamm,2016,2016(2):1-9.doi:10.1155/2016/6813016.
[15] van der Vorst E P,Doring Y,Weber C.Chemokines and their receptors in Atherosclerosis[J].J Mol Med(Berl),2015,93(9):963-971.doi:10.1161/ATVBAHA.115.306359.
[16] Tellides G,Pober J S.Inflammatory and immune responses in the arterialmedia[J].Circ Res,2015,116(2):312-322.doi:10.1161/CIRCRESAHA.116.301312.
[17] Pircher A,Treps L,Bodrug N,et al.Endothelial cell metabolism:A novel player in atherosclerosis?Basic principles and therapeutic opportunities[J].Atherosclerosis,2016,253:247-257.doi:10.1016/j.atherosclerosis.2016.08.011.
[18] Okamoto T,Akita N,Hayashi T,et al.Endothelial connexin 32 regulates tissue factor expression induced by inflammatory stimulation and direct cell-cellinteraction with activated cells[J].Atherosclerosis,2014,236(2):430-437.doi:10.1016/j.atherosclerosis.2014.07.025.
[19] Ha D M,Carpenter L C,Koutakis P,et al.Transforming growth factor-beta 1 produced by vascular smooth muscle cells predicts fibrosis in the gastrocnemius of patients with peripheral artery disease[J].J Transl Med,2016,14(1):39.doi:10.1186/s12967-016-0790-3.
[20] Chadjichristos C E,MorelS,Derouette J P,et al.Targeting connexin 43 prevents platelet-derived growth factor-BB-induced phenotypic change in porcine coronary artery smooth muscle cells[J].Circ Res,2008,102(6):653-660.doi:10.1161/CIRCRESAHA.107.170472.
[21] Alonso F,Krattinger N,Mazzolai L,et al.An angiotensin II-and NF-kappaB-dependent mechanism increases connexin 43 in murine arteries targeted by renin-dependent hypertension[J].CardiovascRes,2010,87(1):166-176.doi:10.1093/cvr/cvq031.
[22] Yuan D,Sun G,Zhang R,et al.Connexin 43 expressed in endothelial cellsmodulatesmonocyteendothelial adhesion by regulating cell adhesion proteins[J].Mol Med Rep,2015,12(5):7146-7152.doi:10.3892/mmr.2015.4273.
[23] Pfenniger A,Meens MJ,PedrigiR M,et al.Shear stress-induced atherosclerotic plaque composition in ApoE(-/-)mice is modulated by connexin37[J].Atherosclerosis,2015,243(1):2015,243(1):1-10.doi:10.1016/j.atherosclerosis.2015.08.029.
[24] Kornerup KN,Salmon G P,Pitchford S C,etal.Circulating plateletneutrophil complexes are important for subsequent neutrophil activation and migration[J].J Appl Physiol,2010,109(3):758-767.doi:10.1152/japplphysiol.01086.2009.
[25] LiZ,Smyth S S.Connexin 37 counteracts clotting[J].Circulation,2011,124(8):873-875.doi:10.1161/CIRCULATIONAHA.111.045104.
[26] Tang J,Li L,Hu L Q,et al.Association between 1019C/T polymorphism in the connexin 37 gene and dilated cardiomyopathy[J].Minerva Cardioangiol,2016,64(2):114-120.
[27] Wen D,Du X,Nie S P,et al.Association of Connexin37 C1019T with myocardial infarction and coronary artery disease:a metaanalysis[J].Exp Gerontol,2014,58:203-207.doi:10.1016/j.exger.2014.06.011.
[28]Zhao L,LiY,Wu D,et al.Cx37 C1019T polymorphism may contribute to the pathogenesis of coronary heart disease[J].Genet Test Mol Biomarkers,2014,18(7):497-504.doi:10.1089/gtmb.2014.0034.
[29] Guo S,Chen W,Yang Y,et al.Association between 1019C/T polymorphism in the connexin 37 gene and essential hypertension[J].Heart Lung Circ,2014,23(10):924-929.doi:10.1016/j.hlc.2014.02.016.
[30] Leu H B,Chung C M,Chuang S Y,et al.Genetic variants of connexin37 are associated with carotid intima-medial thickness and future onset of ischemic stroke[J].Atherosclerosis,2011,214(1):101-106.doi:10.1016/j.atherosclerosis.2010.10.010.
[31] Milasan A,Ledoux J,MartelC.Lymphatic network in atherosclerosis:the underestimated path[J].Future Sci OA,2015,1(4):1-10.doi:10.4155/fso.15.61.
[32] Hansson G K,Hermansson A.The immune system in atherosclerosis[J].Nat Immunol,2011,12(3):204-212.
[33] Getz G S,Reardon C A.Naturalkiller Tcells in atherosclerosis[J].NatRevCardiol,2017,14(5):304-314.doi:10.1038/nrcardio.
[34] Kuczma M,Lee J R,KrajP.Connexin 43 signaling enhances the generation of Foxp3+regulatory Tcells[J].J Immunol,2011,187(1):248-257.doi:10.4049/jimmunol.1003785.
[35] EcheverriTirado L C,Yassin L M.B cells interactions in lipid immune responses:implications in atherosclerotic disease[J].Lipids Health Dis,2017,16(1):30.doi:10.1186/s12944-016-0390-5.
[36] Ketelhuth D F,Hansson G K.Adaptive Response of T and B Cells in Atherosclerosis[J].Circ Res,2016,118(4):668-678.doi:10.1161/CIRCRESAHA.115.306427.
[37] Zhang L,Wang Y.B lymphocytes in abdominalaortic aneurysms[J].Atherosclerosis,2015,242 (1):311-317.doi:10.1016/j.atherosclerosis.2015.07.036.
[38] Koltsova E K,Ley K.How dendritic cells shape atherosclerosis[J].Trends Immunol,2011,32(11):540-547.doi:10.1016/j.it.2011.07.001.
[39] Mendoza-Naranjo A,Saez P J,Johansson C C,et al.Functional gap junctions facilitate melanoma antigen transfer and crosspresentation between human dendritic cells[J].J Immunol,2007,178(11):6949-6957.
[40] Sage AP,Mallat Z.Readapting the adaptive immune responsetherapeutic strategies for atherosclerosis[J].Br J Pharmacol,2017 Jan 4.doi:10.1111/bph.13700.
[41] Drechsler M,Doring Y,Megens R T,et al.Neutrophilic granulocytes-promiscuous accelerators of atherosclerosis[J].Thromb Haemost,2011,106(5):839-848.doi:10.1160/TH11-07-0501.
[42] Branes M C,Contreras J E,Saez J C.Activation of human polymorphonuclear cells induces formation of functional gap junctions and expression of connexins[J].Med Sci Monit,2002,8(8):BR313-323.
2017-07-27)
(本文编辑:沈昱平)
10.12056/j.issn.1006-2785.2017.39.18.2017-1789
312000 绍兴第二医院心血管内科
陈丽娜,E-mail:linachensx@126.com

