miR-181家族在胶质母细胞瘤中的表达及其临床意义
王成德 李群 卢江龙 蔡霖 高志超 苏志鹏
miR-181家族在胶质母细胞瘤中的表达及其临床意义
王成德 李群 卢江龙 蔡霖 高志超 苏志鹏
目的 探讨miR-181家族在人多形性脑胶质母细胞瘤(GBM)中的表达及其与临床病理特征的关系。方法 采用茎环实时荧光定量PCR(RT-qPCR)法检测40例胶质母细胞瘤中miR-181a、miR-181b、miR-181c、miR-181d的表达水平,并分析其与胶质母细胞瘤临床病理特征的关系。采用慢病毒转染上调胶质瘤细胞系U251 miR-181a的表达,分析miR-181a对U251克隆形成、细胞增殖和凋亡的影响。结果 miR-181a高表达的GBM患者生存预期明显延长(P<0.05);且miR-181a表达水平越高,GBM瘤周水肿越明显(P<0.05)。O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)阳性组的GBM miR-181a表达明显高于阴性组(P<0.05)。上调miR-181a的表达后,U251胶质瘤细胞克隆形成数明显少于对照组(P<0.05),且细胞生长抑制在第5天最明显,差异有统计学意义(P<0.01);对细胞凋亡起促进作用(P<0.05)。结论 miR-181a表达水平与GBM患者的临床预后相关。miR-181a表达减少与GBM的发生密切相关。
miR-181 胶质母细胞瘤 MGMT
microRNA是一种内源性、高度保守的微小RNA,不编码任何蛋白质,但能够高效调控癌基因或抑癌基因的表达,在肿瘤的发生、发展中起着重要的调控作用[1]。脑多形性胶质母细胞瘤(Glioblastoma,GBM)是最常见的星形细胞来源的大脑原发性恶性肿瘤[2]。尽管有现代医学的各种治疗手段,但是GBM患者的预后仍然极差[3]。目前临床上缺少准确预测GBM患者生存预后的指标。近年来,发现miR-181a、miR-181b能抑制GBM的生长[4],miR-181a能提高GBM对放化疗的敏感性[5-6]。本研究采用茎环实时荧光定量PCR(RT-qPCR)和免疫组化方法检测GBM组织标本中miR-181家族及O6-甲基鸟嘌呤-DNA 甲基转移酶(MGMT)、Ki-67、p53等蛋白的表达水平,分析miR-181家族的表达与GBM临床病理特征的关系;此外,通过慢病毒转染胶质瘤细胞系U251来上调其表达,分析其对细胞增殖、凋亡及细胞周期的影响,以验证miR-181家族的功能效应。
1 材料和方法
1.1 材料 人miR-181a转染病毒LV-hsa-mir-181a-1(序号 LVKL17475-1)及对照病毒(序号 KL8781-1)由上海吉凯基因化学技术有限公司提供。U251购自中科院上海细胞库;DMEM购自美国Gibco公司;FBS购自北京元亨圣马生物科技公司;Trizol购自美国Invitrogen公司;M-MLV逆转录酶、RNA酶抑制剂、SYBR Mastermix购自日本东洋纺(上海)生物科技有限公司;PCR Marker(100 bpDNAlad-der)购自杭州吉诺生物医药技术有限公司;Matrigel购自美国BD Bioscience公司;凋亡试剂盒购自美国eBioscience公司。PI购自美国Sigma公司,RNase A购自美国Fermentas公司。GIEMSA染色液购自上海鼎国生物技术有限公司。引物由上海英骏生物技术有限公司合成。一抗特异性兔抗人多克隆抗体固定液购于美国Abcan公司,兔二抗、羊血清封闭液和DAB显色液购置于北京中杉金桥生物公司。
1.2 方法
1.2.1 标本采集及处理 GBM组织标本来源于温州医科大学附属第一医院神经外科2008—2013年40例手术切除的肿瘤组织(肿瘤组织切除后立即予液氮冷冻备用),病理类型的判断标准参照WHO脑胶质瘤的病理学分类。术后对患者行标准化同步放化疗加辅助化疗。患者中男 20 例,女 20 例;年龄 14~75(53.15±14.97)岁。1.2.2 免疫组化染色 取出液氮冷冻肿瘤组织并置于冰冻切片机冷架上(温度-18~22℃),解冻后投入冷冻的丙酮;取出在空气中二次解冻;10%福尔马林浸泡过夜,常规石蜡包埋。将石蜡块作3μm连续切片,脱蜡,3%甲醇-过氧化氢浸泡,柠檬酸修复液抗原修复;一抗4℃过夜,二抗、三抗各孵育 30min;DAB显色,苏木精复染对比;脱水、树胶封片等具体操作步骤按常规进行。各步骤间用PBS缓冲液漂洗3×5min,用PBS作为一抗阴性对照。免疫组化染色后阳性细胞呈黄色、棕黄色或棕褐色。在高倍镜(10×20)下,随机选择5个视野,每个视野计数1 000个细胞以上,计算肿瘤细胞阳性率。肿瘤细胞阳性率评分标准:阳性细胞<5%为0分,5%~25%为1分,>25%~50%为2分,>50%为3分;阳性着色评分标准:无色为0分,黄色为1分,棕黄色为2分,棕褐色为3分;以上两种评分相加所得的总分:<3分为阴性(-),3分为弱阳性(+),≥4分为强阳性(++)。
1.2.3 小RNA抽提 取液氮保存的GBM组织标本,在液氮中碾碎至粉状,按Trizol试剂说明书提取总RNA,DEPC处理水溶解。抽提的RNA溶液按DNase I说明书步骤进一步纯化。采用NanoDrop2000超微量分光光度计(美国Thermo公司)检测RNA溶液吸光值(OD260、OD280),计算RNA浓度、纯度,OD260/OD280>1.8方可用于检测。1.0%琼脂糖变性凝胶电泳检测RNA的完整性。
1.2.4 RT-qPCR GBM组织及细胞中miRNA-181的检测:取GBM组织200mg,匀浆后根据Trizol试剂盒说明书提取肿瘤组织中总RNA。U251细胞中miRNA-181a/b/c/d按照mirVa-naTMRT-PCR miRNA检测试剂盒操作。均采用U6作为内参照。变性条件:93~94℃,1min;退火条件:40℃,30s;延伸条件:70℃,1min;共30个循环。扩增完成后,在ABI 7300 System软件上分析,用2-ΔΔCt方法计算相对表达量。
1.2.5 稳定过表达miR-181a U251的建立 慢病毒载体质粒LV-hsa-mir-181a-1(17475-1,导入基因片段序列为 hsa-mir-181a-1 序列,5′-AACAUUCAACGCUGUCGGUGAGU-3′),对照病毒 KL8781-1(导入基因片段序列为 5′-TTCTCCGAACGTGTCACGTTTC-3′),均由上海吉凯基因化学技术有限公司制备。载体质粒含有绿色荧光蛋白(GFP)及嘌呤霉素抗性基因。96孔板中进行感染,每孔接种细胞数为3.5×103,加入100μl完全培养基,感染细胞的病毒滴度为5×108TU/ml。分别于48、72、96、120h后在荧光显微镜下观察细胞发光情况,确定U251在感染72h后荧光达到最强。换用含抗生素(puromycin)的培养基筛选细胞。筛选2周后取一定量细胞,调整浓度为1.0×105个/ml,应用流式细胞仪检测1.0×104个细胞中发光细胞数,确定发光效率。筛选培养期间根据细胞的生长状况进行传代。实验分为3个组:实验组(OE组,U251+hsa-mir-181a-1基因mirco up病毒感染的细胞)、阴性对照组(NC组,U251+阴性对照病毒感染的细胞),另设置一组未经病毒感染的空白对照组(CON组)。
1.2.6 MTT实验 取消化生长对数期的两组细胞,调整细胞浓度为1.0×104个/ml。按100μl/孔接种于96孔板,分别于接种后 24、48、72、96、124h 以每孔浓度 0.5mg/ml加入MTT溶液,培养箱继续培养4h后吸弃培养液。再每孔加入150μl二甲基亚砜(DMSO),37℃恒温摇床上低速震荡10min,使结晶物充分溶解。置于酶联免疫检测仪490nm波长处测量各孔吸光值(OD490),实验重复3次。
1.2.7 细胞克隆形成实验 取消化生长对数期细胞,调整细胞浓度为0.8×103个/ml。取1ml细胞分别接种于6孔板中,37℃、5%CO2培养箱培养;每3d更换一次培养液。培养10d后,吸弃每孔培养液,0.5%结晶紫染色显微镜下计数克隆数。>50个细胞的集落计数为1个克隆团。实验重复3次。
1.2.8 细胞凋亡实验 培养细胞融合度达85%,消化细胞,完全培养基重悬成细胞悬液,与上清液细胞收集于同一个5ml离心管中,每组设3个复孔。1 300rmp离心5min,弃上清液,4℃预冷的 D-Hanks(pH7.2~7.4)洗涤细胞沉淀。1×染色缓冲液洗涤细胞沉淀1次,1 300rmp离心3min,收集细胞。200μl 1×染色缓冲液重悬细胞沉淀。加入10μl Annexin V-APC染色,室温避光10~15min。根据细胞量,补加400~800μl 1×染色缓冲液,上机检测。1.3 统计学处理 应用Graphpad Prism 5统计软件。由于miR-181相对表达量不符合正态分布,予-lg转化使数据近似正态分布,用表示,组间比较采用两独立样本t检验。总生存期(OS)的统计以GBM患者手术时间当日起至病死日期为止,以d为单位,数据用M(P25,P75)表示,组间比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 胶质瘤标本中miR-181家族检测特异性分析 miR-181a、miR-181b、miR-181c 及 miR-181d 的 RT-PCR产物的熔解曲线为单峰,见图1(插页);说明茎环RT-qPCR可以特异检测该4条microRNA。
2.2 荧光显微镜观察转染效率 在荧光显微镜观察V-hsa-mir-181a-1(17475-1)及对照病毒 KL8781-1 感染U251的效率,结果显示70%~80%的U251可见荧光,说明具有较高的感染效率,可以满足后续试验要求,见图 2(插页)。
2.3 miR-181表达水平与GBM临床特征的关系 分别按 miR-181a、miR-181b、miR-181c、miR-181d 相对表达量0.1、0.03、0.002和0.02为界限,将GBM患者分成高表达组、低表达组,miR-181a高表达组总生存期较低表达组明显延长(P<0.05),miR-181b、miR-181c、miR-181d高、低表达组总生存期比较差异均无统计学意义(均PP>0.05),见表1和图3。此外,miR-181a与GBM瘤周水肿程度有关,即轻微水肿患者的miR-181a相对表达量低于明显水肿患者(P<0.05),见表2。
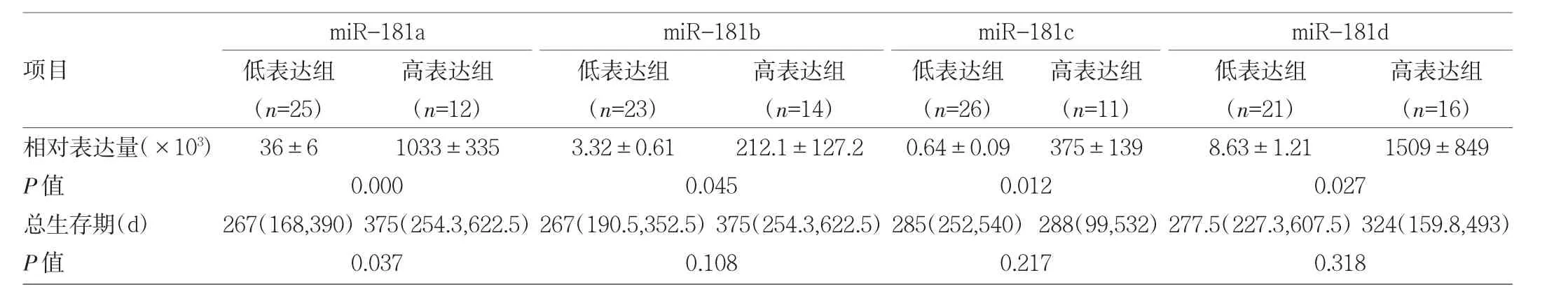
表1 miR-181高、低表达组总生存期比较
2.4miR-181表达水平与GBM病理特征的关系 MGMT阴性组miR-181a、miR-181c表达水平均明显低于MGMT阳性组(均P<0.05),miR-181b、miR-181d表达水平比较差异均无统计学意义(均PP>0.05)。miR-181a、miR-181b、miR-181c、miR-181d表达水平与p53免疫组化结果未见明显关系(均PP>0.05)。因研究纳入的GBM标本Ki-67(-)只有2例,故将Ki-67表达分为弱表达(-,+)与强表达(++)两组进行比较,发现 miR-181a、miR-181b、miR-181c、miR-181d 表达水平与 Ki-67 免疫组化结果未见明显关系(均PP>0.05),见表3。
2.5 MTT实验结果 各实验组细胞于接种后连续5d用MTT法检测细胞增殖情况,所测得的OD值作细胞生长曲线,见图4a。miR-181a高表达对U251的增殖产生抑制作用。OE组与NC组相比较,miR-181a抑制U251生长作用在第5天最为明显,OD值分别为0.616±0.0061和0.832±0.0012,两组比较差异有统计学意义(t=73.02,P<0.05),见图 4b。
2.6 克隆形成实验 OE组克隆形成数为(36±3)个,明显少于NC组的(54±8)个(两组均种植1 000个细胞;t=3.87,P<0.05),见图 5。
2.7 细胞凋亡实验结果 OE组细胞凋亡率为(8.99±0.43)%明显高于 NC 组的(4.28±0.20)%(t=16.98,P<0.05),见图 6。
3 讨论
microRNA作为癌基因和抑制癌基因对肿瘤的发生、发展过程进行调控,目前已被广泛认同。miR-181家族在正常脑组织中呈现高表达[7],而在GBM中低表达,miR-181a、miR-181b在人胶质瘤细胞上具有肿瘤抑制作用,它们在胶质瘤细胞系及WHO-Ⅱ-Ⅳ级的胶质瘤组织标本中的表达均明显降低;此外,miR-181a的表达与肿瘤级别呈负相关[4,8]。在GBM的治疗方面,Chen等[5]研究表明miR-181a能通过靶向Bcl-2来提高胶质瘤对放疗的灵敏度。在GBM的化疗方面,海兔素可使胶质瘤细胞中的miR-181的表达增高,进而抑制其靶基因MEK1的表达,最终协同提高替莫唑胺化疗的灵敏度[9-10]。同时,She等[6]认为miR-181可通过Rap1B介导的细胞骨架重塑而增加GBM对替莫唑胺化疗的灵敏度。关于miR-181对同步放化疗的作用亦有文献报道,miR-181b、miR-181c可作为GBM同步放化疗灵敏度的预测指标[11]。
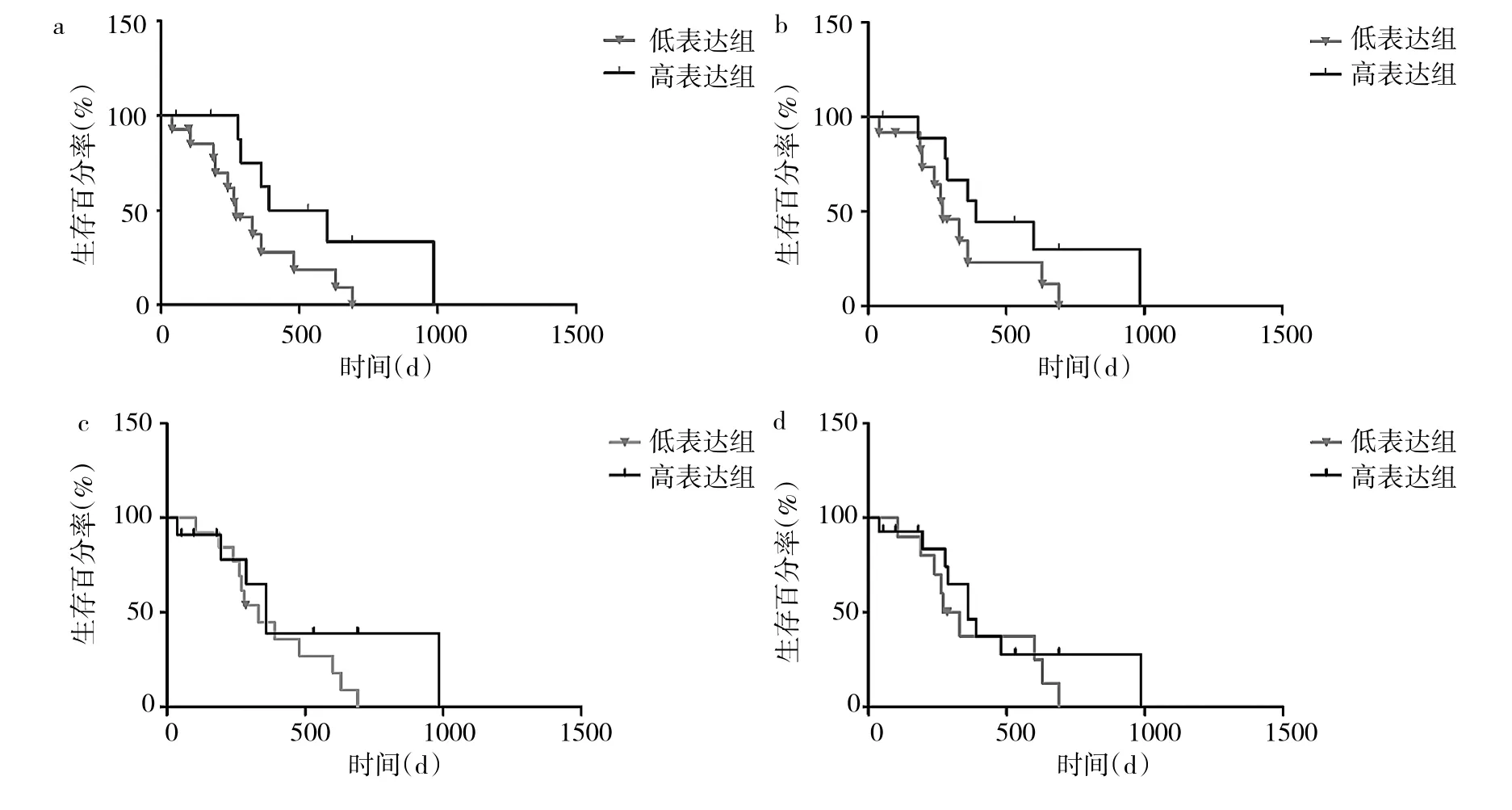
图3 miR-181表达与GBM患者总生存期的关系(a:mir-181a;b:mir-181b;c:mir-181c;d:mir-181d)
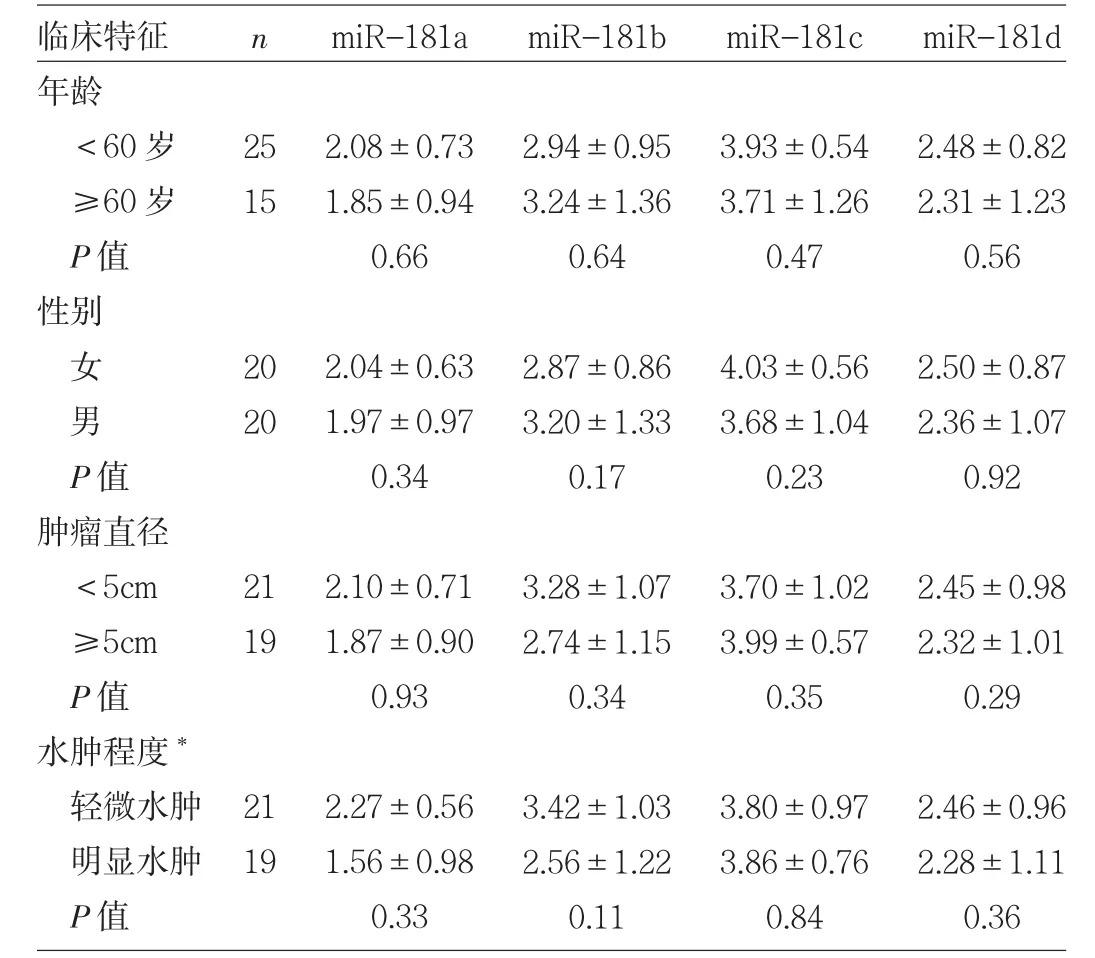
表2 miR-181表达水平与GBM临床特征的关系
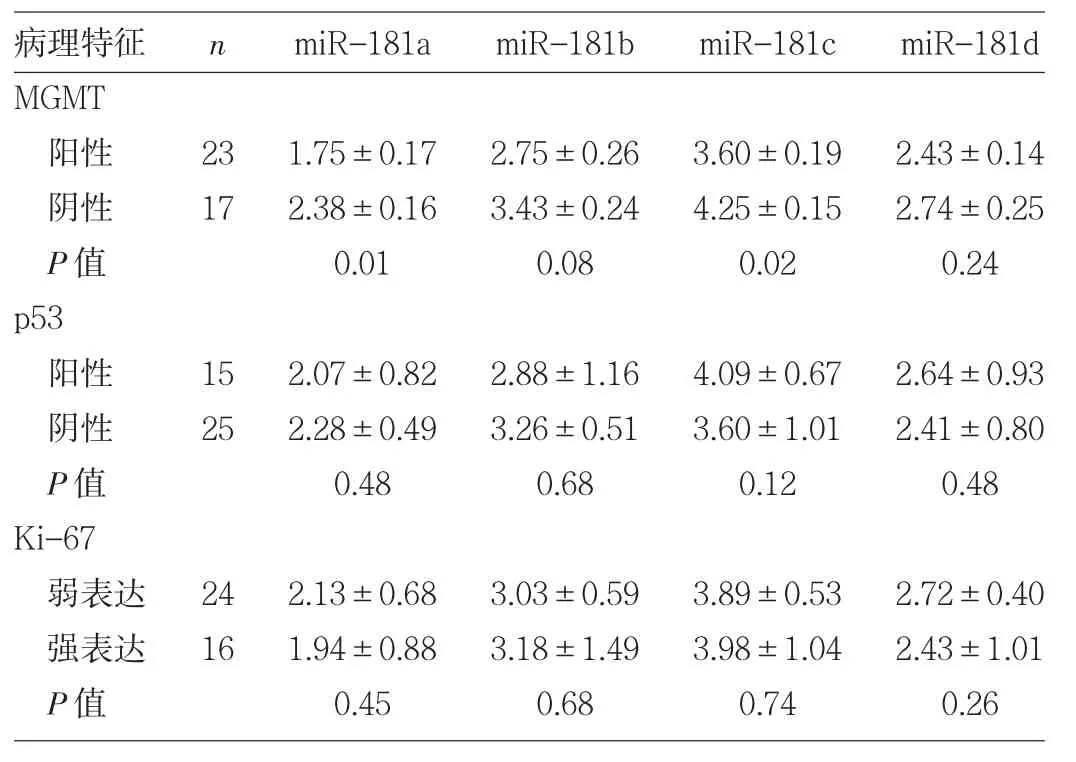
表3 miR-181表达水平与GBM病理特征的关系
笔者对GBM样本进行检测,结果显示miR-181a表达与GBM患者的生存预后存在相关性。miR-181a表达水平越高,患者生存期越长。由于本研究纳入病例均为WHOⅣ级的GBM患者,术后均按指南进行标准放化疗,故生存期延长的这部分患者可能与miR-181a高表达致肿瘤对放疗及替莫唑胺化疗的灵敏度增加有关。以上研究结果具与本文一致,提示miR-181a表达量可能成为临床判断GBM患者预后的指标,并进一步支持miR-181a高表达水平会给GBM患者带来明显生存受益的观点。本研究数据发现miR-181b、miR-181c、miR-181d与GBM患者预后差异均无统计学意义,可能是与miR-181b、miR-181c、miR-181d在 GBM 标本中的相对表达量偏低以及入选病例数偏少等有关。
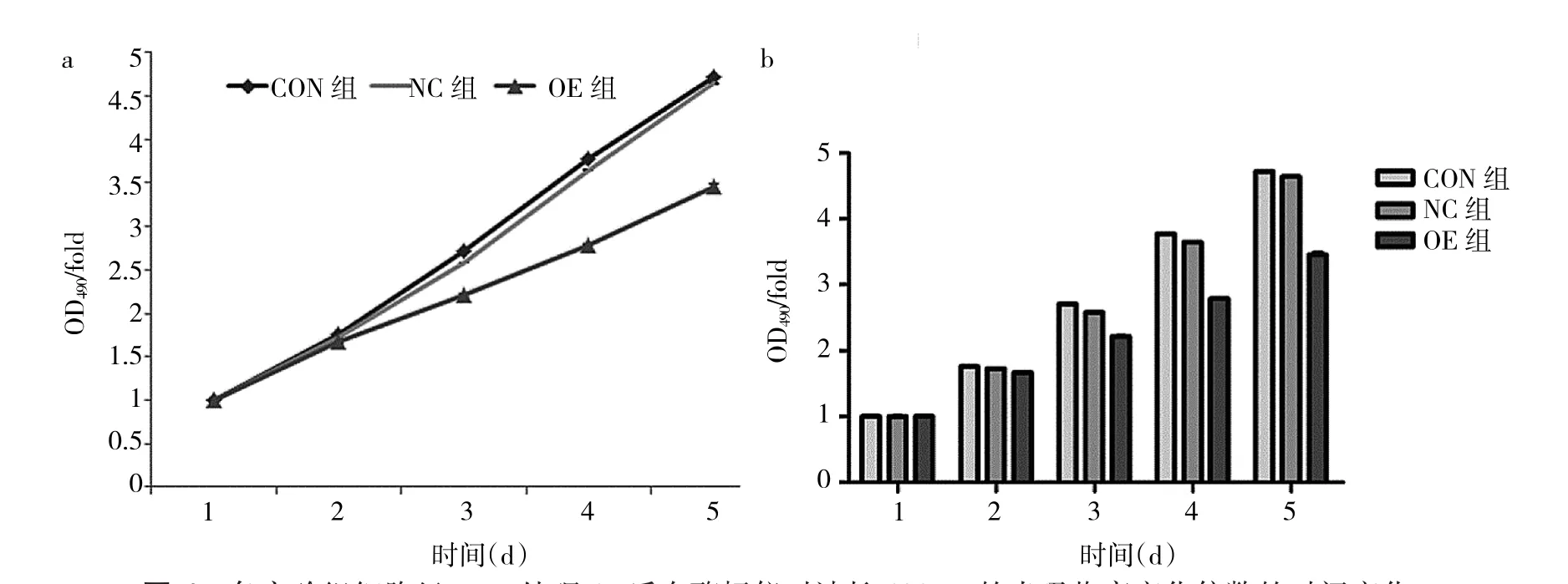
图4 各实验组细胞经MTT处理4h后在酶标仪对波长490nm的光吸收率变化倍数的时间变化

图5 培养板内细胞克隆形成集落及100倍下单个集落明场合绿色荧光视野(a:NC组;b:OE组)
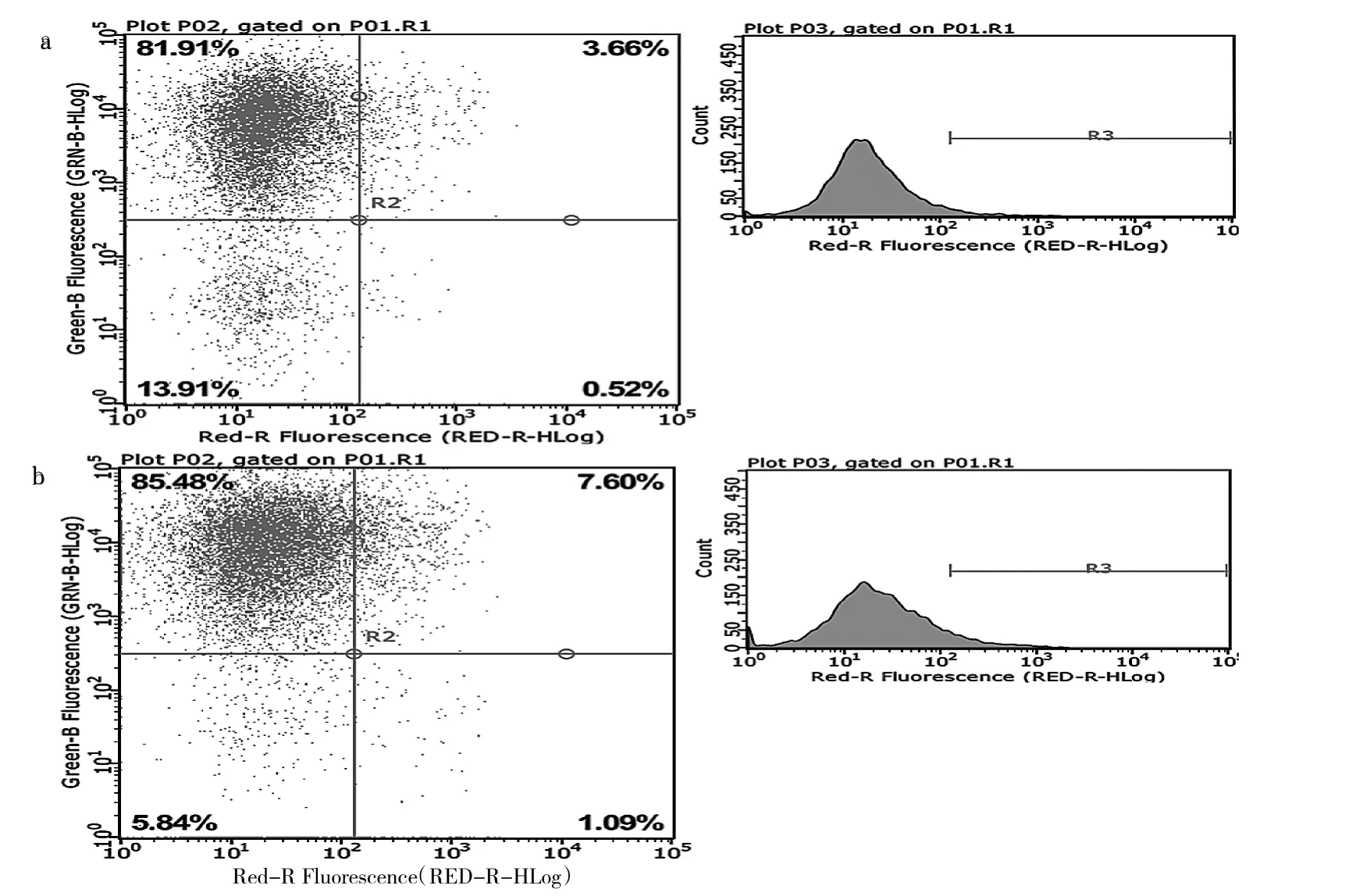
图6 Annexin V-APC法流式细胞检测散点图(a:NC组;b:OE组)
本研究通过慢病毒转染,使用miR-181a表达升高的U251细胞株,并通过MMT、细胞克隆形成和细胞凋亡等实验检测细胞功能改变。实验结果表明转染miR-181a后,U251增殖和克隆形成能力均明显减弱,凋亡发生率明显增加。与GBM组织标本中的miR-181a PCR实验相互印证,为后期分子生物学研究提供了理论基础。Ouyang等[12]利用荧光素酶标记法证实,miR-181能通过与目标基因mRNA的3′UTRs区特异性结合调节Bcl-2家族中的Bcl-2、Bcl-2-L11/Bim和Mcl-1(野生型)的表达;进一步用microRNA模拟物、microRNA抑制剂改变miR-181,发现miR-181对Bcl-2家族中的Bcl-2调控程度最高。Bcl-2能减少促凋亡因子(如细胞色素c等)从线粒体内释放,抑制Caspase的激动,从而抑制凋亡的发生[13-14];本实验结果显示miR-181a增高可以正向调控凋亡的发生,间接印证了上述结论。相关文献表明microRNA可直接靶向甲基转移酶 DNMT,引起DNA甲基化改变而影响特定基因的表达[15-17]。本研究结果发现,在GBM中miR-181a的表达与MGMT蛋白呈正相关。因此,笔者推测MGMT并不是miR-181a的直接靶基因,miR-181a可能通过靶向甲基转移酶而正向影响MGMT的蛋白表达。本研究还发现miR-181a与GBM瘤周水肿存在统计学关系。Ma等[18]发现miR-181a能通过靶向KLF6增加血瘤屏障的通透性,同时发现miR-181a的表达能抑制ZO-1、occludin和claudin-5蛋白的表达;而这些蛋白与内皮细胞之间的紧密连接通透性密切相关[19-20]。以上研究发现的机制在一定程度上解释了miR-181a可增加GBM瘤周水肿的原因。
[1] Lewis B P,Burge C B,Bartel D P.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNAtargets[J].Cell,2005,120(1):15-20.
[2] Schwartzbaum J A,Fisher J L,Aldape K D,et al.Epidemiology and molecular pathology of glioma[J].Nat Clin Pract Neurol,2006,2(9):494-503.
[3] Ohgaki H,Dessen P,Jourde B,et al.Genetic pathways to glioblastoma:a population-based study[J].Cancer Res,2004,64(19):6892-6899.
[4] ShiL,Cheng Z,Zhang J,et al.hsa-mir-181a and hsa-mir-181b function as tumor suppressors in human glioma cells[J].Brain Res,2008,1236:185-193.
[5] Chen G,Zhu W,Shi D,et al.MicroRNA-181a sensitizes human malignant glioma U87MG cells to radiation by targeting Bcl-2[J].OncolRep,2010,23(4):997-1003.
[6] She X,Yu Z,Cui Y,et al.miR-181 subunits enhance the chemosensitivity of temozolomide by Rap1B-mediated cytoskeleton remodeling in glioblastoma cells[J].Medical Oncology,2014,31(4):1-10.
[7] Miska E A,Alvarez-Saavedra E,Townsend M,et al.Microarray analysis of microRNA expression in the developing mammalian brain[J].Genome Biol,2004,5(9):R68.
[8] Ciafre S A,Galardi S,Mangiola A,et al.Extensive modulation of a set of microRNAs in primary glioblastoma[J].Biochem Biophys Res Commun,2005,334(4):1351-1358.
[9] Wang J,Sai K,Chen F R,et al.miR-181b modulates glioma cell sensitivity to temozolomide by targeting MEK1[J].Cancer Chemother Pharmacol,2013,72(1):147-158.
[10] Gong A,Ge N,Yao W,et al.Aplysin enhances temozolomide sensitivity in glioma cells by increasing miR-181 level[J].Cancer Chemother Pharmacol,2014,74(3):531-538.
[11] Slaby O,Lakomy R,Fadrus P,et al.MicroRNA-181 family predicts response to concomitant chemoradiotherapy with temozolomide in glioblastoma patients[J].Neoplasma,2010,57(3):264-269.
[12] Ouyang YB,Lu Y,Yue S,et al.miR-181 targets multiple Bcl-2 family members and influences apoptosis and mitochondrial function in astrocytes[J].Mitochondrion,2012,12(2):213-219.
[13] Lucken-Ardjomande S,Martinou J C.Regulation of Bcl-2 proteins and of the permeability of the outer mitochondrial membrane[J].C R Biol,2005,328(7):616-631.
[14] Yang E,Korsmeyer S J.Molecular thanatopsis:a discourse on the BCL2 family and celldeath[J].Blood,1996,88(2):386-401.[15] Xiang Y,Ma N,Wang D,et al.MiR-152 and miR-185 co-contribute to ovarian cancer cells cisplatin sensitivity by targeting DNMT1 directly:a novel epigenetic therapy independent of decitabine[J].Oncogene,2014,33(3):378-386.
[16]Wang YS,Chou W W,Chen K C,et al.MicroRNA-152 mediates DNMT1-regulated DNA methylation in the estrogen receptor alpha gene[J].PLoS One,2012,7(1):e30635.
[17] Garzon R,Liu S,Fabbri M,et al.MicroRNA-29b induces global DNA hypomethylation and tumor suppressor gene reexpression in acute myeloid leukemia by targeting directly DNMT3A and 3B and indirectly DNMT1[J].Blood,2009,113(25):6411-6418.
[18] Ma J,Yao Y,Wang P,et al.MiR-181a regulates blood-tumor barrier permeability by targeting Kruppel-like factor 6[J].J Cereb Blood Flow Metab,2014,34(11):1826-1836.
[19] Rubin L L,Staddon J M.The cell biology of the blood-brain barrier[J].Annu Rev Neurosci,1999,22:11-28.
[20] Vorbrodt A W,Dobrogowska D H.Molecular anatomy of intercellular junctions in brain endothelial and epithelial barriers:electron microscopist's view[J].Brain Res Brain Res Rev,2003,42(3):221-442.
Expression of miR-181 family in glioblastoma and its clinical significance
WANG Chengde,LI Qun,LU Jianglong,et al.
Department of Neurosurgery,the First Affiliated Hospital of Wenzhou Medical University,Whenzhou 325000,China
Objective To investigate the expression of miR-181 family in multiform glioblastoma(GBM)and its correlation with clinicopathological characteristics of the tumor. Methods The expression of miR-181a,miR-181b,miR-181c and miR-181d was detected by loop RT-qPCR in tumor tissue specimens of 40 GBM patients.The relationship between miR-181 expression and clinicopathological characteristics was analyzed.The lentiviral vector carrying miR-181a was transfected into U251 cells,the proliferation clone-forming ability and apoptosis of miR-181a-transfected U251 cells were determined. Results The up-regulation of miR-181a expression was correlated with the survival of patients and peritumoral brain edema(P<0.05).Expression of miR-181a was significantly higher in patients with O6-methylguanine-DNA methyltransferase(MGMT)positive than those with MGMT negative(P<0.05).Cell studies indicated that the over-expression of miR-181a significantly inhibited the proliferation of U251 cells(P<0.01),reduced clone-forming ability(P<0.05),and increased apoptosis(P<0.05). Conclusion The expression of MiR-181a may be associated with the prognosis of GBM,and down-expression of miR-181a may be involved in the development of GBM.
miR-181 Glioblastoma MGMT
2016-11-30)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.18.2016-2010
浙江省自然科学基金项目(LY16H160053);浙江省医药卫生科技计划项目(2012RCA042);温州市科技计划项目(Y20120008)
325000 温州医科大学附属第一医院神经外科
苏志鹏,E-mail:drsuzhipeng@163.com

