FTY720对蛛网膜下腔出血大鼠神经功能的作用及机制
董晓巧 俞文华 杜权 王昊 杨定博 沈永锋 江力 胡强 杜垣锋 朱强 车志豪 孙承龙 刘群杰 王鼎
●论 著
FTY720对蛛网膜下腔出血大鼠神经功能的作用及机制
董晓巧 俞文华 杜权 王昊 杨定博 沈永锋 江力 胡强 杜垣锋 朱强 车志豪 孙承龙 刘群杰 王鼎
目的 探讨FTY720对蛛网膜下腔出血大鼠神经功能的作用及相关机制。方法 将96只大鼠随机分成正常组、假手术组、模型组和治疗组,每组24只,采用枕大池二次注血建立蛛网膜下腔出血大鼠模型。治疗组按1mg/kg腹腔注射FTY720,其他3组腹腔注射0.9%氯化钠溶液1ml。24h后每组取12只断头处死并分离海马组织,采用Western blot法检测NF-κB蛋白表达,采用免疫组化染色法检测小胶质细胞OX-42蛋白表达;每组剩余12只大鼠用于神经功能评估。结果 模型组大鼠海马组织NF-κB蛋白表达水平、小胶质细胞OX-42蛋白表达水平均较正常组、假手术组明显增加(均P<0.05),治疗组较模型组明显减少(P<0.05)。前肢放置实验评分、平衡实验评分和改良神经功能缺损程度评分术后7、14、21、28d比较,治疗组较模型组均明显下降(均P<0.05)。结论 FTY720可改善蛛网膜下腔出血大鼠神经功能,其作用机制可能与FTY720的中枢炎症抑制作用有关。
FTY720 大鼠 蛛网膜下腔出血 神经功能 炎症反应 脑保护作用
蛛网膜下腔出血诱发的免疫反应可继发脑损伤,严重影响患者预后[1-2]。FTY720是一种新型的免疫抑制剂,系冬虫夏草抽提物中具有免疫抑制作用的成份ISP-I作结构改造而成,对人体的免疫功能具有双向调节作用,即在体内抑制免疫反应发生的同时,又不破坏机体对病毒的免疫应答及免疫记忆能力,不良反应少,生物利用度高[3]。因此,目前FTY720广泛用于多发性硬化症、器官移植等免疫性疾病的治疗,它有望成为新一代免疫抑制剂[4-7]。本研究通过建立大鼠蛛网膜下腔出血模型并腹腔注射FTY720,观察其对大鼠神经功能的保护作用,并检测海马组织炎症因子(NF-κB、OX-42)的变化,以探讨这一作用的机制。
1 材料和方法
1.1 主要试剂及仪器 FTY720(批号:SML0700;规格:25mg)购自美国Sigma公司;二辛可宁酸法(BCA)蛋白定量试剂盒(批号:23229)购自美国Thermo Scientific公司;Tris 0.9%氯化钠溶液和吐温20缓冲液(TBST,批号:117087)均购自上海经科化学科技有限公司;化学发光(ECL)试剂盒(批号:K820-50)购自武汉艾美捷科技有限公司;卵白素-生物素-酶复合物染色(ABC)复合物抗体(批号:PK-6100)购自上海翊圣生物科技有限公
司;转印槽(型号:Trans-Blot)购自美国Biorad公司;电泳仪(型号:EPS-200)购自上海天能科技有限公司;小型垂直电泳槽(型号:164-8001)购自美国Biorad公司;脱色摇床(型号:TY-80B)购自常州澳华仪器有限公司;生物倒置显微镜(型号:IX-71)购自中国奥林巴斯有限公司;低温高速离心机(型号:BECKMAN)购自北京普瑞麦迪实验室技术有限公司;荧光分光光度仪(型号:UV-1202)购自日本岛津公司。
1.2 方法
1.2.1 实验动物分组及造模 将96只健康Wistar大鼠(雄性,清洁级,由南京大学模式动物研究所提供)随机分成正常组、假手术组、模型组和治疗组,每组24只。按50mg/kg腹腔注射戊巴比妥钠麻醉,采用Roux等[8]建立的枕大池二次注血法制作蛛网膜下腔出血大鼠模型,假手术组两次注入等量0.9%氯化钠溶液。治疗组大鼠模型形成前0.5h按1mg/kg腹腔注射FTY720,其他3组大鼠均予腹腔注射0.9%氯化钠溶液1ml。24h后每组取12只大鼠,按80mg/kg腹腔注射戊巴比妥钠深度麻醉,断头处死,分离海马组织;每组剩余12只大鼠用于神经功能评估。正常组、假手术组、模型组和治疗组24h分别死亡0、2、4和3只,4组大鼠死亡率比较差异无统计学意义(PP>0.05);大鼠死亡后补充成活大鼠,以保证每组24只大鼠。
1.2.2 Western blot检测NF-κB蛋白表达水平 取部分海马组织按1∶10(密度∶体积)加入细胞裂解液,冰上匀浆,13 000g离心20min,收集上清液;采用BCA法测定蛋白浓度,等量蛋白(50μg)经12%SDS-PAGE电泳后,电转移至PVDF膜上,5%脱脂奶粉TBST室温封闭1h;加入相应兔抗大鼠 NF-κB 单克隆抗体(1∶1 000)4℃孵育过夜,TBST洗膜3次;加入HRP标记的羊抗兔IgG二抗(1∶10 000)室温摇床孵育 1h,TBST 洗膜 3 次;ECL试剂作用5min,X线胶片曝光。冲洗并扫描后结果用Quality one软件分析杂交条带灰度值,以GAPDH水平为内对照,计算相对灰度值,即NF-κB蛋白表达水平。1.2.3 免疫组化染色法检测小胶质细胞OX-42蛋白表达 取部分海马组织,采用ABC法进行OX-42免疫组化染色。按常规方法将海马组织制作蜡块,切片,贴片,磷酸盐缓冲液(PBS)清洗,二甲苯脱蜡,梯度乙醇水化;依次加入0.3%过氧化氢甲醇溶液(甲醇80ml+0.01mol PBS 100ml+30%过氧化氢)、0.3%Triton X-100(0.3ml Triton X-100+0.01mol PBS 100ml)、血清稀释液(牛血清白蛋白 1g+0.01mol PBS 100ml+叠氮钠 0.08g)稀释的一抗、0.01mol PBS稀释的的二抗和ABC复合物抗体,每次予以0.01mol PBS清洗,最后蒸馏水迅速冲洗,加入显色液,进行免疫组化显色,苏木素复染,梯度酒精脱水,透明,封片,拍照。利用细胞计数软件系统进行细胞立体测量计数,以正常组计数细胞值100为对照,计算相对表达值,即小胶质细胞OX-42蛋白表达水平。
1.2.4 动物行为测试 参照Kawamata等[9]的前肢放置试验和平衡试验方法,在术后 1、3、7、14、21、28d 对大鼠进行前肢放置试验和平衡试验评分测定,前肢放置试验得分0~10分,平衡试验得分1~7分;得分越高表示神经功能损伤越严重。
1.2.5 改良神经功能缺损程度评分测定 参考Chen等[10]的方法,在术后 1、3、7、14、21、28d 对大鼠进行改良神经功能缺损程度评分测定,包括运动、感觉、反射和平衡试验,得分0~18分;得分越高表示神经功能损伤越严重。1.3 统计学处理 应用SPSS19.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t法;两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 FTY720对NF-κB蛋白表达的影响 正常组、假手术组、模型组和治疗组大鼠海马组织NF-κB蛋白表达 水 平 分 别 为 100.0±5.2、102.2±7.0、263.8±21.9 和171.6±21.2,差异有统计学意义(P<0.05)。其中正常组与假手术组比较差异无统计学意义(PP>0.05),模型组较正常组、假手术组均明显增加(均P<0.05),治疗组较模型组明显减少(P<0.05),见图1-2。

图1 4组大鼠海马组织NF-κB蛋白表达的电泳图

图2 4组大鼠海马组织NF-κB蛋白表达水平的比较
2.2 FTY720对小胶质细胞OX-42蛋白表达的影响 正常组、假手术组、模型组和治疗组大鼠小胶质细胞OX-42 蛋白表达水平为 100.0±15.5、98.6±15.4、299.2±36.9和192.1±30.8,差异有统计学意义(P<0.05)。其中正常组与假手术组比较差异无统计学意义(PP>0.05),模型组较正常组、假手术组均明显增加(均P<0.05),治疗组较模型组明显减少(P<0.05),见图3-4。

图3 4组大鼠海马组织小胶质细胞OX-42免疫组化染色结果(×20)
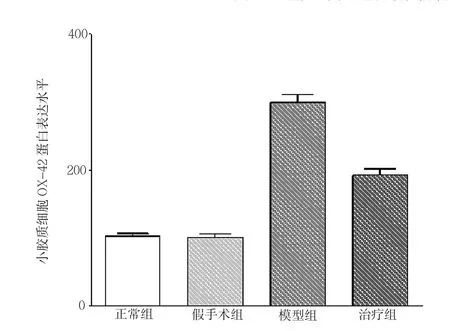
图4 4组大鼠海马组织小胶质细胞OX-42蛋白表达的比较
2.3 FTY720对大鼠运动功能的影响 正常组、假手术组大鼠前肢放置试验评分均为0分(最低分),平衡实验评分均为1分(最低分)。因此对模型组与治疗组前肢放置试验评分、平衡实验评分进行比较,发现术后1、3d差异均无统计学意义(均 P >0.05);术后 7、14、21、28d,治疗组较模型组均明显下降(均P<0.05),见表1。
2.4 FTY720对大鼠改良神经功能缺损程度评分的影响 正常组、假手术组大鼠改良神经功能缺损程度评分均为0分(最低分)。因此对模型组与治疗组改良神经功能缺损程度评分进行比较,发现术后1、3d差异均无统计学意义(均 P >0.05);术后 7、14、21、28d,治疗组较模型组均明显下降(均P<0.05),见表2。
FTY720是一种新型的免疫抑制剂,将冬虫夏草抽提物中具有免疫抑制作用的成份ISP-I进行结构改造而成,属于鞘氨醇-1-磷酸盐受体阻滞剂[5]。FTY720在
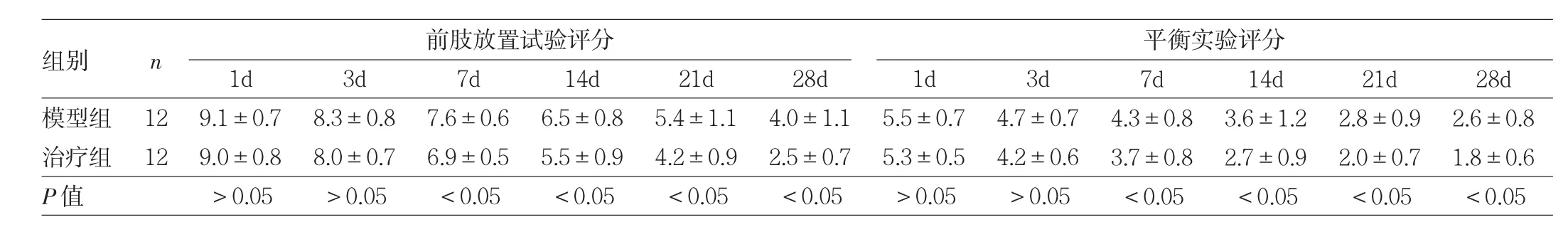
表1 模型组与治疗组大鼠术后各时点运动功能的比较(分)
3 讨论
蛛网膜下腔出血是脑动脉瘤破裂最常见的表现,出血导致的早期脑损伤会影响患者的预后[9-10]。免疫反应是继发性脑损伤病理生理机制的重要组成部分,也参与蛛网膜下腔出血继发的早期脑损伤过程;脑组织局部免疫反应增强会加重脑组织的继发性脑损伤[1-2],为临床应用免疫抑制剂治疗蛛网膜下腔出血早期脑损伤提供一定的实验依据。但临床常规免疫抑制剂可导致全身免疫功能降低,继发感染。因此,寻找一种安全有效的免疫抑制剂对于降低蛛网膜下腔出血早期脑损伤具有重要意义。体外以无活性的形式存在,在体内经鞘氨醇激酶2磷酸化为具有生物活性的(S)-FTY720-P异构体而发挥作用。FTY720主要用于抑制器官移植所引起的排斥反应,还可以用于治疗皮炎、重症肌无力等免疫紊乱或障碍疾病以及某些转移性癌症[3-7]。小胶质细胞在中枢神经系统扮演炎症细胞的角色。当脑组织受到外伤、缺血及缺氧等损害时,小胶质细胞增生活跃,包括NF-κB在内的诸多NF表达上调;通过不同信号途径与DNA结合,使IL-1β、TNF-α、IL-6等炎性因子分泌增加,进而损伤神经细胞,影响神经功能[11-13]。OX-42是小胶质细胞特异性的表达蛋白,OX-42表达能反映小胶质细胞增生活跃程度,也能间接反映中枢神经系统炎症反应的程度[14]。目前动物实验选择1mg/kg FTY720腹腔或静脉注射治疗脑损伤[16-17]。本研究结果显示大鼠蛛网膜下腔出血后海马组织NF-κB、小胶质细胞OX-42蛋白表达均明显增加,给予FTY720处理后出现不同程度的下调,提示FTY720可降低蛛网膜下腔出血后的炎症反应。既往研究表明FTY720可抑制体外培养胶质细胞的炎性因子释放[15],阻止脑外伤大鼠外伤皮层炎性细胞的聚集[16],抑制动物脑出血后脑内淋巴细胞的浸润[17];以上研究结果均说明FTY720对中枢神经系统的炎症反应具有明显抑制作用。

表2 模型组与治疗组大鼠术后各时点改良神经功能缺损程度评分的比较(分)
目前关于FTY720改善脑损伤功能的研究较少。为评价FTY720对蛛网膜下腔出血大鼠神经功能的影响,本研究采用前肢放置实验、平衡实验和改良神经功能缺损程度评分,以综合反映蛛网膜下腔出血大鼠的运动、感觉及协调功能。研究结果提示FTY720可明显降低蛛网膜下腔出血大鼠前肢放置实验、平衡实验和改良神经功能缺损程度评分。既往研究表明FTY720能有效抑制短暂性脑缺血导致的大鼠神经细胞死亡[18],降低脑出血大鼠脑水肿并改善脑功能[19]。因此,笔者推测FTY720可能通过抑制脑炎症反应,改善蛛网膜下腔出血导致的大鼠神经功能障碍;但本研究未深入分析FTY720治疗大鼠蛛网膜下腔出血的药物剂量与疗效的关系,有待进一步研究。
[1] Lee C I,Chou A K,Lin C C,et al.Immune and inflammatory gene signature in rat cerebrum in subarachnoid hemorrhage with microarray analysis[J].MolMed Rep,2012,5(1):118-125.
[2] Ayer R E,Ostrowski R P,Sugawara T,et al.Statin-induced T-lymphocyte modulation and neuroprotection following experimentalsubarachnoid hemorrhage[J].Acta Neurochir Suppl,2013,115:259-266.
[3]Pitman M R,Woodcock J M,Lopez A F,et al.Molecular targets of FTY720(fingolimod)[J].Curr MolMed,2012,12(10):1207-1219.
[4] Patmanathan S N,Yap L F,Murray P G,et al.The antineoplastic properties of FTY720:evidence for the repurposing of fingolimod[J].J CellMolMed,2015,19(10):2329-2340.
[5]Zhang L,Wang H D,Ji XJ,et al.FTY720 for cancer therapy(Review)[J].OncolRep,2013,30(6):2571-2578.
[6] Estella-Hermoso de Mendoza A,Castello-Cros R,Imbuluzqueta E,et al.Lipid nanosystems enhance the bioavailability and the therapeutic efficacy of FTY720 in acute myeloid leukemia[J].J Biomed Nanotechnol,2015,11(4):691-701.
[7] Yoshida Y,Tsuji T,Watanabe S,et al.Efficacy of combination treatment with fingolimod (FTY720)plus pathogenic autoantigen in a glucose-6-phosphate isomerase peptide(GPI325-339)-induced arthritis mouse model[J].Biol Pharm Bull,2013,36(11):1739-1746.
[8] Roux S,Lo ffler B M,Gray G A,et al.The role of endothelin in experimentalcerebralvasospasm[J].Neurosurgery,1995,37(1):78-85.
[9] Kawamata T,Dietrich W D,Schallert T,et al.Intracisternal basic fibroblastgrowth factorenhances functional recovery and up-regulates the expression of a molecular marker of neuronal sprouting following focalcerebralinfarction[J].Proc NatlAcad Sci USA,1997,94(15):8179-8184.
[10] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005-1011.
[11] Hinson H E,Rowell S,Schreiber M.Clinical evidence of inflammation driving secondary brain injury:A systematic review[J].J Trauma Acute Care Surg,2015,78(1):184-191.
[12] Abdul-Muneer P M,Schuetz H,Wang F,et al.Induction of oxidative and nitrosative damage leads to cerebrovascular inflammation in animal model of mild traumatic brain injury induced by primary blast[J].Free Radic Biol Med,2013,60(2):282-291.
[13] Dong X Q,Du Q,Yu W H,et al.Anti-inflammatory effects of oxymatrine through inhibition of nuclear factor-kappa B and mitogen-activated protein kinase activation in lipopolysaccharide-induced BV2 microglia cells[J].Iran J Pharm Res,2013,12(1):165-174.
[14] Ghosh M,Garcia-Castillo D,Aguirre V,et al.Pro-inflammatory cytokine regulation of cyclic AMP-phosphodiesterase 4 signaling in microglia in vitro and following CNS injury[J].Glia,2012,60(12):1839-1859.
[15] Janssen S,Schlegel C,Gudi V,et al.Effect of FTY720-phosphate on the expression of inflammation-associated molecules in astrocytes in vitro[J].MolMed Rep,2015,12(4):6171-6177.
[16] Zhang Z Y,Zhang Z R,Fauser U,et al.FTY720 attenuates accumulation of EMAP-Ⅱ+and MHC-Ⅱ+monocytes in early lesions of rat traumatic brain injury[J].J CellMolMed,2007,11(2):307-314.
[17] Rolland WB,Lekic T,Krafft P R,et al.Fingolimod reduces cerebral lymphocyte infiltration in experimental models of rodent intracerebralhemorrhage[J].Exp Neurol,2013,241(1):45-55.
[18] Hasegawa Y,Suzuki H,Sozen T,et al.Activation of sphingosine 1-phosphate receptor-1 by FTY720 is neuroprotective after ischemic stroke in rats[J].Stroke,2010,41(2):368-374.
[19] Rolland W B,Manaenko A,Lekic T,et al.FTY720 is neuroprotective and improves functional outcomes after intracerebral hemorrhage in mice[J].Acta Neurochir Suppl,2011,111(2):213-217.
Effect of FTY720 on neurological function in rats with subarachnoid hemorrhage and related mechanism
DONG Xiaoqiao,YU
Wenhua,DU Quan,et al.Department of Neurosurgery,Hangzhou First People's Hospital,Hangzhou 310006,China
Objective To investigate the effect of FTY720 on neurological function in rats with subarachnoid hemorrhage(SAH)and the related mechanism. Methods A total of 96 rats were randomly assigned to normal group,sham-operation group,model group and treatment group with 24 rats in each group.The rat SAH model was established via autologous blood injection into cisterna magna.Rats in treatment group were given intraperitoneally with 1mg/kg FTY720.Rats in other three groups were given intraperitoneal injection of 1ml normal saline.After 24 hours,12 rats in each group were sacrificed by decapitation and their hippocampus tissue samples were collected.Western blot was used to determine the expression of nuclear factor-kappa B(NF-κB).Immunohistochemistry was utilized to investigate the microglial OX-42 expression.Other 12 rats in each group experienced neurological function assessment. Results The relative expressions of NF-κB and microglial OX-42 in the hippocampus tissues were significantly higher in model group than those in normal group and sham-operation group (allP<0.05),also higher than those in treatment group(allP<0.05).Forelimb-placement test,balance test and modified neurological severity scores at d 7,14,21 and 28 postoperatively in treatment group were all significantly lower than those in model group(allP<0.05). Conclusion FTY720 can markedly improve the neurological function of rats with SAH,which may be related to the inhibition of inflammation in central nervous system.
FTY720 RatSubarachnoid hemorrhage Neurologicalfunction Inflammation Cerebralprotective effect
2016-09-08)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.18.2016-1373
浙江省实验动物科技计划项目(2015C37082)
310006 杭州市第一人民医院(南京医科大学附属杭州医院)神经外科
董晓巧,E-mail:dxqhyy@163.com

