螺旋CT在进展期胃癌术前分期中的应用
郑启元,顾禄寿,王好微
(1.甘肃省武威肿瘤医院,甘肃 武威 733000;2.重庆云阳益康医院,重庆 云阳 404500)
螺旋CT在进展期胃癌术前分期中的应用
郑启元1,顾禄寿2,王好微1
(1.甘肃省武威肿瘤医院,甘肃 武威 733000;2.重庆云阳益康医院,重庆 云阳 404500)
目的 通过与术后病理结果比较,评价多排螺旋CT在进展期胃癌术前TNM分期中的应用价值。方法 对28例经胃镜证实的胃癌患者行多层螺旋CT平扫及双期增强扫描,确定肿瘤浸润深度(T)、淋巴结转移(N)、远处转移(M),并与手术后病理结果进行对照分析。结果28例患者多层螺旋CT与手术病理检查结果比较显示TNM判断准确率为18例(64.23%)。T分期判断准确率为23例(82.14%),N分期判断准确率为21例(75.00%),M判断准确率为(100%)。结论 MSCT在进展期胃癌的术前分期中具有重要的参考价值。
胃癌;增强CT;TNM分期
胃癌是最常见的消化系统恶性肿瘤,胃癌根据肿瘤的浸润深度分为早期胃癌和进展期胃癌。目前首选的治疗方法是手术切除,术前准确评估肿瘤的TNM分期对于肿瘤的治疗尤为重要;胃癌术前确诊最简单的方法是胃镜检查,然而外科医生关注更重要的是肿瘤的浸润深度,有无淋巴结转移及远处转移。以往研究发现局部浸润和淋巴结转移是影响进展期胃癌患者生存率和预后的相关重要因素[1]。超声内镜、CT、MRI均可用于肿瘤的术前分期并各具优势,其中螺旋CT应用普及率最高,已经成为首选的影像学检查方法。关于胃癌的CT诊断与术前分期的应用报道很多,与术后病理对照TNM符合率各有不同。笔者根据所收集的影像病理对照资料,探讨影响胃癌术前正确分期的各种因素,旨在客观评价螺旋CT在胃癌术前分期中的优势与不足。
1 资料与方法
1.1 临床资料 选择甘肃省武威肿瘤医院2015~2016年经胃镜确诊并经手术病理证实的进展期胃癌患者28例,其中男25例,女3例,年龄44~74岁,平均年龄(58±8)岁。所有患者均在术前1周内行平扫及MSCT双期增强检查,所有患者均为首次发现病灶,未经抗肿瘤等治疗。临床表现主要为上腹胀痛不适,黑便。
1.2 检查方法 采用美国GE Brightspeed16层螺旋CT机,病人空腹,于检查前肌注盐酸(氢溴酸)山莨菪碱20 mg,待口干后服温开水400~1 000 mL,使胃部最大限度充盈。患者取仰卧位,扫描前进行屏气训练,扫描范围膈顶至脐部。扫描参数:120 kv,Auto mA,层厚 5 mm,螺距 1.375∶1,矩阵512×512。利用高压注射器以3~4 mL/s的速率经肘静脉团注碘海醇80 mL,浓度300 mgI/mL,延迟25~30 s后进行动脉期扫描,65~70 s静脉期扫描。
记录包括胃癌位置、厚度、双期病变强化特点,进行胃癌T分期。记录淋巴结转移部位、数目、大小、强化特点进行N分期,记录肝脏等实质脏器有无异常强化、腹膜有无异常增厚及腹水进行M分期,
TNM分期结果由2名高年资放射科医生共同阅片确定。1.3 胃癌分期诊断标准 采用UICC第5版TNM分期标准进行分期。用T表示浸润深度:T1,肿瘤侵及黏膜和(或)黏膜肌或黏膜下层;T2,肿瘤侵及肌层或浆膜下;T3,肿瘤侵透浆膜;T4,肿瘤侵犯邻近结构。用N表示淋巴结转移:N0,无淋巴结转移;N1,1~6个区域性淋巴结转移;N2,7~15个区域性淋巴结转移;N3,超过15个区域性淋巴结转移。用M表示远处转移:M0,无远处脏器转移;M1,有远处脏器转移(包括肝、肺、腹膜、肾、腹腔淋巴结和腹水)。
2 结果
多层螺旋CT双期增强扫描对胃癌术前TNM分期总准确率为64.23%,T分期总准确率为82.14%,其中T2准确率50%,T3准确率86.96%,T4准确率66.67%,N分期总准确率为75.00%,其中N075.00%、N166.67%、N270.59%、N380.00%。M分期准确率为100%。
2.1 胃癌的T分期 与手术病理分期对照组织病理检查结果。见表1。

表1 手术病理与螺旋CT胃癌T分期对照(n)
2.2 胃癌N分期 与手术病理分期对照组织病理检查结果。见表2。
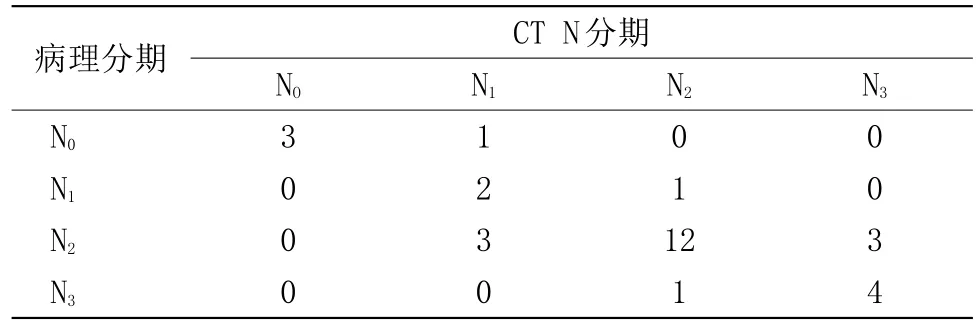
表2 手术病理与螺旋CT胃癌N分期对照(n)
2.3 胃癌患者MDCT TNM分期与手术病理分期对照对照组织病理检查结果。见表3。
3 讨论
3.1 胃癌的增强CT表现与T分期 胃癌T分期是用于判断肿瘤原发灶对胃壁的浸润深度,对于能否手术切除至关重要。基于多层螺旋CT快速扫描、薄层重建、高分辨率成像优势,使胃癌术前检测及准确分期成为可能[2]。在MSCT增强图像上,充盈良好的胃腔胃壁厚度通常在5 mm以下,当局部胃壁增厚大于5 mm,动脉期出现黏膜下层早期强化或门静脉期强化持续推进贯穿全层,使胃壁原有的分层结构消失作为胃癌的诊断金标准[3]。充盈良好的胃腔胃壁一般显示为两层或三层结构,其中两层结构最多见,显示率约为60%[4]。当胃壁显示为双层结构时,外层为肌层及浆膜层,增强后仅轻度强化。内层结构为黏膜层及黏膜下层,呈明显线样强化。少数情况下胃壁可以显示为三层结构,外层结构代表肌层与浆膜层,增强后呈轻中度强化。中层结构代表黏膜下层,其相对于粘膜层显示为低密度;内层结构为黏膜层,增强后呈明显线样强化;单层型早期胃癌表现为胃壁正常或略显增厚,有或无异常强化;多层型胃壁异常增厚强化区可见中外层结构清晰显示;进展期胃癌在动脉早期可见黏膜下层早期强化,门静脉期时病灶强化区持续推进扩大,贯穿整个病灶。在门静脉期观察胃壁有无全层强化,浆膜面及周围脂肪间隙是否毛糙以及与邻近结构脂肪间隙消失与否,是区分T2,T3及T4期病灶的关键。本研究全部为进展期胃癌患者,T分期总准确率达82.14%,由于胃癌周围脂肪间隙内存在微浸润和炎症反应,MSCT对于T2、T3的区分存在过度和不足,其中T2期误判为T3期1例,T3期误判为T2期2例,因此,当胃癌的浆膜轮廓征象不规则或有索条凸出时,应结合其他征象来作出正确的分期。Chen CY等人报道,轴位结合MPR可以将胃癌T分期的准确率由73%提高到89%[5]。胃癌的能谱曲线不仅可以反应肿瘤的浸润深度,利用单能量模式重建增强影像进行物质分离定量分析有助于癌肿胃周脂肪浸润的判定[6],所以利用MPR重建及能谱曲线变化规律进行综合分析,有助于提高T分期的准确率。

表3 手术病理与螺旋CT胃癌TNM分期对照(n)
3.2 胃癌的淋巴结转移与分期 淋巴结转移是胃癌转移的重要途径之一,进展期胃癌患者若出现胃周淋巴结转移其术后五年生存率明显减低,术前评估淋巴结转移情况对于胃癌预后及临床治疗决策具有重要的意义,可以帮助选择合理的淋巴结切除范围,提高患者生存率。目前胃癌术前分期中最有争议的是转移淋巴结的判定,虽然淋巴结大小与转移率呈显著正相关,但有部分淋巴结存在假阳性与假阴性,乔英等[7]发现,蚕噬状、囊状、周边高密度中心低密度相对高密度及花斑者,呈串珠状排列并融合,对血管产生压迫和肿块状增大的淋巴结,增强并有强化首先考虑转移。唐磊提出了测量淋巴结均径及径线和的方法,通过CT检出淋巴结的数目联合径线和对于术前N分期具有积极意义[8]。在一项Meta分析中[9],影像学N分期准确率在50%~70%不等。本研究中N分期整体准确率为75.00%,其判断标准及准确性与乔英、Meta分析数据基本一致。本研究显示绝大部分转移淋巴结无论大小,首先从邻近肿瘤部位发生第一站转移,然后随支配血管继续向下一站转移,在上述引流区域发现异常肿大淋巴结,对判断淋巴结转移有一定帮助。MDCT对于胃小弯、贲门、腹主动脉旁、腹腔干周围转移淋巴结敏感性较高,胃窦部、脾动脉旁淋巴结敏感性较差。
胃癌远处转移主要转移部位包括肝脏、肺及腹膜腔,其中肝脏转移最常见[10]。本研究中所有患者以肝脏转移瘤和腹水作为远处转移征象,术中均未发现肝脏典型转移瘤及可疑癌性腹水,故M0期的准确率为100%。
综上所述,MDCT对胃癌浸润深度的评价一致性高,可以作为评价胃癌T分期的可靠方法,对胃癌淋巴结转移的评价一致率不够理想,对远处转移评价较为准确,对肝转移、腹膜后淋巴结转移评价较为准确,但对无腹水的腹腔种植转移小结节或网膜种植转移小结节敏感性不高,容易漏诊。
[1] Pye JK,Crumplin ME,Biffin A,et al.One—year survey of carcinoma of the oesophagus and stomach in Wales[J].Br J Surg,2001,88:278-285.
[2] 杨旋彪,许茂杰.多层螺旋CT对胃癌的诊断价值[J].当代医学,2012,18(7):5-6.
[3] 曾凡勇,金彪,张海兵.64排螺旋CT多期增强扫描对进展期胃癌术前评估的价值[J].中国肿瘤临床与康复,2013,20(11):1221-1223.
[4] Zhang H,Pan Z,Du L,et al.Advanced gastric cancer and perfusion imaging using a multidetector row computed tomography:correlation with prognostic determinants[J].Korean Journal of Radiology,2008,9(2):119-127.
[5] Chen CY,Hsu JS,Wu DC,et al.Gastric cancer:preoperative local staging with 3D multi-detector row CT-correlationwithsurgicalandhistopathologic results[J].Radiology,2007,242(2):472-482.
[6] Bolus DN.Dual-energy computed tomographic canners:principles,comparisons,and contrasts[J].J Comput Assist Tomogr,2013,37:944-947.
[7] Qiao Ying,Li Jianding,Zhang Ruiping,et al.Diagnostic vaIue of tri-phasic enhanced spiral CT in the diagnosis of lymph node metastasis of gastric carcinoma[J].Radiol Practice,2006,21(5):507-510.
[8] Tang Lei,Zhang Xiaopeng,Sun Yingshi,et al.Comparison study of CT indicators and pathological N staging in lymph node metastasis of gastric cancer[J].Chin J GastroIntestinal Surg,2008,11(6):529-532.
[9] Seevaratnam R,Cardoso R,McGregor C,et al.How useful is preoperative imaging for tumor,node,metastasis(TNM)staging of gastric cancer?A meta-analysis[J].Gastric Cancer,2012,15(Suppl 1):S3-S18.
[10]徐月阳,牛建华,袁明,等.64排螺旋CT与组织病理对胃癌患者TNM分期的对照研究[J].中华实用诊断与治疗杂志,2013,27(9):875-877.
10.3969/j.issn.1009-4393.2017.30.036

