孤独症患儿与正常儿童血清性激素水平对照研究
章素芳
(南昌大学第一附属医院儿科,江西 南昌 330006)
孤独症患儿与正常儿童血清性激素水平对照研究
章素芳
(南昌大学第一附属医院儿科,江西 南昌 330006)
目的 对照研究孤独症患儿与正常儿童血清性激素水平是否存在不同。方法 选取诊断为孤独症的患儿30例(孤独症组)及同期门诊正常体检无异常的儿童30例(对照组),以化学发光法测定血清孕酮(P)、雌二醇(E2)、睾酮(T)、促黄体生成素(LH)、卵泡刺激素(FSH)水平。结果 孤独症组患儿血清T水平为(0.13±0.05)ng/mL,高于对照组(0.03±0.01)ng/mL,比较差异有统计学意义(P<0.05),P、E2、LH、FSH水平两组比较差异无统计学意义。孤独症组中不同性别患儿血清T、P、E2、LH、FSH水平比较差异无统计学意义。结论 孤独症患儿血清T水平明显高于正常儿童,T水平与患儿性别无关,T升高可能是引起孤独症发病的病因之一,其机制值得进一步深入研究。
孤独症;性激素;儿童
孤独症(childhood autism)又称孤独症谱系障碍,是一种以语言交流障碍、社会交互障碍、重复刻板行为及兴趣狭窄为特征的广泛性精神发育障碍性疾病,包括典型孤独症、童年瓦解性精神障碍、Rett综合征、未分类的广泛发育障碍等。孤独症病因不明,但是研究发现存在性别差异[1-2],男性发病率明显高于女性,有研究显示孤独症患儿类固醇激素有升高现象[3-5],高睾酮被认为是引起孤独症发病的危险因素。本研究对孤独症患儿与正常儿童血清性激素水平进行了对照研究,现将结果报道如下。
1 资料与方法
1.1 临床资料 选取2015年1月~2016年12月期间诊断为孤独症的患儿30例(孤独症组),选取同期门诊正常体检无异常的儿童30例(对照组),纳入标准:①孤独症符合相关诊断标准[6]。②年龄≤7岁。孤独症组排除童年瓦解性障碍、Rett氏综合征、精神发育迟滞、儿童少年精神分裂症、特定性言语和语言发育障碍、儿童内分泌疾病、染色体疾病、慢性器质性疾病。孤独症组中男21例、女9例,年龄21~84个月,平均(45.22±13.84)个月,出生胎龄36~42周,平均(38.95±0.82)周,出生体质量2.6~4.2 kg,平均(3.13±0.24)kg;对照组中男18例、女12例,年龄20~84个月,平均(45.64±13.32)个月,出生胎龄36~42周,平均(38.63±0.80)周,出生体质量2.3~4.1 kg,平均(3.15±0.20)kg;两组在性别、年龄、出生胎龄、出生体质量等方面比较差异无统计学意义,具有可比性。
1.2 方法 抽取空腹外周静脉血3 mL,进行离心处理后分离血清及血浆,以化学发光法测定血清孕酮(P)、雌二醇(E2)、睾酮(T)、促黄体生成素(LH)、卵泡刺激素(FSH)水平,检验仪器为美国贝克曼库尔特有限公司生产ACCESS全自动化学发光仪,检测试剂盒为同机自带。
1.3 观察指标 观察两组血清P、E2、T、LH、FSH水平变化。1.4 统计学方法 本研究数据均用SPSS 19.0统计软件处理,计量资料采用“x±s”表示,组间比较采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组血清性激素水平比较 孤独症组患儿血清T水平为(0.13±0.05)ng/mL,高于对照组(0.03±0.01)ng/mL,比较差异有统计学意义(P<0.05),P、E2、LH、FSH水平两组比较差异无统计学意义。见表1。
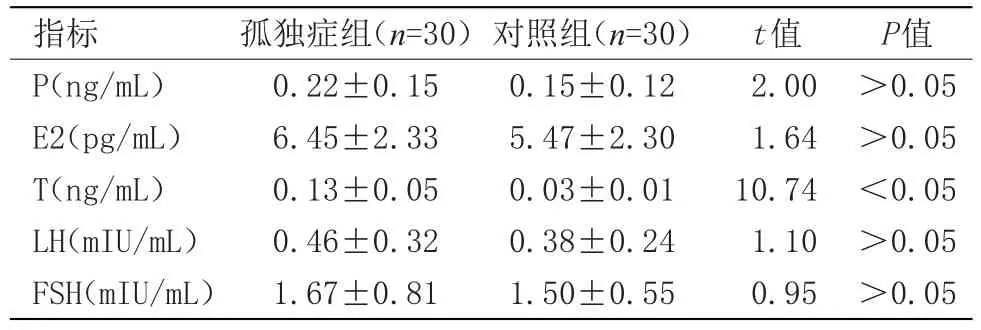
表1 两组血清性激素水平比较(x±s)Table 1 Comparison of serum sex hormone levels between the two groups(x±s)
2.2 不同性别孤独症患儿血清性激素水平比较 孤独症组中不同性别患儿血清T、P、E2、LH、FSH水平比较差异无统计学意义。见表2。
3 讨论
孤独症的发病机制尚未完全明确,临床相关相关研究显示遗传因素(基因突变)、环境因素共同作用可能是引起孤独症发病的主要原因[7-9]。遗传因素是最重要的致病因素,同卵双胎同时患有孤独症的发病率明显高于一般人群,患有苯丙酮尿症等疾病的患儿可存在孤独症症状,部分孤独症患者还存在遗传综合征和染色体的异常,如染色体片段重复、缺失、平衡易位、倒位等异常。环境因素包括孕初期及围生期生物学因素、感染及免疫因素、社会心理因素等,研究显示孕期母亲如存在紧张等不良情绪、有吸烟史等不良围生期因素[10],可能成为孕期孤独症发生的辅助因素;单纯疱疹病毒、风疹病毒等感染也已经被证实与孤独症发病有关[7-9];也有研究显示孤独症可能与铁、钙等微量元素的缺乏或吸收障碍有关[11],还有研究显示孤独症患儿睾酮含量高于正常人群[3-5],提示性激素异常可能也有孤独症的发病有关。

表2 不同性别孤独症患儿血清性激素水平比较(x±s)Table 2 Comparison of serum sex hormone levels in autistic children of different sex(x±s)
临床有研究显示[12-14],神经系统的发育及神经系统疾病发生与血清P水平存在密切关系,孤独症患儿存在血清P的下降,认为P和孕烯醇酮的形成是类固醇激素合成途径的主要限速步骤,浦肯野细胞又是大脑合成T的主要场所,对P合成如存在影响,孤独症患儿有边缘系统灌注不足的特征性损害,而T又能对边缘系统γ-氨基丁酸受体基因形成影响,因此P的下降可能是导致孤独症患者出现边缘系统功能不足的原因。有学者研究显示[15],孤独症患儿不仅存在P升高,还存在E2和T升高,这一现象的出现被认为是孤独症患者内分泌活动调节中枢-下丘脑存在异常所致,其原因不清。本研究对孤独症患儿与正常儿童血清性激素水平进行了对照研究,以探讨性激素对孤独症的影响,研究结果显示孤独症组患儿血清T水平明显高于正常对照儿童,P、E2、LH、FSH水平则与正常对照儿童比较未见明显差异,其原因不明,是否与研究对照的种族、年龄等因素影响有关,尚不明确。同时,由于孤独症患儿男性患病率明显高于女性,性激素在不同性别之间是否存在不同,是否为性别因素所导致孤独症患儿T升高,本研究对这一因素也进行了分析,结果显示孤独症组中不同性别患儿血清T、P、E2、LH、FSH水平比较差异无统计学意义,说明血T的升高并非性别因素影响所致。
综上所述,孤独症患儿血清T水平明显高于正常儿童,T水平水平与患儿性别无关T升高可能是引起孤独症发病的病因之一,其机制值得进一步深入研究。
[1] 陈文雄.孤独症70年:从Kanner到DSM-V[J].临床儿科杂志,2013,31(11):1001-1004.
[2] Becerra TA.孤独症谱系障碍与人种、种族和出生地的关系:基于人群的研究[J].PEDIATRICS,2014,9(6):361.
[3] Pivovarciova A,Hnilicova S,Tomova A,et al.Testosterone and explosive aggression in children with autism spectrum disorders[J].Eur Neuropsychopharmacol,2014,24(Suppl 2):S712-S713.
[4] Kung KTF,Spencer D,Pasterski V,et al.No relationship between prenatal androgen exposure and autistic traits:convergent evidence from studies of children with congenital adrenal hyperplasia and of amniotic testosterone concentrations in typically developing children[J].Journal of Child Psychology and Psychiatry,2016,57(12):1455-1462.
[5] Kung KTF,Constantinescu M,Browne WV,et al.No relationship between early postnatal testosterone concentrations and autistic traits in 18 to 30-monthold children[J].Molecular autism,2016,7(1):15.
[6] 邹小兵,邓红珠.儿童孤独症谱系障碍——美国精神疾病诊断分类手册“孤独症谱系障碍诊断标准”解读[J].中国实用儿科杂志,2013,28(8):561-563.
[7] 谭晶晶,高雪屏,苏林雁.儿童孤独症病因学研究进展[J].中国实用儿科杂志,2013,28(2):143-146.
[8] 叶蓓,焦敏.儿童孤独症高危因素和早期特征的回顾性分析[J].当代医学,2015,21(4):83-84.
[9] 贾秋利,曾序春,谷学英,等.孤独症病因研究进展[J].中国实用儿科杂志,2013,28(8):630-634.
[10]郑冬梅,吕莹,孙彩虹,等.母孕产期环境因素与孤独症谱系障碍的关联研究[J].哈尔滨医科大学学报,2015,49(6):524-527.
[11]李刚,韦荔莉,齐立,等.血微量元素水平与儿童孤独症关系的研究[J].广西医科大学学报,2015,32(5):754-755.
[12]Whitaker-Azmitia PM,Lobel M,Moyer A.Low maternal progesterone may contribute to both obstetrical complications and autism[J].Medical hypotheses,2014,82(3):313-318.
[13]Kosidou K,Dalman C,Widman L,et al.Maternal polycystic ovary syndrome and the risk of autism spectrum disorders in the offspring:a population-based nationwide study in Sweden[J].Molecular psychiatry,2016,21(10):1441-1448.
[14]游聪,邓红珠,岑超群,等.青春前期孤独症患儿血清性激素水平变化的病例对照研究[J].中华行为医学与脑科学杂志,2012,21(11):991-993.
[15]张英,柯晓殷,寇聪,等.孤独症患儿血清性激素水平的病例对照研究[J].国际精神病学杂志,2015,42(4):5-8.
Acomparative study of serum sex hormones in children with autism and normal children
Zhang Su-fang
(Department of Pediatrics,the FirstAffiliated Hospital of Nanchang University,Nanchang,Jiangxi,330006,China)
Objective To study whether there are different levels of serum sex hormones in children with autism and normal children.Methods 30 cases of children diagnosed with autism(autism group)and normal physical examination over the same period patient abnormal children 30 cases(control group),serum progesterone was measured by chemiluminescence(P),estradiol(E2),testosterone(T)and luteinizing hormone(LH),follicle stimulating hormone(FSH)the level of.Results The serum T level for the autism group(0.13±0.05)ng/mL,higher than that of the control group(0.03±0.01)ng/mL,the difference was statistically significant(P<0.05),no statistically significant P,E2,LH,FSH level difference between the two groups.There was no significant difference in serum T,P,E2,LH and FSH levels in children with different gender in autism group.Conclusion The level of serum T in children with autism was significantly higher than that of normal children.The level of T was not related to the gender of children,and the increase of T may be one of the causes of autism.
Autism;Sex hormones;Children
10.3969/j.issn.1009-4393.2017.30.012

