多孔结构TiO2/CdS复合物在可见光下的光催化性能研究
宁 轲,朱 光,杨 杰,许胜南,陈 磊
宿州学院 1.机械与电子工程学院;2.化学化工学院,宿州,234000
多孔结构TiO2/CdS复合物在可见光下的光催化性能研究
宁 轲1,朱 光1,杨 杰1,许胜南2,陈 磊2
宿州学院 1.机械与电子工程学院;2.化学化工学院,宿州,234000
采用水热法制备MOF衍生的多孔二氧化钛,然后掺入CdS进行复合,得到复合材料TiO2/CdS。采用扫描电子显微镜(SEM)和X射线衍射仪(XRD)等表征方法对所制备的样品进行分析与检测,然后对亚甲基蓝(MB)进行光降解实验。结果表明,90 min后,复合材料TiO2/CdS降解MB的效率达49%,较纯TiO2的光降解率有明显提高。通过掺入CdS,使TiO2的吸收范围拓展到了可见光区,从而有效提高二氧化钛的光催化性能。
二氧化钛;硫化镉;水热法;光催化
1 相关研究与问题提出
光催化反应指光照和催化剂共同作用在催化剂表面将光能转变成化学能的反应,可分为光反应和催化反应[1]。1967年A.Fujishima和K.Honda发现二氧化钛单结晶在紫外光的照射下,可以将水分解为氧气和氢气[2]。二氧化钛凭借自身独特的优点,在工业和日常生活中都有广泛的应用。但是由于TiO2对太阳光中的可见光利用率较低,严重制约了它在实际生产和生活中的应用[3]。因此,近年来提高二氧化钛的光催化活性就成为了科学家探索的主要方向,目前研究主要集中在两个方面:一是减小光生电子-空穴符合率,二是扩大对可见光的响应范围[4]。于向阳等通过Sol-gel 法和静电纺丝相结合的办法制备铜离子掺杂的介孔二氧化钛纳米纤维,在可见光下降解异丙醇,发现铜离子延长了电子和空穴的复合时间,提升了该材料的光催化性能[5]。
二氧化钛俗称钛白粉,为白色固体或粉状两性氧化物质,是目前性能非常好的白色无机颜料,广泛应用于化妆品、印刷油墨、耐高温实验器皿等方面[6]。二氧化钛的光化学性能使它在半导体光触媒领域大受欢迎,其中以金红石型(R型)和锐钛矿型(A型)的光催化研究最为广泛[7]。两种晶型的原子排列都是一个钛原子位于八面体中央,和周围6个构成八面体棱的氧原子进行配位。可是R型拥有2个化学单位的二氧化钛,A型拥有4个,因此两种晶体结构的二氧化钛有截然不同的物理和化学性质[8-9]。图1给出了两种晶型的立体结构示意图[10]。
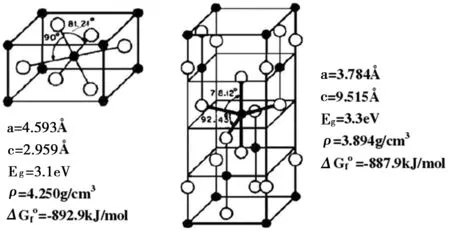
图1 TiO2晶型结构示意图
半导体复合是通过将两种或两种以上电子能带位置相匹的半导体材料进行复合,从而拓展其光响应范围,提高光生电荷的分离比率,极大地提升光催化性能的一种改性手段[11]。目前研究较多的半导体复合材料有SnS2-TiO2、WO3-CdS、TiO2-MnO2、SnO2-PbS等[12-14]。其中TiO2和CdS能级匹配效果较好,备受关注。Anil Kumar等采用溶胶凝胶法制备了复合材料TiO2/CdS,发现二氧化钛能减少硫化镉的禁带光发射时间,虽然CdS对吡啶不能发挥光催化作用,但复合材料的光降解效果很好[15]。李昱昊等在研究中发现复合材料CdS/TiO2在可见光下降解亚甲基蓝的效果高于纯的TiO2,同时还克服了CdS容易被腐蚀的缺点[16]。H.Tada等用吡罗红B做探针,运用离子交换法制备纳米介孔TiO2和CdS的复合物来探究其光催化的动力学特点,结果发现两种材料通过复合解决了彼此的弊端,在光化学反应中展现出了较好催化性能[17]。
本文以钛酸四丁酯为原料,制备了MOF结构的TiO2多孔材料,在此基础上选用CdS进行复合,制备晶型稳定的复合材料TiO2/CdS,采用XRD、SEM方法进行表征,测定其形貌和结构,并探究该光催化剂在可见光下降解MB的效率。
2 实验部分
2.1 实验试剂与仪器
2.1.1 实验试剂
钛酸四丁酯(AR,国药集团化学试剂有限公司)、甲醇(AR,国药集团化学试剂有限公司)、N,N-二甲基甲酰胺(DMF)(AR,上海展云化工有限公司)、对苯二甲酸(AR,湖北巨盛科技有限公司)、硝酸镉(AR,上海展云化工有限公司)、氨水(NH3含量≥25%~28%,上海苏懿化学试剂有限公司)、硫脲(AR,国药集团化学试剂限公司)。
2.1.2 实验仪器
79-1型磁力搅拌器(江苏杰瑞尔电器有限公司)、SUI510扫描电子显微镜(日本日立株式会社)、DX-2600型X射线衍射仪(丹东方圆仪器有限公司)、D4-3310紫外可见分光光度计(日本日立株式会社)、BL-GHX-V型光催化反应仪(上海比朗仪器制造有限公司)、DZF-6020恒温干燥箱(上海笃特科学仪器有限公司)。
2.2 MOF结构的多孔TiO2的制备
称量0.500 0 g对苯二甲酸溶解于10 mL DMF和甲醇以9∶1混合的溶液中,45℃下搅拌为澄清透明的溶液,然后加入0.26 mL钛酸四丁酯,继续搅拌30 min,至溶液均一。将其转入水热反应釜中,150℃下反应20 h后,沉淀物用甲醇和DMF交替清洗6次,置于鼓风干燥箱中60℃干燥24 h后,再将得到的样品在550℃下煅烧5 h,得到纯的MOF结构的多孔TiO2。
2.3 复合材料TiO2/CdS的制备
秤量0.020 0 g二氧化钛溶解于30 mL去离子水中,在室温下搅拌1 h至溶液均匀,然后依次加入0.025 7 g硝酸镉,0.015 2 g硫脲,0.28 mL氨水,将所得的混合物在60℃下搅拌3 h,收集所获得的沉淀物,用超纯水和无水乙醇进行清洗、离心各3次,然后在70℃下真空干燥3 h。
2.4 表征测试及光催化实验
将制备的TiO2和复合材料TiO2/CdS的形貌和结构用扫描电镜、X射线衍射仪等方法进行表征测试。光催化实验如下:取50 mg所合成的样品,将其溶解于50 mL 10 mg/L的亚甲基蓝溶液中,超声30 min,然后将混合溶液在避光的条件下暗反应30 min。再将溶液置于300 W的氙灯下进行可见光降解,在光催化降解过程中,每间隔约15 min收集5 mL溶液,离心,抽取上层澄清溶液,用紫外可见分光光度计测其吸光度。
3 结果与讨论
3.1 TiO2及复合物的SEM分析
图2(a)为MOF结构的多孔TiO2的扫描电镜图像。由图可知,纯TiO2颗粒大小均一,分散性较好。(b)为复合材料TiO2/CdS的扫描电镜图,从图可以看出,与纯TiO2相比,复合材料TiO2/CdS表面比较粗糙,表明已有CdS沉积于TiO2表面。

图2 TiO2的SEM图片
3.2 复合材料TiO2/CdS的EDX分析
图3为复合材料TiO2/CdS的EDX图。从图可以看出复合物中存在Ti、O、Cd、S、C元素峰,在0.24 keV左右出现S元素,在0.3 keV和0.33 keV左右出现Cd元素,说明以水热-沉积法制备复合材料TiO2/CdS的方法是可行的。
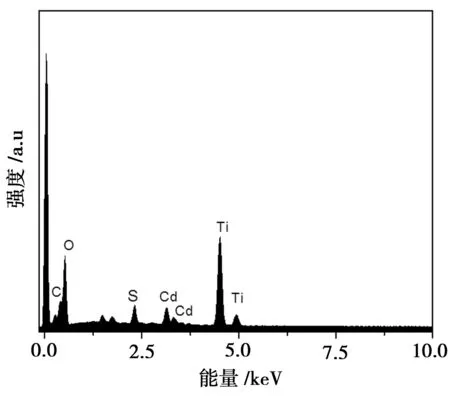
图3 TiO2/CdS的能谱图
3.3 TiO2及复合物的XRD分析
图4为TiO2与TiO2/CdS的XRD谱图。从图可以看出,在2θ = 25.2°,26.8°,36.3°,38.5°,42.1°,42.6°,48.5°,54.7°,63.2°,68.4°,75.3°处对应TiO2(101),(110),(004),(102),(103),(200),(211),(204),(220),(210)晶面。由此可知,该方法制备的TiO2存在金红石型和锐钛矿型两种晶型。在2θ =26.3°,44.8°,52.3°处是CdS的特征峰,分别对应(111),(220),(311)晶面。因此,该复合材料除了有纯TiO2的特征峰以外,还出现了CdS的特征峰,进一步证明CdS已沉积于TiO2表面上。
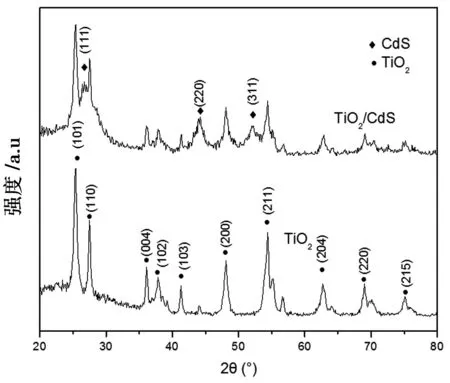
图4 TiO2与TiO2/CdS的XRD谱图
3.4 TiO2及复合物的紫外可见吸收光谱分析
图5为 TiO2及其复合物TiO2/CdS的紫外可见吸收光谱。从图可以看出经纯TiO2与CdS复合之后,复合材料TiO2/CdS由于带隙减小,吸收边界产生了一定程度的红移,扩展了在可见光区的吸收范围,进而提高了TiO2的光催化性能。
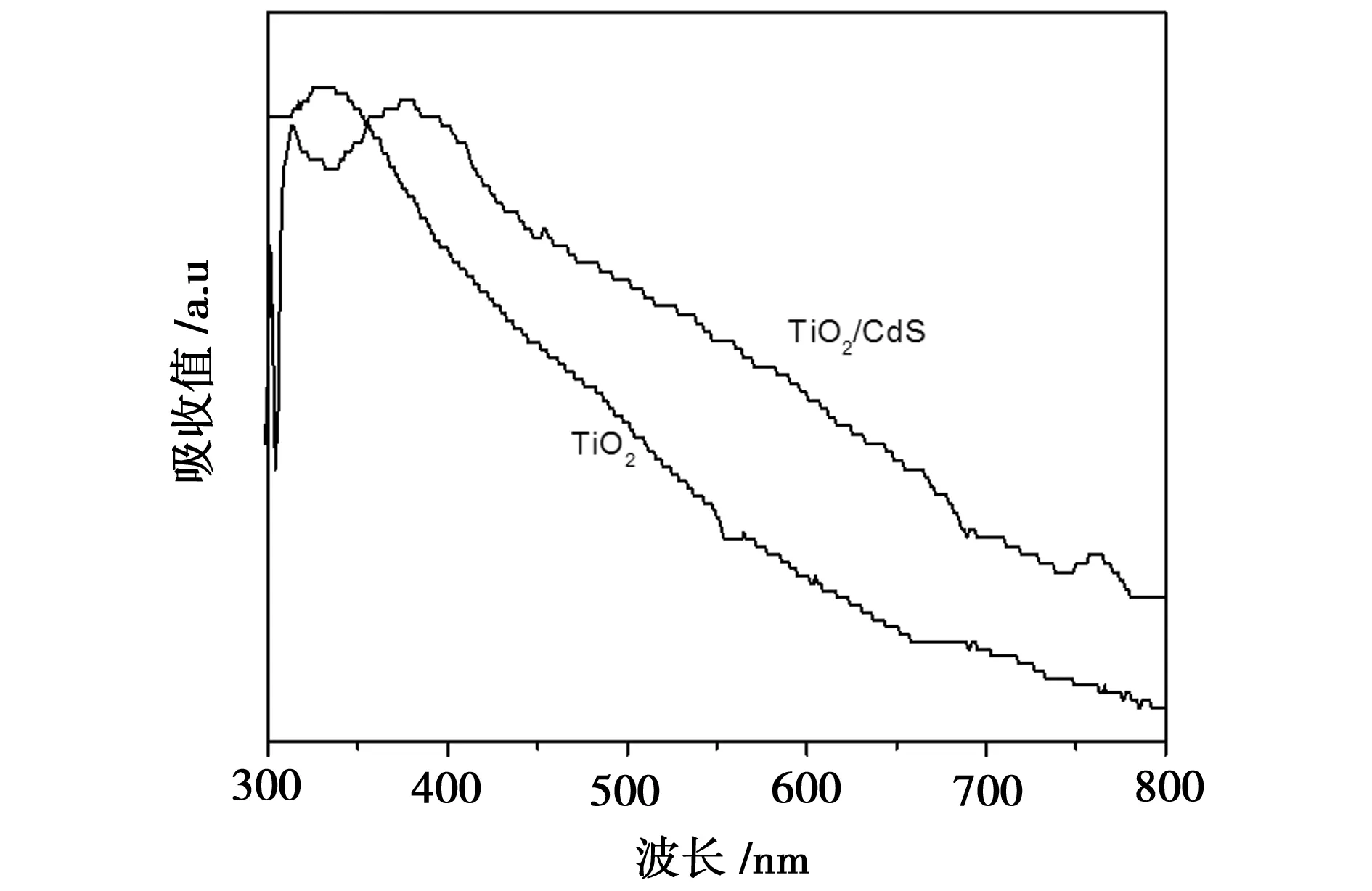
图5 TiO2及其复合物的紫外可见吸收光谱
3.5 TiO2及复合物的光催化性能分析
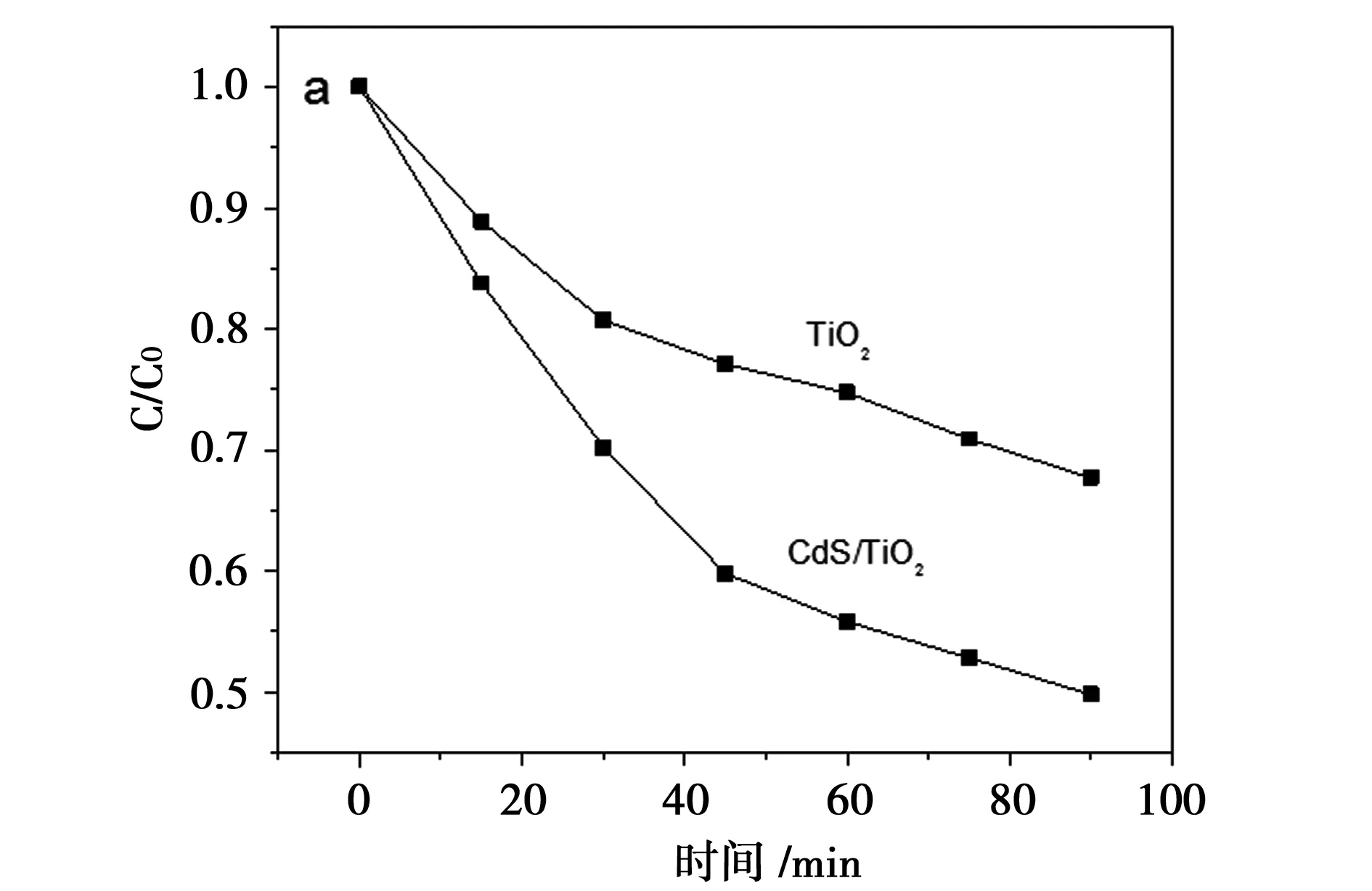
图6 TiO2及其复合物TiO2/CdS的光催化性能
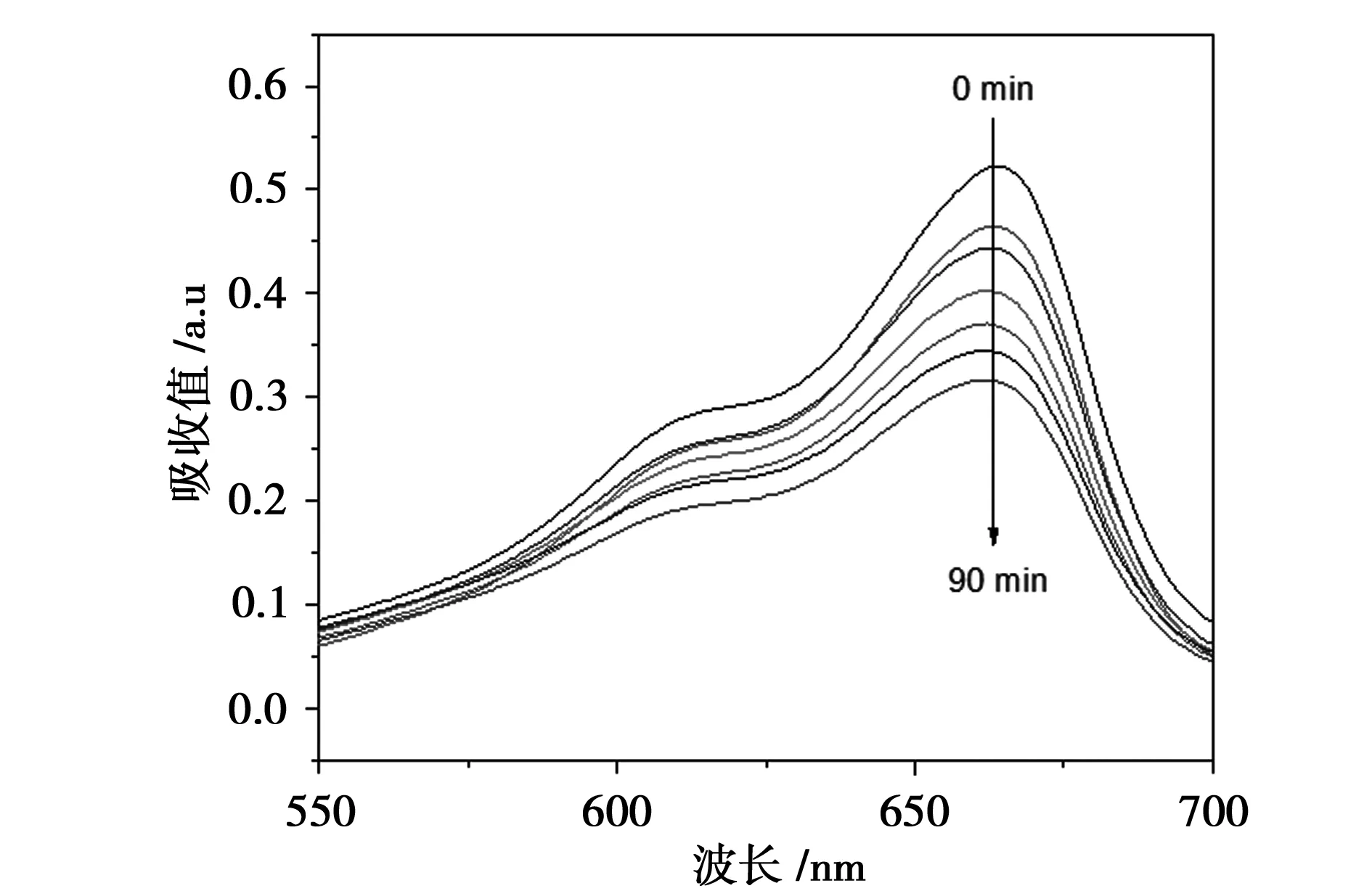
图7 TiO2/CdS催化下亚甲基蓝的紫外-可见吸收图谱
在可见光照射下,制备的TiO2及其复合物的光催化性能如图6所示。从图6可知,复合材料TiO2/CdS展现出了比TiO2更高的可见光催化性能。纯TiO2在90 min内降解MB的效率为29%。TiO2/CdS复合材料相比纯TiO2对MB的降解效果较好,降解率明显上升,90 min后降解率达到49%。这是因为通过复合,将吸收范围扩展到了可见光区。图7是在可见光照射下,TiO2/CdS作催化剂,亚甲基蓝的紫外-可见吸收图谱。从图中可以看出,随着时间的延长,亚甲基蓝的吸光度逐渐降低,且浓度逐渐减小。
图8为复合物的光催化机理图。由图可知,CdS和TiO2的导带宽度分别为-3.98 ev和-4.2 ev(相对于真空条件),当可见光照射时,光诱导电子从CdS的导带传递到TiO2的导带,光生电子在导带(CB)汇聚,空穴电子涌向价带(VB),从而有效提高了光生电子与空穴电子的分离,阻碍了电子传输过程中电荷复合,光催化效率由此提高。
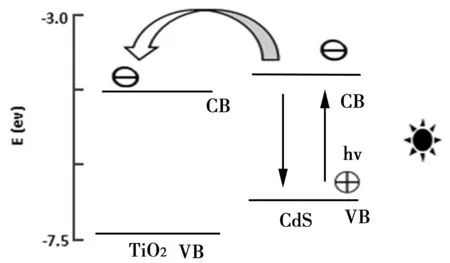
图8 TiO2和CdS的能级结构示意图
4 结束语
本文采用水热-沉积法制备的光催化复合材料TiO2/CdS,采用XRD、EDX、SEM、UV-vis等方法对其形貌和结构进行分析。在可见光下,光催化降解亚甲基蓝溶液,90 min后,TiO2降解率为29%,而TiO2/CdS的降解率为49%。结果表明,TiO2通过与CdS的复合,提高了光生电子和光生空穴的分离率,扩展了吸收光范围,进而提高了其光催化效率。
[1]Robinson B H.E-waste:an assessment of global production and environmental impacts[J].Science of the total environment,2009,408(2):183-191
[2]Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode [J] .Nature,1972,238(1):37-38
[3]孙晓君,才伟民.二氧化钛半导体光催化技术研究进展[J].哈尔滨工业大学学报,2001,33(4):534-540
[4]孙锦宜,林西平.环保催化材料与应用[M].北京:化学工业出版社,2012:25-30
[5]于向阳,梁文,程继.提高二氧化钛光催化性能的途径[J].硅酸盐通报,2000(1):53-57
[6]黄文娅,余颖.可见光化的半导体光催化剂[J].化学进展,2005,17(2):242-247
[7]尹浩.TiO2纳米结构的生长及其在能源环境方面的应用探索[D].上海:上海交通大学研究生院,2012:20-22
[8]吴树新.改性纳米TiO2光催化氧化还原性能的研究[D].天津:天津大学研究生院,2003:12-18
[9]夏金德.水热法制备二氧化钛纳米材料[J].安徽工业大学学报:自然科学版,2007,24(2):140-142
[10]程国峰,杨传峥,黄月鸿.纳米材料的X射线分析[M].北京:化学工业出版社,2010:112-115
[11]陈永,曹峰,马艳平.SiO2改性纳米TiO2及可见光催化性能研究[J].纳米科技,2008,3(2):40-43
[12]郭雪婷.钼掺杂TiO2纳米材料的制备及光催化性能的研究[D].吉林:吉林大学研究生院,2013:28-30
[13]丘永樑,陈洪龄,徐南平.水热法制备CdS/TiO2及其光活性[J].化工进展,2005,56(7):1338-1342
[14]谷留安.共轭分子/二氧化钛复合材料的制备及光催化性能研究[D].哈尔滨:哈尔滨工业大学研究生院,2013:12-15
[15]A Kumar,A K Jain.Photophysics and photochemistry of colloidal CdS-TiO2coupled semiconductors-photocatalytic oxidation of indole [J].Journal of Molecular Catalysis A:Chemical 2001,165(1-2):265-273
[16]李昱昊,毛立群,张顺利,等 .CdS/TiO2复合半导体的表面态及光催化性能[J].河南大学学报:自然科学版,2004,34(2):28-32
[17]H Tada,T Mitsui, T Kiyonaga,et al.All-solid-state Z-scheme in CdS-Au-TiO2three-component nanojunction system[J].Nature Materials,2006,5:782-786
(责任编辑:汪材印)
O614.41
A
1673-2006(2017)09-0107-04
10.3969/j.issn.1673-2006.2017.09.025
2017-06-18
宿州学院科研平台开放课题“静电纺纳米材料制备及其光催化性能研究”(2013YKF24);国家级大学生创新创业训练计划项目(201610379018)。
宁轲(1990-),安徽宿州人,助理实验师,研究方向:纳米材料,光催化。

