肺腺癌中PLK1的异常表达及其临床病理意义
徐艳, 沈小星, 刘标, 饶秋, 时姗姗, 王璇, 何燕, 黄培林
(1.东南大学医学院 病理与病理生理学系,江苏 南京 210009;2.解放军杭州疗养院 特勤疗养科,浙江 杭州 310007;3.南京总医院 病理科,江苏 南京 210002)
·论著·
肺腺癌中PLK1的异常表达及其临床病理意义
徐艳1,2, 沈小星2, 刘标3, 饶秋3, 时姗姗3, 王璇3, 何燕3, 黄培林1
(1.东南大学医学院 病理与病理生理学系,江苏 南京 210009;2.解放军杭州疗养院 特勤疗养科,浙江 杭州 310007;3.南京总医院 病理科,江苏 南京 210002)
目的探讨肺腺癌中PLK1的异常表达及临床病理意义。方法免疫组化SP法检测266例I- IV期肺腺癌中PLK1的表达并分析其与临床病理特征、预后、TTF1和p53表达及分子学表型的关系。结果PLK1过表达与吸烟(P<0.05)、转移/复发(P<0.01)及高临床分期(P<0.05)显著相关。常见于胶样腺癌(87.5%)、浸润性黏液腺癌(86.7%)和实体型腺癌(81.1%)(P<0.01)。在泌黏液型腺癌(73.1%)中发生率显著高于非泌黏液型腺癌(57.5%)(P<0.05)。PLK1过表达与KRAS突变、p53表达及三阴性肺腺癌显著相关(P<0.01),与TTF1表达、EGFR突变和EML4-ALK融合基因无显著相关性。肺腺癌中PLK1过表达与预后相关(P<0.01)且为独立预后因素(HR=2.235,P<0.01)。结论PLK1过表达在部分肺腺癌的发病和进展过程中发挥重要作用。
肺腺癌; PLK1; 表达; 临床病理特征;KRAS突变; 三阴性; 预后
近10余年来,随着小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)广泛应用于肺腺癌靶向治疗,部分肺腺癌患者的生存期显著提高。但仍有约10- 30%KRAS突变型肺腺癌及约30%尚未发现标志性驱动基因改变的肺腺癌患者尚不能受益于目前的TKIs靶向治疗,迫切需要寻找和鉴定新的驱动基因和治疗靶点。Polo样激酶1 (Polo- like kinase 1, PLK1) 在人类多种恶性肿瘤中过表达且是预后不良指标。可能是治疗肿瘤的理想分子靶点[1]。然而,两项基于PLK1小分子抑制剂BI2536单剂或联合培美曲塞治疗Ⅲ/Ⅳ期、或复发难治性或转移性非小细胞肺癌(non- small cell lung cancer, NSCLC)的Ⅰ、Ⅱ期临床试验结果却并不令人满意,某种程度上反映出NSCLC的高度异质性以及不同PLK1表达状态可能是影响PLK1小分子抑制剂临床疗效的重要因素[2- 3]。本研究以一组肺腺癌病例为研究对象,观察PLK1的表达状态,并结合临床病理参数、分子学表型及患者预后,探讨PLK1在肺腺癌中的异常表达及其临床病理意义。
1 材料与方法
1.1 标本来源
收集南京总医院病理科2005年02月至2013年09月手术切除的肺腺癌病例,复习病人的临床病理资料并进行随访,剔除临床病理资料不完整、术前经过放化疗病例,最终将266例肺腺癌作为本研究对象。
1.2 主要试剂
免疫组化染色试剂盒SuperPictureTM3rdGen IHC Detection Kit(87- 8793)购自美国Invitrogen公司,一抗为PLK1(EPR2650,Abcam公司,1∶100稀释)、p53(318- 6- 11,Dako公司,1∶200稀释)及TTF1(8G7G3/1,Dako公司,1∶50稀释)。QIAGEN石蜡样品DNA提取试剂盒(cat.no.56404)购自美国Qiagen公司。PCR引物由上海浦美生物工程技术公司提供。ALK商品化Vysis双色分离LSI探针购自美国Abbott Molecular公司。
1.3 病理学评估
所有病例均按2015年WHO肺肿瘤分类标准重新进行组织学分类[4],即按“5%递加”的方式记录每一种组织学成分,并取比率最高的成分作为该腺癌的组织学类型,如乳头型腺癌、腺泡型腺癌。临床分期按IASLC第7版肺癌TNM分期标准[5]。其他重点观察指标包括肿瘤内脉管浸润(intratumoral vascular invasion,IVI)和脏层胸膜浸润(visceral pleural invasion, VPI)等。
1.4 免疫组化标记及结果评定
蜡块4μm 厚切片,进行免疫组化SP法染色。PLK1表达定位于胞膜和/或胞质,TTF- 1及P53的表达定位于胞核。评分标准按阳性细胞所占比例分为0分(≤5%),1分(6- 25%),2分(26- 50%),3分(>50%),按细胞染色强度分为0分(不着色),1分(浅黄色),2分(棕黄色)和3分(棕褐色),两项相乘结果为- (0分)、+(1~3分)、++(4~6分)和+++(9分)。PLK1结果判断“- ”为阴性,“+”为低表达,“++”- “+++”为过表达。P53+定义为弥漫一致性中- 强表达,视为TP53基因错义突变,“- ”、部分表达或不均一性表达视为TP53同义突变或野生型。TTF1结果判断“- ”为阴性,“+”- “+++”为阳性。
1.5 直接基因测序检测EGFR和KRAS突变
蜡块4 μm厚切片5~10张,置入EP管充分消化,QIAGEN石蜡样品DNA提取试剂盒提取DNA,所有PCR反应体系总体积为25 μl,模板DNA200 ng,EGFR及KRAS的PCR反应程序均为:94 ℃预变性5 min;94 ℃变性30 sec,58 ℃退火30 sec,72 ℃延伸1 min,共35次循环,最后72 ℃延伸10 min。所有PCR扩增产物经琼脂糖凝胶电泳。紫外线下鉴定扩增片段,有清晰且特异的迁徙条带的PCR产物进一步用DNA测序仪3730进行DNA序列测定,测序结果经ABI公司软件分析。
1.6 荧光原位杂交(fluorescence in situ hybridization,FISH)检测EML4- ALK融合基因
切片准备和杂交按FISH试剂盒说明书进行,野生型ALK表现为红色和绿色信号形成融合(黄色)信号或距离非常靠近的红色和绿色信号。ALK发生重排则形成2种阳性杂交信号模式:一种为经典的红色和绿色信号分离模式,即一个正常的黄色融合信号和一对分离的红色和绿色信号,且红绿信号分离间距至少大于2个信号点直径;另一种是孤立的红色信号模式,即存在一个黄色信号和一个红色信号,而对应的绿色信号丢失。每张切片至少观察60个肿瘤细胞,当大于15%的肿瘤细胞出现阳性信号时判断为ALK易位。
1.7 随访
采用病历跟踪、门诊、电话随访及信件随访的方式;随访时间从手术日开始到死亡(或最近一次随访),总生存期(Overall survival,OS)定义为从手术至任何因素所致死亡或最近一次随访,患者在最近一次随访仍然存活被视为“截断(censored)”事件。随访截止日期为 2013年12月15日。
1.8 统计学处理
应用SPSS 17.0软件分析资料,计量资料均数比较采用方差分析,两组或多组率的比较采用R×C表χ2检验,格子数小于5的应用Fisher确切概率法。随访资料单因素分析采用Kaplan-Meier法,生存率的比较采用log-rank检验;采用Cox比例风险回归法进行多因素分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 临床病理资料
本组病例,男性94例(35.3%),女性172例(64.7%)。年龄22~79岁(平均57.8±2.14岁)。82例(30.8%)有吸烟史。左肺癌101例(38%),右肺癌165例(62%),肿瘤大小0.8~16.0 cm(平均3.5±1.93 cm),按2015年WHO肺腺癌分类标准:贴壁型34例(12.8%),乳头型57例(21.4%),腺泡型94例(35.3%),微乳头型13例(4.9%),实体型伴黏液产生型37例(13.9%),浸润性黏液腺癌15例(5.7%),胶样和肠型腺癌16例(6.0%);按危险度级别,低级别腺癌40例(15 %),中级别腺癌160例(60.2%),高级别腺癌66例(24.8%)。按肿瘤细胞是否产生显著的细胞内/外黏液分为泌黏液型腺癌78例(29.3%)和非黏液型腺癌188例(70.7%)。本组病例中,79例(29.7%)存在VPI,98例(36.8%)检出IVI,89例(33.5%)出现肺内复发、区域淋巴结和/或远位器官转移。按第7版TNM分期标准,Ⅰ期121例(45.5%),其中IA期78例,IB期43例,Ⅱ期87例(32.7%),Ⅲ期44例(16.5%),Ⅳ期14例(5.3%)。
2.2 PLK1在肺腺癌中的表达
62%(165)的肺腺癌组织PLK1呈过表达,而正常肺组织中PLK1不表达或呈微弱表达(图1),差异有统计学意义(P<0.01)。PLK1过表达在有吸烟史(P<0.05)、转移/复发(P<0.01)以及晚期(Ⅲ- Ⅳ期)(P<0.05)肺腺癌中发生率高。不同组织学类型肺腺癌中,PLK1过表达常见于肠型和胶样腺癌(87.5%)、浸润性黏液腺癌(86.7%)和实体型腺癌(81.1%),而在贴壁型腺癌(35.3%)、乳头型腺癌(43.9%)和微乳头型腺癌(38.5%)中较少见,差异有统计学意义(P<0.01)。PLK1过表达与性别、年龄、部位、肿块大小、危险度分级、肿瘤内脉管浸润和脏层胸膜浸润无显著相关性。73.1%的泌黏液型腺癌呈PLK1过表达,与非泌黏液型腺癌(57.5%)比较差异有统计学意义(P<0.05)(表1)。PLK1过表达与TTF1表达无相关性(P>0.05),与p53蛋白表达存在显著相关性(P<0.01)(表2)。
2.3 PLK1表达与肺腺癌分子学表型的相关性
本组病例,EGFR突变108例(40.6%),包括3例E18突变(G719X),47例E19缺失(46例E746- A750缺失,1例L747- P753缺失),52例E21突变(51例L858R,1例L861Q),4例E20突变(T790M),其余2例为E19和E21复合型突变。20例(7.5%)检测出KRAS突变,分别为18例12号密码子(13例GGT- GTT,5例GGT- CGT)和2例13号密码子(GGC- GAC)突变。14例(5.3%)检测出EML4-ALK融合基因。剩余124例(46.6%)为无EGFR突变、KRAS突变、EML4-ALK融合基因的三阴性肺腺癌。20例KRAS突变病例中18例呈PLK1过表达,两者存在显著相关性(P<0.01)。124例三阴性肺腺癌中,98例(79%)呈PLK1蛋白过表达,两者存在显著的相关性(P<0.01)。PLK1过表达与EGFR突变及EML4-ALK融合基因无显著相关性(表3)。
2.4 预后分析
本组病例245例(92.1%)获得随访结果,截止最近一次随访共153例(62.4%)死于肺腺癌,11例(4.5%)死于其他疾病或未明原因,81例(33.1%)存活。生存函数显示PLK1表达状况在手术早期(<20个月)对患者的生存影响不明显,但随后PLK1的表达状况对患者预后的影响逐渐显现,PLK1过表达者的OS显著低于PLK1不/低表达者(P<0.01)(图2)。
表1肺腺癌临床病理参数与PLK1表达的关系

参 数n(%)PLK1P-值性别 男94(35.3)52 女172(64.7)113>0.05年龄(X,岁) <57.8149(56.0)91 ≥57.8117(44.0)74>0.05吸烟史 无184(69.2)105 有82(30.8)60<0.05部位 右肺165(62.0)109 左肺101(38.0)56>0.05肿瘤大小(X,cm) <3.5174(65.4)103 ≥3.592(34.6)62>0.05组织学类型 贴壁型34(12.8)12 乳头型57(21.4)25 腺泡型94(35.3)65 微乳头型13(4.9)6 实体型伴黏液产生37(13.9)30 浸润性黏液腺癌15(5.7)13 胶样腺癌+肠型16(6.0)14<0.01危险度分级 低40(15)18 中160(60.2)103 高66(24.8)44>0.05脏层胸膜浸润(VPI) 否187(70.3)112 是79(29.7)53>0.05瘤内脉管浸润(IVI) 否168(63.2)107 是98(36.8)58>0.05转移/复发 否177(66.5)99 是89(33.5)66<0.01临床分期 Ⅰ-Ⅱ208(78.2)122 Ⅲ-Ⅳ58(21.8)43<0.05
表2肺腺癌中PLK1表达与TTF1和p53表达的相关关系

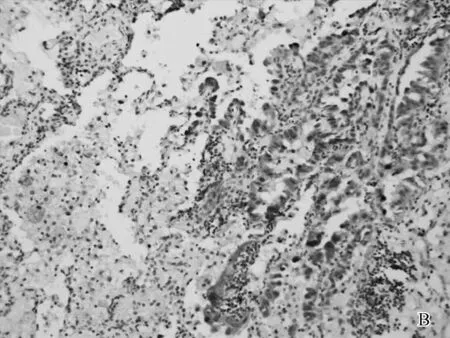
A.在肺腺癌组织中呈中度表达(右下),在正常肺组织中呈微弱表达(左上)(IHC,10×);B.在肺腺癌组织中呈中度表达(右下),在正常肺组织中不表达(左上)(IHC,20×)
图1PLK1在肺腺癌和正常肺组织中的表达
表3肺腺癌中PLK1表达与肺腺癌分子学表型的相关关系
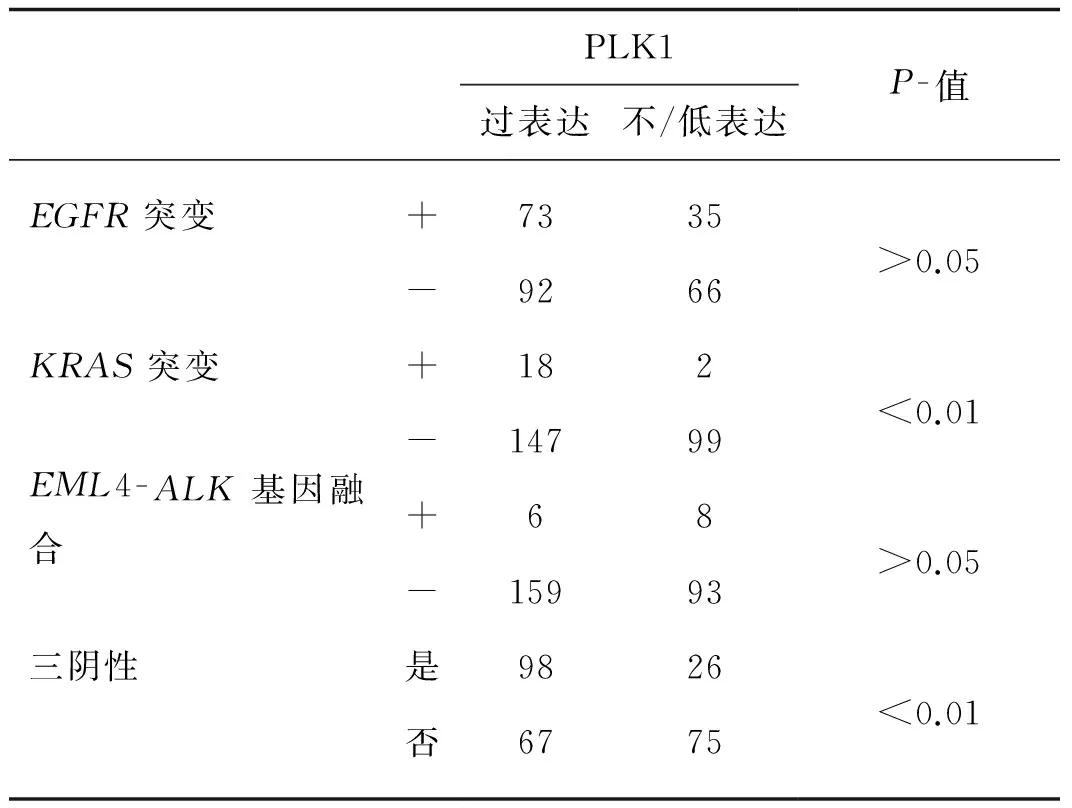
PLK1过表达不/低表达P-值EGFR突变+7335-9266>0.05KRAS突变+182-14799<0.01EML4-ALK基因融合+68-15993>0.05三阴性是9826否6775<0.01
三阴性肺腺癌中PLK1过表达者的OS也显著低于PLK1不/低表达者(P<0.05)(图3)。将PLK1过表达与其他临床病理参数进行多因素分析,结果显示PLK1过表达为肺腺癌的独立预后因素(HR=2.235,P<0.01),其他独立预后因素包括临床分期(HR=2.874,P<0.001)、复发转移(HR=1.932,P<0.01)和p53表达(HR=1.626,P<0.05)。
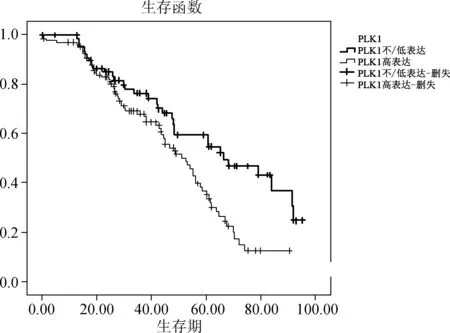
图2肺腺癌中不同PLK1表达水平患者的生存曲线比较
3 讨 论
PLK1是一个细胞有丝分裂相关基因,编码一种高度保守的丝氨酸/苏氨酸蛋白激酶,其氨基酸序列包括N末端的丝氨酸/苏氨酸激酶结构域和C末端的2个被称作polo盒的保守区域。PLK1是调控细胞周期和DNA损伤反应的关键激酶,多项研究显示PLK1在多种肿瘤包括NSCLC中过表达,且与多种肿瘤的组织学分级、临床分期及预后密切相关[1]。本研究也证实PLK1在肺腺癌中过表达,而在正常成熟组织中罕见表达。PLK1独特的蛋白结构序列可以作为药物设计的理想靶点,使得其成为肿瘤治疗领域的研究热点。
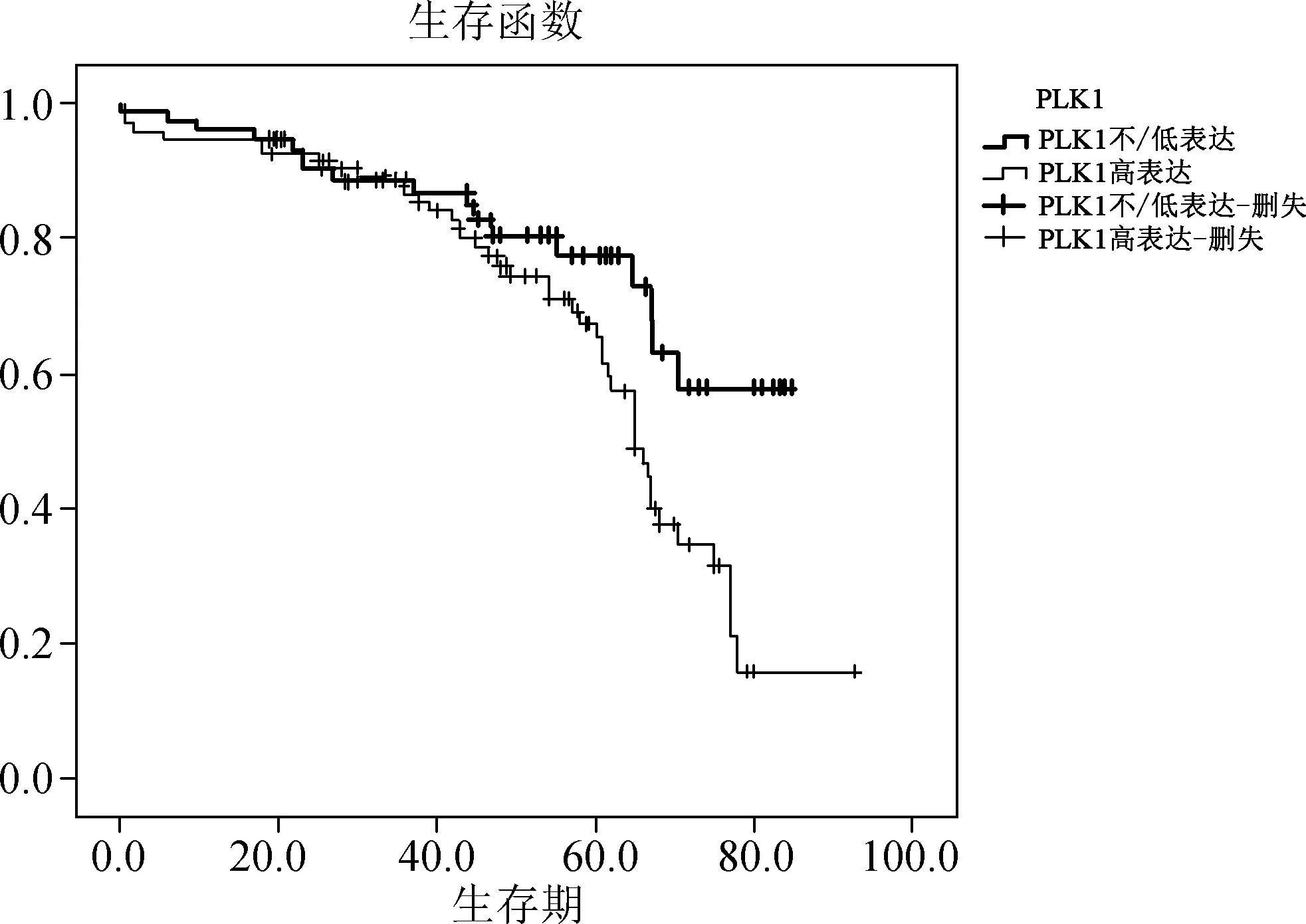
图3三阴性肺腺癌中不同PLK1表达水平患者的生存曲线比较
本研究发现PLK过表达并与吸烟显著相关。吸烟相关肺腺癌多为老年男性,常有烟草刺激诱导的相关基因异常表达,如KRAS、TP53基因突变,以及NEK2、TTK和PRC1等基因过表达,这些基因的一个共同作用是调控细胞周期中纺锤体形成和染色体分离等过程。PLK1作为细胞周期调控的关键基因提示肺腺癌中烟草刺激可能是导致PLK1过表达的诱导因素之一。
本组资料中,PLK1过表达在不同组织学类型的肺腺癌之间存在显著性差异,PLK1过表达常见与胶样和肠型腺癌、实体型腺癌及浸润性黏液腺癌,胶样和肠型腺癌是PLK1过表达率最高的组织学类型,其通常由杯状细胞样的柱状上皮或印戒样细胞组成,富于细胞内/外黏液。实体型腺癌组织学表现为癌细胞呈实性片状排列,缺乏腺癌组织学结构,细胞内可见黏液产生。浸润性黏液腺癌即过去所谓的黏液性细支气管肺泡癌,癌细胞具有显著的杯状细胞特征,同样富于细胞内/外黏液[4]。由此可见,尽管PLK1过表达的肺腺癌表现为多种组织学类型,但它们具有一个共同的组织学特征即富于细胞内/外黏液,为了进一步验证PLK1过表达与肺腺癌黏液产生的关系,本研究参考Kadota等[6]提出的黏液型和非黏液型腺癌的分类标准,结果显示73.1%的黏液型腺癌呈PLK1过表达,与非黏液型腺癌比较差异有统计学意义,提示PLK1过表达与肺腺癌产生黏液具有显著相关性,可能在这类肺腺癌的发病和进展中扮演着重要角色。
除了WHO组织学分类,还有学者根据细胞起源、分子学改变等提出不同的肺腺癌分类方案。Yatabe等[7]根据细胞起源将肺腺癌分为TRU型和non- TRU型腺癌,TRU型腺癌具有II型肺泡细胞和 Clara细胞特征,通常为周围型肺癌,病理演进模式为非典型腺瘤样增生- 原位腺癌- 微浸润性腺癌- 浸润性腺癌,浸润性癌常为贴壁型、乳头型、腺泡型和微乳头型。TRU型腺癌多见于东亚裔不吸烟的年轻女性,肿瘤分化程度高,临床分期低,其经典的特征是表达TTF1和EGFR突变,可接受EGFR- TKIs靶向治疗,预后较好;而non- TRU型腺癌通常是中央型腺癌,病理演进模式为支气管上皮细胞的柱状上皮变- 柱状上皮异性增生- 原位癌- 浸润性癌,浸润性癌多表现为复杂性腺样结构、实体型和富于细胞内/外黏液的腺癌[8]。non- TRU型腺癌与吸烟有关,常不表达TTF1而表达黏蛋白MUC5A和MUC5B,常有KRAS、TP53基因突变,肿瘤分化程度差,临床分期高,常无机会接受EGFR- TKIs靶向治疗且对常规化疗耐受,预后较差。结合组织学类型分析,本研究认为PLK1过表达主要见于non- TRU型腺癌,可能在这类肺腺癌的发病和进展中发挥重要作用。
根据常见的驱动基因改变,肺腺癌可以分为EGFR突变型、KRAS突变型、EML4-ALK融合基因型以及三阴性肺腺癌。本组资料中,PLK1过表达与EGFR突变和EML4-ALK融合基因均无相关性,而与KRAS突变存在显著的相关性。Posch 等[9]研究发现在NRAS突变的肺癌和恶性黑色素瘤中存在PLK1的过表达。结合本研究结果提示PLK1过表达与RAS家族基因突变显著相关。另外,本研究提示PLK1过表达与p53表达显著相关,因p53蛋白弥漫一致性强表达通常是TP53基因错义突变所致,因此可认为PLK1过表达与TP53基因错义突变显著相关。这一结果也在既往研究中被发现,Watanabe等[10]研究发现乳腺癌中PLK1mRNA过表达与TP53基因突变密切相关。综上所述同时存在PLK1过表达和TP53、RAS家族基因突变是许多肿瘤的一种常见特征,并可能在这类肿瘤的发病及进展中起协同作用,是肿瘤进展快、疗效差和预后不良的重要机制之一。本研究也证实PLK1过表达的肺腺癌多处于高临床分期, 5年OS低,表明PLK1过表达可能在肺腺癌的侵袭、复发和转移中发挥关键作用。此外,本研究结果还显示三阴性肺腺癌中PLK1呈显著过表达,尽管三阴性肺腺癌在基因组表达谱和组织学类型方面都表现为异质性群体,但生存分析显示三阴性肺腺癌中PLK1过表达者的预后较差,提示PLK1过表达可以作为三阴性肺腺癌预后不良的一个判断指标,在部分三阴性肺腺癌的发病和进展中可能发挥重要作用。
总之,本研究发现PLK1过表达的肺腺癌具有以下显著的临床病理特征:常见于吸烟患者;多为富于细胞内/外黏液的肺腺癌;不表达TTF1,常属于non- TRU型腺癌;与KRAS和TP53突变显著相关;多为高临床分期,预后较差。具有上述临床病理表现的肺腺癌患者应常规检测PLK1基因或蛋白的表达,对于PLK1过表达的患者临床应采取更积极的治疗措施并密切随访。
[1] GUTTERIDGE R E,NDIAYE M A,LIU X,et al.PLK1 inhibitors in cancer therapy:from laboratory to clinics.Mol Cancer Ther.2016,15(7):1427- 1435.
[2] ELLIS P M,CHU Q S,LEIGHL N,et al.A phase I open- label dose- escalation study of intravenous BI 2536 together with pemetrexed in previously treated patients with non- small- cell lung cancer.Clin Lung Cancer.2013,14(1):19- 27.
[3] SEBASTIAN M,RECK M,WALLER C F,et al.The efficacy and safety of BI 2536,a novel Plk- 1 inhibitor,in patients with stage IIIB/IV non- small cell lung cancer who had relapsed after,or failed,chemotherapy:results from an open- label,randomized phase II clinical trial[J].J Thorac Oncol,2010,5(7):1060- 1067.
[4] TRAVIS W D,BRAMBILLA E,BRUKE A P,et al.WHO classification of tumours of the lung, pleura, thymus and heart[M].Lyon:IARC Press,4th Edition,2015:1- 104.
[5] RUSCH V W,APPLEMAN H D,BLACKSTONE E,et al.Lung.In:Edge S B,Byrd D R,Compton C C,et al,eds.AJCC Cancer staging manual 7th edn.American Joint Commision on Cancer[M].Chicago:Springer; 2009:253- 270.
[6] KADOTA K,YRH Y C,D’ANGELO S P,et al.Associations between mutations and histologic patterns of mucin in lung adenocarcinoma:invasive mucinous pattern and extracellular mucin are associated with KRAS mutation[J].Am J Surg Pathol,2014,38(8):1118- 1127.
[7] YATABE Y.EGFR mutations and the terminal respiratory unit[J].Cancer Metastasis Rev,2010,29(1):23- 36.
[8] SUMIYOSHI S,YOSHIZAWA A,SONOBE M,et al.Non- terminal respiratory unit type lung ADC has three distinct subtypes and is associated with poor prognosis[J].Lung Cancer,2014,84(3):281- 288.
[9] POSCH C,CHOLEWA B D,VUJIC I,et al.Combined inhibition of MEK and Plk1 has synergistic antitumor activity inNRAS mutant melanoma[J].J Invest Dermatol,2015,135(10):2475- 2483.
[10] WATANABE G,ISHIDA T,FURUTA A,et al.Combined immunohistochemistry of PLK1,p21,and p53 for predicting TP53 status:An independent prognostic factor of breast cancer[J].Am J Surg Pathol,2015,39(8):1026- 1034.
TheabnormalexpressionandtheclinicopathologicsignificanceofPolo-likekinase1(PLK1)inadenocarcinomaofthelung
XUYan1,2,SHENXiao-xing2,LIUBiao3,RAOQiu3,SHIShan-shan3,WANGXuan3,HEYan3,HuangPei-lin1
(1.DepartmentofPathologyandPathophysiology,SoutheastUniversitySchoolofMedicine,Nanjing,210009,China;3.Departmentofspecialservicerecuperate,HangzhouSanatoriumofPeople’sLiberationArmy,Hangzhou,310007,China;3.DepartmentofPathology,NanjingGeneralHospital,Nanjing,210002,China)
Objective: To explore the abnormal expression and the clinicopathologic significance of Polo- like kinase 1 (PLK1) in adenocarcinoma (ADC) of the lung.MethodsThe expressions of PLK1 in 266 patients with stage I- IV lung ADC were detected by immunohistochemistry (IHC) (SP method). The correlations with PLK1 expression and the clinicopathological characteristics, the expression of TTF1 and p53 and the molecular phenotype were further analyzed.ResultsThere was a positive correlation with PLK1 overexprssion and smoking history (P<0.05), metastesis/recurrence (P<0.01), and higher stage (P<0.05). PLK1 overexpression was more frequently found in colloid ADCs (87.5%), invasive mucinous ADCs (86.7%) and solid ADCs (81.1%) (P<0.01). PLK1 overexprssion was more common in mucin- product ADCs than in non mucin- product ADCs (P<0.05). PLK1 overexpression was significiantly correlated with KRAS mutation (P<0.01), p53 protein expression (P<0.01) and triple negative ADCs (P<0.01), other than TTF1 expression, EGFR mutation or EML4- ALK fusion. In lung ADCs, PLK1 overexpression was strongly associated with prognosis (P<0.01), and played as an independent prognostic role (HR=2.235,P<0.01).ConclusionPLK1 overexpression possibly plays an important role in pathogenesis and evolution of a subset of lung ADCs.
lung adecnocarcinoma; PLK1; clinicopathological characteristics; KRAS mutation; triple negative; prognosis
2017- 04- 20
2017- 09- 10
江苏省普通高校研究生科研创新计划(CXZZ12_0120)
徐艳(1977-), 女,浙江淳安人,主治医师,博士生,主要从事肺癌发病机制及靶向治疗方面的研究。E- mail: yanxu_1977@126.com
黄培林 E- mail: hpl@seu.edu.cn
徐艳,沈小星,刘标,等.肺腺癌中PLK1的异常表达及其临床病理意义[J].东南大学学报:医学版,2017,36(5):804- 810.
R741. 02
A
1671- 6264(2017)05- 0804- 07
10.3969/j.issn.1671- 6264.2017.05.025
(本文编辑:孙茂民)

