CNPs对肾结石大鼠尿液NGAL、MCP- 1水平和肾功能的影响
张林超,孙继建,潘世杰,高世玉
(河南省中医院/河南中医药大学第二附属医院 泌尿外科, 河南 郑州 450002)
·论著·
CNPs对肾结石大鼠尿液NGAL、MCP-1水平和肾功能的影响
张林超,孙继建,潘世杰,高世玉
(河南省中医院/河南中医药大学第二附属医院 泌尿外科, 河南 郑州 450002)
目的探讨钙化性纳米微粒(CNPs)建立大鼠肾结石模型对其尿液中中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、单核细胞趋化蛋白- 1(MCP- 1)水平和肾功能的影响。方法选取SPF级雄性SD大鼠24只,采用随机数字表法分为实验组、空白组各12只,实验组采取静脉注射CNPs建造大鼠肾结石模型,空白组注射等量生理盐水,检测实验后不同时间点两组大鼠尿液中NGAL、MCP- 1的水平,结石形成情况,大鼠肾脏病理变化及肾功能变化。结果实验组大鼠在鼠造模后4h、12h、24h、1周、2周、8周尿液中NGAL、MCP- 1水平呈现逐渐升高的趋势,并且每一个时间点对应的尿液NGAL水平均高于空白组(P<0.05),造模后第1周、2周、8周时对应的尿液MCP- 1水平均高于空白组(P<0.05);实验组大鼠尿素氮、血肌酐水平在造模后第8周均高于空白组(P<0.05);实验组大鼠肾脏病理检查均发现结石结晶形成,空白组未发现结石结晶形成。结论CNPs建立大鼠肾结石模型的作用机制可能与升高NGAL、MCP- 1水平有关,CNPs可造成肾脏功能的损伤。
钙化性纳米微粒; 肾结石; 中性粒细胞明胶酶相关脂质运载蛋白; 单核细胞趋化蛋白- 1; 大鼠
肾结石是一种常见的泌尿科疾病,其发病率较高,且近些年我国的患病人数持续增多,给家庭和社会带来了沉重的负担[1- 2]。自然环境、社会环境的影响以及个体的遗传因素、饮食、生活习惯等都与肾结石的发生有一定关系,但对于结石产生的机制目前尚不完全清楚[3]。有研究[4]表明,肾小管细胞的损伤会促进草酸钙晶体的成核和聚集,而结石的内部结构成分主要由草酸钙构成。钙化性纳米微粒(calcifying nanoparticles,CNPs)是一种矿化蛋白复合体,其在生理性钙磷浓度下能产生磷酸钙盐结晶,而进入体内后可在肾脏聚集,这可能与结石的形成过程有关[5]。为了进一步探讨CNPs与肾结石形成的关系,本研究利用CNPs建立了大鼠肾结石模型,并对其尿液中中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、单核细胞趋化蛋白- 1(MCP- 1)水平进行了检测分析,为临床提供了理论依据。
1 材料与方法
1.1 实验动物
选取SPF级雄性SD大鼠24只,3月龄,体重150~200g,平均(172.9±12.8)g,购买自西南医科大学动物研究中心,喂养于22~25℃、相对湿度40%~60%、光照交替12h的环境中。
1.2 实验仪器、药品
γ射线灭活的胎牛血清购自美国Sigma公司,二甲苯、酒精、苏木精、伊红等均购自天津大茂试剂公司,NGAL、MCP- 1检测试剂盒购自北京中杉金桥生物有限公司。酶标仪为德国拜发仪器公司生产,显微镜购自日本奥林巴斯公司。
1.3 实验动物分组及造模
将24只大鼠采用随机数字表法分为实验组、空白组各12只,实验组采取静脉注射CNPs混悬液(2ml·只-1)的方式建造大鼠肾结石模型,空白组注射等量生理盐水。CNPs混悬液的制备方法如下:选取术中无菌收集“经皮肾镜取石术”患者的结石标本,依次进行去矿物质、中和、洗涤、研磨处理后经滤器过滤,以2 000 r·min-1离心10 min后取管底液。取少量管底液接种于含 10%(体积分数)热灭活胎牛血清(γ- FBS)的 1640 培养基中,于 37℃、5%CO2条件下培养 6~8 周,每30d换液1次。经形态学鉴定和染色鉴定后筛选出无污染的标本并制成CNPs 混悬液。
1.4 观察指标及检测方法
分别检测两组大鼠造模后4 h、12 h、24 h、1周、2周、8周尿液中NGAL、MCP- 1的水平;分别于建模后第8周检测两组大鼠的尿素氮、血肌酐水平;于第8周处死两组大鼠,采用HE染色后进行显微镜观察,观察肾脏内结晶情况:无结晶(-)、肾髓质内结晶(+)、肾皮质内结晶(++)、肾乳头内结晶(+++)、肾盂内结晶(++++)。
将收集尿液以3 000 r·min-1离心10min后取上清液,利用酶标仪采用酶联免疫吸附法测定上清液中NGAL、MCP- 1水平,具体检测步骤严格按照试剂盒说明书进行。
造模第8周时处死大鼠并摘下肾脏,沿纵轴剖开后利用 10%中性甲醛溶液固定,石蜡包埋后作连续切片,脱蜡后进行HE染色,光镜下观察肾脏组织内的结晶形成情况以及有无病理改变。
1.5 统计学处理
采用SAS10.0统计软件进行数据统计分析,尿液中NGAL、MCP- 1、尿素氮、血肌酐水平采用均数±标准差进行统计描述,比较采用t检验,结石形成率比较采用两独立样本的χ2检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 两组实验动物尿液中NGAL水平的变化
实验组大鼠在鼠造模后4 h、12 h、24 h、1周、2周、8周尿液中NGAL水平呈现出逐渐升高的趋势,并且每一个时间点对应的尿液NGAL水平均高于空白组(P<0.05),见表1。
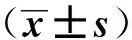
表1 两组实验动物尿液中NGAL水平的变化 ng·L-1
2.2 两组实验动物尿液中MCP- 1水平的变化
实验组大鼠在鼠造模后4 h、12 h、24 h、1周、2周、8周尿液中MCP- 1水平呈现出逐渐升高的趋势,并且造模后第1周、2周、8周时对应的尿液MCP- 1水平均高于空白组(P<0.05),见表2。
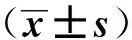
表2 两组实验动物尿液中MCP- 1水平的变化 μg·L-1
2.3 两组实验动物肾功能指标的比较
实验组大鼠尿素氮、血肌酐水平在造模后第8周均高于空白组(P<0.05),见表3。
2.4 两组实验动物的肾脏病理观察
实验组12只大鼠肾脏病理检查均发现结石结晶形成,空白组均未发现结石结晶形成,实验组的结石结晶形成率显著的高于空白组(χ2=24.000,P=0.000),见图1。
3 讨 论
肾结石是一种较为常见的结石类型,属于上尿路结石,主要是指肾、肾盂结石并能引起疼痛和血尿等症状,严重影响患者的生活质量[6- 7]。结石形成的原因有很多,多数认为与尿中形成结石晶体的盐类呈饱和状态有关,而年龄、性别、职业、社会经济地位、饮食成份和结构、水分摄入量、气候、代谢和遗传等因素都会影响结石的发生和发展,但对于结石形成的具体机制目前尚不完全清楚[8- 9]。有研究[10]认为,绝大多数结石的形成过程都可能与间质内的磷酸钙沉积有关,其形成机制可能跟一些感染性或者其他可传播的物质如CNPs有关。CNPs具有独特的生化矿化活性,可加速草酸钙晶体的生长,进而可能参与了结石的形成过程[11]。Garcia等[12]将培养出的CNPs直接经皮向肾内注射,成功建立了CNPs致肾结石大鼠的动物模型。因此,本研究也参照Garcia的方法,将由肾结石患者术后所得的结石标本分离培养出CNPs并制成CNPs混悬液,经静脉注射后建立肾结石模型,并进一步探讨了CNPs对大鼠肾功能指标的影响。
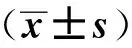
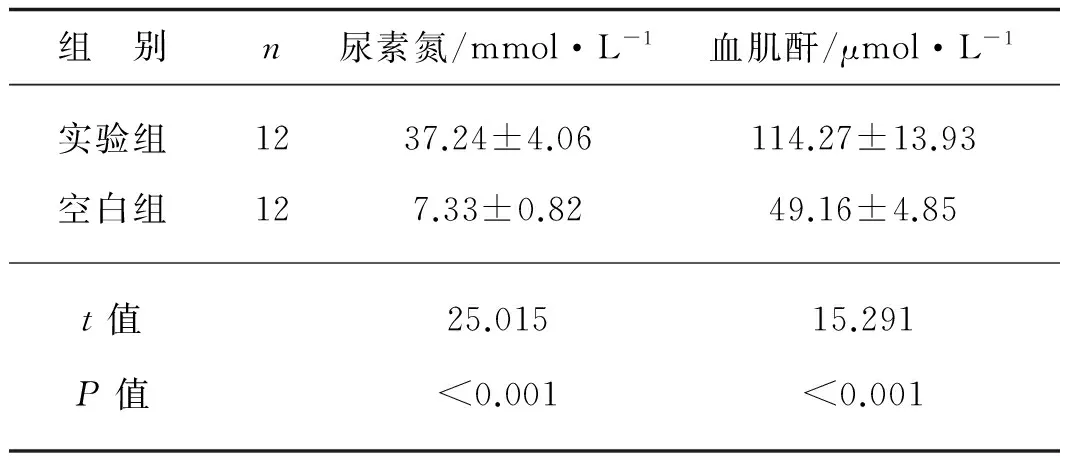
组 别n尿素氮/mmol·L-1血肌酐/μmol·L-1实验组1237.24±4.06114.27±13.93空白组127.33±0.8249.16±4.85t值25.01515.291P值 <0.001<0.001
A.实验组大鼠HE染色结果,可见黄色结晶物质形成;B.验组大鼠HE染色结果,可见图中央肾小管处结石结晶,上方可见间质纤维增生;C.空白组大鼠HE染色结果,可见肾小管、肾小球形态正常
图1第8周肾脏组织HE染色结果×200
3.1 CNPs对大鼠尿液中NGAL水平的影响分析
NGAL是一种相对分子量为25kDa的lipocalin家族蛋白,主要由受损的肾小管上皮细胞分泌和产生,是肾损伤的早期敏感标志物之一[13]。本研究通过对实验组大鼠和空白组大鼠尿液中NGAL进行检测比较发现,实验组大鼠在鼠造模后4h、12h、24h、1周、2周、8周时尿液中NGAL水平呈现出逐渐升高的趋势,并且每一个时间点对应的尿液NGAL水平均高于空白组,提示CNPs对肾小管上皮细胞具有一定的损伤作用,同时也表明CNPs导致结石形成的机制可能与上调NGAL表达水平有关。
3.2 CNPs对大鼠尿液中MCP- 1水平的影响分析
MCP- 1又称单核细胞趋化和激活因子,属于 CC亚族成员,其对单核细胞具有趋化活性,可激活单核细胞和巨噬细胞,并能趋化单核细胞和氧自由基进入炎症组织,进而参与肾损伤的过程[14]。Habibzadegah- Tari等[15]的研究也证实,草酸钙晶体可以促进肾小管上皮细胞合成和分泌 MCP- 1,而使用抗氧化剂可以抑制钙盐沉积,进而抑制肾结石的形成。本研究发现,实验组大鼠在鼠造模后4 h、12 h、24 h、1周、2周、8周时尿液中MCP- 1水平呈现出逐渐升高的趋势,并且造模后第1周、2周、8周时对应的尿液MCP- 1水平均高于空白组,提示CNPs能够刺激和促进大鼠肾脏表达产生 MCP- 1,这可能也是CNPs促进结石形成的机制之一。本研究同时显示,实验组大鼠的尿素氮、血肌酐水平在造模后第8周均高于空白组,提示CNPs会对大鼠肾功能造成一定的损害,其原因可能与CNPs对大鼠肾小管上皮细胞的损伤有关。
本研究通过对大鼠静脉注射CNPs后制作肾结石模型,实验组大鼠肾脏病理检查均显示结石结晶形成,而空白组未发现结石结晶形成,实验组大鼠的NGAL和MCP- 1表达水平均明显升高,提示 CNPs建立大鼠肾结石模型的作用机制可能与升高NGAL、MCP- 1水平有关,但具体机制仍需做进一步的深入研究。
综上所述,CNPs建立大鼠肾结石模型的作用机制可能与NGAL、MCP- 1水平有关,CNPs可造成肾脏功能的损伤。
[1] LIU Y,LI S,ZENG Z,et al.Kidney stones and cardiovascular risk:a meta- analysis of cohort studies.[J].Am J Kidney Dis,2014,64(3):402- 410.
[2] PEARLE M S,GOLDFARB D S,ASSIMOS D G,et al.Medical management of kidney stones:AUA guideline[J].J Urology,2014,192(2):316- 324.
[3] 徐林锋,兰厚金,朱伟东.微创经皮肾镜钬激光碎石术治疗重复肾肾结石11例[J].现代医学,2012,40(2):229- 230.
[4] 汤宗源,江顺建,李江,等.广西壮族自治区恭城县瑶族人群肾结石与膳食因素的相关性分析[J].临床泌尿外科杂志,2014,29(11):1018- 1021.
[5] 王杰,粟宏伟,刘鑫,等.钙化性纳米微粒致肾结石大鼠尿液中性粒细胞明胶酶相关脂质运载蛋白、骨桥蛋白及单核细胞趋化蛋白- 1的变化及其意义[J].中国现代医学杂志,2015,25(23):1- 6.
[6] ASSIMOS D G.Re:soda and other beverages and the risk of kidney stones[J].J Urology,2014,191(2):381- 382.
[7] CIPRIANI C,BIAMONTE F,COSTA A G,et al.Prevalence of kidney stones and vertebral fractures in primary hyperparathyroidism using imaging technology[J].J Clin Endocrinol Metab,2015,100(4):1309- 1315.
[8] 朱敏,周志芳,周家杰,等.肾结石合并肾功能不全患者经皮肾镜取石手术前后尿微量蛋白/尿肌酐值的变化及其意义[J].现代医学,2016,44(12):1694- 1697.
[9] 刘应清,陶凌松,罗莉莉,等.无管化微创经皮肾镜治疗上尿路结石[J].中华腔镜泌尿外科杂志:电子版,2014,8(4):24- 27.
[10] HUNTER L W,CHARLESWORTH J E,YU S,et al.Calcifying nanoparticles promote mineralization in vascular smooth muscle cells:implications for atherosclerosis[J].Int J Nanomedicine,2014,9:2689- 2698.
[11] IZADI A,MOSLEMI E.A survey on the presence of calcifying nanoparticles in renal stones,gallbladder stones and atherosclerosis plaque[J].JKMU,2014,21(4):302- 312.
[12] GARCIA C E,OLAVI K E,CIFTCIOGLU N,et al.Nanobacteria.An experimental neo- lithogenesis model[J].Arch Esp Urol,2000,53(4):291- 303.
[13] 王苗苗,李春盛.中性粒细胞明胶酶相关脂质运载蛋白的特性及临床应用的研究进展[J].中华危重病急救医学,2015,27(9):777- 780.
[14] 史兆坤,丁鹏,孙杰,等.单核细胞趋化蛋白- 1趋化巨噬细胞迁移与侵袭的体外实验研究[J].昆明医科大学学报,2014,35(4):41- 45.
[15] HABIBZADEGAH- TARI P,BYER K G,KHAN S R.Reactive oxygen species mediated calcium oxalate crystal- induced expression of MCP- 1 in HK- 2 cells[J].Urol Res,2006,34(1):26- 36.
AnalysisofNGALandMCP-1levelsinratswithkidneystonesafterCNPsmodeling
ZHANGLin-chao,SUNJi-jian,PANShi-jie,GAOShi-yu
(DepartmentofUrology,theSecondAffiliatedHospitalofUniversityofTraditionalChineseMedicine,Zhengzhou450002,China)
Objective: To investigate the effects of the calcifying nanoparticles (CNPs) to establish a rat model of kidney stones on the levels of urine neutrophil gelatinase associated lipid carrier pale(NGAL), white light monocyte chemoattractant protein - 1 (MCP- 1) and kidney function.Methods24 male SD SPF rats were randomly divided into experimental group and control group with 12 rats in each group, the experimental group adopted intravenous injection of CNPs to build rat renal calculus model, the control group was injected with saline. The level of MCP- 1 and NGAL in rat urine, stone formation in rat kidney, pathological changes and the changes of renal function were measured at different time points.ResultsThe urine NGAL and MCP- 1 levels in the experimental group after modeling 4h, 12h, 24h, 1 week, 2 weeks and 8 weeks showed increasing tendency, and the urine NGAL levels at each time point were higher than that in control group (P<0.05), after modeling 1 week, 2 weeks and 8 weeks the urine MCP- 1 levels were higher than those of control group (P<0.05). The level of serum creatinine, urea nitrogen in rats of the experimental group in 8 weeks after surgery were higher than that in control group (P<0.05). Renal biopsy were found in the formation of stone crystals in the experimental group, the control group did not find the crystal stones form.ConclusionThe mechanism of CNPs to establish rat kidney stones model may be related to the increase of NGAL and MCP- 1 levels, and CNPs can cause kidney functional damage.
calcifying nanoparticles; renal calculi; neutrophil gelatinase associated lipid carrier pale; monocyte chemoattractant protein - 1; rats
2017- 02- 28
2017- 06- 12
张林超(1972-),男,河南新密人,副主任医师, 医学硕士。E- mail: liushan12345624437@126.com
张林超,孙继建,潘世杰,等. CNPs对肾结石大鼠尿液NGAL、MCP- 1水平和肾功能的影响[J].东南大学学报:医学版,2017,36(5):768- 772.
R692.4; R33- 33
A
1671- 6264(2017)05- 0768- 05
10.3969/j.issn.1671- 6264. 2017. 05.017
(本文编辑:何彦梅)

