SOX方案和GP方案对晚期三阴乳腺癌患者临床疗效及CA153、CEA水平的影响
周丽华,杨威
(1.盐城卫生职业技术学院, 江苏 盐城 224005;2.盐城市第一人民医院,江苏 盐城 224000)
·论著·
SOX方案和GP方案对晚期三阴乳腺癌患者临床疗效及CA153、CEA水平的影响
周丽华1,杨威2
(1.盐城卫生职业技术学院, 江苏 盐城 224005;2.盐城市第一人民医院,江苏 盐城 224000)
目的探讨奥沙利铂联合替吉奥(SOX方案)和吉西他滨联合顺铂(GP方案)对晚期三阴乳腺癌患者临床疗效及糖类抗原153(CA153)、癌胚抗原(CEA)水平的影响。方法选取2012年8月至2015年8月盐城市第一人民医院的134例晚期三阴乳腺癌患者作为研究对象,根据随机数字表法分为A组和B组,每组各67例,A组患者给予SOX方案治疗,B组患者给予GP方案治疗,对比分析两组患者近期疗效、远期疗效、不良反应以及血清CA153和CEA水平。结果A组患者总有效率(RR)和疾病控制率(DCR)分别为35.82%和68.66%,B组患者RR和DCR分别为34.33%和65.67%,两组差异均无统计学意义(P>0.05);A组和B组患者中位疾病进展时间分别为9.7个月和8.2个月,差异具有统计学意义(P=0.031);A组和B组患者1年生存率分别为70.15%和64.18%,差异无统计学意义(P=0.462);A组和B组患者中位总生存时间分别为20.1个月和19.4个月,差异无统计学意义(P=0.289)。两组患者常见不良反应相似,其中A组患者手足综合征、肝功能损伤、腹泻以及外周神经毒性发生率分别为44.78%、46.27%、40.30%和58.21%,均显著高于B组患者(分别为0、23.88%、17.91%和14.93%),差异均有统计学意义(P<0.05);A组患者皮疹、恶心/呕吐、血小板降低和肾脏毒性发生率分别为19.40%、41.79%、41.79%和7.46%,均显著低于B组患者(分别为37.31%、70.15%、65.67%和28.36%),差异均有统计学意义(P<0.05);治疗后,两组患者CA153、CEA水平与治疗前相比均显著降低,差异具体统计学意义(P<0.05);且治疗后两组患者CA153、CEA水平比较,差异均无有统计学意义(P>0.05)。结论临床晚期三阴乳腺癌患者采用SOX方案和GP方案治疗,均可取得理想疗效,且耐受性较好。
奥沙利铂; 吉西他滨; 顺铂; 三阴乳腺癌; 糖类抗原153; 癌胚抗原
三阴乳腺癌(triple negative breast cancer,TNBC)是人表皮生长因子受体(human epidermal growth factor receptor 2,HER- 2)、孕激素受体(progesterone receptor,PR)以及雌激素受体(estrogen receptor,ER)均呈现阴性的一种乳腺癌,是乳腺癌的一种特殊亚型,在临床乳腺癌患者中约占 12%~24%[1]。三阴乳腺癌具有高复发风险、强侵袭性、较差的预后和极低的5年生存率等特点[2]。临床常规曲妥珠单抗及内分泌治疗对TNBC基本无效,目前临床对晚期TNBC核心治疗方案仍然为化疗,对于绝大多数进展、复发的晚期TNBC患者来说,目前还无法进行有效治愈,且临床还未能建立标准治疗方案,所以,目前临床对于晚期TNBC治疗主要目的为缓解病情,提高生活质量以及延长生存期[3]。有报道指出,三阴乳腺癌对铂类药物具有较高敏感性[4]。吉西他滨(Gemcitabine,GEM)是一种新型胞嘧啶抗代谢药物,研究发现其与顺铂(PDD)联合使用能够明显提升细胞毒作用,可考虑作为晚TNBC一线化疗首选方案[5]。奥沙利铂(Oxaliplatin,OXA)是第三代铂类药的一种,与氟尿嘧啶间可产生协同作用,替吉奥(S1)作为氟尿嘧啶类的一种口服抗肿瘤药,是临床乳腺癌治疗常用药物之一,具有疗效高且耐受性好、不良反应发生率低等特点[6]。癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原153(carbohydrate antigen 153,CA153)是目前临床乳腺癌检测主要肿瘤标志物,本研究主要通过探讨奥沙利铂联合替吉奥(SOX方案)和吉西他滨联合顺铂(GP方案)对晚期三阴乳腺癌患者临床疗效及CA153、CEA水平的影响,以期为临床治疗方案的选择提供一定指导。
1 资料与方法
1.1 一般资料
选取2012年8月至2015年8月盐城市第一人民医院的134例经病理学及免疫组织化学检查证实的晚期女性三阴乳腺癌患者作为研究对象,根据随机数字表法分为A组和B组,每组各67例,A组患者年龄为30~71岁,平均(45.56±5.38)岁;绝经前23例,绝经后44例;浸润性乳腺导管癌50例,浸润性小叶癌15例,髓样癌2例;发生肿瘤转移数目:1个13例,不低于2个54例;转移部位:肝脏39例,肺部26例,肾上腺14例,淋巴结34例,脑部10,腹部9例,胸壁10例,骨7例,其他8例;既往使用化疗药物:蒽环类13例,紫杉醇类22例,蒽环类和紫杉醇类15例。B组患者年龄为32~70岁,平均(44.37±5.53)岁;绝经前25例,绝经后42例;浸润性乳腺导管癌48例,浸润性小叶癌18例,髓样癌1例;发生肿瘤转移数目:1个11例,不低于2个56例;转移部位:肝脏35例,肺部23例,肾上腺15例,淋巴结32例,脑部9,腹部10例,胸壁8例,骨7例,其他6例;既往使用化疗药物:蒽环类14例,紫杉醇类20例,蒽环类和紫杉醇类19例。两组患者一般资料(年龄、病理类型、转移灶数目、转移部位、既往治疗情况等)差异无统计学意义(P>0.05),具有可比性。 本研究获得医院医学伦理委员会批准。患者及其家属均对本研究方案有详细了解,且自愿签署知情同意书。
1.2 排纳标准
纳入标准:(1)免疫组化及病理学检查证实为三阴乳腺癌晚期患者,且自愿接受抗肿瘤化学药物治疗;(2)临床分期Ⅳ期;(3)具有临床客观能够测量转移病灶(通过B型超声、磁共振成像、CT、体检等);(4)不宜采用根治性手术治疗或术后转移的患者;(5)不伴有外周神经疾病;(6)心脏、肺以及肾功能正常,心电图检测基本正常,肝功能低于1.5倍正常值范围;(7)血小板计数大于75×109L-1,中性粒细胞计数大于1.5×109L-1、白细胞计数大于3.5×109L-1;(8)体力状况(卡氏评分,KPS)高于70分,预计生存期不低于3个月;(9)未接受过本研究所用药物(吉西他滨、奥沙利铂、顺铂和替吉奥)治疗,且入组前1个月内未接受过其他化疗药物治疗。排除标准:(1)伴有严重心脏、肝脏、肾脏等机体重要器官功能障碍的患者;(2)预计生存期不足3个月的患者;(3)年龄大于75岁的患者;(4)正在进行其他化疗药物治疗的患者。
1.3 治疗方法
A组接受奥沙利铂联合替吉奥(SOX方案)治疗:第1天给予奥沙利铂(艾克博康,国药准字H20031048,深圳海王药业有限公司生产)治疗,135 mg·m-2,采用500 ml葡萄糖注射液(5%)稀释,进行静脉滴注,滴注时间为2 h;同时联合采用替吉奥胶囊(维康达,国药准字H20080803,山东新时代药业有限公司生产)给予治疗,剂量为40~60 mg,分别于早饭和晚饭后进行口服治疗,连续服用2周。B组接受吉西他滨联合顺铂(GP方案)治疗:于第1、8天给予吉西他滨(誉捷,国药准字H20040958,哈尔滨誉衡药业股份有限公司)治疗,1 000 mg·m-2,采用100 ml氯化钠注射液(0.9%)稀释,进行静脉滴注,滴注时间为30 min;同时给予顺铂(国药准字H37021357,齐鲁制药有限公司)治疗,75 mg·m-2,采用500 ml氯化钠注射液(0.9%)稀释,分3 d进行静脉滴注。两组患者均以3周为1个周期,每两个周期进行1次疗效评价,病情进展的患者更换治疗方案,对有效和稳定的患者继续进行化疗,化疗时间最长不能超过6个周期,对于脑转移的患者同时给予颅脑局部放疗,骨转移的患者同时给予双磷酸盐进行治疗。所有患者接受化疗前均给予常规5- 羟色胺3(5- HT3)受体拮抗剂进行呕吐预防,并同时进行护胃、保肝治疗;患者在接受化疗后若出现血小板和白细胞数目减少,则分别采用白介素- 11和粒细胞集落刺激因子进行治疗。每个化疗周期前若血小板计数低于75×109L-1或中性粒细胞计数低于1.5×109L-1或白细胞计数低于3.5×109L-1,则延迟化疗;治疗期间若患者出现3度及以上周期神经毒性或4度骨髓抑制,则下周期药物剂量降低25%。定期对所有患者进行随访,随访截至2016年8月31日。
1.4 观察指标
1.4.1 治疗评估及随访 所有患者在每个化疗周期前均需接受常规体检、血生化及血常规检查。一切可测量病灶均进行化疗前基线测量,以及每隔两个周期的影像学测量。疗效判定标准参考WHO制订的统一标准进行评价,分别包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、病变稳定(stable disease,SD)和病变进展(progressive disease,PD),临床治疗有效率(response rate,RR)=(完全缓解例数+部分缓解例数)/总例数×100%;疾病控制率(disease control rate,DCR)=(完全缓解例数+部分缓解例数+病变稳定例数)/总例数×100%[7]。疼痛改善可作为本研究治疗疗效的一种主要指标,通过主观评价法判定癌痛缓解或止痛药用量降低50%以上评价为有效。治疗过程对机体重要器官影响的指标可通过肝、肾功能受损情况判定,生化检验为主要依据,以统计学处理结果为准。骨转移判定标准,完全缓解:扫描以及X线等检查显示患者原有病灶全部消失,且持续时间超过4周;部分缓解:溶骨性病灶出现部分缩小情况,骨病病变或钙化密度减少,持续时间超过4周;无进展:病变未发现任何明显变化,因骨病变化较为缓慢,判定至少在开始进行治疗第8周后;病变进展:患者原有病灶出现扩大或(及)有新病灶出现。疾病进展时间(time to progression,TTP):开始化疗到患者疾病发生进展或患者死亡的时间。总生存时间(overall survival,OS):开始化疗到患者死亡或随访终止时间。不良反应参考WHO在1981年颁布的统一标准进行判定。
1.4.2 治疗前后CA153、CEA水平 采集所有患者治疗前和治疗两个周期后的清晨空腹静脉血3 ml,并及时进行血清分离,转速为4 000 r·min-1,离心时间为10 min,收集血清,通过全自动电化学发光免疫分析系统(罗氏Cobas e601型,购自北京康和源医药科技发展有限公司)同时进行CEA和CA153的测定,所有操作步骤均严格按照试剂说明书进行。阳性判定标准参考试剂盒提供的相关界值标准:CA 153大于25 U·ml-1判定为阳性;CEA大于5.5 ng·ml-1判定为阳性。本研究所有配套试剂均由罗氏公司提供。
1.5 统计学处理
本研究所有数据均采用SPSS 19.0统计软件进行统计分析,计数资料以百分比(%)表示,组间比较采用卡方检验;计量资料的统计描述用均数±标准差表示,组间比较采用独立资料t检验;组内比较采用配对资料t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组近期疗效比较
本研究中134例晚期三阴乳腺癌患者均能够进行疗效评价,其中A组患者RR和DCR分别为35.82%和68.66%,B组患者RR和DCR分别为34.33%和65.67%,两组数据对比分析,差异均无统计学意义(P>0.05),见表1。
2.2 两组远期疗效比较
随访截止2016年8月31日,随访时间为4.2~48.0个月,中位随访时间为28.4个月,其中A组失访1例,B组失访2例。A组患者1年生存率为70.15%(47例),疾病进展时间为3.7~20.1个月,中位疾病进展时间为9.7(95%CI 7.1~11.6)个月,总生存时间为4.5~41个月,中位总生存时间为20.1(95%CI 16.1~22.3)个月;B组患者1年生存率为64.18%(43例),疾病进展时间为3.7~18.9个月,中位TPP为 8.2(95%CI 6.4~10.3)个月,总生存时间为4.0~36.5个月,中位总生存时间为19.4(95%CI 16.4~21.3)个月。两组患者1年生存率比较差异无统计学意义(P=0.462);A组患者中位疾病进展时间比B组患者延长1.5个月,差异具有统计学意义(P=0.031);A组患者中位总生存时间比B组患者延长0.7个月,差异无统计学意义(P=0.289)。
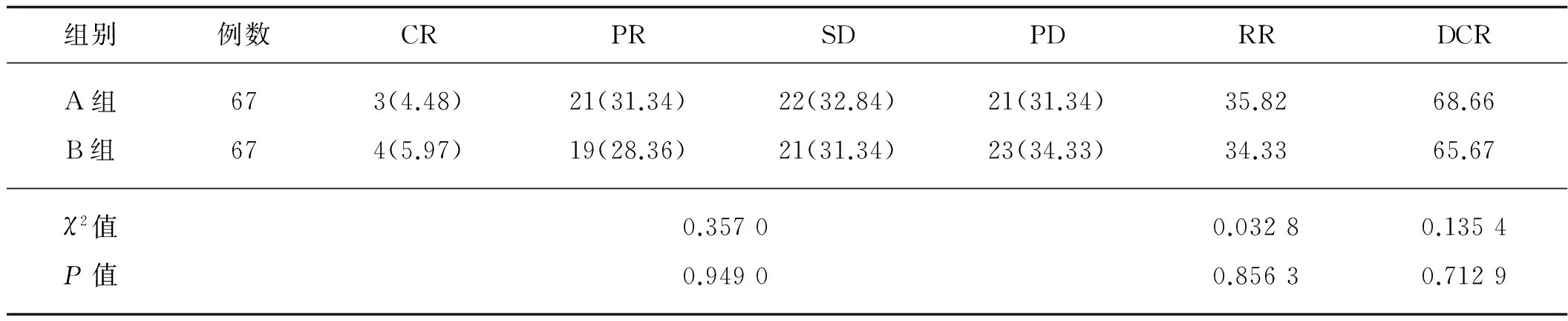
表1 两组疗效比较 例
注:括号内为百分率
2.3 两组不良反应比较
A组患者手足综合征、肝功能损伤、腹泻以及外周神经毒性发生率分别为44.78%、46.27%、40.30%和58.21%,均显著高于B组患者(分别为0、23.88%、17.91%和14.93%),两组比较差异均具有统计学意义(P<0.05)。A组患者皮疹、恶心/呕吐、血小板降低和肾脏毒性发生率分别为19.40%、41.79%、41.79% 和7.46%,均显著低于B组患者(分别为37.31%、70.15%、65.67%和28.36%),两组比较差异均具有统计学意义(P<0.05)。此外,两组患者心电图改变、静脉炎、口腔黏膜炎、贫血、色素沉着、白细胞减少以及脱发等发生率比较,差异均无统计学意义(P>0.05)。见表2。
2.4 两组CA153、CEA水平比较
两组治疗前CA153、CEA水平比较差异无统计学意义(P>0.05);治疗后,两组患者CA153、CEA水平与治疗前相比均显著降低,差异具有统计学意义(P<0.05);且治疗后两组患者CA153、CEA水平比较,差异均无统计学意义(P>0.05)。见表3。
3 讨 论
根据TNBC的生物学功能、基因表达特征以及临床疗效,临床可将其分为5个亚型,包括免疫相关型、管腔型、基底细胞样型、HER2过表达型以及间叶细胞样型[8]。其中基底细胞样型乳腺癌可通过免疫组化染色定义:HER2、PR、ER阴性,细胞角质蛋白CK5/6及表皮生长因子受体阳性[9]。三阴乳腺癌作为一种异质性群体,与乳腺癌易感基因1相关性以及基底细胞样型乳腺癌有较高程度相关性,报道指出,50%~87%的三阴乳腺癌为乳腺癌易感基因1突变相关性乳腺癌[10],还有报道表明,基底细胞样型乳腺癌患者中三阴乳腺癌患者比例超过75%[11]。目前,部分三阴乳腺癌患者临床诊断确诊时已错失手术治疗机会,而且大部分患者存在潜在或临床转移,化学治疗很难取得理想临床疗效,因此,三阴乳腺癌临床治疗所面临的主要问题是如何选择适宜的化学药物。近年来,临床发现多种新药用于三阴乳腺癌治疗均有较为理想疗效。
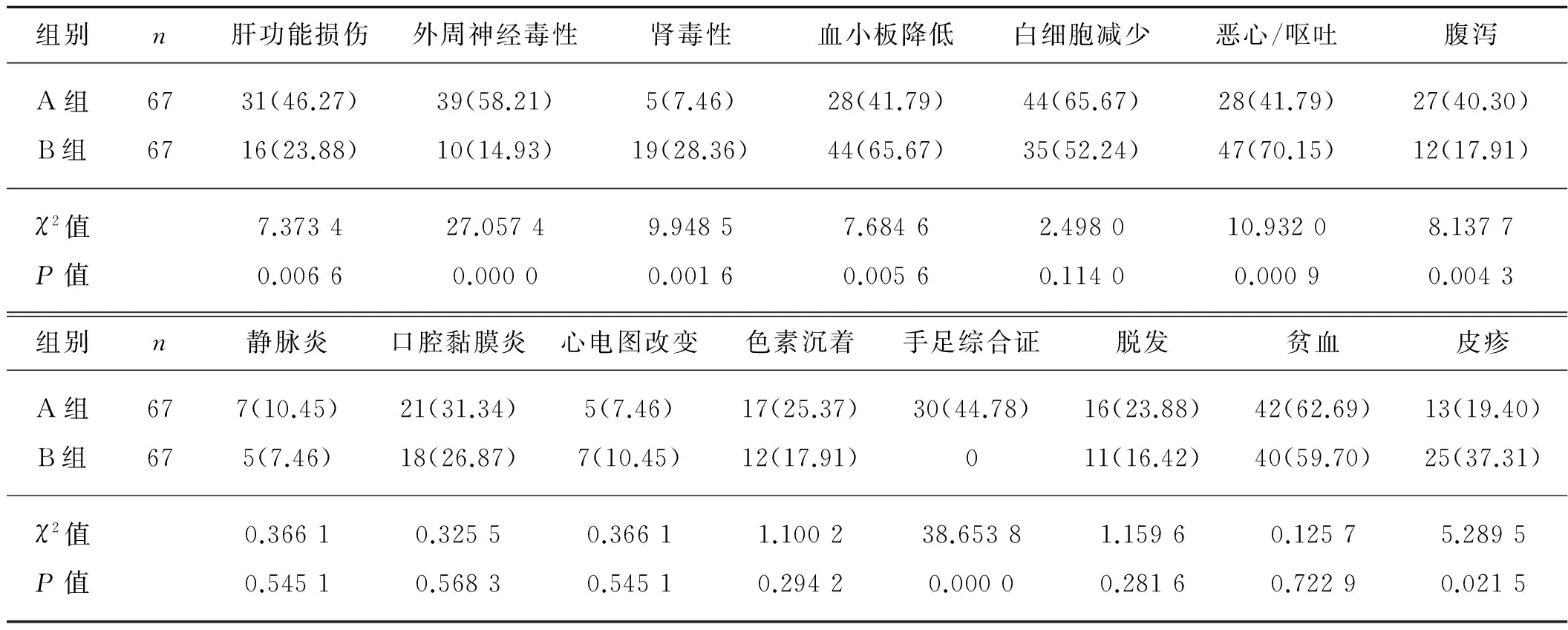
表2 两组不良反应比较 例
注:括号内为百分率
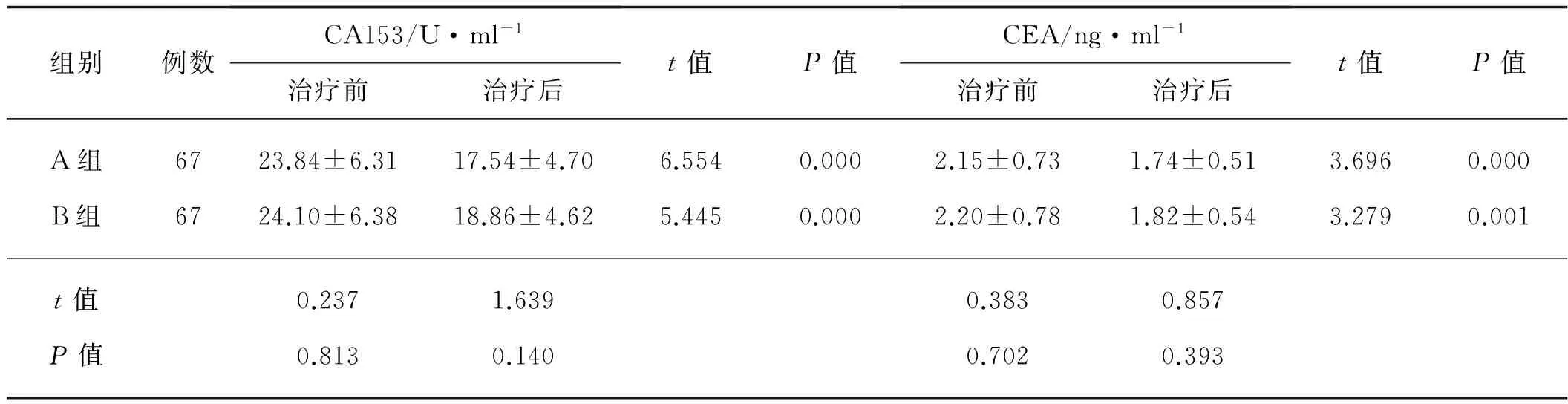
组别例数CA153/U·ml-1治疗前治疗后t值P值CEA/ng·ml-1治疗前治疗后t值P值A组6723.84±6.3117.54±4.706.5540.0002.15±0.731.74±0.513.6960.000B组6724.10±6.3818.86±4.625.4450.0002.20±0.781.82±0.543.2790.001t值0.2371.6390.3830.857P值0.8130.1400.7020.393
研究发现,抗HER2及内分泌治疗用于TNBC无效,但与临床其他类型乳腺癌相比,TNBC对化疗有着更高的敏感性[12]。大部分TNBC患者均具有乳腺癌易感基因1变异或缺失,乳腺癌易感基因1相关乳腺癌对有DNA结构破坏能力的药物具有十分高的敏感性,包括烷化剂和铂类药物等[13]。目前,临床上已对TNBC进行多种铂类药物治疗试验,Uhm等[14]研究发现,通过铂类药物治疗TNBC患者,其病理学完全缓解率为 23%~90%,显著高于采用紫杉醇和经蒽环类药物化疗方案(19%~34%)。此外,研究表明,吉西他滨在晚期乳腺癌治疗中可取得较高疗效,而且吉西他滨的作用机制较为独特,与紫杉类和蒽环类间不存在交叉耐药,因此适用于解救治疗,吉西他滨用于紫杉类或蒽环类治疗失败的晚期乳腺癌二、三线化疗可获得29%的有效率[15]。吉西他滨联合顺铂用于晚期乳腺癌化疗疗效更佳,能够使细胞毒作用明显增强,且可以改善顺铂耐药[16]。第三代铂类药奥沙利铂,与卡铂和顺铂具不完全交叉耐药,而且其与氟尿嘧啶间存在协同作用,可用于治疗氟尿嘧啶耐药肿瘤患者,而替吉奥作为氟尿嘧啶类口服抗肿瘤药,具有显著疗效。
顺铂、吉西他滨、奥沙利铂以及替吉奥均为TNBC以及晚期乳腺癌多线治疗有效单药,本研究通过分别给予顺铂联合吉西他滨(GP方案)、奥沙利铂联合替吉奥(SOX方案)对134例晚期TNBC患者进行治疗,结果发现采用SOX方案,患者RR和DCR分别为35.82% 和68.66%,1年生存率为70.15%,中位疾病进展时间为9.7个月,中位总生存时间为20.1个月;采用GP方案,患者RR和DCR分别为34.33%和65.67%,1年生存率为64.18%,中位疾病进展时间为8.2个月,中位总生存时间为19.4个月。两种方案患者的PP、DCR、1年生存率以及中位总生存时间差异均无统计学(P>0.05)。可见,两种方案用于晚期TNBC治疗均能取得理想疗效。分析原因如下:吉西他滨作为核苷类抗代谢药,可通过其代谢物对DNA链合成进行干扰,并促进脱氧核苷酸消耗,从而起到DNA合成抑制效果,最终诱导细胞凋亡,因此具有独特抗肿瘤效果[17]。替吉奥中含有奥替拉西和吉美嘧啶两种生化修饰剂以及替加氟,替加氟能够在机体肝脏线粒体中生成5- Fu,吉美嘧啶可以对二氢嘧啶脱氢酶(5- Fu分解代谢酶)进行选择性抑制,可有效延长肿瘤组织和血浆内5- Fu的有效浓度,因此具有理想疗效,同时奥替拉西可以明显降低非血液学并发症[18]。SOX方案组患者中位疾病进展时间比GP方案组患者延长1.5个月,差异具有统计学意义(P=0.031),提示SOX方案具有一定优势,但TNBC患者对铂类药的敏感性与乳腺癌易感基因1突变有关,本研究未考虑晚期TNBC患者乳腺癌易感基因1突变情况,因此无法明确两种方案疗效差异与突变率是否存在相关性,需进一步研究。
虽已确定化疗在晚期TNBC患者中具有理想疗效,但还需重视化疗对患者生存质量的影响以及给患者带来的不良反应。本研究中两种方案常见不良反应主要包括肝肾功能损伤、手足综合征、胃肠反应、外周神经毒性以及血液学毒性等几个方面,两组患者不良反应总体发生率基本相似,患者接受对症治疗后均能够有效耐受。
临床对三阴乳腺癌化疗预后的预测方法有较多研究,其中血清肿瘤标志物检测较为常用,具有客观、创伤小和简便等多种优点,广泛用于肿瘤诊断、筛查、复发监测和疗效评定。目前,临床乳腺癌常用肿瘤标志物为CEA和CA153[19]。乳腺癌患者中常常伴有血清CA153过度表达现象,因此,CA153被公认为乳腺癌特异肿瘤标志物之一,对乳腺癌临床诊断以及疾病监测有重要意义,CA153水平过高与乳腺癌预后较差存在一定相关性[20]。CEA也是肿瘤标志物的一种,但不具有特异性,临床常作为乳腺癌、肺癌和消化道癌等诊断辅助指标。有报道表明,CEA在乳腺癌诊断、病情监测、治疗效果和预后判断中有一定意义[21]。本研究结果显示,两组治疗前CA153、CEA水平组间比较差异无统计学意义(P>0.05);治疗后,两组患者CA153、CEA水平与治疗前相比均显著降低,差异具有统计学意义(P<0.05);且治疗后两组患者CA153、CEA水平比较,差异均无统计学意义(P>0.05)。提示三阴乳腺癌患者的病情得到了有效控制,说明SOX和GP这两种方案对三阴乳腺癌患者临床治疗具有较好疗效,可改善预后。
综上所述,奥沙利铂联合替吉奥、吉西他滨联合顺铂方案用于晚期三阴乳腺癌治疗,均可取的较为理想的临床疗效,且不良反应耐受性较好,同时,均能够明显降低患者血清CA153、CEA水平,改善患者预后。
[1] 项丹,姜藻,顾晓怡.西达本胺联合顺铂对三阴乳腺癌细胞株MDA- MB- 231的体外抗增殖作用及其机制的研究[J].东南大学学报:医学版,2013,32(3):283- 288.
[2] MATHE A,SCOTT R J,AVERY- KIEJDA K A.MiRNAs and Other Epigenetic Changes as Biomarkers in Triple Negative Breast Cancer[J].Int J Mol Sci,2015,16(12):28347- 28376.
[3] 袁业伟,孙治君.三阴性乳腺癌最新治疗及研究进展[J].重庆医学,2015,44(16):2279- 2282.
[4] PALMA G,FRASCI G,CHIRICO A,et al.Triple negative breast cancer:looking for the missing link between biology and treatments[J].Oncotarget,2015,6(29):26560- 26574.
[5] 杨慧,黄海欣,李桂生.吉西他滨联合卡铂或顺铂治疗晚期三阴乳腺癌的疗效观察[J].现代肿瘤医学,2014,22(5):1076- 1078.
[6] 刘君,肖扬,马益慧,等.奥沙利铂联合替吉奥治疗难治性晚期乳腺癌临床观察[J].国际肿瘤学杂志,2016,43(5):330- 334.
[7] 戴峰,张秀明,陈骏,等.肝细胞肝癌 TAE 前后血清 HIF- 1α、VEGF表达与疗效的相关性研究[J].东南大学学报:医学版,2016,35(4):537- 540.
[8] LE D F.Is the future of personalized therapy in triple- negative breast cancer based on molecular subtype?[J].Oncotarget,2015,6(15):12890- 12908.
[9] 刘莉萍,魏亚,白君,等.基底细胞样乳腺癌与三阴性乳腺癌临床病理特征[J].中华全科医学,2014,12(2):216- 218.
[10] LEHMANN B D,PIETENPOL J A.Identification and use of biomarkers in treatment strategies for triple negative breast cancer subtypes[J].J Pathol,2014,232(2):142- 150.
[11] RASTELLI F,BIANCANELLI S,FALZETTA A,et al.Triple- negative breast cancer:current state of the art[J].Tumori,2010,96(6):875- 888.
[12] 罗海涛,邹静荷,古伟光,等.卡培他滨维持治疗对联合化疗有效的复发转移三阴乳腺癌的临床观察[J].重庆医学,2015,44(24):3357- 3359.
[13] 樊英,徐兵河.BRCA1/BRCA2相关性乳腺癌的全身治疗[J].临床药物治疗杂志,2011,9(1):48- 50.
[14] UHM J E,PARK Y H,YI S Y,et al.Treatment outcomes and clinicopathologic characteristics of triple- negative breast cancer patients who received platinum- containing chemotherapy[J].Int J Cancer,2009,124(6):1457- 1462.
[15] BRODOWICZ T,KOSTLER W J,MÖSLINGER R,et al.Single- agent gemcitabine as second- and third- line treatment in metastatic breast cancer[J].Breast,2001,9(6):338- 342.
[16] 蔡锐刚,徐兵河.吉西他滨联合顺铂方案治疗晚期乳腺癌临床研究[J].中国肿瘤,2014,23(7):612- 615.
[17] 谷子.吉西他滨联合卡培他滨与顺铂治疗耐药性晚期乳腺癌的近期疗效及不良反应比较[J].实用医院临床杂志,2014,11(5):82- 85.
[18] 王梦洁,孙苏平.替吉奥和卡培他滨治疗老年晚期乳腺癌临床疗效及安全性比较[J].现代仪器与医疗,2014,20(6):36- 38.
[19] 曾利军,陈建魁,于农,等.血清CEA、CA153和CYFRA21- 1联合检测对乳腺癌的诊断价值[J].临床误诊误治,2011,24(6):72- 74.
[20] MOLINA R,FILELLA X,ALICARTE J,et al.Prospective evaluation of CEA and CA 15.3 in patients with locoregional breast cancer[J].Anticancer Res,2003,23(6):1035- 1041.
[21] 苏晓玥,杨伟明,杨雪峰,等.CEA和PTEN在双侧原发性乳腺癌中的表达和分析[J].贵州医药,2015,39(9):779- 781.
EffectsofSOXandGPregimensonadvancedtriple-negativebreastcancerpatientsanditsaffectiononlevelsofCA153,CEA
ZHOULi-hua1,YANGWei2
(1.YanchengHealthVocationalTechnologyCollege,Yancheng224005,China;2.YanchengCityFirstPeople’sHospital,Yancheng224000,China)
Objective: To explore the effects of Oxaliplatin plus S- 1(SOX) and Gemcitabine plus Cisplatin (GP) regimens on advanced triple- negative breast cancer patients and its affection on levels of carbohydrate antigen 153(CA153) and carcinoembryonic antigen(CEA).Methods134 patients with advanced triple- negative breast cancer treated in Yancheng City First People’s Hospital from August 2012 to August 2015 were selected, and divided into group A and group B(67 cases in each group). Group A was treated with SOX regimen, and group B was treated with GP regimen. The short term effect, long term curative, adverse reactions,serum CA153 and CEA levels were compared between the two groups.ResultsAfter treatment, the response rate and disease control rate of group A was 35.82% and 68.66%, and group B was 34.33% and 65.67%, the difference was not statistically significant(P>0.05).The median time to progression was 9.7 months in group A and 8.2 months in group B, the difference between the two groups was statistical significantly(P=0.031). The 1- year survival rates was 70.15% in group A and 64.18% in group B, the difference was not statistically significant(P=0.462). The median time to overall survival was 20.1 months in group A and 19.4 months in group B, the difference was not statistically significant(P=0.289). Adverse reactions were similar between the two groups. The incidence of hand- foot syndrome, liver function damage, diarrhea and peripheral nerve toxicity in group A were 44.78%, 46.27%, 40.30% and 58.21%, were significantly higher than those in group B(0, 23.88%, 17.91% and 14.93%), the difference between the two groups was statistically significant(P<0.05). The incidence of skin rash, nausea/vomiting, thrombocytopenia and renal toxicity in group A were 19.40%, 41.79%, 41.79% and 7.46%, were significantly lower than those in group B(37.31%, 70.15%, 65.67% and 28.36%), the difference between the two groups was statistically significant(P<0.05). After treatment,the levels of CA135 and CEA of the two groups were significantly reduced compared with before, the difference was statistically significant(P<0.05). And the levels of CA135 and CEA of two groups had no statistically significant difference after treatment(P>0.05).ConclusionBoth SOX and GP regimens are safe, effective and tolerable in reating advanced triple- negative breast cancer patients.
Oxaliplatin; Gemcitabine; Cisplatin; triple- negative breast cancer; carbohydrate antigen 153; carcinoembryonic antigen
2016- 12- 06
2017- 06- 19
周丽华(1982-),女 ,江苏盐城人,讲师。E- mail:dhdt675@163.com
杨威 E- mail:291047317@qq.com
周丽华, 杨威.SOX方案和GP方案对晚期三阴乳腺癌患者临床疗效及CA153、CEA水平的影响[J].东南大学学报:医学版,2017,36(5):728- 734.
R737.9
A
1671- 6264(2017)05- 0728- 07
10.3969/j.issn.1671- 6264.2017.05.009
(本文编辑:何彦梅)
收稿日期2016- 11- 24修回日期2017- 06- 30
武汉市卫计委支持项目(WX11D01)
操作亮(1963-),男,湖北武汉人,副主任医师。Email: caozzzl@126.com
操作亮,刘双林,袁劲东,等. 标准通道和微通道PCNL在不同肾盂压力下治疗感染性肾结石效果的Meta分析.东南大学学报:医学版,2017,36(5):735- 742.

