连作对再植枸杞根际细菌群落多样性和群落结构的影响*
纳小凡 郑国旗 邢正操 马金平 李占辉 卢俊辉 马 飞
(1 宁夏大学生命科学学院,银川 750021)
(2 宁夏大学环境工程研究所,银川 750021)
(3 宁夏农林科学院枸杞研究所,银川 750013)
连作对再植枸杞根际细菌群落多样性和群落结构的影响*
纳小凡1郑国旗1邢正操1马金平3李占辉1卢俊辉1马 飞2†
(1 宁夏大学生命科学学院,银川 750021)
(2 宁夏大学环境工程研究所,银川 750021)
(3 宁夏农林科学院枸杞研究所,银川 750013)
受枸杞道地产区土地资源等因素限制,连作障碍已成为影响枸杞产业发展的重要原因之一,导致严重的经济损失。研究连作条件下枸杞农田土壤生态系统微生物群落的演替规律对枸杞产业的可持续发展具有重要的理论意义。以宁夏银川市南梁农场连作多年的枸杞地为研究对象,利用Illumina MiSeq测序技术分析了连作对再植枸杞根际/非根际细菌群落的影响。结果表明,连作地显著抑制再植枸杞苗地径的增加,且其土壤pH较对照样地显著降低(p<0.05)。测序结果证实,与对照样地相比,连作地再植枸杞根际土壤细菌物种数显著降低(p<0.05),细菌群落α多样性下降(p>0.05)。主坐标分析表明,连作和对照样地间枸杞非根际细菌群落结构无明显差异,但连作显著改变再植枸杞根际细菌的群落结构。对细菌群落丰度的统计分析发现,连作地枸杞根际浮霉菌门、非根际假单胞菌门的相对丰度较对照样地显著降低(p<0.05)。此外,冗余分析结果表明:枸杞园土壤pH和有效磷含量是影响枸杞非根际土壤细菌群落结构变化的主要因素,分别解释了41.8%和35.4%的群落结构变化(p<0.05),其他土壤因子无统计学意义,但土壤理化因子对再植枸杞根际细菌群落结构变化的影响均未达显著水平。这些结果证实连作能够显著抑制再植枸杞生长、影响再植枸杞根际细菌群落结构和多样性,干扰枸杞与土壤细菌群落间的互作关系。这些研究结果将为解析枸杞连作障碍机制提供理论基础。
枸杞;连作;根际;细菌群落;16S rRNA
枸杞子是卫生部公布的第一批药食两用中药材,该商品涵盖了饮品、保健品和食品等多个领域,需求量逐年增加。目前,我国枸杞种植主要分布在宁夏、新疆、内蒙和青海四大产区,其中以宁夏地区枸杞种植面积及产量最大,是枸杞唯一国家地理标志产品保护区。截至2015年底,宁夏全区枸杞种植面积达6×104hm2,枸杞干果总产量8.8×103t,年综合产值达100亿元。枸杞产业已经成为促进宁夏农业增效和区域经济增长最具潜力的富民产业之一。但受枸杞生产年限、道地产区土地资源紧张和农民种植习惯等因素影响,连作障碍已成为枸杞产业可持续发展面临的重大难题之一。研究表明,生长超过10年的枸杞树均出现鲜果百粒重下降等现象[1]。笔者在近五年的田间调查中也发现,枸杞园死树苗的原位补种及连作果园老树更新时均存在再植苗成活率低和生长势弱等特点。因此,连作障碍已经成为制约枸杞产量和品质提高以及区域经济发展的重要因素之一,导致严重的经济损失和生态问题。研究枸杞连作障碍及其作用机制对改善枸杞生产,促进枸杞产业的可持续发展具有重大的理论和实践意义。
近期对宁夏枸杞园土壤铜含量的分析发现,枸杞园土壤有效铜和全铜含量随种植年限增长显著增加[2]。对宁夏中宁和惠农地区不同种植年限枸杞园土壤理化性质的分析表明,枸杞园土壤速效氮残留以硝态氮为主,且硝态氮含量及有效磷含量随树龄增加而增大[3]。另一项对不同种植年限枸杞园土壤线虫的研究表明:当树龄大于9年时,枸杞根际土壤线虫多样性指数、均匀度指数和丰富度指数均呈现降低趋势;同时植物寄生线虫的相对丰度较低龄树显著增多[4]。利用测序技术,纳小凡等[1]对枸杞根际细菌和真菌群落组成随种植年限增长的变化规律进行了初步分析。这些结果从不同方面证实了枸杞园土壤微环境在长期连作过程中的变化模式。
研究表明,土壤微生物群落区系变异是导致植物连作障碍形成的主要原因之一[5]。在农田土壤生态系统中,土壤微生物具有提高农田土壤肥力、改善土壤结构、增强植物对生物/非生物胁迫抗性、提高植物对水分和土壤养分的利用效率等重要作用[6-7]。在连作条件下,同类型植物根系分泌物、植物残片及渗出液不断输入土壤,导致土壤微生物群落多样性下降、群落结构失衡和功能紊乱,严重影响了土壤微生物与植物间的有益互作,从而诱发连作障碍[5]。
然而,由于植物连作障碍的成因复杂,不同植物产生连作障碍的机制也不尽相同[5]。在近几年对宁夏枸杞生产情况的调研中发现,多数枸杞产业从业人员和农业科技人员对枸杞连作障碍现象已深有了解,但目前有关枸杞连作障碍及其作用机制的研究尚少见报道。为进一步探索枸杞连作障碍形成的分子机制,本文利用Illumina MiSeq测序技术,分析了连作地再植四年枸杞根际/非根际细菌群落的多样性和组成变化。同时结合枸杞生长和土壤理化性质分析,探讨了土壤理化因子与枸杞根际/非根际细菌群落间的耦合关系,为揭示枸杞连作障碍机制提供理论基础。
1 材料与方法
1.1 试验设计
所选样地位于银川市南梁农场,区域气候、土壤类型见文献[1]。试验以区域内种植十年的枸杞园为连作地,以前期的设施农业用地为对照样地(拆除温室大棚等设施,无枸杞种植历史)。挖去连作地内种植枸杞,连作及对照样地经整理后于2012年4月种植一年生枸杞苗(宁杞一号)。枸杞田间管理参照文献[1]。
1.2 枸杞根际/非根际土壤样本的采集
于2016年8月进行枸杞根际/非根际土壤样本采集。在连作和对照样地内随机设置3个样方,分别于每个样方内采用随机布点法设置至少5个采样点,利用土钻采集树冠范围内深度0~20 cm土壤。同一样方内的土壤合并为1个土壤样品(非根际样本)。同时于采样点附近挖取深度在0~20 cm枸杞根,用无菌剪刀快速剪下直径小于2 mm的枸杞根15~20 cm,用无菌镊子抖去浮土,转至15 ml无菌离心管中。同一样方内的5个样本合并成1个根际样品。所有样品标记后立即置于冰上保存,带回实验室进行后续分析。
1.3 枸杞根际土壤样本制备及土壤DNA提取
向盛有新鲜枸杞根的离心管中加入5 ml无菌0.1% NaCl,充分震荡、洗下附于根表面的土壤颗粒。所得液体经10 000 g离心10 min,小心弃去上清、收集离心管底部根际土壤,此步进行3次。将制备得到的枸杞根际土壤样品直接用于DNA提取。枸杞根际/非根际土壤DNA提取及质量检测参照文献[1]。
1.4 土壤理化性质分析
将采集的枸杞非根际样品风干,过1 mm筛。土壤有机碳采用重铬酸钾容量法[8]、全氮采用凯氏定氮法、碱解氮采用碱解扩散法[8]、无机氮采用流动分析仪法、土壤pH采用酸度计法[9]、土壤电导率采用电导率仪法[9]、全磷采用矾钼抗比色法[10]、有效磷采用0.5 mol L-1NaHCO3浸提—钼锑抗比色法[8]、全钾采用ICP法[10]、速效钾采用乙酸铵提取—火焰光度计法[10]测定。
1.5 细菌16S rRNA V4区段扩增及测序
分别对不同样地中的三个平行枸杞根际和非根际土壤DNA样本进行PCR扩增和文库构建(n=3)。细菌16S rRNA V4区段扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),扩增方法参照文献[1]。文库构建参照Na等的方法[11],测序由Illumina MiSeq2500测序平台(Novogene,北京)完成。
1.6 DNA数据分析
测序原始数据的拼接、过滤、聚类分析及物种注释均参照文献[11]。其中,序列拼接利用FLASH(V1.2.7)、序列过滤利用QIIME(V1.7.0)、聚类利用UPARSE pipeline(V7.0.1001)、物种注释利用RDP classifier(V2.2)软件。此外,利用QIIME计算不同样品中细菌群落的α多样性和β多样性指标[12]。
1.7 统计分析
数据用Excel(2010)进行处理,统计分析采用SPSS (22.0)处理。单因素方差分析(one way ANOVA,Tukey t-test)用于不同处理间的差异显著性校验(p=0.05),皮尔逊相关系数(Pearson correlation coefficient)用于评价土壤理化性质与土壤细菌群落间的相关性。土壤理化因子对细菌群落结构变异的解释度利用Conoco(5.0)软件中基于距离矩阵的冗余分析(distance based-Redundancy Analysis,db-RDA)进行。绘图使用Origin(8.0)软件。
2 结 果
2.1 土壤理化性质
对连作及对照枸杞园土壤理化性质分析表明,连作地土壤碱解氮和有效磷含量较对照样地显著升高,而土壤pH和电导率则显著降低(表1)。同时对不同样地再植枸杞的生长情况分析表明,连作地再植枸杞地径(21.7 mm±4.2 mm,均值±SD)较对照样地(31.4 mm±4.8 mm)显著降低(p<0.01),证实枸杞连作障碍现象的存在。
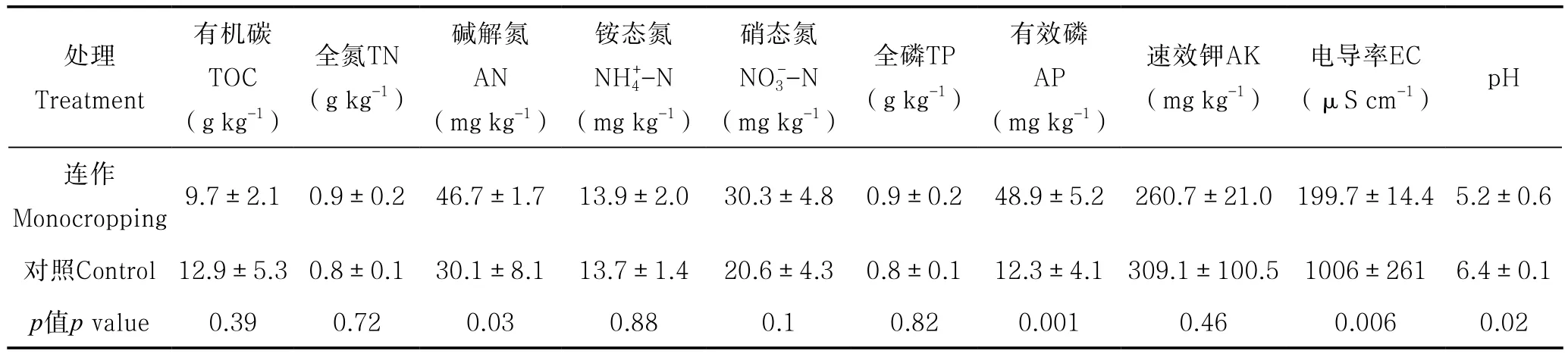
表1 连作及对照枸杞园土壤主要理化性质Table 1 Soil properties of the monocropping field and control
2.2 枸杞根际土壤细菌α多样性
细菌16S rRNA V4区段的测序结果表明,连作地再植枸杞根际土壤细菌种类较对照样地显著降低(p<0.05),细菌群落α多样性指数也有所下降,但结果不显著(p=0.16,图1)。枸杞非根际土壤的细菌种类及群落α多样性在不同样地间无显著变化。在同一样地内,枸杞非根际土壤中的细菌种类均显著高于根际土壤(p<0.05),但仅对照样地的非根际土壤细菌群落α多样性显著高于枸杞根际土壤(图1)。
2.3 连作对枸杞根际细菌群落结构的影响
对测序结果的主坐标分析(Principal coordinate analysis,PCoA)发现,连作及对照样地枸杞非根际土壤微生物群落结构较为相似,但连作地枸杞根际土壤细菌群落结构与对照样地相比差异较大,说明长期种植对枸杞根际土壤微生物群落结构的影响较非根际土壤更加明显(图2A)。聚类分析也进一步证实,连作和对照样地枸杞非根际土壤细菌群落的相似度最高,而连作地枸杞根际土壤细菌群落结构与其他土样差异最大(图2B)。
对各样品中测序得到的OTU进行分类表明,所有四类样品中共有OTU为3124个。此外,连作地枸杞根际/非根际土壤中分别具有特异OTU为476和325个,对照样地则分别为287和358个(图3)。
2.4 OTU丰度在门水平的变化
对不同样品中优势细菌门的分析表明,枸杞根际/非根际相对丰度排名前十的优势细菌门分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、
蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)以及浮霉菌门(Planctomycetes)。这些细菌的相对比例占各样品总序列数的93.8%~96.1%(表2)。虽然这些细菌的相对丰度在不同样品内(重复之间)变化较大,但芽单胞菌门和浮霉菌门的相对丰富在不同样品间仍发生显著变化(表2)。其中,连作地枸杞根际土壤中浮霉菌门的相对丰度较对照显著降低。

图1 枸杞根际/非根际土壤细菌群落物种数(A)及α多样性指标(B)Fig. 1 Number of soil bacterial species(A)and shannon index(B)of the rhizosphere of Lycium barbarum L. and bulk soil

图2 枸杞根际/非根际土壤细菌群落β多样性分析Fig. 2 β diversity analysis of the soil bacterial communities in the rhizosphere and bulk soil

图3 枸杞根际/非根际土壤细菌群落OTUs的维恩图Fig. 3 Venn diagram of the OTUs of the soil bacterial communities in the rhizosphere and bulk soils
2.5 OTU丰度在属水平的变化
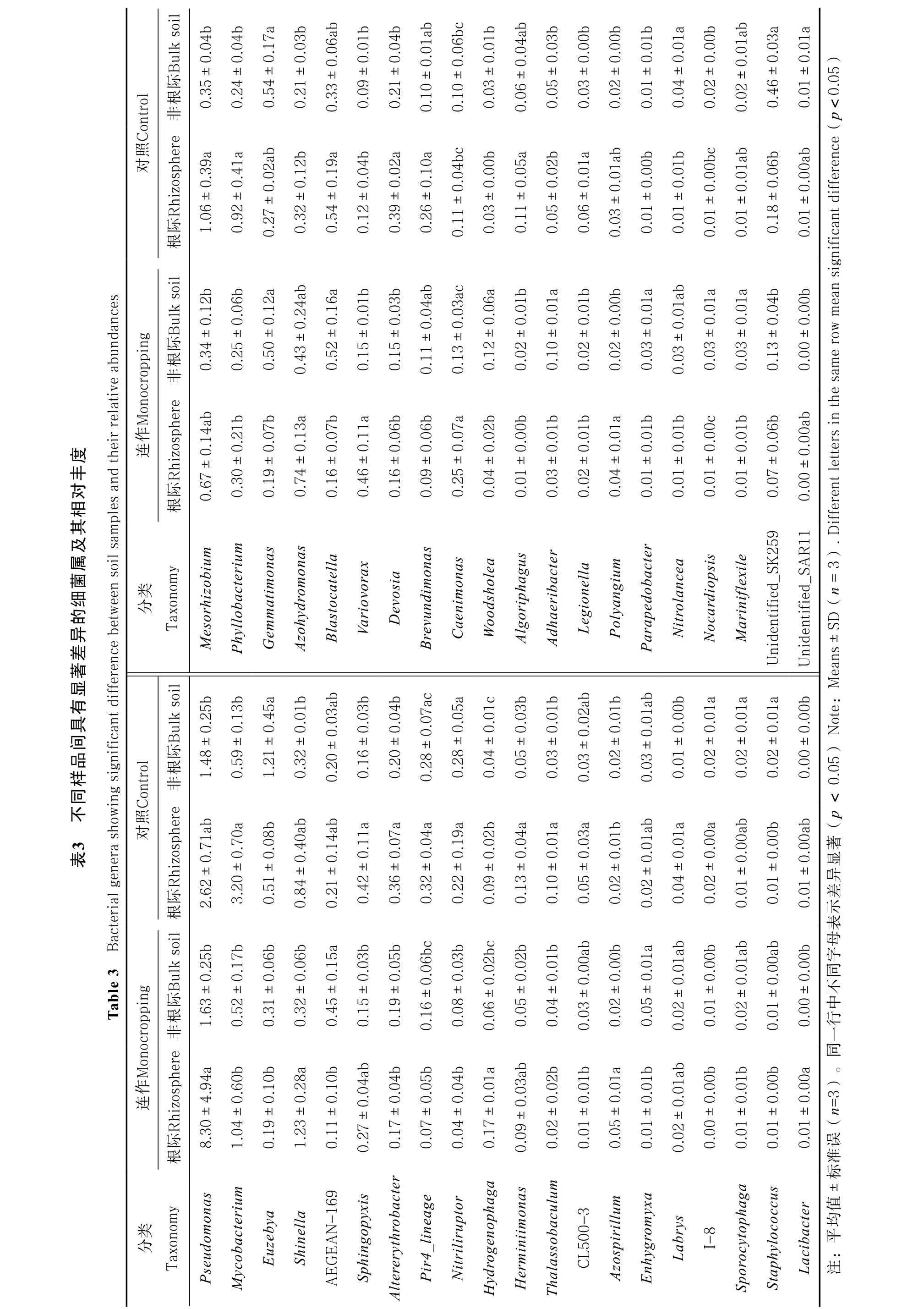
在所有样品中,相对丰度排名前十的优势属分别为不动细菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)、克罗诺杆菌属(Cronobacter)、类芽孢杆菌属(Paenibacillus)、芽孢杆菌属(Bacillus)、分枝杆菌属(Mycobacterium)、鞘氨醇单胞菌属(Sphingomonas)、假黄色单胞菌属(Pseudoxanthomonas)以及鞘氨醇杆菌属(Sphingobacterium),这些细菌占所测细菌总数的10.4%~23.2%。统计分析表明,在所检测到的579个细菌属中,共有40个属的相对丰度在不同样地间发生显著改变(表3)。其中,连作地枸杞根际中Azohydromonas、Variovorax、Caenimonas、Hydrogenophaga及Azospirillum的相对丰度较对照样地显著增加,而Mycobacterium、Phyllobacterium、Blastocatella、Altererythrobacter、Devosia、Pir4 lineage、Brevundimonas、Nitriliruptor、Algoriphagus、Thalassobaculum、Legionella、CL500-3及I-8的相对丰度则显著降低(表3)。对非根际细菌而言,连作地中Woodsholea、Adhaeribacter、Parapedobacter和Nocardiopsis的相对丰度较对照样地显著增加,而Euzebya、Nitriliruptor、I-8、unidentified SK259和unidentified SAR11的相对丰度则显著减少(表3)。
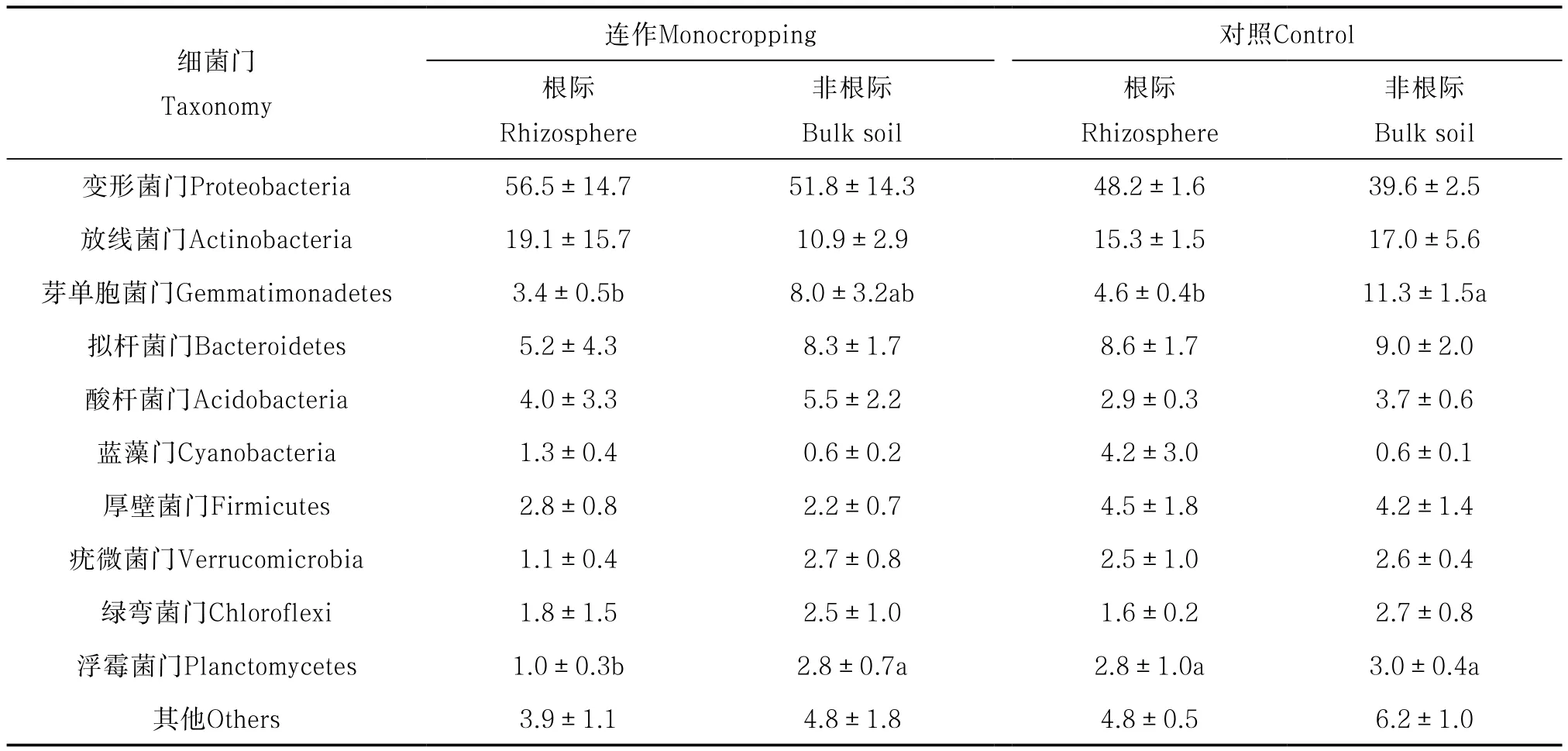
表2 枸杞根际/非根际细菌群落在门水平上的丰度变化Table 2 Relative abundance of dominant bacterial phyla in rhizosphere of Lycium barbarum L. and bulk soil
2.6 连作地土壤理化性质与主要细菌群落间的相关关系
相关性分析表明,在枸杞根际土壤中,芽孢单菌门与pH、浮霉菌门与EC呈显著正相关关系,而放线菌门与铵态氮含量、芽孢单菌门与有效磷含量以及浮霉菌门与有效磷含量呈显著负相关关系(表4)。在枸杞非根际土壤中,芽孢单菌门与pH、变形菌门与硝态氮含量存在显著正相关,而变形菌门与pH、蓝藻门与全氮含量、绿弯菌门与铵态氮含量、放线菌门与硝态氮含量、蓝藻门与全磷含量、厚壁菌门与有效磷含量间则存在显著负相关(表4)。此外,土壤有效钾含量与任何优势细菌门均无显著相关性。
为进一步了解枸杞园土壤理化性质变化对枸杞根际/非根际土壤细菌群落组成的影响,利用Canoco 5.0软件进行了基于距离的冗余分析(db-RNA)。结果表明,枸杞园土壤主要理化因子不能解释枸杞根际细菌群落的变化(p>0.05,表5),但土壤pH和有效磷含量则分别解释了枸杞非根际土壤细菌群落变异的41.8%和35.4%(p<0.01,表5),其他因子的影响均无统计学意义。这一结果说明,连作导致的土壤酸化驱动了枸杞非根际细菌群落的演替,而连作对枸杞根际细菌群落的影响可能主要通过影响再植枸杞生长以及再植枸杞与土壤细菌间的互作而实现。
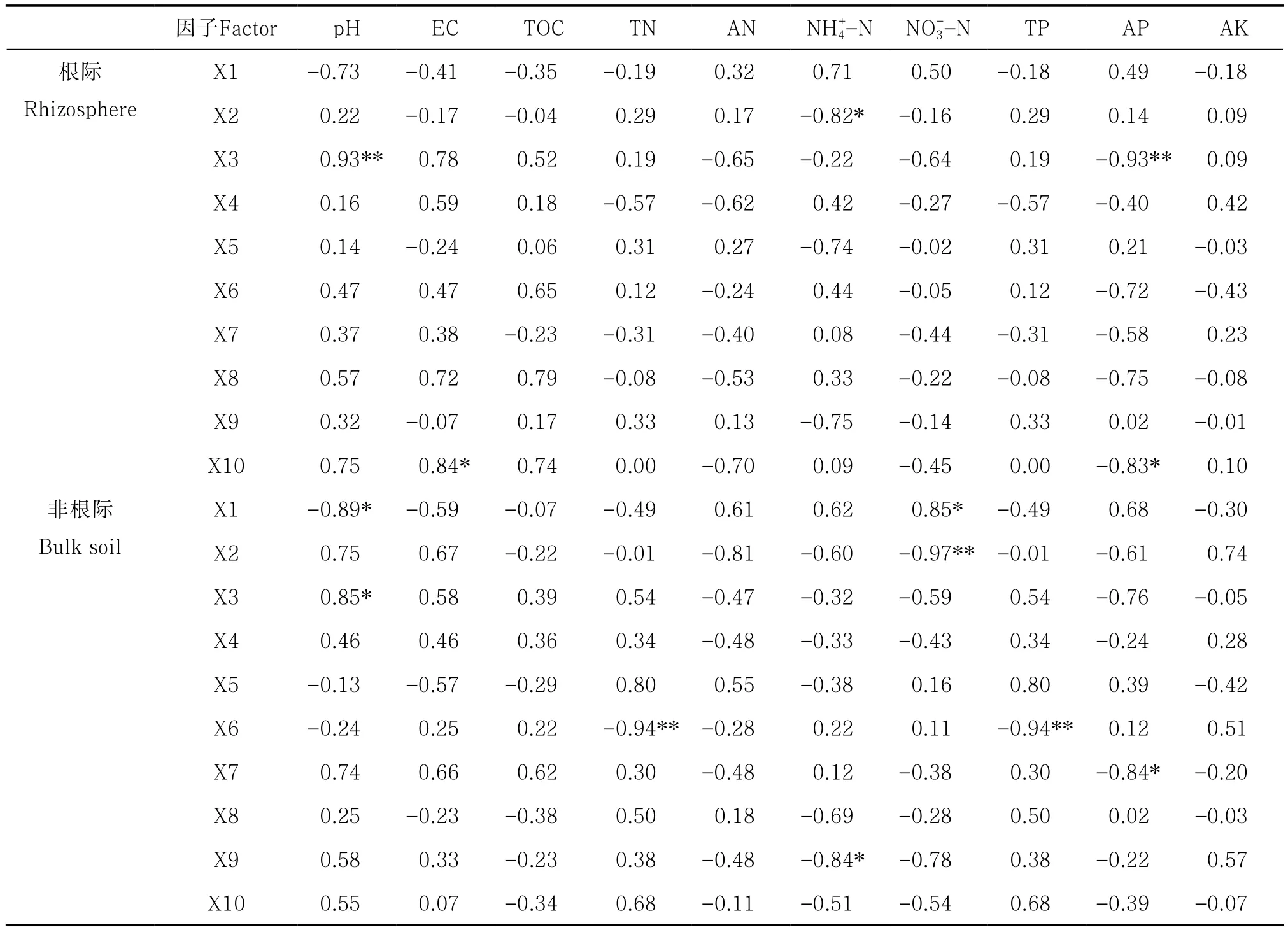
表4 土壤理化性质与枸杞根际/非根际优势细菌门丰度的相关系数Table 4 Pearson correlation coefficients of relative abundance of the dominant bacterial phyla in rhizosphere of Lycium barbarum L. and bulk soils with soil properties

表5 土壤理化性质对枸杞根际/非根际细菌群落结构变异的影响Table 5 Effects of soil properties on composition of the bacterial communities in the rhizosphere of Lycium barbarum L. and bulk soil
3 讨 论
枸杞园土壤环境是枸杞-土壤-土壤生物组成的特殊微环境。经过多年耕作,连年不断的施肥、翻耕及喷洒农药等高强度人工管理,以及枸杞根系分泌物、树叶凋落物和组织渗滤液年复一年输入土壤,必然深刻影响着枸杞园土壤的理化性质和微生物群落组成。探索枸杞园土壤微生物群落及其功能变化,对于揭示枸杞连作障碍机制具有重要研究意义。
3.1 连作对枸杞园土壤理化因子及土壤细菌群落的影响
研究表明,土壤类型[13-14]、土壤理化特征[15-16]、环境因子[11,16]及植物种类[17]均能在不同程度直接或间接地影响土壤微生物的群落结构。其中,土壤pH被认为是预测陆地土壤微生物群落演替规律的最佳因子之一[18],并显著影响土壤细菌的群落多样性[19]。本研究的样地位于银川市南梁农场,是典型的银北盐碱地区域之一[1]。由于土壤pH较高、土壤含盐量较大,种植枸杞是当地农户的主要经济来源。本文的研究结果表明,与对照样地相比,长期连作能够导致枸杞园土壤pH显著降低(表1),并影响枸杞园土壤细菌群落结构(表5)。相关性分析发现,枸杞非根际土壤中变形菌门和芽单胞菌门的相对丰度与土壤pH存在显著相关关系(表4)。其中,变形菌门在对照和连作样地枸杞非根际土壤中的相对丰度分别达48.2%和56.5%(表2),是丰度最高的优势细菌门。因此,pH对枸杞非根际土壤细菌群落的影响可能主要通过影响变形菌门而实现。
目前研究认为,土壤pH能够通过直接和/或间接因素影响土壤微生物群落结构。例如,pH可以直接影响土壤微生物生理代谢、改变微生物群落间竞争关系或抑制非适应性微生物生长等方式,改变土壤微生物群落结构[18]。此外,许多土壤特征(营养有效性、金属阳离子可溶性、有机碳特征、土壤盐分及含水量)与土壤pH直接或间接相关[20]。因此,土壤pH的变化不仅影响土壤微生物群落多样性和结构,而且对多种土壤生物学过程具有显著作用。对茶园土壤的研究发现茶园土壤的pH随植茶年龄增加逐渐降低,且土壤硝化速率与土壤pH显著负相关[21],表明土壤酸化影响了茶园土壤的氮素循环过程。通过对宁夏主要枸杞产区土壤养分的分析,刘云翔等[3]发现枸杞园土壤中速效氮以硝态氮为主,其含量随树龄增加而积累。本文的结果表明连作地土壤碱解氮含量较对照样地显著升高(p<0.05),且硝态氮含量也高于对照样地(表1,p>0.05)。相关性分析也表明土壤pH分别与碱解氮含量(R2=-0.82,p<0.05)及硝态氮含量(R2=-0.87,p<0.05)显著负相关,这些结果说明长期连作可能影响枸杞园土壤的硝化和反硝化过程。Yao等[21]的结果还表明,氨氧化古菌是茶园酸化土壤中硝化作用的主要驱动因子,但在枸杞连作条件下,土壤硝化和反硝化过程以及生物固氮等氮素循环过程如何变化仍需进一步研究。
db-RDA分析还发现土壤速效磷含量是影响枸杞非根际土壤细菌群落结构变化的另一个主要因素,这一结果与前期研究结论一致[1]。研究表明,土壤中的磷元素多以不溶或难溶的复杂化合物形式存在,仅20%能被植物利用,是限制植物生长的关键元素之一[22]。土壤解磷微生物,如假单胞菌属、芽孢杆菌属、曲霉属以及青霉属等,能够通过溶解或矿化过程释放土壤全磷中的有机磷和无机磷供植物吸收,同时增强土壤微生物的固氮效率,促进植物生长[22]。目前认为,土壤类型、气候和环境因子、植被类型以及连作等均能显著影响土壤解磷菌的种群丰度和群落结构[22]。近期,马雪松等[23]利用宏基因组测序技术分析了杨树连作对其根际/非根际土壤解磷菌群落的影响,表明土壤磷酸酶总丰度随连作时间的加长而逐渐降低,且土壤解磷菌的丰度变化与土壤pH呈显著正相关。这一结果可能与土壤pH对土壤磷形态转化及其有效性的影响有关[24]。当土壤pH升高时,土壤中磷的有效性下降,迫使植物-微生物间的互作关系改变,并通过增加土壤解磷菌丰度以提高磷的有效性。在连作条件下,枸杞园土壤pH的降低增加了土壤磷的有效性,因此表现为土壤有效磷含量与pH显著负相关(R2=-0.90,p<0.01)。此外,对解磷微生物的相对丰度分析发现,仅有假单胞菌属的相对丰度在连作和对照样地间发生显著变化,该属细菌在连作地再植枸杞根际中的相对丰度是对照样地的3.2倍(表3)。而我们前期的研究结果也发现土壤有效磷含量与酸杆菌门、厚壁菌门、变形菌门、芽单胞菌门、子囊菌门、担子菌门和结合菌门的相对丰度显著相关[1]。这些结果表明在长期种植过程中,枸杞园土壤生态系统中的磷素循环过程及相关微生物群落可能受到影响,并且这种作用可能与土壤pH的变化有关。然而,本研究所采用的扩增子测序技术仅能从细菌群落组成及相对丰度的角度分析连作对枸杞园土壤微生物群落结构的作用,对于连作条件下微生物群落功能的变化规律仍需要利用宏基因组、宏转录组及酶活分析等技术从不同角度进行解析和验证。
3.2 枸杞连作障碍与枸杞根际细菌群落
根际是植物根系和土壤生物之间形成的独特群落环境。在根际,植物通过根系分泌物和沉淀物调节和塑造根际微生物群落[25]。现已发现,根际微生物对植物生长和生存存在有益、中性或有害的生理效应。例如,益生菌能够提高植物抗性、固氮、解磷以及分泌生长素而促进植物生长,同时致病菌则可影响植物生长和发育[11]。因此,理解根际微生物群落的变化对于揭示土壤功能变化和植物-微生物互作机制至关重要。本研究结果发现,枸杞根际土壤细菌物种数量显著低于非根际土壤(图1),表明枸杞根与土壤微生物间的相互选择和作用。前人对枸杞根以及枸杞根皮层(地骨皮)有效成分的分析发现,枸杞根或地骨皮的主要成分为黄酮类物质、多肽类、有机酸(阿魏酸、香草酸)、地骨皮甲素/乙素、东茛菪内酯、甾醇、香豆素和挥发油等[26]。其中,地骨皮甲素/乙素、东茛菪内酯、香豆素、阿魏酸和香草酸等活性物质均具有一定的抗菌作用[26]。随着连作年限的增加,这些活性物质的不断输入和/或积累可能导致连作地再植枸杞根际土壤微生物物种数量和群落α多样性的下降(图1)。而db-RDA分析结果进一步证实,连作地对再植枸杞根际细菌群落的影响可能首先通过影响再植枸杞的生长和生理状况所实现。相对于对照样地而言,连作地的土壤环境不利于再植枸杞生长。胁迫条件促使再植枸杞根系分泌物组成和数量发生改变,进一步引发细菌群落结构变化和多样性降低(图1和图2),使枸杞根际土壤生态系统的稳定性下降。此外,由于土壤微生物群落遗传多样性与其功能多样性间存在显著相关关系[27],由连作导致的群落多样性和结构的变化必然引起群落功能改变,使枸杞-土壤-土壤微生物间形成负调控,诱发连作障碍。
对枸杞根际/非根际细菌群落丰度的对比分析表明,不同细菌间存在明显不同的根际效应。例如,变形菌门和蓝藻门更易聚集在枸杞根际,芽单胞菌门和绿弯菌门在非根际土壤的相对丰度更高,而放线菌门、拟杆菌门、酸杆菌门、疣微菌门及浮霉菌门则在根际和非根际土壤中无明显差别(表2)。在连作条件下,一些细菌在再植枸杞根际/非根际土壤中的分布规律也受到影响。例如疣微菌门和浮霉菌门的相对丰度在连作地再植枸杞根际较对照样地明显降低(表2)。在属水平,连作地再植枸杞根际的贪食菌属(Variovorax)、噬氢胞菌属(Hydrogenophaga)以及固氮螺旋菌属(Azospirillum)的相对丰度显著较对照升高,而叶瘤杆菌属(Phyllobacterium)、戴沃斯菌属(Devosia)等则显著降低(表4)。这些细菌中,贪食菌属具有固氮、解磷、抗逆等促生作用[28],噬氢胞菌属具有反硝化作用[29],固氮螺旋菌属[30]和叶瘤杆菌属[31]具有固氮和促生作用,戴沃斯菌属参与氮、磷循环等过程[32]。此外,前期对不同种植年限枸杞根际细菌和真菌群落的分析发现,种植年限与可能致病菌的相对丰度呈抛物线关系,即种植10年枸杞根际致病菌群落丰度最低,随后逐渐增加[1]。这些结果均说明连作能够干扰再植枸杞与土壤微生物间的互相作用、影响枸杞根际益生菌和致病菌群间的平衡关系。然而,虽然本文通过高通量测序技术分析了连作条件下枸杞园土壤细菌群落的相对丰度及其变化规律,但就这些细菌及其丰度变化所导致的生态系统功能改变仍需进一步研究。这些研究将为进一步改良枸杞种植技术和减缓枸杞连作障碍提供理论基础。
?
4 结 论
本文研究表明,连作显著抑制再植枸杞苗的生长,并导致土壤酸化和土壤碱解氮及有效磷的积累。测序结果表明,与对照样地相比,连作地再植枸杞根际细菌物种数显著降低、群落多样性指数下降、群落结构发生显著改变,而连作对枸杞非根际土壤细菌群落的影响相对较小。RDA分析表明,土壤pH和速效磷含量是影响枸杞非根际细菌群落结构变化的主要因素,分别解释了细菌群落结构变异的41.8%和35.4%(p<0.05),但土壤理化因子对枸杞根际细菌群落结构的变化无显著影响(p>0.05)。
[1] 纳小凡,郑国琦,彭励,等. 不同种植年限宁夏枸杞根际微生物多样性变化. 土壤学报,2016,53(1):241—252 NA X F,Zheng G Q,Peng L,et al. Microbial biodiversity in rhizosphere ofLycium bararumL. relative to cultivation history(In Chinese). Acta Pedologica Sinica,2016,53(1):241—252
[2] 王彩艳,李彩虹,王晓菁. 不同种植年限枸杞园土壤铜空间变异规律. 宁夏农林科技,2016,57(1):21—22 Wang C Y,Li C H,Wang X J. Spatial heterogeneity of soil copper in Chinese wolfberry fields with different planting duration(In Chinese). Ningxia Journal of Agricultural and Forest Science and Technology,2016,57(1):21—22
[3] 李云翔,王少东,柯英,等. 宁夏主要枸杞产区施肥现状与土壤养分特征. 干旱地区农业研究,2016,34(2):113—118 Li Y X,Wang S D,Ke Y,et al. Characteristics of soil nutrients and present situation of fertilization in the major wolfberry producing areas of Ningxia(In Chinese). Agricultural Research in the Arid Areas,2016,34(2):113—118
[4] 张俊华,郑国琦. 宁夏枸杞根际土壤线虫群落特征. 应用生态学报,2016,27(5):1647—1656 Zhang J H,Zheng G Q. Soil nematode community structure in the rhizosphere ofLycium barbarum(In Chinese). Chinese Journal of Applied Ecology,2016,27(5):1647—1656
[5] Huang L F, Song L X, Xia X J, et al. Plantsoil feedbacks and soil sickness:from mechanisms to application in agriculture. Journal of Chemical Ecology, 2013,39(2):232—242
[6] Artursson V,Finlay R D,Jansson J K. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth.Environmental Microbiology,2006,8(1):1—10
[7] de Vrieze J. The littlest farmhands. Science,2015,349(6249):680—683
[8] 谢文军,张衍鹏,张淼,等. 滨海盐渍化土壤理化性质与小麦生产间的关系. 土壤学报,2015,52(2):461—466 Xie W J,Zhang Y P,Zhang M,et al. Relationships between soil physicochemical properties and wheat production in coastal saline soil(In Chinese). Acta Pedologica Sinica,2015,52(2):461—466
[9] 王璐,仲启铖,陆颖,等. 群落配置对滨海围垦区土壤理化性质的影响. 土壤学报,2014,51(3):638—647 Wang L,Zhong Q,Lu Y,et al. Effects of configuration of plant community on physical and chemical properties of coastal polder soil(In Chinese). Acta Pedologica Sinica,2014,51(3):638—647
[10] 朱丹,韦泽秀,刘晓燕,等. 菌肥对青稞根际土壤理化性质以及微生物群落的影响. 土壤学报,2014,51(3):627—637 Zhu D,Wei Z X,Liu X Y,et al. Effects of bacterial manure on soil physicochemical properties and microbial community diversity in rhizosphere of highland barley(In Chinese). Acta Pedologica Sinica,2014,51(3):627—637
[11] Na X F,Xu T T,Li M,et al. Bacterial diversity in the rhizosphere of two phylogenetically closely related plant species across environmental gradients. Journal of Soils and Sediments,2017,17(1):122—132
[12] Caporaso J G,Kuczynski J,Stombaugh J,et al.QIIME allows analysis of high-throughput community sequencing data. Nature Methods,2010,7:335—336
[13] Guan X Y,Wang J F,Zhao H,et al. Soil bacterial communities shaped by geochemical factors and land use in a less-explored area,Tibetan Plateau. BMC Genomics,2013,14(1):820
[14] Sheng R,Meng D L,Wu M N,et al. Effect of agricultural land use change on community composition of bacteria and ammonia oxidizers. Journal of Soils and Sediments,2013,13(7):1246—1256
[15] Landa B B,Montes-Borrego M,Aranda S,et al. Soil factors involved in the diversity and structure of soil bacterial communities in commercial organic olive orchards in Southern Spain. Environmental Microbiology Reports,2014,6(2):196—207
[16] van Horn D J,van Horn M L,Barrett J E,et al.Factors controlling soil microbial biomass and bacterial diversity and community composition in a cold desert ecosystem:Role of Geographic Scale. PloS One,2013,8(6):e66103
[17] Marques J M,da Silva T F,Vollu R E,et al. Plant age and genotype affect the bacterial community composition in the tuber rhizosphere of field-grown sweet potato plants.FEMS Microbiology Ecology,2014,88:424—435
[18] L a u b e r C L,H a m a d y M,K n i g h t R,e t a l.Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology,2009,75(15):5111—5120
[19] Zhang X M,Liu W,Zhang G M,et al. Mechanisms of soil acidification reducing bacterial diversity. Soil Biology & Biochemistry,2015,81:275—281
[20] Brady N C,Weil R R. The nature and properties of soil.New Jersey:Prentice Hall,2007
[21] Yao H,Gao Y,Nicol G W,et al. Links between ammonia oxidizer community structure,abundance,and nitrification potential in acidic soils. Applied and Environmental Microbiology,2011,77(13):4618—4625
[22] Vassileva M,Serrano M,Bravo V,et al. Multifunctional properties of phosphate-solubilizing microorganisms grown on agro-industrial wastes in fermentation and soil conditions. Applied Microbiology and Biotechnology,2010,85(5):1287—1299
[23] 马雪松,王文波,王延平,等. 杨树人工林连作与轮作对土壤解磷微生物类群的影响. 应用生态学报,2016,27(6):1877—1885 Ma X S,Wang W B,Wang Y P,et al. Characteristics of phosphate-solubilizing microbial community in the soil of poplar plantations under successive-planting and rotation(In Chinese). Chinese Journal of Applied Ecology,2016,27(6):1877—1885
[24] 刘世亮,介晓磊,李有田,等. 土壤-植物根际磷的生物有效性研究进展. 土壤与环境,2002,11(2):178—182 Liu S L,Jie X L,Li Y T,et al. Advance of study on phosphorus bioavailability in the soil-plant rhizosphere(In Chinese). Soil and Environmental Sciences,2002,11(2):178—182
[25] Bais H P,Weir T L,Perry L G,et al. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology,2006,57(1):233—266
[26] 赵晓玲,张鑫瑶,何春年,等. 不同来源地骨皮药材中地骨皮甲素和乙素及阿魏酸的含量测定分析. 中国药业,2014,23(12):58—61 Zhao X L,Zhang X Y,He C N,et al. Analysis on content determination of kukoamine A/B and ferulic acid in different sources of Cortex Lycii(In Chinese).China Pharmaceuticals,2014,23(12):58—61
[27] Fierer N,Leff J W,Adams B J,et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes. Proceedings of the National Academy of Sciences,2012,109(52):21390—21395
[28] Han J I,Choi H K,Lee S W,et al. Complete genome sequence of the metabolically versatile plant growthpromoting endophyteVariovorax paradoxusS110. Journal of Bacteriology,2011,193(5):1183—1190
[29] Khanitchaidecha W,Kazama F. Hydrogenotrophic denitrification in an attached growth reactor under various operating conditions. Water Science and Technology Water Supply,2012,12:72—80
[30] Amavizca E,Bashan Y,Ryu C M,et al. Enhanced performance of the microalgaChlorella sorokinianaremotely induced by the plant growth-promoting bacteriaAzospirillum brasilenseandBacillus pumilus. Scientific Reports,2017,DOI:10.1038/srep41310
[31] Bouchiba Z,Boukhatem Z F,Ighilhariz Z,et al.Diversity of nodular bacteria ofScorpiurus muricatusin western Algeria and their impact on plant growth.Canadian Journal of Microbiology,2017,63(5):450—463
[32] Agnieszka W,Agnieszka K,Urszula Z,et al.Metagenomic analysis of some potential nitrogen-fixing bacteria in arable soils at different formation processes.Microbial Ecology,2016,73(1):162—176
Effects of Monocropping on Diversity and Structure of the Bacterial Community in Rhizosphere of ReplantedLycium barbarumL.
NA Xiaofan1ZHENG Guoqi1XING Zhengcao1MA Jinping3LI Zhanhui1LU Junhui1MA Fei2†
(1School of Life Science,Ningxia University,Yinchuan750021,China)
(2Institute of Environmental Engineer,Ningxia University,Yinchuan750021,China)
(3Institute of Wolfberry of Agro-forestry Science,Ningxia Academy of Agriculture and Forestry Science,Yinchuan750013,China)
【Objective】 Owing to the limitation of soil resources in the traditional wolfberry(Lycium barbarumL.)production regions,monocropping of the plants has become one of the major factors affecting sustainable development of the industry of wolfberry production and causing serious economic loss every year in Ningxia. It is,therefore,of great theoretic significance to sustainable development of the industry to explore effects of monocropping of the plants on evolution of the soil microbial community in the soil ecosystem.A wolfberry plantation,the Nanliang Farm in Yingchuan of Ningxia was selected as the subject for the study.The Illumina MiSeq sequencing technique was used to analyze the effects.【Method】 Soil samples were collected form rhizosphere and bulk soils of the monocropping wolfberry fields and control(non-monocropping field)for analysis of diversity and structure of the soil microbial communities,and plant samples were,too,for characterization of plant growth. Total genomic DNA was isolated form the rhizosphere and bulk soils using a Power Soil DNA Isolation Kit. Then V4 sections of 16S rDNA were sequenced with the aid of the Illumina MiSeq system and soil microbial communities in the rhizosphere and bulk soils were analyzed for diversity and structure with QIIME.【Result】It was found that soil available nitrogen and phosphorus were significantly higher in the monocropping field than in the control,while soil pH and electric conductivity exhibited a reverse trend;that monocropping significantly inhibited growth of the replanted wolfberry.The barcoded pyrosequencing data revealed that in the monocropping field,the number of soil bacterial species in the rhizosphere significantly decreased(p<0.05)and the soil bacterial community structure substantially altered as compared with the control. However,no much difference in bacterial community diversity and structure was observed in bulk soil between the two fields. Proteobacteria,Actinobacteria,Gemmatimonadetes,Bacteroidetes,Acidobacteria,Cyanobacteria,Firmicutes,Verrucomicrobia,Chloroflexi and Planctomycetes were the most dominant bacterial phyla in all the soil samples,accounting for 93.8%~96.1% of the total taxon tags. Planctomycetes in rhizosphere significantly decreased in relative abundance in the monocropping field as compared with the control(p< 0.05). The analysis at the genera level also shows that 40 of the total 579 genera of soil bacteria obviously varied in relative abundance between the two treatments(p< 0.05). Pearson’s correlation coefficients analysis also shows that in the bulk soils significantly positive relationships were found between soil pH and Gemmatimonadetes and between nitrate nitrogen content and Proteobacteria,whereas highly negative ones were between Proteobacteria and pH,between Cyanobacteria and total nitrogen content,between Chloroflexi and ammonium nitrogen content,between Actinobacteria and nitrate nitrogen content,between Cyanobacteria and total phosphorus content,and between Firmicutes and available phosphorus content,while in the rhizosphere,positive ones were found between soil pH and Gemmatimonadetes,and between electric conductivity and Planctomycetes,whereas negative ones were between ammonium nitrogen content and Actinobacteria,between available phosphorus content and Gemmatimonadetes,and between available phosphorus content and Planctomycetes.Furthermore,distance based redundancy analysis(db-RDA)indicates that soil pH and available phosphorus content were the major factors affecting structure of soil bacterial community in the bulk soil,explained 41.8% and 35.4% of variances(p<0.05),respectively,whereas none of the soil properties was found responsible for the changes in the soil bacterial community structure in the rhizosphere.【Conclusion】 All the findings in this experiment demonstrate that monocropping ofLycium barbarumL. has caused serious soil problems,which in turn affect activity and composition of the soil bacterial community in the rhizosphere of the replantedLycium barbarumL.
Lycium barbarumL.;Monocropping;Rhizosphere;Bacterial community;16S rRNA
S154.36
A
10.11766/trxb201702070036
* 国家自然科学基金项目(31560345,31660188)资助 Supported by the National Natural Science Foundation of China(Nos.31560345,31660188)
† 通讯作者 Corresponding author,E-mail: mafei05@163.com
纳小凡(1983—),男,宁夏人,博士,副教授,主要从事植物生理、植物根土互作及植物营养学。E-mail:nxf-0324@163.com
2017-02-07;
2017-04-24;优先数字出版日期(www.cnki.net):2017-06-19
(责任编辑:卢 萍)

