施氮对镉胁迫下杂交相思树生长及镉吸收分配的影响
谭长强,何琴飞,秦玉燕,申文辉*,刘 秀,曹艳云
(1 广西林业科学研究院,广西南宁 530002;2 广西优良用材林资源培育重点实验室,广西南宁 530002;3 广西壮族自治区亚热带作物研究所,广西南宁 530002)
施氮对镉胁迫下杂交相思树生长及镉吸收分配的影响
谭长强1,2,何琴飞1,2,秦玉燕3,申文辉1,2*,刘 秀1,2,曹艳云1,2
(1 广西林业科学研究院,广西南宁 530002;2 广西优良用材林资源培育重点实验室,广西南宁 530002;3 广西壮族自治区亚热带作物研究所,广西南宁 530002)
【目的】研究不同水平氮的供应对木本固氮植物杂交相思树适应镉环境胁迫及其生物修复能力的影响,可为有目的地进行相思树栽培提供施肥依据。【方法】以杂交相思树 (Acacia mangium×Acacia auriculiformis) 为试材进行了盆栽试验。Cd2+设3个水平(0、30、60 mg/kg),在Cd2+30 mg/kg的基础上设施尿素2个水平(0.4、0.8 g/kg) ,共5个处理。研究了杂交相思幼苗的干物质、氮(N)、磷(P)、钾(K)、镉(Cd)的积累和分配规律。【结果】Cd2+胁迫显著抑制了杂交相思幼苗根、茎、叶和总干物质的积累,限制了N、P、K等元素的吸收和积累;杂交相思Cd转移系数为0.044~0.224,根Cd含量明显高于茎和叶,并且根部Cd累积能力要大于地上部;但Cd2+60 mg/kg胁迫下,杂交相思通过向地上部分转移Cd以更好地适应强胁迫环境。Cd2+30 mg/kg胁迫下,高氮 (0.8 g/kg) 较低氮 (0.4 g/kg) 更显著地促进了茎、叶和植株总的P、K积累,而低氮更有效地增加了根的N、P、K积累量;高氮较低氮更显著地提高了茎、叶干重以及干物质在茎叶中的分配比例,低氮则提高了根干重以及干物质在根中的分配比例和根冠比;Cd2+胁迫下施氮显著促进了杂交相思对Cd的吸收和积累,提高了Cd转移系数;低氮更显著地促进了根、叶和总Cd的积累,高氮更显著地促进了茎Cd的积累及Cd在茎、叶中的分配比例。【结论】Cd2+胁迫下杂交相思通过改变干物质及N、P、K、Cd积累和分配规律以及提高N、P和K利用率的方式,保证根系生长,以更好地适应胁迫环境。低Cd2+胁迫下 (30 mg/kg),施氮可缓解杂交相思由镉胁迫所引起的对N、K吸收的抑制,促进杂交相思各器官干物质以及N、P、K、Cd的积累。低施氮量 (尿素 0.4 g/kg) 促进相思树生长的效果更佳,高施氮量 (尿素 0.8 g/kg) 促进Cd向地上部的运转,提高其对Cd生物修复能力。
镉胁迫;氮肥;杂交相思;干物质;养分利用
镉(Cd)对植物的危害严重,被视为最具危害性的重金属污染元素之一[1]。一定量镉胁迫即会影响植物正常生理以及对矿质营养的吸收、转运与分配[2],抑制植物生长和光合作用[3],改变生物量分配格局[4],但影响程度与镉处理的时间和浓度以及作物种类、生育时期相关。近年来,国内外对如何解除或缓解重金属胁迫越来越重视。氮肥是农业生产中最为常用的肥料,也是植物生长发育中重要的营养元素,施氮有利于植物对镉胁迫环境的适应[5–6]。
木本植物,特别是一些生长迅速、生物量大的植物,已经显示出用于土壤修复的价值[7–8]。菌根能够促进植物对氮、磷、钾以及其他营养物质和水分的吸收,从而增强植物抵抗环境压力的能力[9–10]。因此,利用木本植物内生真菌与宿主植物的协同作用提高修复效率是一种极具潜力的修复方案。相思类树种系含羞草科金合欢属 (Acacia),适应力强,耐贫瘠,是不可多得的具有根瘤固氮菌和兼具改良土壤的树种。主要分布在热带、亚热带干旱、半干旱地区,我国引种种植主要在广东、广西、福建、云南、海南、浙江、台湾等地。杂交相思 (Acacia mangium×Acacia auriculiformis) 为马占相思与大叶相思的杂交种,树干通直,适应能力强,是良好的短周期工业造纸、家居装饰好材料,又是城市绿化、营造高效生态林优良树种[11]。因此,研究其对镉胁迫环境的适应性及施氮对该树种的解毒机制,将为土壤环境镉污染的治理提供更好的途径和方案。
1 材料与方法
1.1 试验地概况
本试验在广西林业科学研究院苗圃进行,该地属湿润的亚热带季风气候,全年降水天数在160 d左右,具有明显的干湿季节,年平均降雨量1650 mm,主要集中在5~9 月份。供试土壤为红壤,土壤pH值为4.73,有机质、全氮、水解氮、全磷、有效磷、全钾、速效钾、全镉含量分别为17.31 g/kg、0.542 g/kg、66.73 mg/kg、0.344 g/kg、1.26 mg/kg、7.08 g/kg、98.14 mg/kg、0.245 mg/kg。
1.2 试验设计
试验杂交相思苗木为6月龄生扦插营养袋苗,采用直径为28 cm、高28 cm的塑料盆,每盆装10 kg土,根据广西土壤镉污染情况[12],设置5个处理,其中,3个Cd2+水平分别为0、30、60 mg/kg,记为CK、Cd1、Cd2;在Cd1基础上设2个尿素施用水平分别为0.4 g/kg (N1) 和0.8 g/kg (N2)。每处理重复20次。土壤经风干、粉碎、过筛备用。Cd2+以CdCl2·2.5H2O (分析纯) 水溶液的形式一次性加入土壤,并与其混合均匀在遮雨棚下均衡一周。于2016年2月20日取预先培养好的健壮植株 (生物量大致一致,苗高、地径分别约为45.6 cm、3.25 mm),每盆栽植一株,试验期间保持土壤湿润,并在盆下放置塑料托盘,浇水后,将盘内渗出水分倒回至盆中,以免镉流失。按照常规方法进行松土、除草等。
1.3 测定方法
培养90天后,于5月20日每处理取3株,根、茎、叶分别烘干称重,并分别粉碎装自封袋,待测氮、磷、钾。全氮采用凯氏定氮法,全磷采用钒钼黄比色法,全钾采用火焰光度法测定[13]。植物体内镉含量的测定参照文献[14]。
1.4 数据分析
根据试验始末杂交相思各器官生物量计算不同浓度镉、氮处理下植株生物量;根据试验期间各器官生物量与氮、磷、钾和Cd含量,计算各元素积累与分配特征,以及N/P、P/K和总的氮、磷、钾利用效率。
N/P = 氮积累量/磷积累量;
P/K = 磷积累量/钾积累量;
氮 (磷、钾) 利用效率 = 植株生物量/氮 (磷、钾)总累积量。
Cd转移系数 (TF) 主要用来评价从植物根部转移重金属至地上部分的能力[7]。计算公式:
TF = 地上部分 (茎叶) 平均Cd含量/根部Cd含量。
生物富集系数 (BCF) 用于评价植物从土壤中积累重金属的能力[7]。计算公式:
BCF = 根或地上部分 (茎叶) 平均Cd含量/土壤Cd含量。
数据运用Excel 2003及DPS 7.0软件进行处理与分析,多重比较采用Duncan新复极差法,运用Origin软件进行制图。
2 结果与分析
2.1 施氮对镉胁迫下杂交相思干物质积累与分配的影响
由表1可知,镉胁迫显著抑制杂交相思苗木根、茎、叶干物质积累。与CK相比,Cd1处理根、茎、叶及植株总的干重分别下降了56.6%、65.7%、62.0%和62.3%,Cd2处理分别下降了61.7%、68.4%、71.6%和69.2%。与CK相比,Cd1处理根和地上部分分配比例分别增加和下降了2.2个百分点,Cd2处理则为3.6个百分点;与CK相比,Cd1处理根冠比增加了3.1个百分点,Cd2处理则增加了5.2个百分点,说明镉胁迫对杂交相思地上部干物质的影响较大。
从表1可以看出,在30 mg/kg镉处理 (Cd1)下,施氮均显著促进了杂交相思根、茎、叶干物质的积累,并且Cd1N1与Cd1N2处理之间也达到了显著差异水平,其中根干物质积累量Cd1N1处理高于Cd1N2处理,与Cd1处理相比,Cd1N1处理增加了86.1%,Cd1N2处理只增加了33.0%;茎、叶及总干物质积累量则是Cd1N2处理高于Cd1N1处理,与Cd1处理相比,Cd1N2处理分别显著增加了109.6%、74.2%和76.2%,Cd1N1处理分别只增加了50.8%、51.7%和57.3%。Cd1N1处理相对Cd1处理提高了根系干物质的比例和根冠比,降低了茎、叶干物重比例,此时根干重占比和根冠比分别增加3.1和4.6个百分点;Cd1N2处理相对Cd1处理降低了根的比例和根冠比,提高了地上部分的占比,此时根占比和根冠比分别比Cd1处理降低了4.1和5.7个百分点。说明施氮有利于镉胁迫下杂交相思根、茎、叶及总干物质的积累,而低氮更有利于根干物质的积累。
2.2 施氮对镉胁迫下杂交相思氮、磷、钾积累与分配的影响
由表2可知,镉胁迫显著降低了杂交相思根、茎、叶和植株总的氮、磷、钾积累量。土壤添加镉浓度30 mg/kg时,与CK相比,根、茎、叶和植株总的氮积累量分别下降了58.6%、70.3%、67.0%和66.5%,根、茎、叶和植株总的磷积累量分别下降了60.6%、86.3%、62.3%和71.7%,根、茎、叶和植株总的钾积累量分别下降了70.9%、82.3%、76.4%和77.9%。当土壤添加镉浓度60 mg/kg时,与CK相比,根、茎、叶和植株总的氮积累量分别下降了64.4%、69.5%、156.8%和74.8%,根、茎、叶和植株总的磷积累量分别下降了69.6%、86.2%、72.2%和77.5%,根、茎、叶和植株总的钾积累量分别下降了79.1%、88.9%、84.3%和85.4%。镉胁迫增加了氮、磷、钾在根中的分配比例,降低了氮、磷、钾在地上部分的分配比例,当土壤镉浓度达到30 mg/kg时,分别比CK显著增加或降低2.9、5.1和2.6个百分点,当土壤镉浓度达到60 mg/kg时,分别比CK显著增加或降低4.9、4.5和3.5个百分点。
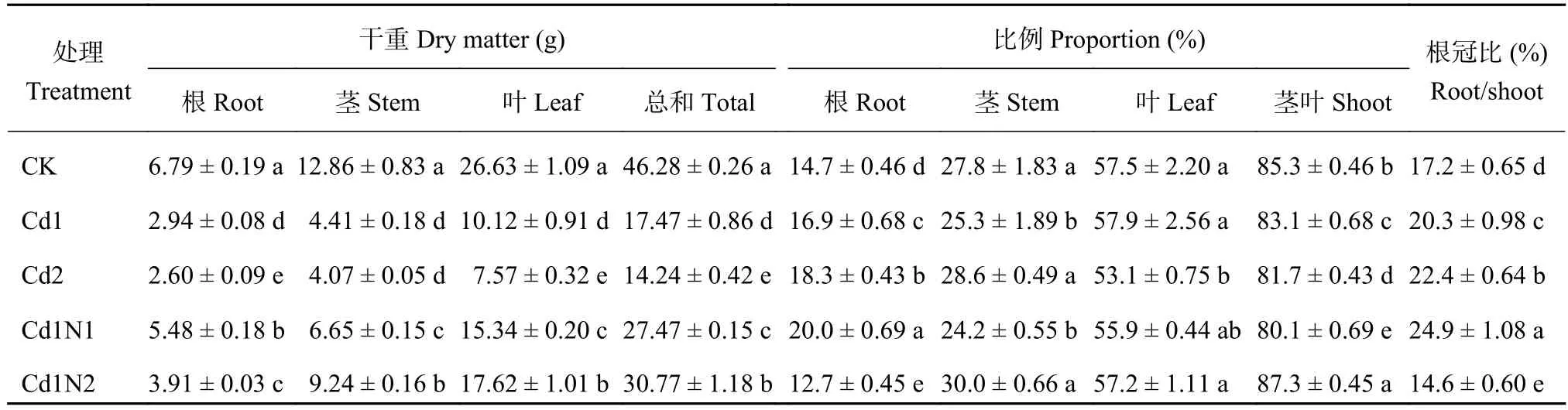
表1 不同镉、氮处理杂交相思树干物积累量及其在根茎叶中的分配Table 1 Dry matter accumulation and proportion of different parts of Acacia mangium × Acacia auriculiformis influenced by N apptication under Cd stress
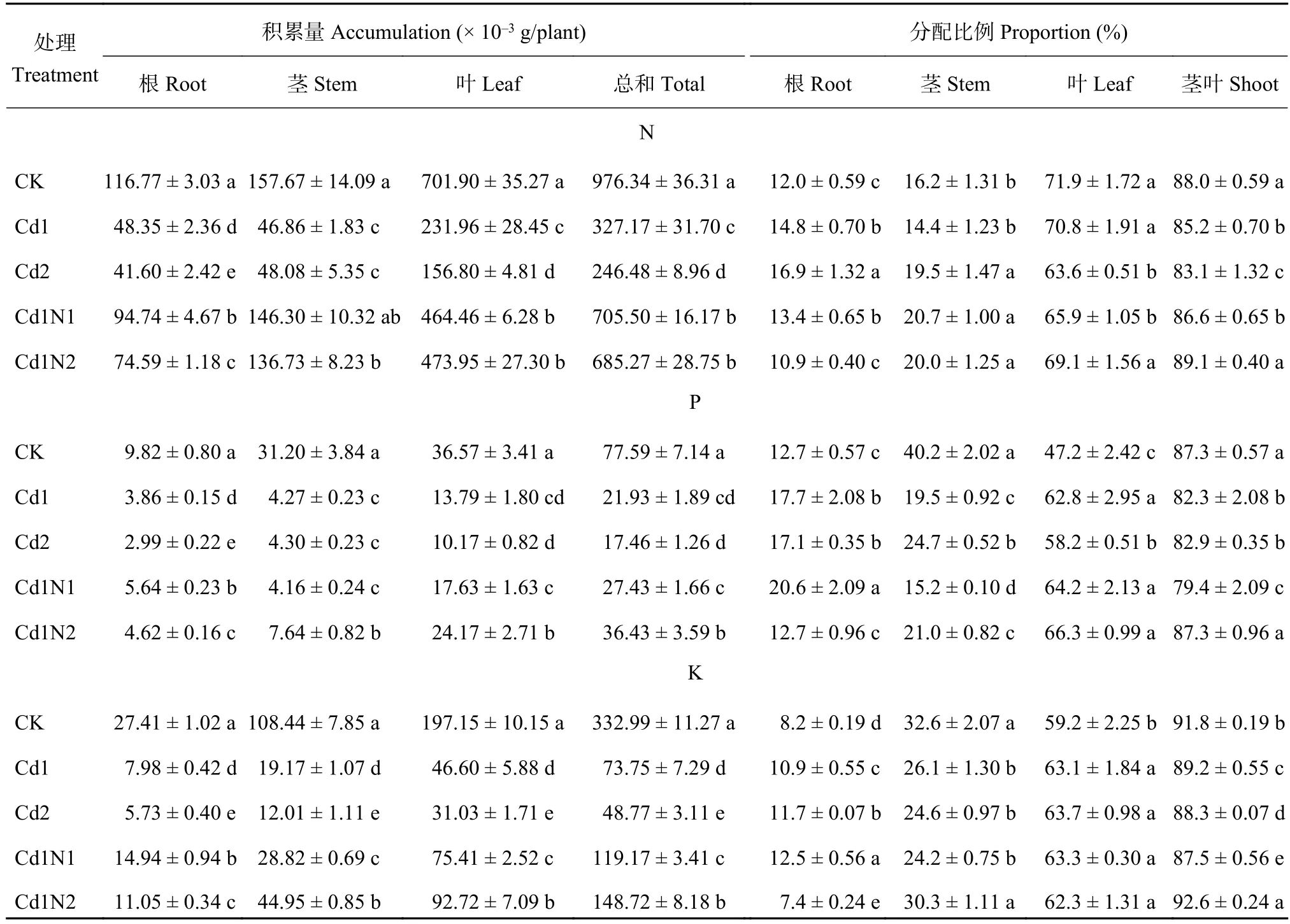
表2 施氮对镉胁迫下杂交相思 氮、磷、钾含量、积累量及分配的影响Table 2 Influence of N application on the N, P and K contents, accumulation and distribution of Acacia mangium × Acacia auriculiformis under Cd stress
在镉30 mg/kg处理 (Cd1) 下,施氮均显著促进了杂交相思根、茎、叶及植株总的氮、磷、钾的积累。Cd1N1处理比Cd1N2处理更有利于根中氮、磷、钾的积累,与Cd1处理相比,Cd1N1处理分别提高95.9%、45.9%和87.3%,而Cd1N2处理分别仅提高54.3%、19.5%和38.5%。Cd1N2处理比Cd1N1处理更有利于茎、叶和总磷、钾的积累。与Cd1处理相比,Cd1N2处理茎、叶和植株总的磷积累量以及茎、叶和植株总的钾积累量分别增加78.8%、75.3%、66.1%和134.5%、98.9%、101.6%;Cd1N1处理分别增加了–2.5%、27.8%、25.1%和50.4%、61.8%、61.6%。Cd1N2处理与Cd1N1处理之间除叶的氮积累量无显著差异外,其他各器官氮、磷、钾积累量均达到了显著差异水平。这表明低氮较高氮能更好地促进氮的吸收和积累,而高氮较低氮显著促进了磷、钾的吸收及由根向地上部的转移。
2.3 施氮对镉胁迫下杂交相思化学计量比及养分利用效率的影响
由图1和表3 可知,镉胁迫显著影响了杂交相思根、茎、叶的N/P值、P/K值、氮利用率 (NUEN)、磷利用率 (NUEP) 和钾利用率 (NUEK)。随镉胁迫浓度增加根和茎的N/P值、根和叶的P/K值以及NUEN、NUEP、NUEK均表现了不断上升趋势,叶的N/P值则表现了不断下降趋势。在30 mg/kg镉处理下,施氮显著提高了杂交相思根、茎、叶和植株总的N/P值,显著降低了根、茎、叶及植株总的P/K值;Cd1N1处理更显著地提高了杂交相思根、茎、叶和植株总的N/P值,降低了根、茎、叶及植株总的P/K,并且其茎、叶的N/P、P/K值与Cd1N2处理之间均达到了显著差异水平。施氮还在一定层度上降低了NUEN、NUEK,提高了 NUEP。
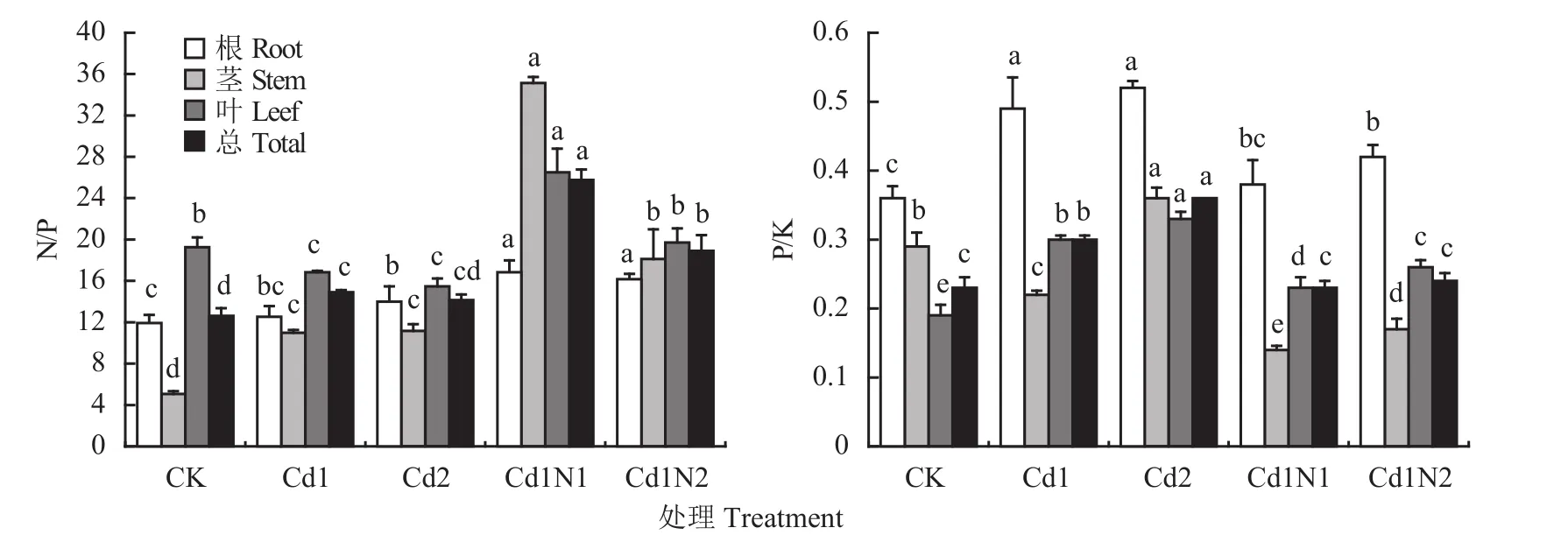
图1 施氮对镉胁迫对杂交相思N/P和P/K的影响Fig. 1 Influence of N application on the N/P and P/K ratios of Acacia mangium × Acacia auriculiformis under Cd stress
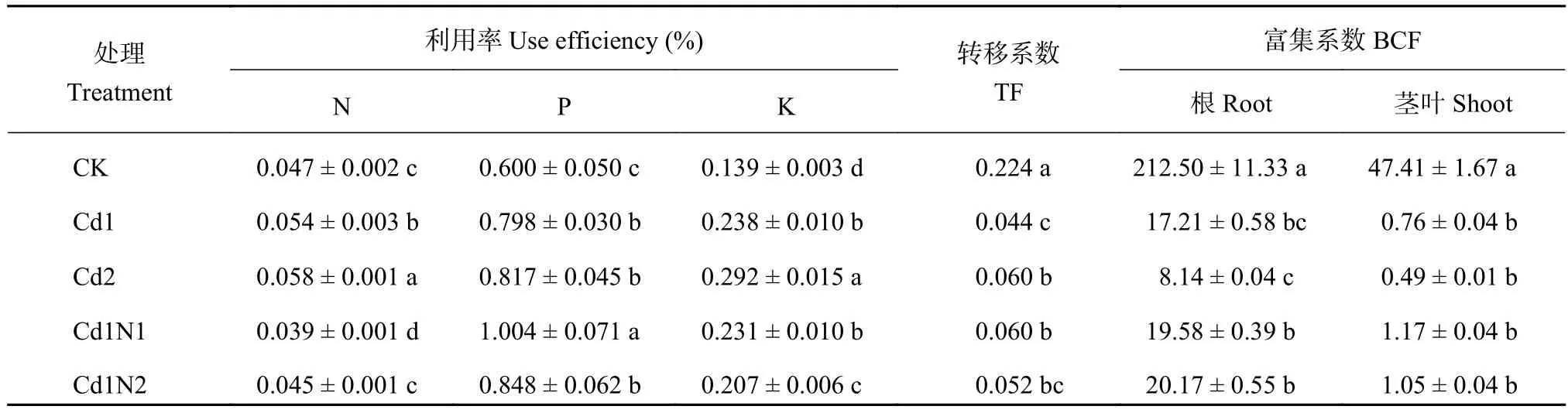
表3 施氮对镉胁迫下对杂交相思氮、磷、钾利用率及Cd转移系数和富集系数的影响Table 3 Influence of N application on the N, P and K use efficiencies, and Cd TF and BCF of Acacia mangium × Acacia auriculiformis under Cd stress
2.4 施氮对镉胁迫下杂交相思Cd含量、积累与分配的影响
由表4可知,不同镉胁迫水平下,杂交相思茎、叶Cd含量变化不大;Cd1处理根部Cd含量最高,与Cd2处理和CK的差异均达到了显著水平。Cd2处理的根、茎和叶Cd含量分别比CK增加838.6%、120.4%和273.1%。杂交相思根和植株总的Cd积累量在Cd1处理时达到最高,分别比CK增加329.6%和149.8%,并且与CK达到显著差异水平。叶Cd积累量Cd2处理与CK相当,无显著差异。镉胁迫显著增加了Cd在杂交相思根中的分配比例,降低了Cd在茎叶中的分配比例。
30 mg/kg镉处理下,施氮均显著提高了杂交相思根、茎的Cd含量以及根、茎和植株总的Cd积累量。高氮比低氮更明显地促进了根Cd含量及茎的Cd积累量。与Cd1处理相比,Cd1N2处理分别显著增加了17.2%和236.5%,而Cd1N1处理也分别显著增加13.7%和154.3%;低氮比高氮更明显地增加了茎、叶Cd含量以及根、叶和植株总的Cd积累量,与Cd1处理相比,Cd1N1处理分别显著增加了68.9%、15.9%、111.8%、75.4%和112.7%,而Cd1N2处理也分别显著增加了60.8%、–16.6%、55.9%、45.0%和69.7%。其中叶的Cd含量以及根、叶和植株总的Cd积累量Cd1N2处理与Cd1N1处理之间达到了显著差异水平。同时,施氮均降低了Cd在根中的分配比例,显著增加了Cd在茎中的分配比例。而高氮比低氮更好地提高了Cd在茎中的分配比例,更好地降低了Cd在根中的分配比例。
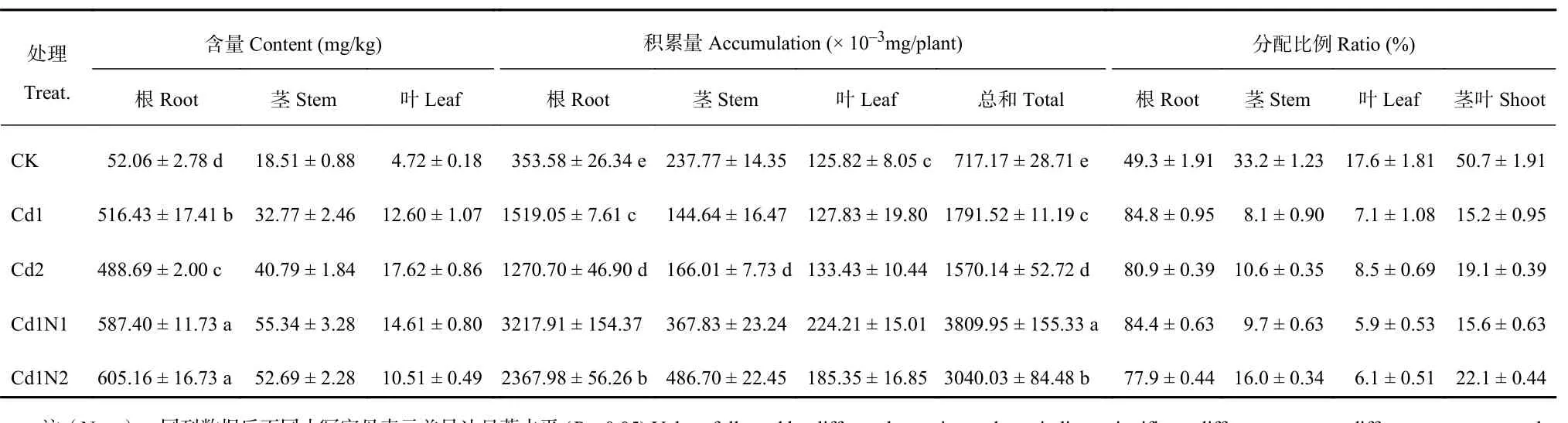
表4 施氮对镉胁迫下杂交相思Cd含量、积累量及分配的影响Table 4 Influence of N application on the Cd contents, accumulation and distribution of Acacia mangium × Acacia auriculiformis under Cd stress
2.5 施氮对镉胁迫下杂交相思Cd转移系数 (TF)和生物富集系数 (BCF) 的影响
由表3可知,镉胁迫均显著降低了杂交相思Cd转移系数 (TF) 和根、茎叶生物富集系数 (BCF),并且根BCF、茎叶BCF呈现不断降低趋势。30 mg/kg镉胁迫处理下,施氮均提高了杂交相思TF和根、茎叶BCF,但TF除Cd1N1与Cd1之间达到显著差异外,其他处理与Cd1之间并无显著差异。
3 讨论
3.1 镉胁迫影响杂交相思树的生长和氮磷钾养分吸收
植物在受到镉污染之后,首先反映在生长量的变化[15],即根、茎、叶等正常生长发育都会受到影响。本研究表明,镉胁迫显著抑制了杂交相思根、茎、叶和总干物质的积累,并且随着镉胁迫浓度的增加,这种抑制作用不断增强。这与前人研究结果,植物在一定程度的镉胁迫下均表现出生长受阻的现象相一致[7,16]。
镉的存在常常改变土壤的生态过程,影响土壤养分的有效性和植物对土壤养分的吸收利用,进而形成Cd与养分同时限制植物生长的恶性循环,而植物可通过改变资源分配与利用方式等以应对环境的变化[4,17]。本试验结果表明,镉胁迫促进了干物质向杂交相思根的积累,提高了其根冠比。说明在一定程度范围内的镉胁迫下,杂交相思可通过保证根系生长的方式,更好地适应镉胁迫环境。这与吴福忠等[4]研究的关于桂花在镉胁迫条件下增加地下部分生物量比例以及根茎比,可以更好地获取有限的土壤资源,以维持更好的生长相吻合。而与郭智等[18]关于超富集植物龙葵 (Solauum uigrum) 冠/根 (T/R) 比的结论相悖,该研究认为,镉胁迫使根系发育受到的抑制程度高于地上部,而使T/R比有所增高,而这样更有利于植物进行光合作用,促进植物干物质的积累。以上研究结果的不同,可能与植物种类对镉胁迫环境的响应机制的不同有关。
植物的N/P和P/K是确定植物受限元素的重要指标,是环境和植物共同作用的结果,决定了植物的生长策略和适应特征[19]。植物叶片保持稳定的N/P是正常生长发育的基础,当植物组织N/P小于14时,植物生长受氮限制;大于16时,受磷限制;而当在14~16之间时,受氮和磷的共同限制[20]。大量研究表明,植物在逆境胁迫下会通过提高利用效率的形式来适应胁迫环境[17,21]。本研究表明,杂交相思除了叶外,根和茎的N/P均低于14,而值得注意的是叶的N/P在镉60 mg/kg处理也低于镉30 mg/kg处理,而根和叶的P/K值不断上升。同时,镉胁迫显著影响了杂交相思各器官的氮利用率(NUEN)、磷利用率 (NUEP) 和钾利用率 (NUEK)。因此,可以推断镉胁迫下,杂交相思对氮、磷、钾的吸收受到不同程度的限制,促使其通过提高NUEN、NUEP和NUEK的形式来适应镉胁迫环境。
植物根系对Cd有显著的截留作用,起到解毒害的作用,这已为众多的研究所证实[22–23]。本研究也证实了杂交相思根Cd含量明显高于茎和叶。高镉 (60 mg/kg) 胁迫下杂交相思根Cd含量以及积累量均明显比低镉 (30 mg/kg) 胁迫下要低,并且高镉胁迫促使Cd在茎叶中的分配比例增加,而降低在根中的分配比例。说明高镉胁迫下,杂交相思通过向地上部分转移Cd来适应强胁迫环境。这印证了前人研究结果,植物对重金属的另一种耐受机制是将重金属运输到地上部[24]。而重金属转移系数 (TF) 是地上部重金属含量与根部重金属含量之比,可用来表征植株向地上部运转重金属的能力,其值越大,表示重金属在植物中的迁移能力越强[14]。本研究得出杂交相思TF在0.044~0.224之间,镉胁迫明显降低了TF值。这比顾翠花等[7]研究的4个树种山矾、山茶、绣线菊、桑树的TF (0.35~0.75之间) 均要低,说明Cd在杂交相思体内的迁移能力较低。而木本植物对重金属吸收富集能力的种间差异可能与树种本身的解剖构造相关。据测定,同是速生树种,散孔材树木的富集量比环孔材的树木要大得多。其次,也与树木生长速度、生理上代谢强度的大小有关[25]。植物对重金属的积累是植物体内吸收与分配的结果,通常用富集系数 (BCF) 来说明植物对Cd的吸收、累积能力[14]。本研究得出,杂交相思根及地上部分BCF随着镉胁迫浓度的增加而下降,但根BCF均高于地上部分,这也说明了杂交相思根部Cd累积能力大于地上部。
3.2 镉胁迫下施氮对杂交相思的影响
胁迫条件下,人为补充氮素不仅可促进植物的生长,同时将会改变植物对矿质元素的吸收和利用[8]。张帆等[26]指出在高浓度镉胁迫下,叶绿素生物合成受阻,受阻位点可能位于UrogenIII到CoprogenIII之间,而施氮可缓解Cd对杨树叶绿素合成的抑制。同时,氮有助于叶绿素含量的平衡,促进镉胁迫下类囊体膜蛋白复合体的组装和稳定,增强水的光解和电子传递的速率[27–28]。曹莹等[6]研究也得出了类似的结论:镉胁迫下,小麦施用铵态氮可提高叶片气孔导度 (Gs)、胞间二氧化碳含量 (Ci) 、蒸腾速率(Tr)、净光合速率 (Pn)、叶绿素含量、Hill反应活力和叶绿体Ca2+/Mg2+-ATPase活性。杨容孑等[29]研究表明,镉胁迫下不同形态氮均能在一定程度上提高硝酸还原酶 (NR) 和谷氨酰胺合成酶 (GS) 活性。这些研究均表明,镉胁迫下施氮可促进植物的碳同化能力和新陈代谢速率,缓解镉胁迫对其生长的抑制,从而提高植物对物质积累的能力。本研究表明,30 mg/kg镉胁迫下,施氮均在一定程度上促进了杂交相思各器官干物质的积累以及氮、磷、钾的积累。低氮 (0.4 g/kg) 更能促进根氮、磷、钾以及干物质的积累,提高干物质在根中的分配比例和根冠比。高氮(0.8 g/kg) 则更有利于茎、叶及植株总的磷、钾、干物质的积累;高氮显著降低了氮、磷、钾在根中的分配比例,而增加了在茎中的分配比例。施氮还显著提高了杂交相思根、茎、叶和植株总的N/P值(16.16~35.12之间),而显著降低了P/K值、NUEN和NUEK,一定程度上提高了NUEP。说明施氮可缓解杂交相思由镉胁迫所引起的对氮、钾吸收的限制,而转为受磷的限制。这与Koerselman等[20]研究的结果相一致,即植物组织N/P大于16时,植物生长主要受磷限制。
植物对土壤Cd的吸收受土壤Cd含量及有效量、土壤pH、有机质及其他二价阳离子等多种因素的影响[30]。不同氮肥可改变土壤pH,从而影响土壤Cd的有效性,进而影响植物对Cd的吸收[31]。Grant等[32]、李艳梅等[33]研究表明,施氮在促进生长的同时,在一定程度上也促进了植株对Cd的吸收和累积。翟晶等[8]研究表明,施氮促进了杨树 (Poplar) 叶片中Cd含量,加强了对Cd的富集作用。而李继光等[34]研究表明低氮促进了东南景天 (Sedum alfredii) 地上部分对Cd的积累,而高氮则表现为根部高于地上部分。易蔓等[35]研究表明,施氮不仅可改变烟草中Cd含量和积累量,同时也改变了TF。本研究结果表明,30 mg/kg镉胁迫下,施氮均促进了杂交相思各器官干物质以及根和茎Cd含量的提高,同时也促进了各器官对Cd的积累;而低氮更能促进根、叶和植株总的Cd积累量,高氮更能促进茎部Cd的积累量。施氮均降低了Cd在杂交相思根中的分配比例,提高了在茎中的分配比例。低氮显著改变了杂交相思的TF,但对根以及茎叶BCF并无显著影响。研究结果与前人存在一定相似也存在不同,不同的原因可能是因为植株体内Cd含量除了与外源Cd浓度有关外,还与植物因素如种类、品种、植物部位[7,36]有关,而培养介质、施肥种类[37–38]、施肥水平和土壤溶液中不同离子之间的相互作用也影响着植物对土壤中Cd的吸收和累积。
[ 1 ]Pelfrêne A, Waterlot C, Mazzuca M,et al. Assessing Cd, Pb, Zn human bioaccessibility in smelter—contaminated agricultural topsoils(Northern France)[J]. Environmental Geochemistry and Health, 2011,33(5): 477–493.
[ 2 ]刘柿良, 潘远智, 杨容孑, 等. 外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响[J]. 植物营养与肥料学报, 2014, 20(2): 445–458.Liu S L, Pan Y Z, Yang R J,et al. Effects of exogenous NO on mineral nutrition absorption, lipid peroxidation and ATPase of plasma membrane inCatharanthus roseustissues under cadmium stress[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(2):445–458.
[ 3 ]曹玲, 王庆成, 崔东海. 土壤镉污染对四种阔叶树苗木叶绿素荧光特性和生长的影响[J]. 应用生态学报, 2006, 17(5): 769–772.Cao L, Wang Q C, Cui D H. Impact of soil cadmium contamination on chlorophyll fluorescence characters and biomass accumulation of four broad-leaved tree species seedlings[J]. Chinese Journal of Applied Ecology, 2006, 17(5): 769–772.
[ 4 ]吴福忠, 杨万勤, 张健, 等. 镉胁迫对桂花生长和养分积累、分配与利用的影响[J]. 植物生态学报, 2010, 34(10): 1220–1226.Wu F Z, Yang W Q, Zhang J,et al. Effects of cadmium stress on growth and nutrient accumulation, distribution and utilization inOsmanthus fragransvar. Thunbergii[J]. Chinese Journal of Plant Ecology, 2010, 34(10): 1220–1226.
[ 5 ]Fabian G, Dezsi-Devay M. Ecophysiological studies of the relationship between heavy metal toxicity and nitrogen nutrition in the early development stage of winter wheat[J]. Acta Botanica Hungarica, 1987, 33(3): 219–234.
[ 6 ]曹莹, 段萌, 刘玉莲, 赵天宏. 镉胁迫下铵态氮对春小麦光合生理特性的影响[J]. 生态环境学报, 2011, 20(2): 359–363.Cao Y, Duan M, Liu Y L, Zhao T H. Effects of NH4+-N on photosynthetic characteristics of spring wheat plant under cadmium[J]. Ecology and Environmental Sciences, 2011, 20(2):359–363.
[ 7 ]顾翠花, 王懿祥, 白尚斌, 等. 四种园林植物对土壤镉污染的耐受性[J]. 生态学报, 2015, 35(8): 2536–2544.Gu C H, Wang Y X, Bai S B,et al. Tolerance and accumulation of four ornamental species seedlings to soil cadmium contamination[J].Acta Ecologica Sinica, 2015, 35(8): 2536–2544.
[ 8 ]翟晶. 镉胁迫下增施氮对杨树生长和叶绿素合成的影响[D]. 四川雅安: 四川农业大学硕士学位论文, 2013.Zhai J. The effects of nitrogen on poplar growth and chlorophyll synthesis under cadmium stress [D]. Ya’an, Sichuan: MS Thesis of Sichuan Agricultural University, 2013.
[ 9 ]童琳, 唐旭利, 张静, 等. 菌根真菌侵染对植物生物量累积的影响[J]. 生态环境学报, 2014, 23(9): 1520–1525.Tong L, Tang X L, Zhang J,et al. Influence of mycorrhizal colonization on plant biomass accumulation[J]. Ecology and Environmental Sciences, 2014, 23(9): 1520–1525.
[10]马海宾, 康丽华, 江业根, 等. 接种根瘤菌对厚荚相思水分胁迫的响应[J]. 中南林业科技大学学报, 2009, 29(4): 74–78.Ma H B, Kang L H, Jiang Y G,et al. Response ofAcacia crassicarpaseedlings inoculated with rhizobia to drought stress[J]. Journal of Central South University of Forestry & Technology, 2009, 29(4):74–78.
[11]任苓. 杂交相思与黑木相思快速繁殖体系的建立[D]. 南宁: 广西大学硕士学位论文, 2011.Reng L. To establish the system ofAcacia mangium × Acaciaauriculaef OrmisandAcaciamelanoxylon rapid propagation [D].Nanning : MS Thesis of Guangxi University, 2011.
[12]覃朝科, 易鹞, 刘静静, 等. 广西某铅锌矿区废水汇集洼地土壤重金属污染调查与评价[J]. 中国岩溶, 2013, 32(3): 318–324.Qin C K, Yi Y, Liu J J,et al. Investigation and evaluation on heavy metal pollution in the waste water collecting depression in a lead-zinc mine of karst area[J]. Carsologica Sinica, 2013, 32(3): 318–324.
[13]鲍士旦. 土壤农化学分析[M]. 北京: 中国农业出版社, 2005: 263-271.Bao S D. Soil agricultural chemical analysis [M]. Beijing: China Agriculture Press, 2005: 263-271.
[14]黄耿磊, 黄冬芬, 刘国道, 等. 镉胁迫对3种柱花草生长及植株镉积累和分配的影响[J]. 草地学报, 2011, 19(1): 97–101.Huang G L, Huang D F, Liu G D,et al. Effects of cadmium stress on the growth, cadmium accumulation and distribution of threeStylosanthesspp. varieties[J]. Acta Agrestia Sinica, 2011, 19(1):97–101.
[15]Shi X, Chen Y T, Wang S F,et al. Growth and metal uptake of three woody species in lead/zinc and copper mine tailing[J]. Acta Ecologica Sinica, 2011, 31(7): 1818–1826.
[16]Wu F, Yang W, Zhang J,et al. Cadmium accumulation and growth responses of a poplar (Populus deltoids×Populusnigra) in cadmium contaminated purple soil and alluvial soil[J]. Journal of Hazardous Materials, 2010, 177(1): 268–273.
[17]刘柿良, 杨容孑, 马明东, 等. 镉胁迫对白车轴草生长, 镉含量及养分分配的影响[J]. 核农学报, 2015, 29(3): 595–604.Liu S L, Yang R J, Ma M D,et al. Effects of cadmium stress on growth, cadmium content and nutrient distribution inTrifolium repeusL. plants[J]. Journal of Nuclear Agricultural Sciences, 2015,29(3): 595–604.
[18]郭智, 王涛, 奥岩松. 镉对龙葵幼苗生长和生理指标的影响[J]. 农业环境科学学报, 2009, 28(4): 755–760.Guo Z, Wang T, Ao Y S. Physiological responses ofSolanum nigrumL. seedlings to cadmium stress[J]. Journal of Agro-Environment Science, 2009, 28(4): 755–760.
[19]Zhang L X, Bai Y F, Han X G. Application of N∶P stoichiometry to ecology studies[J]. Acta Botanica Sinica, 2003, 45(9): 1009–1018.
[20]Koerselman W, Meuleman A F M. The vegetation N∶P ratio: a new tool to detect the nature of nutrient limitation[J]. Journal of Applied Ecology, 1996, 33(6): 1441–1450.
[21]陈良华, 徐睿, 杨万勤, 等. Cd 污染下香樟和油樟幼苗 N、P、K 的积累与分配特征[J]. 西北农林科技大学学报 (自然科学版), 2016,44(10): 1–9.Chen L H, Xu R, Yang W Q,et al. N, P and K accumulation and allocation pattern ofCinnamomum camphoraandC.longepaniculatumseedlings under Cd pollution[J]. Journal of Northwest A&F University (Natural Science Edition), 2016, 44(10):1–9.
[22]Benavides M P, Gallego S M, Tomaro M L. Cadmium toxicity in plants[J]. Brazilian Journal of Plant Physiology, 2005, 17(1): 21–34.
[23]Polle A, Schützendübel A. Heavy metal signalling in plants: linking cellular and organismic responses[A]. Hirt H, Shinozaki K. Plant responses to abiotic stress[M]. Berlin,Heidelberg :Springer-verlg 2003: 187-215.
[24]田小霞, 孟林, 毛培春, 等. 重金属Cd、Zn对长穗偃麦草生理生化特性的影响及其积累能力研究[J]. 农业环境科学学报, 2012, 31(8):1483–1490.Tian X X, Meng L, Mao P C,et al. Effects of Cd and Zn on the physiological and biochemical characteristics and accumulation abilities ofElytrigia elongate[J]. Journal of Agro-Environment Science, 2012, 31(8): 1483–1490.
[25]蒋德明, 黄会一. 木本植物对土壤镉污染物吸收蓄积能力及其种间差异[J]. 城市环境与城市生态, 1992, 5(1): 26–30.Jiang D M, Huang H Y. Capacities of absorption and accumulation of cadmium by woody plants in polluted soil and their differences among species[J]. Urban Environment & Urban Ecology, 1992, 5(1):26–30.
[26]张帆, 万雪琴, 王长亮, 等. 镉胁迫下增施氮对杨树生长和光合特性的影响[J]. 四川农业大学学报, 2011, 29(3): 317–321.Zhang F, Wan X Q, Wang C L,et al. Effects of nitrogen supplement on photosynthetic characteristic and growth rate of poplar plants under cadmium stress[J]. Journal of Sichuan Agricultural University,2011, 29(3): 317–321.
[27]张永平, 范红伟, 杨少军, 等. 外源水杨酸对镉胁迫下甜瓜幼苗生长、光合作用和活性氧代谢的缓解效应[J]. 植物生理学报, 2014,50(10): 1555–1562.Zhang Y P, Fan H W, Yang S J,et al. Alleviating effects of exogenous salicylic acid on growth, photosynthesis and reactive oxygen metabolism in melon seedlings under cadmium stress[J].Plant Physiology Journal, 2014, 50(10): 1555–1562.
[28]Liu S L, Yang R J, Pan Y Z,et al. Beneficial behavior of nitric oxide in copper-treated medicinal plants[J]. Journal of Hazardous Materials,2016, 314(1): 140–154.
[29]杨容孑, 刘柿良, 宋会兴, 等. 不同氮形态对龙葵镉积累、抗氧化系统和氮同化的影响[J]. 生态环境学报, 2016, 25(4): 715–723.Yang R J, Liu S L, Song H X,et al. Impacts of different nitrogen forms on cadmium accumulation, antioxidant system and nitrogen assimilation in hyper accumulatorSolanum nigrumL.[J]. Ecology and Environmental Sciences, 2016, 25(4): 715–723.
[30]李森, 亢秀平, 邢国明. 影响植物吸收镉的因素[J]. 北方园艺, 2007,(7): 76–78.Li S, Kang X P, Xing G M. Factors affected the cadmium absorbability of plants[J]. Northern Horticulture, 2007, (7): 76–78.
[31]赵晶. 不同氮磷钾肥对土壤镉有效性和小麦吸收镉的影响[D]. 四川雅安: 四川农业大学硕士学位论文, 2009.Zhao J. Effects of different nitrogen, phosphorus and potassium fertilizers on availability of soil cadmium and cadmium uptake by wheat[D]. Ya’an, Sichuan: MS Thesis of Sichuan Agricultural University, 2009.
[32]Grant C A, Bailey L D, McLaughlin M J,et al. Management factors which influence cadmium concentrations in crops[A]. Mclaughlin M J, Singh B R. Cadmium in soils and plants[M]. Dordrecht: Kluwer Academic Publishe 1999: 151–198.
[33]李艳梅, 刘小林, 袁霞, 等. 镉氮交互作用对小白菜生长及其体内镉累积的影响[J]. 干旱地区农业研究, 2008, 26(6): 110–113.Li Y M, Liu X L, Yuan X,et al. Interactive effects of nitrogen application and cadmium contamination on pakchoi growth and Cd accumulation[J]. Agricultural Research in the Arid Areas, 2008,26(6): 110–113.
[34]李继光, 朱恩, 李廷强, 等. 氮对镉胁迫下东南景天根系形态及镉积累的影响[J]. 环境污染与防治, 2007, 29(4): 271–275.Li J G, Zhu E, Li T Q,et al. Effects of nitrogen fertilizer on biomass,root morphology and Cd accumulation of Cd-stressedSedum alfrediiHance species[J]. Environmental Pollution & Control, 2007, 29(4):271–275.
[35]易蔓, 韦慧琴, 胡梦坤, 等. 氮素形态对烟草根际镉的有效性及镉吸收的影响[J]. 环境工程学报, 2016, 10(2): 941–947.Yi M, Wei H Q, Hu M K,et al. Effects of nitrogen forms on bioavailability of cadmium in rhizosphere and its uptake by tobacco[J]. Chinese Journal of Environmental Engineering, 2016,10(2): 941–947.
[36]Moreno-Caselles J, Moral R, Pérez-Espinosa A,et al. Cadmium accumulation and distribution in cucumber plant[J]. Journal of Plant Nutrition, 2000, 23(2): 243–250.
[37]Gavi F, Basta N T, Raun W R. Wheat grain cadmium as affected by long-term fertilization and soil acidity[J]. Journal of Environmental Quality, 1997, 26(1): 265–272.
[38]Landberg T, Greger M. Influence of N and N supplementation on Cd accumulation in wheat grain[A]. Conference Proceedings of 7th International Conference on the Biogeochemistry of Trace Elements[C]. Uppsala, Sweden, 2003: 90-91.
Effect of nitrogen application on seedling growth and cadminm uptake and distribution in Acacia mangium × Acacia auriculiformis under cadmium stress
TAN Zhang-qiang1,2, HE Qin-fei1,2, QIN Yu-yan3, SHEN Wen-hui1,2*, LIU Xiu1,2, CAO Yan-yun1,2
(1 Guangxi Academy of Forestry, Nanning 530002, China; 2 Guangxi Key Laboratory of Superior Timber Trees Resource Cultivation, Nanning 530002, China; 3 Guangxi Subtropical Crops Research Institute, Nanning 530002, China)
【Objectives】The adaptation and bioremediation capability ofAcacia mangium×Acacia auriculiformiswere studied under different nitrogen and cadmium stress levels for providing support for scientific fertilization of the target cultivation ofAcacia mangium×Acacia auriculiformis.【Methods】A pot experiment was carried out with two cadmium stress levels of Cd2+30 and 60 mg/kg and two urea levels of 0.4 and 0.8 g/kg soil. The accumulation and distribution of dry matter, N, P, K and Cd in shoots and roots of the trees were analyzed.【Results】The cadmium stress significantly inhibited dry matter accumulation in roots, stems and leaves ofAcacia mangium×Acacia auriculiformis, and also reduced the N, P and K absorption and accumulation.The Cd transfer coefficients of the plant were from 0.044 to 0.224 when treated with different Cd concentrations.The concentrations of Cd in roots were significantly higher than those in stems and leaves, and the accumulation ability of Cd in roots was higher than that in shoots. In order to adapt to the environment better, theAcacia mangium×Acacia auriculiformistransferred more Cd from roots to shoots under the high Cd stress. Under the Cd2+stress of 30 mg/kg, the high N increased P and K contents and accumulations in shoots, while the low N increased P and K contents in roots. The high N was more efficient in accumulation and distribution of dry matter in shoots, while the low N showed the same performance in roots. The nitrogen fertilization promoted the absorption and accumulation of Cd in the plants and improved the Cd transfer coefficients when treated with different Cd concentrations. The low nitrogen significantly promoted the Cd accumulation in roots, leaves and plants, and the high nitrogen significantly promoted the Cd accumulation in stems and the allocation proportion of Cd in stems and leaves.【Conclusions】Nitrogen fertilization could alleviate the limitation of N and K absorption ofAcacia mangium×Acacia auriculiformisin 30 mg/kg Cd concentration and promote accumulation of dry matter, N, P, K and Cd. The low nitrogen is good for better growth of the plant, and the high nitrogen performs better in promoting the transferring of Cd to the aboveground ofAcacia mangium×Acaciaauriculiformis, which is required for the ability of the Cd bioremediation.
cadmium stress; nitrogen fertilizer;Acacia mangium×Acacia auriculiformis; dry matter; nutrient use
2017–01–09 接受日期:2017–05–02
广西优良用材林资源培育重点实验室自主课题(15-A-02-02);广西林科院基本科研业务费项目(林科 201601号);广西林业科技项目(桂林科研 [2015] 18号)资助。
谭长强(1987—),男,广西桂林人,工程师,硕士,主要从事森林培育和森林生态研究。E-mail:315990730@qq.com
* 通信作者 E-mail:shenwenhui2003@163.com

