探讨CT引导下微波消融术对晚期第一肝门区肝癌患者的临床疗效
杨 琴 王泽鑫
探讨CT引导下微波消融术对晚期第一肝门区肝癌患者的临床疗效
杨 琴①王泽鑫②*
目的:探讨CT引导下微波消融术对丧失手术治疗机会的晚期第一肝门区肝癌患者的临床疗效。方法:选取医院收治的56例丧失手术治疗机会的晚期第一肝门区肝癌患者,采用随机数表法将其分为观察组与对照组,每组28例。观察组患者接受CT引导下的微波消融术等靶向综合疗法,对照组则接受常规动脉栓塞化疗法,比较两组患者治疗效果及生存情况。结果:观察组肝癌患者治疗总有效率为82.14%,明显高于对照组的46.43%,两组比较差异有统计学意义(x2=7.778,P<0.05);两组患者治疗后甲胎蛋白(AFP)水平明显降低,但观察组患者AFP改善程度明显优于对照组,两组比较差异有统计学意义(t=14.662,P<0.0,5);观察组患者术后1~2年生存率略高于对照组,但两组比较差异无统计学意义(x2=4.156,x2=0.080;P>0.05);治疗过程中及治疗后观察组患者不良反应发生率明显低于对照组,两组比较差异有统计学意义(x2=6.842,P<0.05)。结论:CT引导下微波消融术等综合靶向疗法具有操作简单、治疗精准的优点,对丧失手术时机的晚期第一肝门区肝癌患者具有良好疗效,并且不良反应较轻,较传统动脉栓塞术具有明显的治疗优势。
CT引导;微波消融术;第一肝门区肝癌;临床疗效
肝癌是临床上较为常见的恶性肿瘤之一,近年来我国肝癌发病率以及癌因性病死率均居首位,已成为威胁人类生命健康安全及生活质量的主要恶性肿瘤之一[1-2]。外科手术治疗以及辅助放化疗是目前临床治疗肝癌的主要手段,早期和中期的大部分肝癌患者可经外科根治术及辅助放化疗达到理想的临床疗效,可有效延长患者生存期,改善患者术后生活质量,但对于就诊时已进展为晚期的肝癌患者而言已经丧失手术治疗机会,仅可通过放射治疗、化疗和生物学疗法等改善患者临床症状,提升患者生活质量,尽可能的延长患者生存期[3-4]。微波消融术是近年来临床应用治疗晚期肝癌的新型手段,本研究通过比较56例晚期第一肝门区肝癌患者的不同治疗方法,探讨CT引导下微波消融术对丧失手术治疗机会的晚期第一肝门区肝癌患者的临床疗效。
1 资料与方法
1.1 一般资料
回顾性选取2013年1月至2016年1月内蒙古医科大学附属医院收治的56例晚期第一肝门区肝癌患者。采用随机数表法将其分为观察组和对照组,每组28例。对照组中男性19例,女性9例;年龄36~73岁,平均年龄(56.2±4.5)岁;病理组织学检查证实原发性肝癌21例,继发性肝癌7例,肿瘤直径为2.5~4.0 cm,平均肿瘤直径为(3.1±0.5)cm,18例患者为单发肿瘤,10例患者为多发肿瘤。观察组中男性18例,女性10例;年龄39~71岁,平均年龄(56.5±3.9)岁;病理组织学检查证实原发性肝癌22例,继发性肝癌6例,肿瘤直径为1.5~5.1 cm,平均直径为(3.2±0.6)cm,19例患者为单发肿瘤,9例患者为多发肿瘤。两组患者一般基础资料比较差异无统计学意义,具有可比性。所有患者对本组研究内容及风险完全知情同意,已通过医院伦理道德委员会审核。
1.2 纳入与排除标准
(1)纳入标准:①经临床症状、既往病史、血清甲胎蛋白(alpha-fetoprotein,AFP)和影像学检查确诊为晚期第一肝门区肝癌;②明确丧失手术指征。
(2)排除标准:①严重精神疾病;②急慢性感染患者;③严重心脑血管疾病患者;④严重心、肝、肾功能不全;⑤微波消融术禁忌证;⑥原发性凝血功能障碍。
1.3 仪器设备
采用64层螺旋CT(美国GE公司);MTC-3C型微波消融机(南京维京九州公司)。
1.4 检查方法
(1)观察组患者在64层螺旋CT下进行经皮靶向微波消融术等综合治疗,术前定位病变位置并进行标记,测量肿瘤与进针点最短距离并评估并制定穿刺路径,计算进针角度与插入深度,靶向穿刺瘤体并尽量避开重要脏器以及血管丰富区域,CT扫描下观察并调整穿刺部位,应用MTC-3C型微波消融机,输出功率为50~85 W,针道消融每点持续9 min,对直径超过2 cm的肿瘤需进行多次多点消融,2 cm直径以下的肿瘤则可进行一次消融。
(2)对照组患者单纯接受常规肝动脉栓塞化疗方法治疗。
1.5 观察指标与评价标准
比较两组肝癌患者治疗后总有效率,参考实体肿瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)进行评价,其中完全缓解(complete response,CR)为肿瘤完全消失且持续4周以上,未发现新发病灶,部分缓解(partial response,PR)为肿瘤缩小50%以上且持续4周以上,未发现新发灶,稳定(stable disease,SD)则为肿瘤缩小50%以下或肿瘤为增大25%以上,进展(progressive disease,PD)则为肿瘤增大25%以上或出现新发灶,总有效率(overall rate,OR)为CR与PR率之和;于治疗前后检测患者血清AFP指标;随访调查两组患者治疗后1~2年生存情况;记录并比较两组患者治疗过程中及治疗后不良反应发生情况。
1.6 统计学方法
采用SPSS 16.0软件对治疗数据进行分析。计量资料结果以均值±标准差(x-±s)表示,正态分布的计数资料以百分数(%)表示,采用x2检验比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者治疗总有效率比较
观察组患者治疗后总有效率为82.14%,明显高于对照组的46.43%,两组比较差异有统计学意义(x2=7.778,P<0.05),见表1。
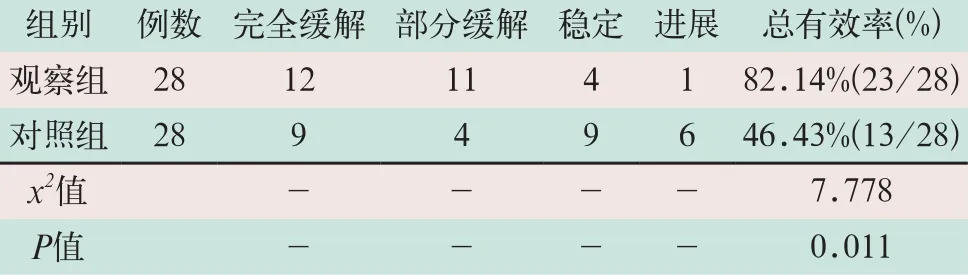
表1 两组患者治疗总有效率比较(例)
观察组治疗后与治疗前影像评价比较,其效果明显改善,肝区不规则片状低密度影面积明显减少,如图1、图2所示。

图1 肝门区肝癌治疗前图像
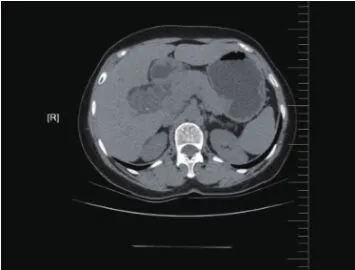
图2 肝门区肝癌治疗后图像
2.2 两组患者治疗前后AFP指标比较
两组患者治疗前血清AFP水平比较差异无统计学意义(t=-3.053,P>0.05),治疗后均明显降低,观察组患者AFP改善程度明显优于对照组,差异具有统计学意义(t=14.662,P<0.05)。观察组和对照组治疗前后比较差异均有统计学意义(t=33.953,t=21.542;P<0.05),见表2。
2.3 两组患者治疗后1~2年生存情况比较
观察组患者术后1~2年生存率略高于对照组,但两组比较差异无统计学意义(x2=4.156,x2=0.080;P>0.05),见表3。

表2 两组患者治疗前后AFP指标比较(μg/L,x-±s)
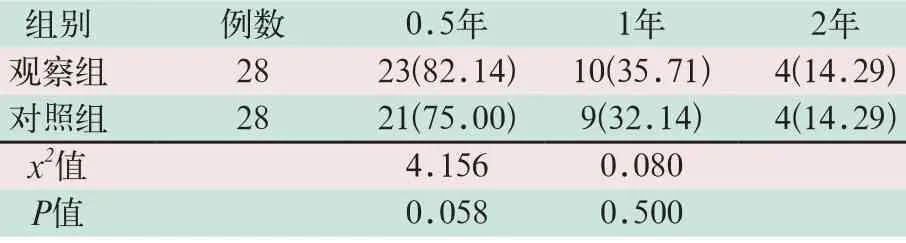
表3 两组患者治疗后生存率比较[例(%)]
2.4 两组患者治疗不良反应发生情况比较
治疗过程中及治疗后观察组患者不良反应发生率明显低于对照组,两组不良反应发生率比较差异有统计学意义(x2=6.842,P<0.05),见表4。

表4 两组患者治疗不良反应发生情况比较(例)
3 讨论
由于第一肝门区解剖学位置的特殊性,发生于此区的肝癌患者往往肿瘤的切缘较近,手术切除难度较大,因此患者术后复发率较高、术后恢复困难且预后较差[5-6]。由于胆管内胆汁的流速相对较为缓慢,在进行射频消融时易损伤第一肝门区胆管从而导致胆漏、单管狭窄等不良临床结局的产生,因此临床上曾将第一肝门区肿瘤成为射频消融治疗禁区[7-8]。而随着近年来医疗技术的不断进展,微波消融治疗丧失手术时机的晚期第一肝门区肿瘤成为了可能,对肝癌采用微创治疗已非常普遍且效果比较理想,其中微波消融技术对肝癌治疗具有升温快、受热均匀以及实时检测的优点,能够有效提升患者治疗效果及生活质量,可在一定程度上延长患者生存期[9-10]。
本研究结果显示,观察组肝癌患者治疗总有效率明显高于对照组,两组患者治疗前血清AFP水平比较差异无统计学意义,治疗后均明显降低,但观察组患者AFP改善程度明显优于对照组,观察组患者术后1年、2年生存率略高于对照组,但差异无统计学意义,治疗过程中及治疗后观察组患者不良反应发生率明显低于对照组,表明CT引导微波消融治疗晚期第一肝门区肝癌具有良好的疗效与安全性。结合本研究结果分析,第一肝门区肝癌的穿刺消融应采用穿刺探头配合合适的穿刺架进行穿刺,并且其对穿刺路径、穿刺点的精确度要求更高,因此制定准确、有效的穿刺路径计划具有重要的临床价值[11-13]。由于CT引导微波消融能够准确显示肝门区结构及胆管位置、血管走行等,能够实时制定穿刺路径从而有效避免误伤,并且结合结果分析认为CT还可在术后评估病情中具有重要作用,CT微波消融术后CT平扫图像上可见消融区不规则片状强化区,延迟期、静脉期与周围正常肝组织密度接近[14-15]。通过CT影像对微波消融术后的患者病灶的实时监测呈圆形和部分不规则图形,密度主要表现为均匀低密度,或者在均匀低密度中存在高密度和等密度等特征,通常认为这是由治疗后局部组织细胞脱水或者病灶内出血所导致。消融区范围一般表现为前期增大,后期减小直至消失。
CT引导下微波消融术等综合靶向疗法具有操作简单、治疗精准的优点,对丧失手术时机的晚期第一肝门区肝癌患者具有良好疗效,并且不良反应较轻,较传统动脉栓塞术具有明显的应用优势。然而,本研究仍存在一定的缺点与不足,如样本容量较小可能导致结果客观性欠佳,且未进行远期随访等。因此,CT引导微博消融技术的远期疗效仍需进一步研究证实。
[1]Zhao P,Zheng JS,Zhang HH,et al.[Efficacy evaluation and exploration of TACE combined with CT-guided precision microwave ablation treatment for primary liver cancer][J].Zhonghua zhong liu za zhi [Chinese journal of oncology],2016,38(2):138.
[2]王宏云,彭晓明.CT引导下肝癌微波消融治疗及护理[J].中外健康文摘,2012,9(21):330-332.
[3]武正山,浦立勇,张峰.经CT引导微波消融治疗小肝癌合并严重肝硬化的价值[J].江苏医药,2012,38(18):2143-2145.
[4]Jiao DC,Zhou Q,Han XW,et al.Microwave ablation treatment of liver cancer with a 2,450-MHz cooled-shaft antenna:pilot study on safety and efficacy[J].Asian Pac J Cancer Prev,2012,13(2):737-742.
[5]房达,崔石昌,李京华,等.CT引导微波消融治疗肝癌中CT剂量的优化控制[J].医学影像学杂志,2016,26(10):1837-1840.
[6]李文锋.腹腔镜射频消融治疗第一肝门区肝癌的临床分析[J].吉林医学,2015,36(5):909-909.
[7]郭晨阳,胡鸿涛,黎海亮,等.CT引导微波治疗原发性肝癌的并发症分析[J].实用医学杂志,2010,26(13):2356-2358.
[8]Lai RC,Lu YL,Huang W,et al.[Application of a narcotrend-assisted anesthesia in-depth monitor in the microwave coagulation for liver cancer during total intravenous anesthesia with propofol and fentanyl][J].Chin J Cancer,2010,29(1):117-120.
[9]李丽珍,钟秋红,黄昌辉,等.超声引导下经皮微波消融与CT超声引导下肿瘤射频消融治疗原发性肝癌的临床比较[J].中国CT和MRI杂志,2017,15(1):76-78.
[10]Zhai W,Lin S,Song Y,et al.Image Guided Computer Assisted Microwave Ablation for Liver Cancer[J].J Computer Research Development,2011,48(2):281-288.
[11]沈立杰,严鹏,张娟娜,等.CT引导下氩氦冷冻、射频消融和微波消融治疗肝癌的疗效对比[J].医学影像学杂志,2015,25(10):1836-1839.
[12]宋泽,李虹,齐翰,等.CT导向下微波消融治疗肝癌肺转移瘤的疗效[J].实用医学杂志,2015,31(1):57-60.
[13]叶本功,张榕培,刘毅.CT在肝癌微波消融术临床疗效评价中的应用[J].中国CT和MRI杂志,2016,14(6):67-68.
[14]Jiao D,Qian L,Zhang Y,et al.Microwave ablation treatment of liver cancer with 2,450-MHz cooled-shaft antenna: an experimental and clinical study[J].J Cancer Research Clinical Onco logy,2010,136(10):1507-1516.
[15]郑小令,张亮.肝动脉化疗栓塞序贯联合CT导向下微波消融术治疗原发性肝癌的近期疗效观察[J].海南医学,2010,21(17):96-98.
The clinical efficacy of microwave ablation under CT-guidance for patients with liver cancer of the first hepatic hilar region at advanced period/
YANG Qin, WANG Ze-xin//
China Medical Equipment,2017,14(10):69-72.
Objective: To explore the clinical efficacy of microwave ablation under CT-guidance for patients with liver cancer of the first hepatic hilar region at advanced period. Methods: 56 patients with liver cancer of the first hepatic hilar region at advanced period, who had lost the chance of operative treatment, were divided into observation group (28 cases) and control group (28 cases) as the random number table. The patients of observation group
CT-guidance microwave ablation and other targeted combining therapy while patients of control group underwent routine chemotherapy of arterial embolism. The therapeutic effect and survival situation of the two groups were compared and analyzed. Results: The total effective rate of patients with liver cancer of the observation group(82.14%) was significantly higher than that of control group (46.43%)(x2=7.778, P<0.05). The AFP of both of the two group was obviously reduced, and the improvement degree of observation group was significantly better than that of control group (t=14.662, P<0.05). The survival rate of post-operative 1-2 y of observation group was slightly higher than that of control group, but it was no significant (x2=4.156, x2=0.080, P>0.05).During the process of treatment and post the process of treatment, the occurrence rate of adverse reaction of observation group was significantly lower than that of control group (x2=6.842, P<0.05).Conclusion: The microwave ablation under CT-guidance and other targeted combining therapy has outstanding advantages including simple operation, curative precision and so on. And it has better curative effect for patients with liver cancer of the first hepatic hilar region at advanced period who had lost optimum opportunity of operative treatment. Besides, its adverse reaction is lower and it has obviously preponderance to compare with routine arterial embolism.
CT guidance; Microwave ablation; Liver cancer of first hepatic hilar region; Clinical efficacy
Department of Infectious Diseases, Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010010, China.
10.3969/J.ISSN.1672-8270.2017.10.020
杨琴,女,(1983- ),硕士研究生,内蒙古医科大学附属医院感染科,研究方向:病毒性肝炎、肝癌等肝病学。
2017-07-10
1672-8270(2017)10-0069-04
R735.7
A
①内蒙古医科大学附属医院感染科 内蒙古 呼和浩特 010010
②内蒙古医科大学附属医院介入科 内蒙古 呼和浩特 010010
*通讯作者:yq20171908@126.com

