川芎嗪注射液对高眼压大鼠视网膜Bcl-2、Bax蛋白表达和视网膜神经节细胞凋亡的影响*
杜红彦 李建良 骆 煌 闫 冉 蔡金英 王 蓉(广东省广州市中医医院,广东 广州510120)
川芎嗪注射液对高眼压大鼠视网膜Bcl-2、Bax蛋白表达和视网膜神经节细胞凋亡的影响*
杜红彦 李建良 骆 煌 闫 冉 蔡金英 王 蓉△(广东省广州市中医医院,广东 广州510120)
目的观察川芎嗪注射液对高眼压大鼠模型视网膜Bcl-2、Bax蛋白表达和视网膜神经节细胞凋亡的影响并探讨其机制。方法应用前房注射羟丙基甲基纤维素的方法建立高眼压大鼠模型,随机分为模型组、川芎嗪组,并设立空白对照组,每组10只。造模成功3 d后开始给药,川芎嗪组给予盐酸川芎嗪注射液7.2mg/kg腹腔注射。模型组和空白对照组每天用等体积的0.9%氯化钠注射液腹腔注射。每日1次,共2周。观察川芎嗪注射液对高眼压模型大鼠Bcl-2、Bax蛋白表达和视网膜神经节细胞凋亡的影响。结果川芎嗪组视网膜Bcl-2蛋白的表达增高,与模型组和空白对照组比较其间差别有统计学意义(P<0.01);川芎嗪组视网膜Bax蛋白的表达低于模型组,两组间的差异有统计学意义(P<0.01)。川芎嗪组的Bcl-2/Bax比值最高,与模型组和空白对照组比较其间差别有统计学意义(P<0.01)。川芎嗪组视网膜神经节细胞凋亡指数低于模型组,两组间的差异有统计学意义(P<0.01)。结论川芎嗪注射液能够减少高眼压大鼠模型视网膜神经节细胞的凋亡,其机制可能是通过升高视网膜Bcl-2蛋白的表达、降低Bax蛋白的表达、改变Bcl-2/Bax的比值而实现的。
川芎嗪注射液 青光眼 视网膜神经节细胞凋亡Bcl-2 Bax
青光眼是以视网膜神经节细胞(RGCs)及其轴突数目进行性丢失、视野逐渐丧失和视神经萎缩为特征的眼部疾病[1]。青光眼可导致患者的视力逐渐丧失,直至失明,在全世界的致盲性眼病种位列第2。流行病学资料显示[2-3],目前我国青光眼患病人数达700万,其中有65万左右的患者致盲,预计到2020年世界的青光眼患病人数将会突破8000万,青光眼的高发病率及其致盲的严重后果将会对患者及其家庭和社会带来巨大的经济负担和社会压力。RGCs及其轴突的变性、萎缩和丧失是导致青光眼视功能永久损伤的主要病理机制,而细胞凋亡是导致RGCs丧失的重要因素[4-6]。 本研究通过观察川芎嗪注射液对高眼压大鼠模型视网膜Bcl-2、Bax蛋白表达及RGCs凋亡的影响,探讨川芎嗪保护青光眼视神经损伤的作用机制。现报告如下。
1 材料与方法
1.1 实验动物 实验动物选用10周龄的SD大鼠,雌雄各半共30只,体质量(250±50)g,由广州中医药大学实验中心提供。实验动物的许可证编号:SYXK(粤)2013-0085。实验前对大鼠进行裂隙灯、眼底镜检查及眼压测量,眼前节、眼底正常,眼压<21 mmHg的动物方可选用。
1.2 药物与仪器 盐酸川芎嗪注射液,由上海现代哈森(商丘)药业有限公司生产,国药准字H20054485。眼用羟丙基甲基纤维素,由天津晶明新技术开发有限公司提供,国食药监械(准)字2014第3220731号。
1.3 分组与造模 实验前适应性饲养3 d,将实验动物随机分成空白对照组、模型组、川芎嗪组。10%水合氯醛(4mL/kg)腹腔注射麻醉,右眼表麻下抽出前房房水0.1 mL后,注入等量的羟丙基甲基纤维素,使其干预期内眼压均维持在30~39mmHg。空白对照组注入等量0.9%氯化钠注射液,均在30min后测量眼压。
1.4 给药方法 造模3 d后开始给药,药物剂量换算参考徐叔云《药理实验方法学》,采用体表面积换算法。川芎嗪组:给予盐酸川芎嗪注射液7.2mg/kg腹腔注射。模型组和空白对照组用等体积的0.9%氯化钠注射液腹腔注射。每日1次,共2周。
1.5 标本采集与检测
1.5 .1眼压检测 以0.5%的盐酸丙美卡因滴眼液表面麻醉后,Schiotz眼压计连续测量眼压3次,取平均值。
1.5 .2免疫组化法检测Bcl-2、Bax的表达 视网膜标本经固定、脱水、透明、包埋、复染、脱水、透明、封片等处理。免疫组化借助HPIAS-2000高清晰彩色病理图文报告分析系统,每张组织切片随机取10个视野,测定视网膜组织Bcl-2、Bax,根据其光密度计算各组的平均吸光度值(MOD)。
1.5 .3细胞凋亡检测(TUNEL法)[7]将视网膜切成0.5mm3的小块,用4%多聚甲醛磷酸固定,常规脱水、浸蜡、包埋、切片,光镜下观察视网膜神经节细胞凋亡。正常的视网膜神经节细胞核染色呈蓝色,而凋亡的细胞核呈棕褐色,观察细胞核数大于400个,根据(阳性细胞数/总细胞数)计算出视网膜神经节细胞的凋亡指数。
1.6 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,统计方法应用单因素方差分析。方差齐时采用LSD法;方差不齐时采用Tamhane’T2法。P<0.05为差异有统计学意义[8]。
2 结 果
2.1 各组大鼠实验前后眼压水平比较 见表1。造模前1 d,各组之间的眼压差异无统计学意义(P>0.05)。造模后30min和用药后2周,模型组和川芎嗪组眼压均有明显升高,与空白对照组比较差异有统计学意义(P<0.01),模型组与川芎嗪组比较其间差异无统计学意义(P>0.05)。
表1 各组大鼠实验前后眼压水平比较(mmHg,±s)
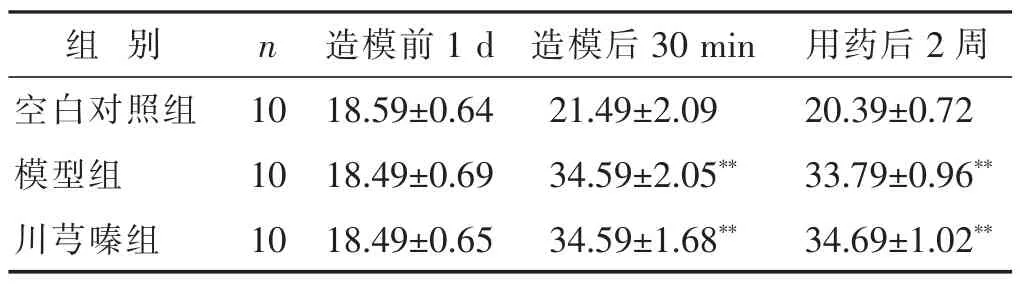
表1 各组大鼠实验前后眼压水平比较(mmHg,±s)
与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。 下同。
组 别n用药后2周造模前1 d造模后30min空白对照组10 20.39±0.72模型组10 33.79±0.96**18.59±0.64 21.49±2.09 18.49±0.69 34.59±2.05**川芎嗪组10 34.69±1.02**18.49±0.65 34.59±1.68**
2.2 川芎嗪对模型大鼠视网膜Bcl-2和Bax蛋白表达的影响 见表2。结果示各组大鼠间Bcl-2比较,空白对照组最低,其与模型组和川芎嗪组比较差别均有统计学意义(P<0.01)。 模型组和川芎嗪组的Bcl-2与空白对照组比较均有明显升高,川芎嗪组升高幅度大于模型组(P<0.01)。 各组大鼠间Bax比较,空白对照组最低,其与模型组和川芎嗪组比较差异有统计学意义(P<0.01)。模型组和川芎嗪组的Bax与空白对照组比较均有明显升高,模型组升高幅度大于川芎嗪组,(P<0.01)。 各组间Bcl-2/Bax比较,模型组最低,川芎嗪组最高,组间差异有统计学意义(P<0.01)。
表2 各组大鼠视网膜Bcl-2和Bax蛋白表达水平比较(吸光度值,s)

表2 各组大鼠视网膜Bcl-2和Bax蛋白表达水平比较(吸光度值,s)
组 别n Bcl-2/Bax Bcl-2 Bax空白对照组10 1.26±0.19模型组10 0.58±0.58**20.28±2.28 16.19±1.57 31.83±2.82**54.88±4.54**川芎嗪组10 1.58±0.16**△△47.38±5.90**△△30.10±2.91**△△
2.3 各组大鼠视网膜神经节细胞凋亡指数比较 见表3,图1。表3示各组大鼠间视网膜神经节细胞凋亡指数的比较,空白对照组最低,其与模型组和川芎嗪组比较差异有统计学意义(P<0.01)。模型组的凋亡指数最高,其与川芎嗪组比较组间差异统计学意义(P<0.01)。光镜结果示空白对照组视网膜神经节细胞偶见凋亡,模型组视网膜神经细胞数比空白对照组明显增多,凋亡细胞核染色呈深棕色,颜色明显加深。川芎嗪组神经节细胞凋亡数较模型组减少,但多于空白对照组,凋亡细胞核染色呈浅棕色。
表3 各组大鼠视网膜神经节细胞凋亡指数比较(±s)

表3 各组大鼠视网膜神经节细胞凋亡指数比较(±s)
组 别n 凋亡指数(%)空白对照组10模型组10 6.50±1.78 53.25±5.90**川芎嗪组1031.46±2.62**△△

图1 各组大鼠视网膜石蜡切片光学显微镜像(TUNEL法标记,400倍)
3 讨 论
视网膜神经节细胞凋亡是青光眼导致视力损伤的主要病理因素[9-11],RGCs是构成视网膜神经元的主要细胞,而且RGCs一旦发生变性坏死便很难再生,最终导致视功能的不可逆损伤[12],因此有效防止RGCs的凋亡是保护青光眼视神经损伤的重要途径。视网膜神经节细胞的凋亡受到多种基因调控[13],目前研究发现与视网膜神经节细胞凋亡有关的基因有:Bcl-2、Bax、Bcl-x、以及P53等,其中Bcl-2、Bax对RGCs凋亡的调控起主要作用。Bcl-2是一种原癌基因,通过其编码的Bcl-2蛋白能够起到抑制细胞凋亡的作用,是重要的抗凋亡基因[14-15]。Bcl-2蛋白抑制细胞凋亡的主要机制有[16-18]:降低细胞内Ca2+的水平,减少细胞色素C的释放以及阻止星形胶质细胞活化等。Bax基因则能够促使细胞凋亡的发生,是重要的促凋亡基因[19]。眼压正常时,视网膜中的Bcl-2和Bax蛋白的表达基本稳定。眼压增高时,Bax蛋白在视网膜中过表达,Bax/Bax同源二聚体的数量显著增多,从而诱导细胞凋亡。在Bcl-2表达增加时,则可引起Bax/Bax二聚体解离,而形成稳定的Bcl-2/Bax异源二聚体,从而有效拮抗Bax诱导的RGCs凋亡[16]。 因此,调控Bcl-2、Bax蛋白的表达水平,是减少RGCs凋亡,防治青光眼视神经损伤的重要途径。
青光眼属中医学“绿风内障”“青风内障”范畴,对于本病的病因病机,传统中医学有比较深刻的认识。本课题组认为青光眼的主要病机为气血失和,脉络不利,玄府闭塞,神水瘀积而成此病。青光眼视神经损害机理不外乎“瘀”与“虚”两端,初起以瘀为主,后期以虚为主,虚实夹杂,因此治疗本病以活血祛瘀、行气开郁、祛风止痛为法。本课题组临床研究发现,川芎嗪注射液有减轻青光眼患者临床症状,改善视野,提高视力的作用。现代研究表明[20-21],川芎嗪具有抗脂质过氧化、抗自由基、扩张血管、改善微循环、钙拮抗等作用,具有视神经保护作用。
本研究结果显示,川芎嗪注射液能够降低高眼压模型大鼠视网膜神经节细胞凋亡的,与模型组差异有统计学意义。光镜结果显示,模型组视网膜神经节细胞凋亡数比空白对照组明显增多,凋亡细胞核染色呈深棕色,颜色明显加深。川芎嗪组神经节细胞凋亡数较模型组减少,但多于空白对照组,凋亡细胞核染色呈浅棕色。免疫组化结果显示,川芎嗪组大鼠的Bcl-2蛋白的表达明显增高,与模型组比较差别有统计学意义;Bax蛋白的表达较模型组低,两组比较差异有统计学意义。川芎嗪组的Bcl-2/Bax比值最高,与模型组和空白对照组比较差异有统计学意义。以上研究结果表明,川芎嗪注射液能够减少高眼压大鼠模型视网膜神经节细胞的凋亡,具有视神经保护作用,其机制可能是通过升高视网膜Bcl-2蛋白的表达,降低Bax蛋白的表达,从而改变Bcl-2/Bax的比值而实现的。
[1]Quigley HA,Broman AT.The number of peoplewith glaucoma worldwide in 2010 and 2020[J].Br J Ophthalmol,2006,90:262-267.
[2]葛坚.我国近五年青光眼临床与基础研究进展[J].中华眼科杂志,2005,56(41):710-716.
[3]袁援生.青光眼流行病学研究进展[J].昆明医学院学报,2010,31(9):1-3.
[4]Whitmore AV,Libby RT,John SW.Glaucoma:thinking in new ways-a role for autonomous axonal self-destruction and other compartmentalized processes[J].Prog Retin Eye Res,2005,24(6):639-662.
[5]Foster PJ.The epidemiology of primary angle closure and associated glaucomatous optic neuropathy[J].Semin Ophthalmol,2002,17(2):50-58.
[6]Chang EE,Goldberg JL.Glaucoma 2.0:neuroprotection,neuroregeneration,neuroenhancement[J].Ophthalmology,2012,119(5):979-986.
[7]任培华,冼绍祥,孙敬和,等.养心康对慢性心功能不全兔心室重构的影响[J].中药新药与临床药理,2012,23(1):58-60.
[8]任培华,张志敏,谭玮璐,等.全真一气汤多糖对慢性心功能不全大鼠TNF-α和IL-6的影响[J].中国中医急症,2014,23(10):1796-1798.
[9]Wan C,Qian J,Li F,et al.Ultrasound-targeted microbubble destruction enhances polyethylenimine-mediated gene trans-fection in vitro in human retinal pigment epithelial cells and in vivo in rat retina F[J].Mol Med Rep,2015,12(2):2835-2841.
[10]Cots D,Bosch A,Chillon M.Helper dependent adenovirus vectors:progress and future prospects[J].Curr Gene Ther,2013,13(5):370-381.
[11]Puppo A,CesiG,Marrocco E,etal.Retinal transduction profiles by high-capacity viral vectors[J].Gene Ther,2014,21(10):855-865.
[12]You Y,Gupta VK,Li JC,et al.0ptic neuropathies:characteristic features and mechanisms of retinalganglion cell loss[J].Rev Neurosci,2013,24(3):301-321.
[13]Dan YiWang,Arjun Ray,Kathryn Rodgers,etal.Globalgene expression changes in rat retinal ganglion cells in experimental glaucoma[J].Invest Ophthalmol Vis Sci,2010,51(8):4084-4095.
[14]陈伟,彭秀军.视网膜细胞凋亡与bcl-2基因[J].国际眼科杂志,2008,8(6):1236-1238.
[15]Dongmei He,Baoying Fang.Small hairpin RNA targeting at bcl-2 increases cytarabine-induced apoptosis in rajicells[J].Acta Biochim Biophys Sin,2009,41(2):131-136.
[16]王雪维.Bcl-2、Bax在青光眼神经节细胞凋亡中的研究进展[J].医学综述,2015,21(22):4077-4079.
[17]Huang W,Fileta J,Rawe I,eta1.Calpain activation in experimental glaucoma[J].Invest Ophthalmol vis Sci,2010,51(6):3049-3054.
[18]Rama Rao,Malla,Sreelatha,Gopinath,et al.uPAR and cathepsin B downregulation induces apoptosis by targeting calcineurin A to BAD via Bcl-2 in glioma[J].Journal of neuro-oncology,2012,107(1):69-80.
[19]Kirti Bhatt,Leping Feng,Navjotsingh Pabla,et al.Effects of targeted Bcl-2 expression in mitochondria or endoplasmic reticulum on renal tubular cell apoptosis[J].AJP-Renal Physiol,2008,294(3):499-507.
[20]杨雪梅.川芎嗪药理作用研究进展[J].中国生化药物杂志,2010,31(3):215-216.
[21]Cao J,Miao Q,Zhang J,et al.Inhibitory effect of tetramethylpyrazine on hepatocellular carcinoma:possible role of apoptosis and cell cycle arrest[J].J Biol Regul Homeost A-gents,2015,29(2):297-306.
Effects of Ligustrazine Injection on Expression of Bcl-2 and Bax Proteins in Retina and Apoptosis of Retinal Ganglion Cells of Rats with High Intraocular Pressure
DU Hongyan,LI Jianliang,LUO Huang,et al.Guangzhou Hospital of TCM,Guangdong,Guangzhou 510120,China.
Objective:To observe the effect of Ligustrazine Injection on the expression of Bcl-2 and Bax protein in the retina and the apoptosis of retinal ganglion cells of rats with high intraocular pressure.Methods:Ratmodels of intraocular hypertension were established by injecting the hydroxypropyl methylcellulose into the anterior chamber and randomly divided into the model group,Ligustrazine group and the blank control group,10 cases in each.Three days after the success of modeling,the drug was administered to the Ligustrazine group,which was intraperitoneally injected with 7.2 mg/kg.The model group and the blank control group were injected intraperitoneally with equal volume of saline per day,once a day for 2 weeks.The effect of Ligustrazine Injection on the expression of Bcl-2 and Bax protein and the apoptosis of retinal ganglion cells in ratswith high intraocular pressure was observed.ResultsThe expression of Bcl-2 protein in Ligustrazine group was significantly higher than that in the model group and the blank control group(P<0.01).The expression of Bax protein in Ligustrazine group was lower than that in the model group;the difference between the two groups was statistically significant(P<0.01).The ratio of Bcl-2/Bax in Ligustrazine group was the highest,which was significantly different from that in the model group and the blank control group(P<0.01).The apoptotic index of retinal ganglion cells in Ligustrazine group was lower than that in the model group;the difference between the two groups was statistically significant(P<0.01).ConclusionLigustrazine Injection can reduce the apoptosis of retinal ganglion cells in rats with high intraocular pressure.The mechanism may be achieved by increasing the expression of the retina Bcl-2 protein,reducing the expression of Bax protein,and changing the ratio of Bcl-2/Bax.
Ligustrazine Injection;Glaucoma;Retinal ganglion cell apoptosis;Bcl-2;Bax
R285.5
A
1004-745X(2017)10-1703-04
10.3969/j.issn.1004-745X.2017.10.004
广东省中医药局科研项目(20141211);广东省广州市卫生局科研项目(20142A010003)△通信作者(电子邮箱:gzwsr@126.com)
2017-05-03)

