氧化应激下黑素细胞自噬相关基因差异表达分析
龚晴丽 李雪 丁高中 凌雨婷 赵文娥 熊喜喜 鲁严
210029南京医科大学第一附属医院皮肤科(龚晴丽、李雪、丁高中、凌雨婷、熊喜喜、鲁严);南京医科大学分析测试中心(赵文娥)
·论著·
氧化应激下黑素细胞自噬相关基因差异表达分析
龚晴丽 李雪 丁高中 凌雨婷 赵文娥 熊喜喜 鲁严
210029南京医科大学第一附属医院皮肤科(龚晴丽、李雪、丁高中、凌雨婷、熊喜喜、鲁严);南京医科大学分析测试中心(赵文娥)
目的探讨过氧化氢(H2O2)对黑素细胞自噬的影响及可能的调节机制。方法取对数生长期健康人黑素细胞,分为空白对照组(不予任何处理)、阳性对照组(100 nmol/L西罗莫司处理)和实验组(体积分数为10⁃7~10⁃3的H2O2处理),处理4 h后,使用CCK8法、流式细胞仪分别检测各组黑素细胞活性及凋亡率。吖啶橙染色检测自噬小泡,透射电镜下观察自噬小体,Western印迹检测自噬特异性蛋白Beclin 1、微管相关蛋白轻链3B(LC3B)。最后采用包含84个自噬相关基因的RT2Profiler PCR Array筛选自噬相关的差异表达基因。结果黑素细胞分别经10⁃3、5 × 10⁃4、10⁃4、5 × 10⁃5、10⁃5、5 ×10⁃6、10⁃6H2O2处理后,细胞增殖活性及凋亡率与空白对照组相比差异均有统计学意义(F值分别为286.95、301.23,均P<0.05),且随H2O2体积分数升高,增殖活性降低,凋亡率升高。除5 × 10⁃6H2O2组分别与10⁃5、10⁃6H2O2组间相比细胞凋亡率差异无统计学意义外,上述各H2O2组间两两比较,黑素细胞增殖活性及凋亡率差异均有统计学意义(P<0.05)。吖啶橙染色及电镜观察发现,10⁃5H2O2、10⁃6H2O2和西罗莫司处理的黑素细胞中有自噬小体形成。Western印迹显示,10⁃5H2O2、10⁃6H2O2和西罗莫司组黑素细胞Beclin 1表达量和LC3B⁃Ⅱ/LC3B⁃Ⅰ比率均较空白对照组显著升高(P<0.05)。RT2 Profiler PCR Array结果显示,与空白对照组相比,10⁃5H2O2组、10⁃6H2O2组和西罗莫司组中ATG12、ATG3、ULK1、PIK3CG、PTEN、PIK3C3表达均显著上调,EIF2AK3表达显著下调;10⁃5H2O2组和西罗莫司组mTOR表达显著下调,ULK2表达显著上调;10⁃6H2O2组mTOR表达未发生明显改变,AMPK、JNK1表达显著上调。结论体积分数为10⁃5和10⁃6的H2O2均能有效诱导黑素细胞自噬,可能与影响相关信号分子表达相关。
黑素细胞;自噬;过氧化氢;氧化性应激;寡核苷酸序列分析;细胞凋亡
Namazi等[1]提出“黑素细胞经表皮丢失”即:氧化应激下线粒体结构功能障碍与自噬能力降低是导致黑素细胞粘附功能降低及经表皮丢失的重要原因[2⁃4]。适量的自噬被认为是重要的细胞保护性反应[5]。如何调整氧化应激下黑素细胞的自噬水平从而起到保护细胞的作用,需要明确这一过程中黑素细胞自噬调节的分子机制。我们应用不同体积分数的过氧化氢(H2O2)模拟氧化应激环境,诱导黑素细胞发生自噬,采用PCR阵列技术(PCR array)筛选相关差异表达基因,探讨氧化应激下黑素细胞自噬特有的调节方式。
材料与方法
一、主要试剂及仪器
Ham F12培养基、胎牛血清(FBS)、胰蛋白酶(美国Gibco公司),G418、左旋多巴(L⁃DOPA)、西罗莫司(美国Sigma公司),山羊抗小鼠IgG、山羊抗兔IgG二抗(上海碧云天生物技术有限公司),H2O2溶液(南京化学试剂有限公司),CCK8试剂盒(日本Dojindo公司),膜联蛋白V-异硫氰酸荧光素/碘化丙锭(Annexin V⁃FITC/PI)细胞凋亡检测试剂盒(南京凯基生物技术有限公司),吖啶橙(美国Amresco生化试剂公司),鼠抗人Beclin 1抗体、兔抗人微管相关蛋白1轻链3B(LC3B)抗体、鼠抗人3-磷酸甘油醛脱氢酶(GAPDH)抗体(美国 Sigma公司),RT2Profiler PCR Array(德国Qiagen公司),128C型酶标仪(奥地利CliniBio公司),流式细胞仪(美国Beckman Coulter有限公司)。
二、黑素细胞培养及处理
标本来自南京医科大学第一附属医院泌尿外科健康男性包皮环切术后的皮肤组织(已征得患者知情同意)。根据Swope等[6]的方法获得单细胞悬液,接种于含常规黑素细胞培养基[7]的培养瓶中,置于5%CO2培养箱37℃孵育。24 h后换液去除未贴壁细胞,并加入G418,48 h后改用不含G418的培养基,当细胞融合至80%~90%时,用2.5 g/L胰酶消化传代。L-多巴染色鉴定黑素细胞。
取对数生长期细胞,分为空白对照组(不予任何处理)、阳性对照组(100 nmol/L西罗莫司[8]处理)和实验组[不同体积分数(10⁃3,5 × 10⁃4,10⁃4,5 × 10⁃5,10⁃5,5 × 10⁃6,10⁃6,5 × 10⁃7,10⁃7)H2O2处理],处理 4 h后,检测黑素细胞增殖活性及凋亡率,并筛选出体积分数为10⁃4、10⁃5和10⁃6的H2O2进行吖啶橙染色、电镜观察及Western印迹实验。最后,根据上述实验结果确定用体积分数为 10⁃5和10⁃6的 H2O2诱导后进行PCR array实验,检测自噬相关差异表达基因。
三、CCK8检测H2O2处理后黑素细胞的增殖活性
向已处理好的96孔板中每孔加入100 μl培养基和10 μl CCK8溶液,孵育2 h后,使用酶标仪于450 nm波长处测定各孔的吸光度(A450值)。每组设4个平行孔,实验重复3次取均值。
四、流式细胞仪检测黑素细胞凋亡率
黑素细胞经不同体积分数H2O2处理后,胰酶消化,收集各组细胞,每组加入500 μl结合缓冲液、5 μl Annexin⁃FITC和5 μl PI混匀,室温避光反应5 ~15 min,用流式细胞仪检测凋亡率,将Annexin⁃FITC单标+Annexin⁃FITC和PI双标细胞视为凋亡细胞。实验重复3次。
五、吖啶橙染色检测自噬小泡
取对数生长期细胞接种于小培养皿中,细胞处理同前,磷酸盐缓冲液(PBS)洗涤后,用4%多聚甲醛室温下固定细胞10 min,再加入0.01%吖啶橙溶液,室温避光孵育10~20 min后,PBS清洗3次,倒置荧光显微镜下观察并摄片。
六、透射电镜下观察自噬小体
细胞处理同上,作用4 h后收集各组黑素细胞,加入4℃预冷的3%戊二醛,固定2 h以上,PBS洗涤3次,再加1%锇酸固定2 h,PBS洗涤3次,经脱水后包埋、切片(厚度为80 nm),3%醋酸铀-枸橼酸铅双染色,置于透射电镜下观察自噬小体并摄片。
七、Western印迹检测LC3B、Beclin 1蛋白表达
取对数生长期细胞,接种于直径为10 cm的培养皿,细胞经上述处理后,提取各组细胞总蛋白,经十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS⁃PAGE)电泳,转移至硝酸纤维素膜上。5%脱脂奶粉封闭1 h,与Beclin 1、LC3B特异性抗体及相应二抗作用后,经化学发光法显色。用Image J软件分析图片,计算LC3B、Beclin 1与GAPDH的灰度比值。
八、PCR array检测自噬相关基因的差异表达
取对数生长期黑素细胞接种于T25细胞培养瓶,细胞经上述处理4 h后,按照试剂盒说明操作提取总RNA,反转录生成cDNA。实时PCR采用RT2Profiler PCR Array检测自噬相关的84个基因,包含5种管家基因即次黄嘌呤磷酸核糖基转移酶、β2微球蛋白、大核糖体蛋白、GAPDH和β肌动蛋白。计算循环数阈值(Ct),ΔCt=目的基因Ct-平均管家基因 Ct,ΔΔCt= 实验组 ΔCt- 对照组 ΔCt,2⁃ΔΔCt值即为实验组目的基因较对照组相应基因表达的倍数。
九、统计学处理
使用SPSS 13.0软件进行统计学分析。实验数据均采用±s表示,各组间差异比较采用单因素方差分析法,各处理组与空白对照组比较采用LSD法,各处理组间两两比较采用SNK法,剂量效应采用Pearson相关性分析,P<0.05为差异有统计学意义。登陆网站http://www.sabiosciences.com/dataanalysis.php在线分析PCR Array检测结果,差异表达基因定义为2⁃ΔΔCt≥ 2的基因。
结 果
一、H2O2可降低黑素细胞的增殖活性
如表1所示,黑素细胞经10-7~10-3H2O2处理后,细胞增殖活性与空白对照组相比差异有统计学意义(P<0.05),且随H2O2体积分数升高而明显下降(r=-0.979,P<0.001)。100 nmol/L西罗莫司组黑素细胞增殖活性与空白对照组、5×10⁃7H2O2组和10⁃7H2O2组相比,差异均无统计学意义(P> 0.05),与其他各H2O2组相比差异均有统计学意义(P<0.05)。除5 × 10⁃7H2O2与10⁃7H2O2组间差异无统计学意义(P=0.518)外,其他各H2O2组间两两比较差异均有统计学意义(P<0.05)。
二、H2O2对黑素细胞凋亡的影响
分别经西罗莫司和H2O2处理4 h后,黑素细胞凋亡率与空白对照组相比差异均有统计学意义(P<0.05),且随H2O2体积分数升高而升高(r=0.950,P<0.001)。西罗莫司组与除5 × 10⁃7H2O2组外的其他各H2O2组相比,黑素细胞凋亡率差异均有统计学意义(P<0.05)。除5 × 10⁃7与10⁃7H2O2组间、5 × 10⁃6与10⁃5或10⁃6H2O2组间差异无统计学意义外(P>0.05)外,其余各H2O2组间两两比较差异均有统计学意义(P<0.05)。见表1。
三、吖啶橙染色检测结果
10⁃4H2O2组吖啶橙染色未见红色点状荧光,西罗莫司、10⁃5H2O2、10⁃6H2O23组黑素细胞内红色荧光强度明显高于空白对照组。见图1。
四、透射电镜下观察自噬小体
空白对照组黑素细胞内自噬小泡少见,细胞膜及核膜结构完整,线粒体及内质网结构正常。10⁃4H2O2处理组黑素细胞中线粒体肿胀,嵴排列紊乱,伴有内质网扩张,未见到自噬小泡。在西罗莫司、10⁃5H2O2、10⁃6H2O23个处理组中发现黑素细胞内自噬小泡明显增多,并观察到线粒体自噬,且线粒体损伤较10⁃4H2O2组轻,细胞核结构完整。见图2。
表1 不同体积分数H2O2对黑素细胞增殖活性及凋亡的影响(±s)

表1 不同体积分数H2O2对黑素细胞增殖活性及凋亡的影响(±s)
注:n=3。a:与空白对照组比较,P<0.05;b:与西罗莫司组比较,P<0.05
组别空白对照组西罗莫司组H2O2组10⁃3 5 × 10⁃4 10⁃4 5 × 10⁃5 10⁃5 5 × 10⁃6 10⁃6 5 × 10⁃7 10⁃7 F值P值增殖活性(A450)0.958±0.041 0.927±0.041凋亡率(%)10.08±1.13b 15.20±1.05a 0.247±0.008ab 0.307±0.026ab 0.388±0.036ab 0.509±0.039ab 0.669±0.032ab 0.748±0.039ab 0.798±0.021ab 0.895±0.014a 0.909±0.022a 286.95<0.05 61.74±1.63ab 53.72±2.30ab 43.76±3.32ab 34.51±3.43ab 22.03±1.47ab 20.85±1.20ab 18.04±3.05ab 12.71±0.58 12.01±1.02b 301.23<0.05
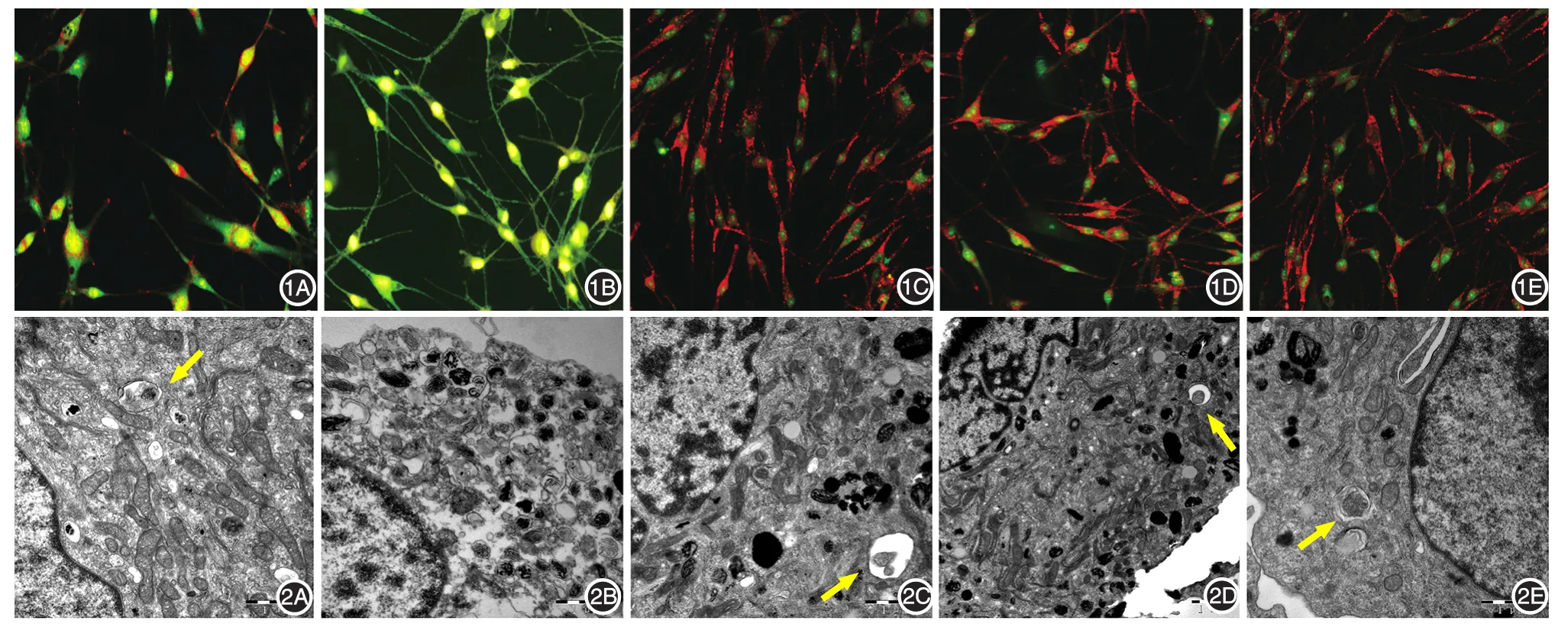
图1 倒置荧光显微镜下观察自噬小泡(吖啶橙染色×200) 1A:空白对照组胞质中见少量红色荧光;1B:10⁃4H2O2组细胞核及细胞质均呈黄绿色荧光,未见红色荧光;1C~1E:分别为10⁃5H2O2组、10⁃6H2O2组、西罗莫司组,3组细胞胞质内可见斑点状红色荧光,荧光强度明显高于空白对照组 图2 透射电镜下观察自噬小体(黄色箭头) 2A:空白对照组(×30 000)自噬小泡少见,细胞膜及核膜结构完整,线粒体及内质网结构正常;2B:10⁃4H2O2组(×30 000),线粒体肿胀、嵴排列紊乱,伴有内质网扩张,未见到自噬小泡;2C ~2E:分别为10⁃5H2O2组(× 30 000)、10⁃6H2O2组(× 20 000)、西罗莫司组(× 30 000),黑素细胞内自噬小泡明显增多,可见线粒体自噬,且线粒体损伤较10⁃4H2O2处理组轻,细胞核结构完整
五、Beclin 1与LC3B⁃Ⅱ/LC3B⁃Ⅰ比率比较
黑素细胞经西罗莫司、10⁃5H2O2和10⁃6H2O2作用后,Beclin 1/GAPDH灰度比值分别为2.953±0.480、2.048±0.212和2.550±0.281,均显著高于空白对照组(0.952 ± 0.110,均P<0.05),而 10⁃4H2O2组(0.521±0.062)显著低于空白对照组(P<0.05);LC3B⁃Ⅱ/LC3B⁃Ⅰ比率分别为6.088± 0.064、5.287 ±0.314和6.032±0.082,均显著高于空白对照组(2.151 ± 0.106,均P<0.05),而10⁃4H2O2组(2.396 ±0.144)与空白对照组相比差异无统计学意义(P=0.105),且西罗莫司组和 10⁃6H2O2组间差异无统计学意义(P=0.697)。见图3。
六、差异表达的自噬相关基因
见表2。与空白对照组相比,各处理组的自噬相关基因12(ATG12)、自噬相关基因3(ATG3)、失调51样激酶1(ULK1)、磷脂酰肌醇-3-激酶催化亚单位γ(PIK3CG)、磷脂酰肌醇-3-激酶class 3(PIK3C3)、第10号染色体缺失的磷酸酶和张力蛋白的同源基因(PTEN)表达均显著上调,真核生物翻译起始因子-2α-激酶-3基因(EIF2AK3)表达显著下调;10⁃5H2O2组和西罗莫司组哺乳动物西罗莫司靶蛋白(mTOR)基因显著下调,失调51样激酶2(ULK2)显著上调;10⁃6H2O2组mTOR未发生明显改变,腺苷酸活化蛋白激酶(AMPK)、c⁃Jun氨基末端激酶1(JNK1)显著上调。

图3 Western印迹检测各处理组Beclin 1与LC3B表达 1:空白对照组;2:10⁃4H2O2组;3:10⁃5H2O2组;4:10⁃6H2O2组;5:西罗莫司组。LC3B:微管相关蛋白1轻链3B;GAPDH:3⁃磷酸甘油醛脱氢酶

表2 H2O2作用后黑素细胞与空白对照组相比差异表达的自噬相关基因(2⁃ΔΔCt)a
讨 论
自噬与凋亡之间存在复杂的相互作用。在某些特定情况下,自噬能够抵抗或延缓凋亡,利于细胞存活;但有些情况下又可与凋亡协作导致细胞死亡或在凋亡缺陷时作为后备机制诱导细胞死亡[9]。H2O2浓度、作用时间及作用的细胞类型不同,细胞可能发生自噬、自噬性死亡、凋亡或坏死等[10]。为了诱导氧化应激下黑素细胞发生自噬,我们首先检测不同体积分数H2O2对黑素细胞增殖活性及凋亡的影响,结果显示,与空白对照组黑素细胞相比,10⁃4~ 10⁃3H2O2处理的黑素细胞增殖活性明显降低,且凋亡率显著升高;而10⁃7、5 × 10⁃7H2O2组黑素细胞凋亡率与空白对照组相比差异无统计学意义,且5 × 10⁃6与 10⁃5H2O2组间及5 × 10⁃6与 10⁃6H2O2组间细胞凋亡率差异无统计学意义,仅 10⁃4、10⁃5、10⁃6H2O23组黑素细胞增殖活性及凋亡率与空白对照组相比及组间比较均存在统计学差异。所以,在后续自噬实验中选择了这3个浓度。而根据吖啶橙染色、透射电镜及Western印迹实验结果,在10⁃5及10⁃6H2O2这两组观察到黑素细胞发生自噬,故选择这两个浓度进行PCR array实验。
自噬分子机制复杂,涉及30多个ATG基因、50个溶酶体水解酶及多条信号途径[11]。目前已证实ULK1/2⁃ATG13⁃ATG17复合物的形成可启动自噬,并受mTOR调控[12]。当mTOR被抑制时,ATG13去磷酸化并和ULK1/2⁃ATG17复合物结合,激活ULK1/2,引发自噬[13]。已知mTOR的上游受多条信号通路的调控,磷脂酰肌醇-3-激酶/丝氨酸-苏氨酸蛋白激酶(PI3K/AKT)信号转导通路是经典的调节自噬的mTOR上游信号途径[14]。PTEN是一肿瘤抑制因子,对PI3K/AKT途径进行负调节[15],从而抑制mTOR激活,促进自噬发生。
本研究显示,与空白对照组相比,10⁃5H2O2组和西罗莫司组PIK3CG、PTEN、ULK1、ULK2均显著上调2倍以上,10⁃5H2O2组和西罗莫司组mTOR显著下调,而10⁃6H2O2组mTOR无明显改变。由此,我们推测10⁃5H2O2和西罗莫司可能主要通过PTEN负调节PIK3/AKT/mTOR依赖性途径来促进自噬。而Ueno等[16]证明,在PTEN缺陷自噬受抑制的肝细胞中,西罗莫司并不能通过抑制mTOR来激发自噬,推测PTEN可通过mTOR非依赖性途径调节自噬,10⁃6H2O2可能通过以上途径诱导黑素细胞发生自噬。
Egan等[17]在线粒体自噬中观察到,氧化应激作用下线粒体去极化能够迅速减少细胞内ATP水平,激活AMPK,使其磷酸化,从而直接促进ULK1磷酸化,激活自噬。此外,在饥饿诱导的细胞自噬和心肌细胞自噬中观察到,AMPK还可通过磷酸化JNK1,使凋亡相关蛋白BCL2发生多位点磷酸化,从而抑制BCL2⁃Beclin 1结合,Beclin 1得以解离,使得PIK3C3⁃BECN1多重复合物活性增加,从而促进自噬发生[18⁃20]。本研究显示,与空白对照组相比,10⁃6H2O2组AMPK、JNK1显著上调,BCL2与BECN1的上调倍数大于其他两组;各组PIK3C3均显著上调。由此推断,10⁃6H2O2诱导的黑素细胞自噬可能通过上述途径进行调节。此外,10⁃5H2O2、10⁃6H2O2和西罗莫司可能均直接刺激PIK3C3活性增加,促进自噬。
值得注意的是,EIF2AK3在10⁃5H2O2、10⁃6H2O2和西罗莫司组中均出现显著下调,且下调倍数>15。EIF2AK3参与内质网类似激酶⁃真核细胞翻译启始子2α(PERK⁃eIF2α)通路介导的内质网应激(ERS)[21],近年研究发现,ERS途径也是自噬的重要调控通路[22]。在ERS状态下,EIF2AK3通过自身胞质侧羧基端的蛋白激酶催化促进自身磷酸化,继而使eIF2α蛋白51位丝氨酸磷酸化,导致蛋白合成受抑,减轻内质网负荷。EIF2AK3下调和EIF2AK3磷酸化水平增高是同时进行的,这也合理解释了10⁃5H2O2、10⁃6H2O2组 EIF2AK3 基因较空白对照组显著下调的结果。由此推测,ERS可能参与调控氧化应激诱导的黑素细胞自噬,通过EIF2AK3自身磷酸化来磷酸化eIF2α,进而上调ATG12并促进自噬。
综上所述,10⁃5H2O2和10⁃6H2O2模拟的氧化应激条件均可诱导黑素细胞发生自噬,且不同浓度H2O2的诱导机制可能不仅涉及共同的调节通路,还涉及不同的调节方式。
[1]Namazi MR.Neurogenic dysregulation,oxidative stress,autoim⁃munity, and melanocytorrhagy in vitiligo: can they be interconnected?[J].Pigment Cell Res,2007,20(5):360 ⁃363.DOI:10.1111/j.1600⁃0749.2007.00408.x.
[2]Prignano F,Pescitelli L,Becatti M,et al.Ultrastructural and functional alterations of mitochondria in perilesional vitiligo skin[J].J Dermatol Sci,2009,54(3):157 ⁃167.DOI:10.1016/j.jdermsci.2009.02.004.
[3]李雪,周梅华,吴迪,等.白癜风皮损边缘黑素细胞线粒体超微结构的电镜观察[J].中华皮肤科杂志,2013,46(9):636⁃639.DOI:10.3760/cma.j.issn.0412⁃4030.2013.09.008.
[4]Schallreuter KU,Gibbons NC,Zothner C,et al.Hydrogen peroxide⁃mediated oxidative stress disrupts calcium binding on calmodulin:more evidence for oxidative stress in vitiligo[J].Biochem Biophys Res Commun,2007,360(1):70⁃75.DOI:10.1016/j.bbrc.2007.05.218.
[5]Lemasters JJ.Selective mitochondrial autophagy,or mitophagy,as a targeted defense againstoxidative stress,mitochondrial dysfunction,and aging[J].Rejuvenation Res,2005,8(1):3 ⁃5.DOI:10.1089/rej.2005.8.3.
[6]Swope VB,Medrano EE,Smalara D,et al.Long⁃term proliferation of human melanocytes is supported by the physiologic mitogens alpha⁃melanotropin,endothelin⁃1,and basic fibroblast growth factor[J].Exp Cell Res,1995,217(2):453⁃459.DOI:10.1006/excr.1995.1109.
[7]Hu DN,McCormick SA,Seedor JA,et al.Isolation,purification and cultivation of conjunctival melanocytes[J].Exp Eye Res,2007,84(4):655⁃662.DOI:10.1016/j.exer.2006.12.003.
[8]Li X,Wu D,Shen J,et al.Rapamycin induces autophagy in the melanoma cell line M14 via regulation of the expression levels of Bcl⁃2 and Bax[J].Oncol Lett,2013,5(1):167 ⁃172.DOI:10.3892/ol.2012.986.
[9]Eisenberg⁃Lerner A,Bialik S,Simon HU,et al.Life and death partners:apoptosis,autophagy and the cross⁃talk between them[J].Cell Death Differ,2009,16(7):966 ⁃975.DOI:10.1038/cdd.2009.33.
[10]Whittemore ER,Loo DT,Watt JA,et al.A detailed analysis of hydrogen peroxide⁃induced cell death in primary neuronal culture[J].Neuroscience,1995,67(4):921⁃932.
[11]Chen Y,Klionsky DJ.The regulation of autophagy⁃unanswered questions[J].J Cell Sci,2011,124(Pt 2):161⁃170.DOI:10.1242/jcs.064576.
[12]Kabeya Y,Kamada Y,Baba M,et al.Atg17 functions in cooperation with Atg1 and Atg13 in yeast autophagy[J].Mol Biol Cell,2005,16(5):2544⁃2553.DOI:10.1091/mbc.E04⁃08⁃0669.
[13]Jung CH,Jun CB,Ro SH,et al.ULK⁃Atg13⁃FIP200 complexes mediate mTOR signaling to the autophagy machinery[J].Mol Biol Cell,2009,20(7):1992⁃2003.DOI:10.1091/mbc.E08⁃12⁃1249.
[14]Batty IH,Hickinson DM,Downes CP.Cross⁃talk between phospholipase C and phosphoinositide 3⁃kinase signalling pathways[J].Biochem Soc Trans,1997,25(4):1132⁃1137.DOI:10.1042/bst0251132.
[15]Maehama T,Dixon JE.The tumor suppressor,PTEN/MMAC1,dephosphorylates the lipid second messenger,phosphatidylino⁃sitol 3,4,5⁃trisphosphate[J].J Biol Chem,1998,273(22):13375⁃13378.
[16]Ueno T,Sato W,Horie Y,et al.Loss of Pten,a tumor suppressor,causes the strong inhibition of autophagy without affecting LC3 lipidation[J].Autophagy,2008,4(5):692⁃700.
[17]Egan DF,Shackelford DB,Mihaylova MM,et al.Phosphorylation of ULK1(hATG1)by AMP⁃activated protein kinase connects energy sensing to mitophagy[J].Science,2011,331(6016):456⁃461.DOI:10.1126/science.1196371.
[18]Itakura E,Kishi C,Inoue K,et al.Beclin 1 forms two distinct phosphatidylinositol 3⁃kinase complexes with mammalian Atg14 and UVRAG[J].Mol Biol Cell,2008,19(12):5360⁃5372.DOI:10.1091/mbc.E08⁃01⁃0080.
[19]Wei Y,Pattingre S,Sinha S,et al.JNK1⁃mediated phosphorylation of Bcl⁃2 regulates starvation ⁃induced autophagy[J].Mol Cell,2008,30(6):678⁃688.DOI:10.1016/j.molcel.2008.06.001.
[20]He C,Zhu H,Li H,et al.Dissociation of Bcl⁃2⁃Beclin1 complex by activated AMPK enhances cardiac autophagy and protects against cardiomyocyte apoptosis in diabetes[J].Diabetes,2013,62(4):1270⁃1281.DOI:10.2337/db12⁃0533.
[21]Verfaillie T,Salazar M,Velasco G,et al.Linking ER stress to autophagy:potential implications for cancer therapy[J/OL].Int J Cell Biol,2010[2015⁃04⁃05].http://www.ncbi.nlm.nih.gov,SSL+IJCB2010⁃930509.pdf.DOI:10.1155/2010/930509.
[22]Yorimitsu T,Klionsky DJ.Endoplasmic reticulum stress:a new pathway to induce autophagy[J].Autophagy,2007,3(2):160 ⁃162.
Differential expression of autophagy⁃related genes in melanocytes under oxidative stress
Gong Qingli,Li Xue,Ding Gaozhong,Ling Yuting,Zhao Wen′e,Xiong Xixi,Lu Yan
Department of Dermatology,The First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China(Gong QL,Li X,Ding GZ,Ling YT,Xiong XX,Lu Y);Department of Analysis and Testing Center,Nanjing Medical University,Nanjing 210029,China(Zhao WE)
Lu Yan,Email:luyan6289@163.com
ObjectiveTo evaluate the effect of hydrogen peroxide(H2O2) on autophagy in melanocytes,and to explore its possible regulatory mechanisms.MethodsNormal human melanocytes at exponential growth phase were divided into several groups:blank control group receiving no treatment,positive control group treated with 100 nmol/L sirolimus solution,and experiment groups treated with H2O2solution at different volume fractions of 10⁃7-10⁃3respectively.After 4⁃hour treatment,cell counting kit⁃8(CCK⁃8)assay and flow cytometry were performed to evaluate the cellular proliferative activity and detect apoptosis of melanocytes respectively.Acridine orange staining was performed to detect autophagosome formation,transmission electron microscopy to observe ultrastructural changes of autophagosomes,and Western blot analysis to measure the expression of autophagy⁃specific protein Beclin 1 and microtubule⁃associated protein 1 light chain 3B(LC3B).A total of 84 autophagy⁃related genes were analyzed by RT2Profiler PCR Array,so as to screen differentially expressed autophagy⁃related genes.ResultsAfter the treatment with H2O2at different volume fractions of 10⁃3,5 × 10⁃4,10⁃4,5 × 10⁃5,10⁃5,5 × 10⁃6and 10⁃6,experiment groups showed significantly decreased cellular proliferative activity,but significantly increased apoptosis rate compared with the blank control group(F=286.95,301.23,respectively,bothP< 0.05).With the increase in volume fractions of H2O2,the cellular proliferative activity was significantly gradually decreased(P< 0.05),while the apoptosis rate showed an opposite trend(P< 0.05),except that the 5 ×10⁃6H2O2group showed no significant differences in the apoptosis rate compared with the 10⁃5H2O2group and 10⁃6H2O2group.Acridine orange staining and electron microscopy showed autophagosome formation in the 10⁃5H2O2group,10⁃6H2O2group and positive control group.Western blot analysis revealed that Beclin1 expression and LC3B⁃Ⅱ/LC3B⁃Ⅰ ratio were significantly higher in the 10⁃5H2O2group,10⁃6H2O2group and positive control group than in the blank control group(allP< 0.05).RT2Profiler PCR Array showed significant up⁃regulation of ATG12,ATG3,ULK1,PIK3CG,PTEN and PIK3C3 genes and significant down⁃regulation of EIF2AK3 gene in the 10⁃5H2O2group,10⁃6H2O2group and positive control group compared with the blank control group.In the 10⁃5H2O2group and positive control group,the mTOR gene was significantly up⁃regulated,and the ULK2 gene was significantly down⁃regulated.The 10⁃6H2O2group showed no obvious changes in the expression of mTOR gene,but significant up⁃regulation of AMPK and JNK1 genes.ConclusionH2O2at volume fractions of 10⁃5and 10⁃6can induce autophagy in melanocytes,likely by influencing the expression of some related signaling molecules.
Melanocytes;Autophagy;Hydrogen peroxide;Oxidative stress;Oligonucleotide array sequence analysis;Apoptosis
鲁严,Email:luyan6289@163.com
10.3760/cma.j.issn.0412⁃4030.2017.08.001
国家自然科学基金(81171517);江苏省“333工程”培养资金(BRA2013279)
Fund programs:National Natural Science Foundation of China(81171517);The“333”Project of Jiangsu Province(BRA2013279)
2016⁃07⁃12)
(本文编辑:尚淑贤)

