医疗器械重复接触全身毒性试验新方法的研究
——大鼠胃肠外双途径接触试验
范春光,侯丽,展荣凯,许晶,朱福余
(山东省医疗器械产品质量检验中心,山东省医疗器械生物学评价重点实验室,济南250101)
1 引 言
在对医疗器械进行生物学评价的过程中,有很多长期接触人体的产品须进行重复接触全身毒性试验以评估其产生全身毒性的可能性[1-2]。在设计试验方案时,首先要选择一种临床相关性最好的接触途径[2-3]。在这些产品中,有很多是植入类器械,所以选择植入途径是适宜的。然而,有些植入器械由于体积过大等原因很难植入动物体内;另外,对有些产品来说,植入途径也不是临床相关性最好的接触途径。这时一般考虑制备试验样品浸提液进行试验[4]。但是,一直以来,由于相关标准中对非极性浸提液的试验条件如注射体积、注射频率等未作明确规定,导致试验人员无标准化的试验方法可以参考。以往制备浸提液进行的重复接触全身毒性试验一般只检测了试验样品生理盐水浸提液,而未对非极性浸提液进行检测。这样,对试验样品重复接触全身毒性的评价就不够全面。针对以上问题,本研究设计了胃肠外双途径接触试验法,设定了相应的注射剂量体积及频率等条件,静脉注射极性浸提介质(生理盐水)、腹腔注射非极性浸提介质(玉米油)于同一只大鼠体内,14 d后,根据试验结果判断此方法能否引起大鼠产生不良反应,进而分析此方法能否应用于医疗器械大鼠重复接触全身毒性试验。
2 试验材料
2.1 试剂
生理盐水:山东华鲁制药有限公司,500 mL,批号:0105062207;玉米油:sigma,C8267-2.5L,lot#MKBV2080V:戊巴比妥钠:Ruitaibio,批号:2015-04-18。
2.2 器具和仪器设备
注射器:碧迪医疗器械(上海)有限公司,5 mL,批号:1404;采血管:上海科华检验医学产品有限公司,5 mL无添加剂,批号:20150120;2 mL EDTA2K抗凝,批号:20150619;2 mL柠檬酸钠抗凝,批号:20150616;全自动血液分析仪:SYSMEX,型号:XT-2000i;全自动生化分析仪:BECKMAN,型号:AUA680;自动血凝分析仪:SYSMEX,型号:CA-7000;系统显微镜:奥林巴斯,型号:BX51-32H01。
2.3 试验动物
SD大鼠,北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。60只,雌、雄各半,6~9周,适应期7 d。体重范围:试验开始时雌性为177~209 g,雄性为219~250 g。标记方法:苦味酸涂抹染色法。
3 试验方法
3.1 动物选择及随机分组
从检疫后SD大鼠中挑选60只。称重后随机分组并染色编号。雌雄各10只为一组,共3组,分别为对照组、试验组1和试验组2。
3.2 试验液接触
为同时观察试验操作对大鼠的影响,对照组不做任何处理;试验组1按照5 mL/kg·BW的剂量于试验开始第1、4、7、10、13 d腹腔注射玉米油;试验组2按照10 mL/kg·BW的剂量连续14 d尾静脉注射生理盐水,同时按照5 mL/kg·BW的剂量于试验开始第1、4、7、10、13 d腹腔注射玉米油。见表1、表 2。

表1 组别与对应的处理方法Table 1 Groups and the treatments
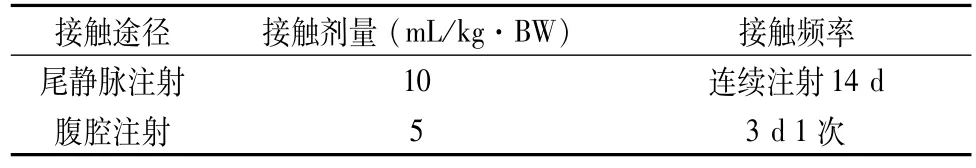
表2 处理条件Table 2 Treatments parameters
3.3 称量体重
试验期间每周称重1次。
3.4 临床观察
每天对大鼠进行临床观察。
3.5 血液收集
解剖前一天大鼠称重并禁食12~18 h。解剖前,按照40 mg/kg·BW的剂量腹腔注射戊巴比妥钠溶液麻醉大鼠。腹主动脉收集血液进行临床病理检测。检测指标及对应英文缩写见表3。

表3 临床病理检测指标及对应英文缩写Table 3 parameters of clinical examination and english abbreviations
3.6 大体检查
大鼠取血后实施安乐死,随即对每只大鼠进行大体检查;将所有大鼠的卵巢/睾丸、子宫/附睾、脾、肝、肾上腺、肾、胸腺、心和脑等去除邻近组织并及时称量其湿重;取所有大鼠的卵巢/睾丸、子宫/附睾、脾、胃、肠、胰、肝、肾上腺、肾、胸腺、心、肺、甲状腺和脑等器官作为样本及时固定在10%福尔马林溶液中以备后续处理。
3.7 组织病理学检查
将固定后的大鼠器官制成切片进行组织病理学检查。
3.8 统计与分析
将试验组和对照组大鼠的以上各项指标分别进行比较和统计学分析(SPSS17.0)。如果P<0.05则认为两组之间存在显著性差异。对于试验中出现的差异结合试验各项结果进行综合分析。
4 试验结果
4.1 胃肠外双途径接触试验法对大鼠一般状态及体重数据的影响
在试验过程,各组大鼠均未出现明显的异常临床表现。双途径组雄性大鼠第2周平均体重显著性低于对照组雄性大鼠(P<0.05),但试验组体重均大幅增长,结合其它观察指标综合分析认为差异没有体现毒性特征,仅体现统计学意义。数据见表4、表5。
表4 试验期间雌性大鼠各组体重数据(±SD)Table 4 Weight data of each female group(±SD)
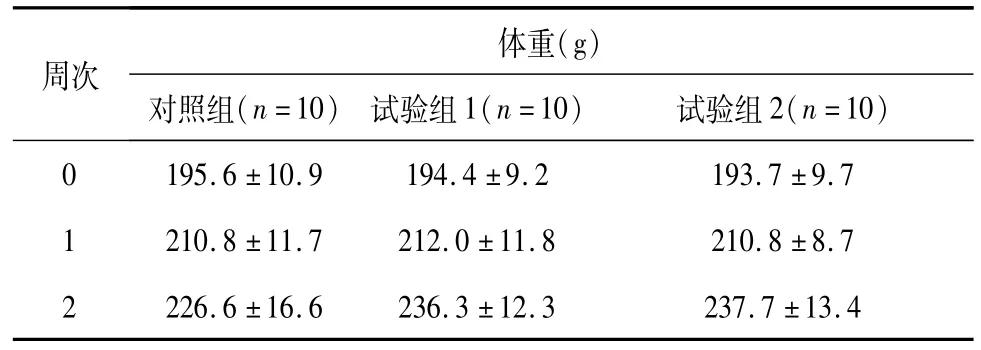
表4 试验期间雌性大鼠各组体重数据(±SD)Table 4 Weight data of each female group(±SD)
体重(g )周次对照组(n=10) 试验组1(n=10) 试验组2(n=10)0 195.6±10.9 194.4±9.2 193.7±9.7 1 210.8±11.7 212.0±11.8 210.8±8.7 2 226.6±16.6 236.3±12.3 237.7±13.4
表5 试验期间雄性大鼠各组体重数据(±SD)Table 5 Weight data of each male group(±SD)
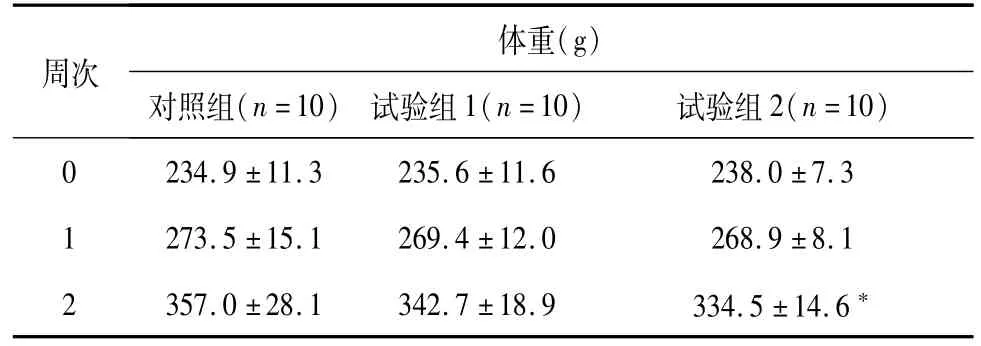
表5 试验期间雄性大鼠各组体重数据(±SD)Table 5 Weight data of each male group(±SD)
注:与对照组比较,*:P<0.05。
体重(g )周次对照组(n=10) 试验组1(n=10) 试验组2(n=10)0 234.9±11.3 235.6±11.6 238.0±7.3 1 273.5±15.1 269.4±12.0 268.9±8.1 2 357.0±28.1 342.7±18.9 334.5±14.6*
4.2 胃肠外双途径接触试验法对大鼠临床病理指标的影响
与对照组相比,双途径组大鼠各项临床病理指标之间未见毒性相关性显著性差异。个别指标出现统计学差异,但差异幅度小,均非病理性改变,结合试验组1结果及雌雄性数据综合分析认为差异仅体现统计学意义。结果见表6~9。
表6 雌性大鼠各组血液学检测结果(±SD)Table 6 Hematology data of each female group(±SD)
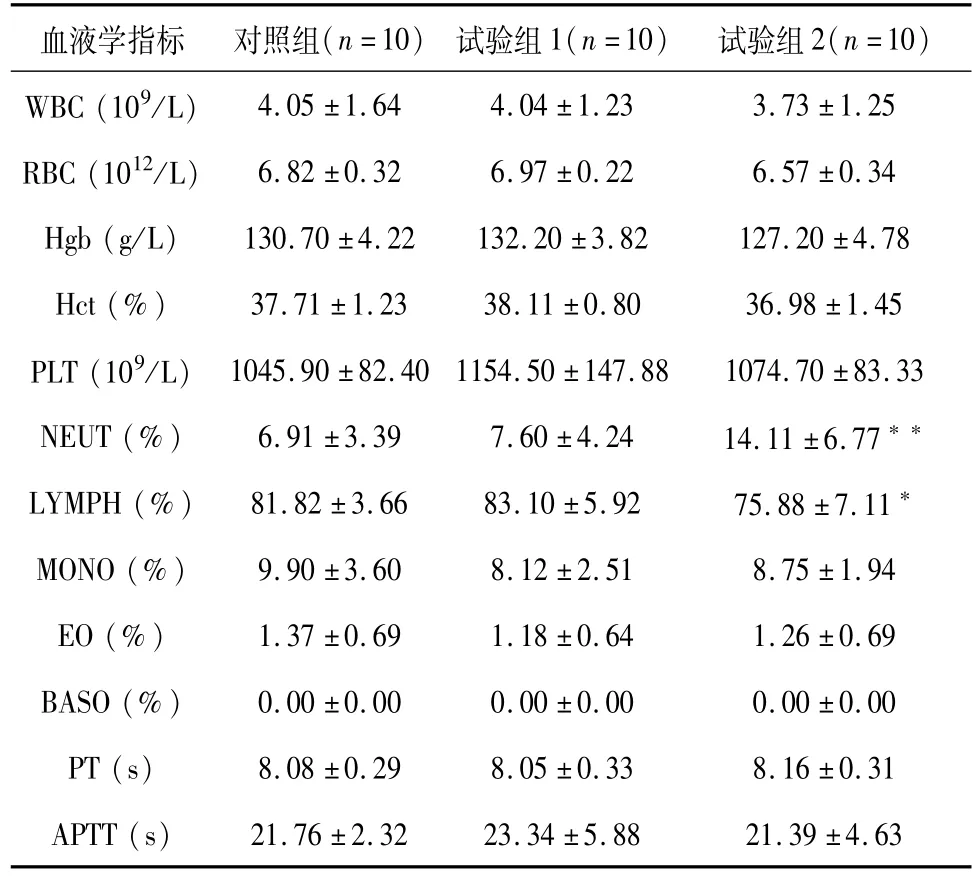
表6 雌性大鼠各组血液学检测结果(±SD)Table 6 Hematology data of each female group(±SD)
注:与对照组比较,*:P<0.05,**:P<0.01。
血液学指标 对照组(n=10) 试验组1(n=10) 试验组2(n=10)4.05±1.64 4.04±1.23 3.73±1.25 RBC(1012/L) 6.82±0.32 6.97±0.22 6.57±0.34 Hgb(g/L) 130.70±4.22 132.20±3.82 127.20±4.78 Hct(%) 37.71±1.23 38.11±0.80 36.98±1.45 PLT(109/L) 1045.90±82.40 1154.50±147.88 1074.70±83.33 NEUT(%) 6.91±3.39 7.60±4.24 14.11±6.77**LYMPH(%) 81.82±3.66 83.10±5.92 75.88±7.11*MONO(%) 9.90±3.60 8.12±2.51 8.75±1.94 EO(%) 1.37±0.69 1.18±0.64 1.26±0.69 BASO(%) 0.00±0.00 0.00±0.00 0.00±0.00 PT(s) 8.08±0.29 8.05±0.33 8.16±0.31 APTT(s)WBC(109/L)21.76±2.32 23.34±5.88 21.39±4.63
表7 雄性大鼠各组血液学检测结果(±SD)Table 7 Hematology data of each male group(±SD)
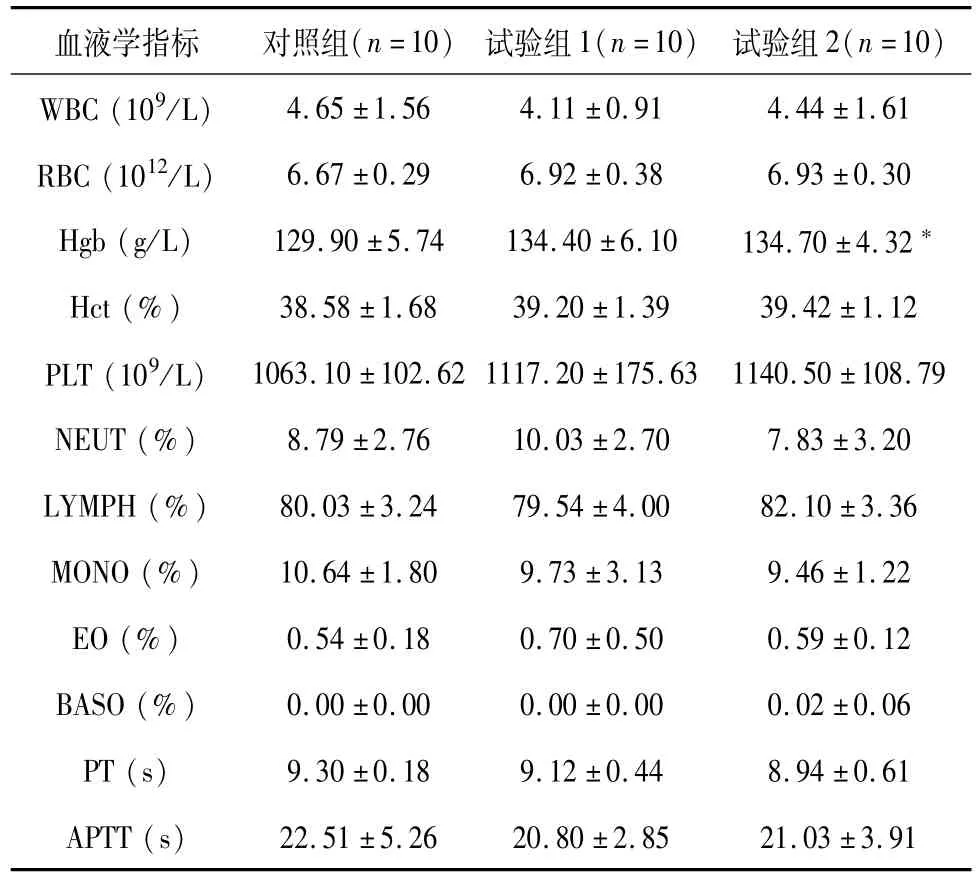
表7 雄性大鼠各组血液学检测结果(±SD)Table 7 Hematology data of each male group(±SD)
注:与对照组比较,*P<0.05。
血液学指标 对照组(n=10) 试验组1(n=10) 试验组2(n=10)4.65±1.56 4.11±0.91 4.44±1.61 RBC(1012/L) 6.67±0.29 6.92±0.38 6.93±0.30 Hgb(g/L) 129.90±5.74 134.40±6.10 134.70±4.32*Hct(%) 38.58±1.68 39.20±1.39 39.42±1.12 PLT(109/L) 1063.10±102.62 1117.20±175.63 1140.50±108.79 NEUT(%) 8.79±2.76 10.03±2.70 7.83±3.20 LYMPH(%) 80.03±3.24 79.54±4.00 82.10±3.36 MONO(%) 10.64±1.80 9.73±3.13 9.46±1.22 EO(%) 0.54±0.18 0.70±0.50 0.59±0.12 BASO(%) 0.00±0.00 0.00±0.00 0.02±0.06 PT(s) 9.30±0.18 9.12±0.44 8.94±0.61 APTT(s)WBC(109/L)22.51±5.26 20.80±2.85 21.03±3.91
4.3 胃肠外双途径接触试验法对大鼠大体及组织病理的影响
大体检查试验组1、2动物腹腔内可见少量未吸收乳白色油类成分,见图1。图2为对照组动物腹腔所见。试验组和对照组雌、雄性大鼠各脏器均未观察到明显肉眼可见的病理改变。与对照组动物相比,双途径组动物各脏器重量未见毒性相关的显著性差异,个别出现统计学差异脏器经组织病理学检查排除病理损伤,其他指标如临床病理等也未见相关脏器受损而致的相应改变。结合试验组1结果及雌雄性数据综合分析,认为差异仅体现统计学意义。结果见表10、表11。试验组及对照组雌、雄性大鼠组织病理学检查中未观察到明显组织病理学改变。
表8 雌性大鼠各组血液生化学检测结果(±SD)Table 8 Clinical chemistry data of each female group(±SD)
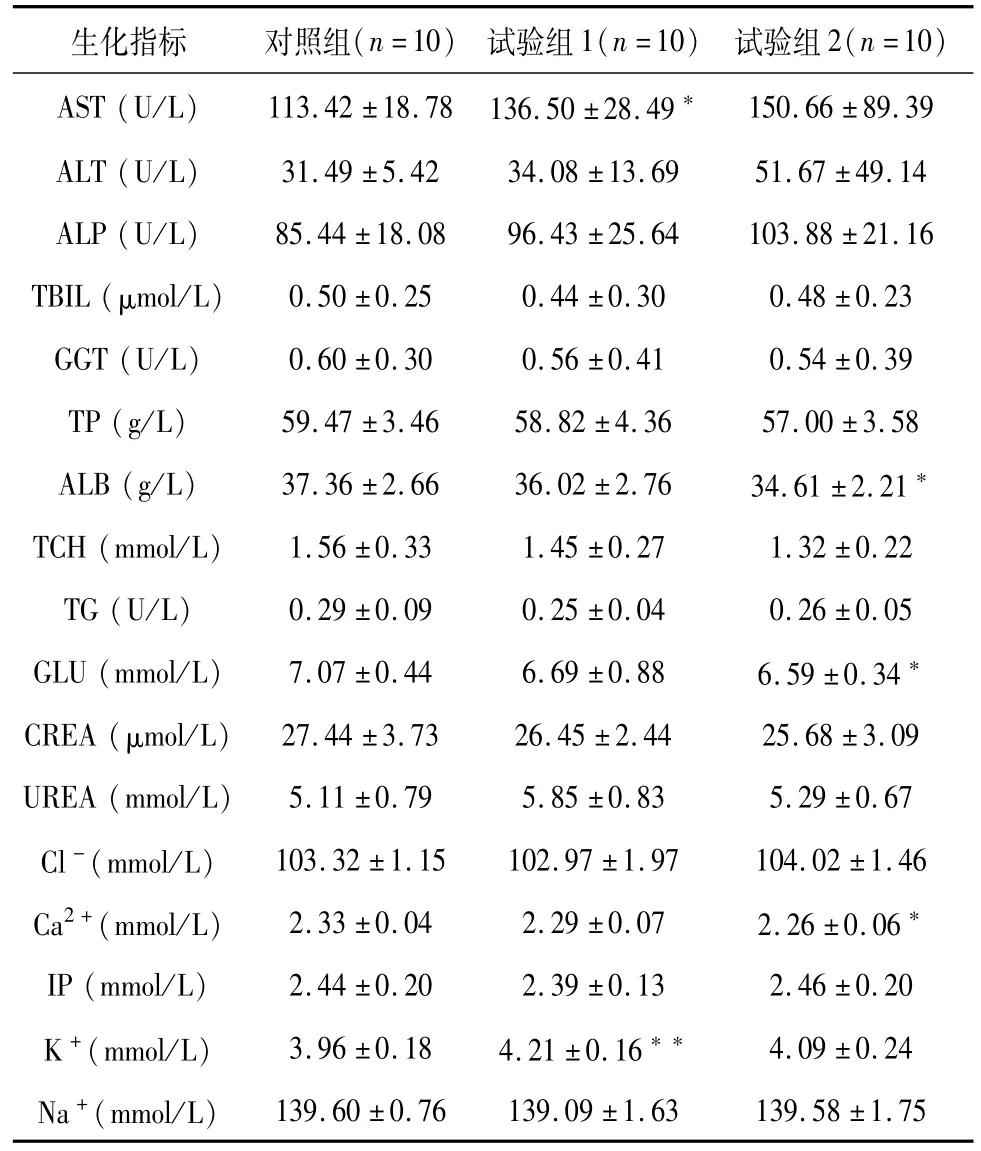
表8 雌性大鼠各组血液生化学检测结果(±SD)Table 8 Clinical chemistry data of each female group(±SD)
注:与对照组比较,*:P<0.05,**:P<0.01。
生化指标 对照组(n=10) 试验组1(n=10) 试验组2(n=10)150.66±89.39 ALT(U/L) 31.49±5.42 34.08±13.69 51.67±49.14 ALP(U/L) 85.44±18.08 96.43±25.64 103.88±21.16 TBIL(μmol/L) 0.50±0.25 0.44±0.30 0.48±0.23 GGT(U/L) 0.60±0.30 0.56±0.41 0.54±0.39 TP(g/L) 59.47±3.46 58.82±4.36 57.00±3.58 ALB(g/L) 37.36±2.66 36.02±2.76 34.61±2.21*TCH(mmol/L) 1.56±0.33 1.45±0.27 1.32±0.22 TG(U/L) 0.29±0.09 0.25±0.04 0.26±0.05 GLU(mmol/L) 7.07±0.44 6.69±0.88 6.59±0.34*CREA(μmol/L) 27.44±3.73 26.45±2.44 25.68±3.09 UREA(mmol/L) 5.11±0.79 5.85±0.83 5.29±0.67 Cl-(mmol/L) 103.32±1.15 102.97±1.97 104.02±1.46 Ca2+(mmol/L) 2.33±0.04 2.29±0.07 2.26±0.06*IP(mmol/L) 2.44±0.20 2.39±0.13 2.46±0.20 K+(mmol/L) 3.96±0.18 4.21±0.16** 4.09±0.24 Na+(mmol/L)AST(U/L) 113.42±18.78 136.50±28.49*139.60±0.76 139.09±1.63 139.58±1.75
表9 雄性大鼠各组血液生化学检测结果(±SD)Table 9 Clinical chemistry data of each male group(±SD)

表9 雄性大鼠各组血液生化学检测结果(±SD)Table 9 Clinical chemistry data of each male group(±SD)
注:与对照组比较,*:P<0.05,**:P<0.01。
生化指标 对照组(n=10) 试验组1(n=10) 试验组2(n=10)156.98±59.45 150.77±37.57 137.68±24.19 ALT(U/L) 52.95±25.08 48.95±13.86 44.68±11.83 ALP(U/L) 244.68±58.72 218.10±35.28 232.80±37.72 TBIL(μmol/L) 0.25±0.14 0.34±0.10 0.39±0.15*GGT(U/L) 0.84±0.39 1.04±0.18 0.72±0.31 TP(g/L) 50.89±1.69 51.98±1.74 51.46±2.18 ALB(g/L) 28.72±1.02 29.59±1.33 29.45±1.22 TCH(mmol/L) 1.26±0.15 1.65±0.24** 1.50±0.30*TG(U/L) 0.31±0.09 0.32±0.06 0.36±0.15 GLU(mmol/L) 6.04±0.50 6.55±0.78 6.43±0.61 CREA(μmol/L) 24.24±2.66 22.82±1.79 22.80±2.24 UREA(mmol/L) 4.56±0.49 4.47±0.59 4.24±0.45 Cl-(mmol/L) 103.12±1.60 103.20±1.17 104.71±1.34*Ca2+(mmol/L) 2.17±0.03 2.18±0.05 2.19±0.05 IP(mmol/L) 2.89±0.18 2.69±0.14* 2.77±0.13 K+(mmol/L) 4.23±0.21 4.31±0.18 4.33±0.18 Na+(mmol/L) 141.22±0.94 141.15±0.97 142.20±0.83 AST(U/L)*

图1 试验组腹腔Fig 1 Peritoneal cavity of test group

图2 对照组腹腔Fig 2 Peritoneal cavity of control group
表10 雌性大鼠脏器重量结果(±SD)Table 10 Organ weight data of each female group(±SD)

表10 雌性大鼠脏器重量结果(±SD)Table 10 Organ weight data of each female group(±SD)
注:与对照组比较,**:P<0.01。
脏器名称 对照组(n=10) 试验组1(n=10) 试验组2(n=10)1.809±0.125 1.786±0.080 1.776±0.080胸腺 0.414±0.062 0.463±0.130 0.398±0.042心 0.840±0.104 0.760±0.063 0.730±0.047**肝 6.548±0.494 6.819±0.333 6.740±0.623脾 0.502±0.092 0.498±0.080 0.521±0.064肾上腺 0.060±0.008 0.058±0.006 0.063±0.005肾 1.769±0.196 1.782±0.129 1.830±0.076卵巢 0.120±0.016 0.110±0.019 0.125±0.017子宫脑0.499±0.101 0.536±0.160 0.561±0.217
5 结论
在该试验条件下,胃肠外双途径组按照10 mL/kg·BW/天的剂量尾静脉注射生理盐水14 d,同时按照5 mL/kg·BW的剂量3 d 1次腹腔注射玉米油后,大鼠未出现导致毒性反应的特异性变化。结果表明胃肠外双途径接触试验法能够使大鼠同时充分接触极性及非极性浸提介质又不引起大鼠产生不良病理反应。
表11 雄性大鼠脏器重量结果(±SD)Table 11 Organ weight data of each male group(±SD)
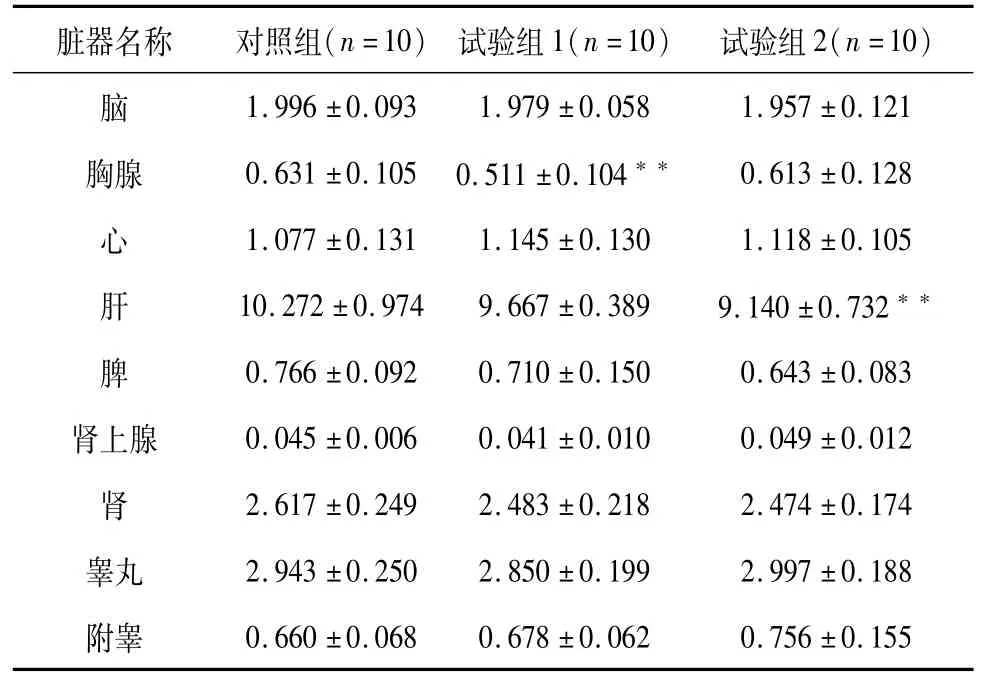
表11 雄性大鼠脏器重量结果(±SD)Table 11 Organ weight data of each male group(±SD)
注:与对照组比较,**:P<0.01。
脏器名称 对照组(n=10) 试验组1(n=10) 试验组2(n=10)1.996±0.093 1.979±0.058 1.957±0.121胸腺 0.631±0.105 0.511±0.104** 0.613±0.128心 1.077±0.131 1.145±0.130 1.118±0.105肝 10.272±0.974 9.667±0.389 9.140±0.732**脾 0.766±0.092 0.710±0.150 0.643±0.083肾上腺 0.045±0.006 0.041±0.010 0.049±0.012肾 2.617±0.249 2.483±0.218 2.474±0.174睾丸 2.943±0.250 2.850±0.199 2.997±0.188附睾脑0.660±0.068 0.678±0.062 0.756±0.155
6 讨论
由于人体的体液内环境兼具极性和非极性的性质,所以当某些医疗器械长期接触人体时,其潜在的极性及非极性有害物质会同时释放到人体内,从而对人体产生毒性作用。本研究设计的双途径接触试验法具有更好的临床相关性,能检测样品极性及非极性可沥虑物的综合作用,更加全面的评价医疗器械的重复接触全身毒性。
研究中两种接触途径的注射体积及频率是比较关键的技术指标。研究表明,非水溶液按照5~10 mL/kg·BW的接触体积腹腔注射大鼠3 d后,可基本吸收完全,且过于频繁的腹腔注射,可能会增加如腹腔脏器损伤及注射至肠管内或膀胱内等不良反应的可能性[5]。研究认为,对于静脉途径重复接触全身毒性试验,为避免引起大鼠过度应激可按照10 mL/kg·BW的接触体积[6]进行试验。该研究的结果中,双途径组动物在本试验条件下,临床观察未见明显不良反应。剖检时,腹腔内玉米油大部分已被吸收。体重数据、血液学血生化数据、大体及组织病理学检查均未见明显毒性或病理性改变。该研究结果表明,胃肠外双途径接触试验法,既可使大鼠同时持续暴露于极性及非极性浸提介质中又不引起大鼠产生明显毒性或病理性不良反应,即本研究体系本身不会干扰浸提液中潜在有害物质毒性反应的判断。
本研究结果表明,大鼠胃肠外双途径接触试验法可检测医疗器械极性及非极性可沥虑物的综合作用,从而更加全面的评价其重复接触全身毒性。此方法的建立可以进一步完善医疗器械重复接触全身毒性试验体系进而提升医疗器械生物学评价水平。

