裸鼠乳腺肿瘤生长过程中电特性的在体测量实验研究*
曹爽,张岩,马任,张顺起,殷涛,刘志朋
(中国医学科学院北京协和医学院生物医学工程研究所,天津300192)
1 引 言
美国癌症研究协会2017年癌症进展报告表明,癌症已成为世界范围内致死率第二位的公共卫生问题。每年大约170万人新被诊断为癌症,有约60万人因为癌症去世[1]。研究表明,癌症早期治愈率高达百分之八十[2],为了对癌症患者进行早期干预治疗,提高长期生存率,癌症的早期诊断和筛查成为医学上亟需解决的问题。生物组织的电导率和介电常数作为与频率相关的电特性,随生物组织生理、病理状态的变化而变化。已有临床医学研究表明,在癌变的早期阶段,电特性变化早于其结构变化[3]。因此,根据生物组织的电特性诊断早期癌症具有可行性[4]。
目前,生物组织电特性测量的研究多数来自于离体生物组织的直接测量和在体组织电特性成像[4-7]。其中,离体生物组织的电特性数据,由于组织含水量发生了变化,与在体的真实电特性存在一定的偏差[8]。因此,建立生物组织(肿瘤组织和正常组织)在体的电特性数据库对癌症早期检测和组织电特性成像尤其重要。对于生物组织电特性数据的在体测量来说,探头的尺寸是影响测量实施的一个重要因素。传统的组织电特性测量探头尺寸较大,较难实现在体测量。本研究采用自制的小尺寸探头对生物组织(乳腺癌组织和正常组织)的电导率及介电常数进行在体测量(频率范围:0.5~5 MHz),并且对肿瘤不同发展阶段的电特性数据进行分析。
2 材料与方法
2.1 自制探头参数
本研究采用自制的小尺寸探头,探头的尖端测量圆环直径为1 mm,与被测生物组织的接触体积仅为0.25πmm3。探头分为测量电极、保护电极和电极支架三个部分,结构见图1。其中,电极(测量电极、保护电极)和电极支架均采用生物相容性良好的材料。电极板厚度约为0.5 mm,宽度为10 mm,两测量电极板平行相对。其中,保护电极为内径0.51 mm,外径1 mm的圆环,与被保护电极处于同一个电极板平面,在测量中可以消除畸变电场。
2.2 裸鼠乳腺癌模型
40只BLAC/c裸鼠,雌性,4~6周龄,体重16±1 g,在SPF级环境中饲养一周。乳腺癌细胞MDA-MB-231在含有10%的胎牛血清和1%的抗生素中培养。癌细胞培养至浓度为1×106/mL时,注射入裸鼠右侧第二对乳腺脂肪垫内。将种植有乳腺癌的裸鼠饲养在SPF级的饲养盒中,每天观察记录裸鼠生命体征,分别于种植后7、14、21、28 d随机选取10只裸鼠进行电特性测量,分别按肿瘤生长时间依次标记为 A、B、C、D四组(A组:7d;B组:14d;C组:21d;D组:28d)。全部实验完成后,处死裸鼠。
2.3 电导率及介电常数的测量步骤
测量前,测量记录裸鼠体温、体重。裸鼠肿瘤尺寸、形状等信息由医用超声仪器进行检测,测量示意见图2a。根据医用超声结果,在肿瘤表面沿2只乳腺所在直线标记测量点,每隔2 mm标记一个点,测量点标记示意见图2b。在医用超声的指引下,采用小尺寸探头逐点测量裸鼠肿瘤的电特性,探头测量示意见图2c。自制探头另一端连接阻抗分析仪(安捷伦4294A),测量频率为0.5~5 MHz,测量前对阻抗分析仪及小尺寸探头进行校准,标准液选用甲醇、乙醇及饱和NaCl溶液[9]。为了区分癌症组织及正常组织,本研究对裸鼠肌肉组织、肝脏组织、脂肪组织进行了在体测量。同时,本研究对离体2 h的肿瘤组织和脂肪组织进行了测量。
2.4 组织病理学检测
对每组乳腺癌组织进行病理学检测,确定肿瘤内癌细胞发展情况。本研究选取裸鼠肿瘤的测量点所在纵向剖面进行病理学检测。
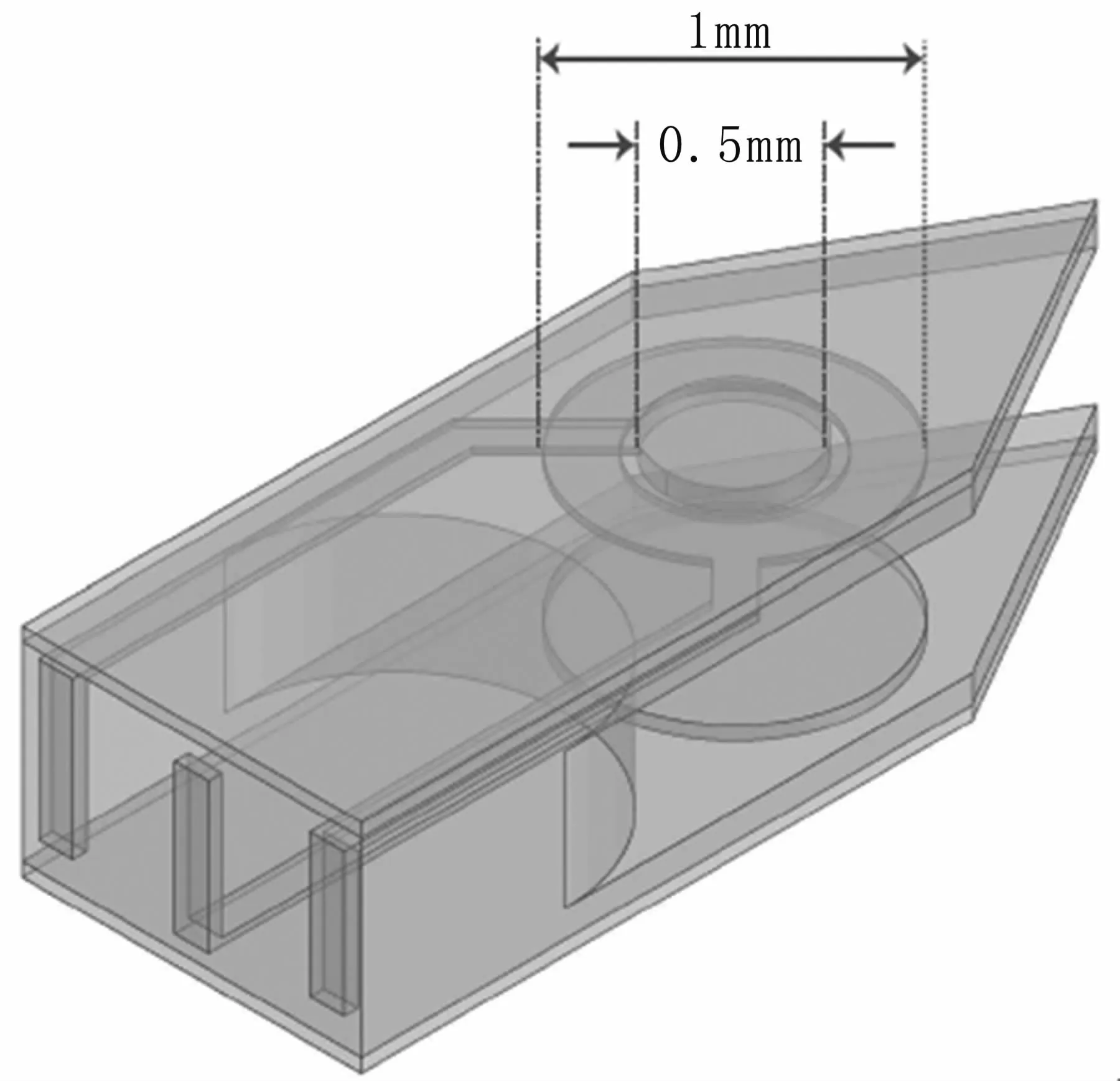
图1 微型探头的结构图示Fig 1 The structure of the microscope
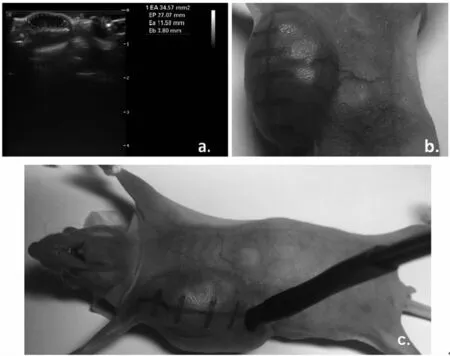
图2 电导率及介电常数测量示意图a.超声测量;b.肿瘤测量点标记;c.小尺寸探头测量肿瘤电特性Fig 2 Measurements of conductivity and permittivity a.Measurements of the ultrasound;b.Mark the cancer measure points c.EPs measurements of cancer using the microprobe
3 结果
3.1 裸鼠体重及体温信息
40只长有乳腺癌肿瘤的裸鼠在生长过程中的体重及体温变化见图3。在癌症发展过程的前三周(A、B、C组),裸鼠体重逐渐上升,在第四周(D组)体重下降;裸鼠体温逐渐下降。
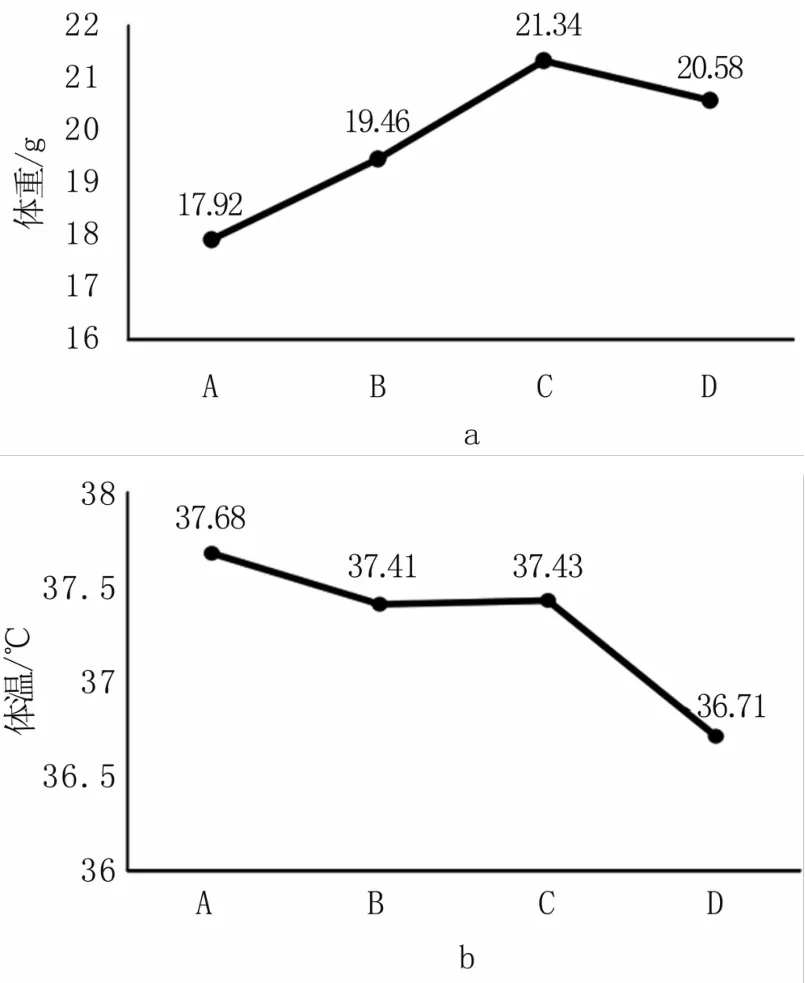
图3 裸鼠体重及体温变化(7~28 d)a.体重;b.体温Fig 3 Body weight and temperature changes of mice(7~28 days)a.Body weight;b.Temperature
3.2 超声检测结果
四组超声检测的肿瘤尺寸见表1,肿瘤尺寸变化见图4,尺寸数据由±s标记(x为平均值,s为标准差)。其中,肿瘤尺寸由其长轴长度×短轴长度(正面、侧面取平均值)标记。在癌症发展的过程中,肿瘤尺寸逐渐增大,前三周(A、B、C组)增速接近一致,从第四周开始,肿瘤尺寸增长速度变慢。
表1 肿瘤尺寸(±s)Table 1 Size of the tumors(±s)

表1 肿瘤尺寸(±s)Table 1 Size of the tumors(±s)
组别 长轴/mm 短轴/mm A 15.77±3.81 6.84±1.37 B 24.54±4.13 12.59±1.95 C 29.34±2.38 18.33±2.91 D 31.03±2.80 18.96±2.53

图4 癌症发展过程中肿瘤尺寸变化Fig 4 Tumor size changes during cancer progression
3.3 肿瘤在体-离体电特性结果
40只裸鼠乳腺肿瘤组织和脂肪组织在体、离体(2 h)电导率及介电常数的对比分别见图5a、图5b。肿瘤组织的在体与离体数据存在显著差异(P<0.01);脂肪组织的在体与离体数据无差异性(图中曲线近似重合)。

图5 肿瘤组织和脂肪组织在体-离体电特性a.电导率;b.介电常数Fig 5 EPs of tumors and fats(in-vivo vs.ex-vivo)a.Conductivity;b.Permittivity
3.4 肿瘤组织与正常组织电特性结果
40只裸鼠乳腺肿瘤组织、脂肪组织、肌肉组织在频率0.5、1、5 MHz处电导率及介电常数的对比分别见图6a、图6b。在所选取的三个特征频率点处,癌症组织的电导率、介电常数与肌肉组织的电导率、介电常数存在显著差异(P<0.01);癌症组织的电导率、介电常数与脂肪组织的电导率、介电常数存在显著差异(P<0.01);肌肉组织与脂肪组织差异无统计学意义(P>0.05)。

图6 肿瘤组织与脂肪组织、肌肉组织电特性对比(0.5、1、5 MHz)a.电导率;b.介电常数Fig 6 EPs comparison of tumor with adipose and muscle tissues(0.5、1、5 MHz)a.Conductivity;b.Permittivity
3.5 肿瘤发展过程中电特性变化结果
40只裸鼠种植乳腺癌肿瘤后放在相同环境(SPF级)中饲养,在肿瘤种植后的第7 d,随机选取10只,进行乳腺肿瘤的电特性测量,标记为A组;随后每隔7 d随机选取10只进行一次测量,分别标记为 B、C、D组(14d-B组;21d-C组;28d-D组)。A-D组裸鼠乳腺癌电特性对比见图7。在肿瘤发展的第1~4周,肿瘤的电导率及介电常数逐渐增大,增速逐渐变慢。肿瘤组织的电导率和介电常数在早期,即1~2周增长迅速,成倍数增长,第3~4周则增长缓慢。
3.6 病理结果
对40只裸鼠乳腺癌组织病理学分析。在乳腺癌发展的第1~4周(A-D组)中每周选取2只裸鼠做病理切片。每周乳腺癌组织的病理结果见图8。在裸鼠乳腺癌发展的第1周(W1),肿瘤界限清楚,肿瘤细胞不规则,切片区域可见中性粒细胞;第2周(W2),肿瘤部分界限清楚,肿瘤细胞不规则、梭形,弥漫生长,肿瘤内可见稀疏血管;第3周(W3),肿瘤界限不清楚,切片区域可见坏死区,肿瘤内可见较多不规则血管,切片区域可见肿瘤内出血;第4周(W4),肿瘤内出现大片状坏死,可见大量不规则血管,切片区域有大量内出血。
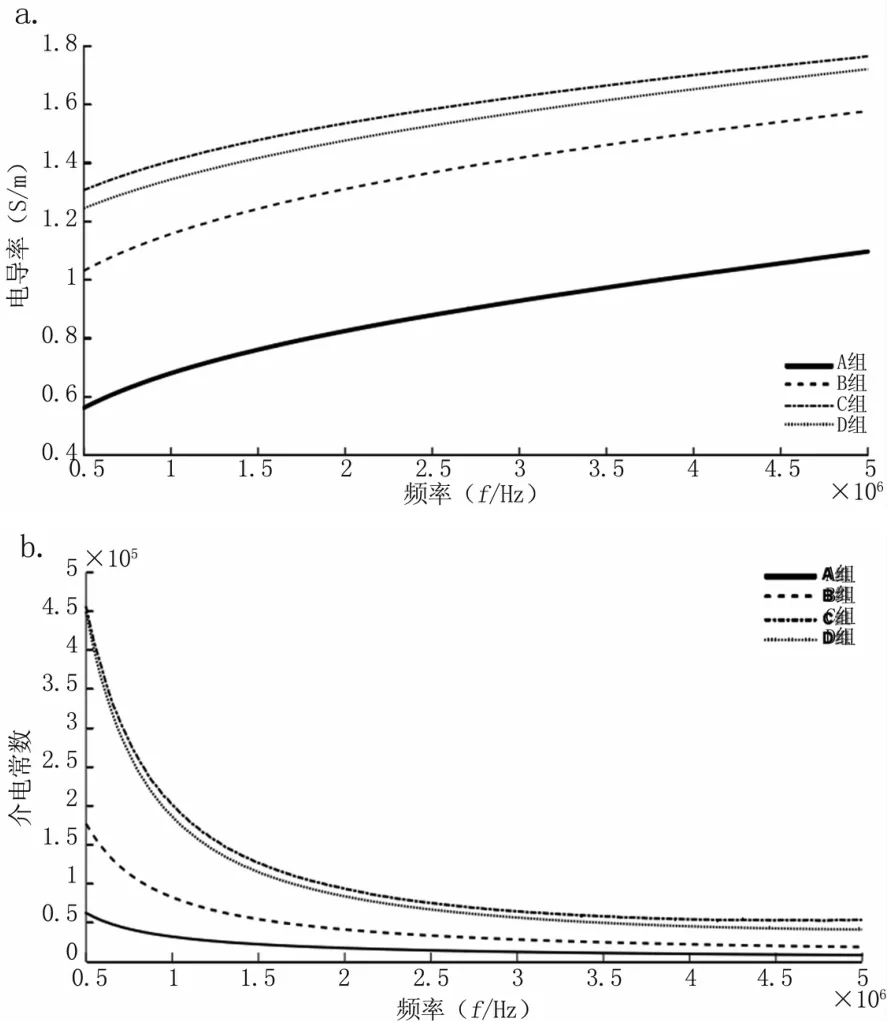
图7 肿瘤发展过程1~4周(A-D组)电特性变化a.电导率;b.介电常数Fig 7 Changes in the EPs of the tumor during the 1~4 weeks(A-D group)a.Conductivity;b.Permittivity

图8 肿瘤发展过程1~4周(A-D组)病理切片Fig 8 Pathological sections of the tumor during the 1~4 weeks(A-D group)
4 讨论
近年来,国内众多报道聚焦于生物组织真实电特性数据的研究[8,10],但仍未得到令人满意的结果,原因是生物组织真实电特性的测量结果受生物组织样本状态及测量条件等多因素的影响[11]。其中,离体测量对测量结果的影响较大,原因是组织离体后细胞的含水量、温度等与在体相比均发生了明显变化[12,13]。当生物组织从生物体切下后,其组织的稳定性与在体相比有所下降,并且这种下降随着组织离体时间的增加而增加[14]。因此,在体测量是获取生物组织真实电特性的最好方法。另外,组织与测量探头接触是否紧密对测量结果也有影响。目前已有的测量探头普遍适用于离体组织,并且有特定的样本制备要求,这就对生物组织的真实形态造成了破坏,从而对测量结果产生了影响。因此,本研究自制了小尺寸刺入式电特性测量探头,并且采用该探头在0.5~5 MHz频率范围内对正常脂肪组织、肌肉组织及乳腺肿瘤组织的电特性进行了在体测量,得到了该低频率范围内生物组织的在体电导率和介电常数。通过对测量数据的分析表明,用该探头测量所得的离体、在体生物组织电特性数据存在差异(P<0.01)。
生物组织的电特性具有分布不均匀性及频率-温度依赖性。其中,分布不均匀性的原因是生物体内细胞种类、密度、细胞膜性结构、内外电解液成分和浓度不同,进而导致组织含水量不同,最终导致生物体内各组织的电特性不同,同一组织不同部位的电特性也不相同[15]。由此,可推断在组织癌变的早期阶段,由于组织细胞含水量和细胞电解液含量发生改变,导致组织电特性与正常组织存在明显差异[3,16-17]。目前,根据组织电特性变化诊断早期癌症是一个研究热点[14,18]。本研究采用小尺寸探头对裸鼠乳腺癌组织测量的平均电导率比肌肉组织高出4.6倍(P<0.01),而比脂肪组织则高出9倍(P<0.01);乳腺癌组织的平均介电常数比肌肉组织高出23倍(P<0.01),而比脂肪组织高出46倍(P<0.01)。从该结果中可以看出,癌症组织的电特性均高于正常组织,这就为应用电特性诊断早期乳腺癌提供了数据支持。
为了进一步探究如何利用组织电特性数据鉴别早期癌症,研究了组织癌变过程中电特性的变化,对裸鼠乳腺癌不同生长时期的电特性进行分阶段、分组测量,得出随着乳腺癌的发展,乳腺组织的电导率和介电常数均逐渐增大,增长率则逐渐降低,说明在乳腺癌发展的早期阶段,乳腺癌组织的电导率和介电常数变化较快,该结果与病理结果相吻合,这也为应用电导率和介电常数诊断早期癌症提供了依据。本研究自制的探头尺寸较小(有效接触体积0.25π mm3),对组织破坏小,因此可以对组织实施微创检测。本研究的局限性是实验中所制备的裸鼠乳腺癌模型为种植模型,其对于癌症真实的发展过程还原度较诱导模型低,下一步的实验应对诱导模型的电特性加以研究,进而总结诱导乳腺癌模型和种植乳腺癌模型在电特性上的差别。
5 结论
本研究采用自制小尺寸探头在体测量裸鼠乳腺癌的发展过程中的电特性参数。测量了裸鼠乳腺癌不同发展阶段电特性的在体数据,并与离体电特性数据及正常组织的电特性数据进行了对比,为今后应用电特性诊断早期癌症奠定了基础。

