一种新型肝细胞癌分子靶向治疗临床药敏检测方法的建立
孙慧伟,柴燕涛,赵爽,王志杰,谢辉,洪志贤,冯帆,侯俊
解放军第三〇二医院 a.临床研究管理中心;b.介入科;c.肝胆外科一中心;北京 100039
一种新型肝细胞癌分子靶向治疗临床药敏检测方法的建立
孙慧伟a,柴燕涛a,赵爽a,王志杰a,谢辉b,洪志贤c,冯帆a,侯俊a
解放军第三〇二医院 a.临床研究管理中心;b.介入科;c.肝胆外科一中心;北京 100039
目的:建立分子靶向药物索拉菲尼(Sorafenib)临床治疗肝细胞癌(HCC)敏感性的新型预测方法。方法:将HCC手术切除癌症标本外围组织性状较好的部分处理成1 mm3,原位接种于免疫缺陷的BALB/c小鼠肝脏,4~6周后B超检测其生长状况;当肿瘤长至2~3 mm3时,用生理盐水配置Sorafenib溶液,以2 mg/kg用量对小鼠进行隔日口服灌胃给药,共给药10次。最后收集动物,观察肝脏原位肿瘤的大小,同时进行病理检测,考察Sorafenib的抗肿瘤治疗效果。结果:实验动物肝脏拍照和病理结果均显示,与溶剂对照组相比,Sorafenib治疗组小鼠肝脏原位HCC病灶明显缩小或消除。结论:建立了HCC分子靶向治疗临床药敏检测方法,为临床有效且个体化治疗HCC提供了新途径。
肝细胞癌;分子靶向治疗;免疫缺陷动物;原位肿瘤模型;药敏检测
我国逾8000万人携带乙型肝炎病毒(HBV)或罹患乙肝,随着疾病的进展,有相当比例的患者最终发展为肝细胞癌(hepatocellular carcinoma,HCC)[1]。由于大部分HCC患者初诊即为进展期,失去肝移植或外科手术等根治性治疗的机会,因此抗肿瘤药物治疗对于HCC临床诊疗具有重要意义[2]。但HCC具有对细胞毒性化疗药多药耐药(multi-drug resistance,MDR)的特性,目前进展期HCC患者惟一的一线治疗药物是口服多靶点小分子蛋白激酶抑制剂(分子靶向药物)索拉菲尼(Sorafenib)。尽管Sorafenib治疗组HCC患者总体生存期(over survival,OS)或疾病进展时间(time to progression,TTP)均较安慰剂组明显延长[3-8],但Sorafenib总体有效率仍较低,仅为26%~43%[9-10]。这表明进展期HCC患者对Sorafenib的敏感性存在明显的个体差异,且Sorafenib治疗过程中也有可能出现药物耐受。因此,建立Sorafenib治疗HCC的敏感性预测方法具有重要的临床意义。
1 材料与方法
1.1 材料
HCC手术切除标本由解放军第三〇二医院肝胆外科一中心一科提供,患者接受降阶梯治疗(射波刀)行为评分提高后接受外科手术切除治疗。病人手术切除标本后立即放入含20%胎牛血清(FBS)的DMEM培养基的50 mL无菌离心管中,尽快送入实验室进行后续实验。
BALB/c免疫缺陷小鼠由北京斯贝福公司提供;HepG2细胞为本实验室保存,以高糖DMEM培养基(Hyclone公司)添加10%FBS(Hyclone公司)培养;Sorafenib为Selleck公司产品;H&E染色试剂盒为北京中杉金桥公司产品;小鼠手术器械与缝合针线、吸入麻醉剂异氟烷等为本实验室保存。
1.2 利用HepG2细胞系建立HCC肝脏原位肿瘤
HepG2细胞培养至指数增长期,待其状态良好后接种于免疫缺陷动物皮下(腋下接种,每个接种点为1×106细胞),生长6~8周形成明显的皮下肿瘤,解剖动物获得肿瘤,剥取肿瘤组织实表面/边缘性状较好的部分(包括肿瘤组织色泽较好并伴有丰富血管的部分),切碎形成组织微块(直径0.5~1 mm),保存于含20%FBS的DMEM培养基中。BALB/c免疫缺陷小鼠用异氟烷进行持续吸入麻醉,将小鼠固定并行开腹手术,在其肝右叶用眼科镊制造孔洞,将前述肿瘤组织微块种植于肝右叶孔洞中,摁压止血后将肝叶小心推回小鼠腹腔,小心缝合肌肉与皮肤,避免伤及内脏。生长6~8周后B超探查病灶(直径2~3 mm),解剖动物,比较B超探查结果与实际大小的差异。
1.3 病理学检测
前述获得的免疫缺陷动物剥离肝右叶,切取肿瘤,用4%多聚甲醛固定24 h后进行病理石蜡包埋、切片等常规操作。HE染色切片石蜡切片依次处理脱蜡复水后,苏木精液染色约1 min,用1%盐酸乙醇分化30 s,最后用伊红液染色。切片脱水后用中性树胶封片。显微镜下观察肿瘤组织的特性并拍照。
1.4 免疫缺陷小鼠HCC原位肿瘤种植
选取HCC患者手术切除标本外围性状较好的部分分解为肿瘤组织微块(直径约0.5 mm),保存于含20%FBS的DMEM培养基中,准备裸鼠的肝脏原位移植。随后将BALB/c免疫缺陷小鼠用异氟烷进行持续吸入麻醉,将小鼠四肢固定并行开腹手术,在其肝右叶用眼科镊制造孔洞,将处理好的肿瘤组织微块种植于肝右叶孔洞中,摁压止血后将肝叶小心推回小鼠腹腔,小心缝合肌肉与皮肤,避免伤及内脏。
1.5 B超检测免疫缺陷小鼠HCC原位肿瘤模型
种植肿瘤组织微块的裸鼠生长4~6周后,B超探查其肝脏原位肿瘤的生长情况。当B超显示有1~2 mm直径低回声病灶时,可认为形成了明确的肝脏原位肿瘤。
1.6 小鼠分子靶向治疗
用生理盐水配置Sorafenib溶液,按2 mg/kg对小鼠隔日口服灌胃给药(生理盐水口服灌胃为对照),共给药10次(18 d)。末次口服灌胃给药后2~3 d收集动物,观察肝脏原位病灶的大小并进行HE染色,评价Sorafenib的抗肿瘤治疗效果。
2 结果
2.1 HepG2细胞免疫缺陷小鼠肝脏原位模型构建
用B超探查与病理学方法(HE染色)检测HepG2细胞免疫缺陷小鼠肝脏原位模型。接种了HepG2皮下肿瘤组织微块的免疫缺陷小鼠,6~8周后B超探查发现其肝脏有明确的病灶信号(图1);解剖动物后,其肝脏原位病灶清晰可见(图2A),HE染色进一步验证了肿瘤的特异性(图2B)。表明建立了HepG2细胞免疫缺陷小鼠肝脏原位模型。
2.2 HCC手术切除标本免疫缺陷小鼠肝脏原位模型构建
在前述基础上,对8只免疫缺陷小鼠进行源于同一患者的HCC肝脏原位种植手术,术后饲养4周,随机挑选其中1只进行B超检查,处死后进行病理分析确证,检测。结果如图3所示,B超探查显示小鼠肝脏有明显低回声的病灶(图3A中白色圆圈标识的阴影),直径1~1.5 mm,与将裸鼠处死后解剖的癌组织大小一致,HE染色结果也验证了肝脏原位肿瘤B超检测的特异性(图3B),表明可以用B超初步判断肿瘤组织在体内的生长。上述实验结果表明,我们成功地利用HCC患者手术切除标本种植免疫缺陷动物肝脏,建立了肝脏原位模型。
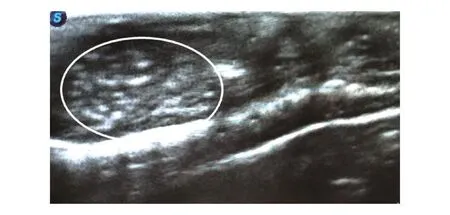
图1 HepG2免疫缺陷动物肝脏原位肿瘤模型的B超探查

图2 HepG2免疫缺陷动物肝脏原位肿瘤与病理学检测
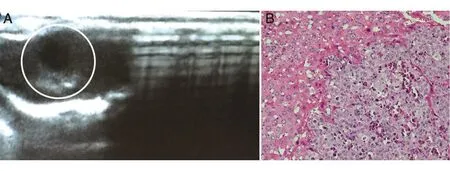
图3 HCC免疫缺陷动物肝脏原位肿瘤模型的B超检测结果
2.3 Sorafenib治疗敏感性检测
将B超扫描确认的6只具有肝脏原位肿瘤的小鼠分成2组(每组3只),分别进行Sorafenib和生理盐水口服灌胃给药。经过18 d治疗,最终获得5只动物的实验结果(对照组1只小鼠因过于衰弱死亡)。由于最终只剩2只对照组小鼠,因此显示2 v.s.2的结果照片。结果显示(图4),2只对照组小鼠肝脏均有明确的HCC病灶(图4A、B)。在剥取肝组织过程中也发现,2只小鼠肝叶上HCC病灶的恶性程度均较高,其生长造成了不同肝叶之间的黏连和侵袭,而Sorafenib治疗组动物肝脏表面病灶明确缩小或消失。由此表明Sorafenib治疗该例病人的HCC有效,Sorafenib具有明确的抗肿瘤活性,几乎能够消融肿瘤病灶(图4C、D)。进一步进行病理学确证,HE染色结果显示HCC患者切除标本在免疫缺陷动物肝脏右叶形成明确病灶,造成严重的肝损伤(图5A、B),接受Sorafenib治疗的动物肝脏无明显病灶(图5C、D),证实了Sorafenib的抗肿瘤活性。

图4 Sorafenib对HCC原位肿瘤的抑制活性检测

图5 Sorafenib对HCC原位肿瘤的抑制活性检测的病理检测确认
3 讨论
HCC具有对传统细胞毒性化疗药物的MDR特性,因此在临床诊疗中患者无法从常规化学药物治疗(口服或静脉滴注化疗药物)中获益[11]。尽管射波刀(Cyber knife)等物理性治疗策略能够在一定程度上局部消融HCC病灶[12],以及动脉化疗栓塞(transarterial chemoembolization,TACE)能够利用奥沙利铂(Oxaliplatin)、表柔比星(Epirubicin)或雷替曲塞(Raltitrexed)等化疗药物进行降阶梯治疗[13],减轻患者肿瘤负荷,提高患者行为评分,但这些治疗策略也存在造成HCC复发或转移的风险,因此研究和建立HCC新的诊疗策略具有重要意义。目前治疗HCC的惟一一线药物Sorafenib总体有效率为25%~40%,如何确定Sorafenib治疗有效的个体,减轻病人的治疗负担,从而达到药物的精准治疗,是医务人员常常思考的问题。因此,建立HCC分子靶向治疗敏感性检测方法具有特殊的临床意义。
本研究目的为建立HCC相关药物敏感性检测方法。在前期实验中,我们用HepG2肝癌细胞注射裸鼠皮下,长出细胞系癌块后用组织块肝脏原位移植手术将其从裸鼠皮下取出,切碎后重新植入裸鼠肝脏,建立了组织块肝脏原位移植技术。我们利用该技术,将患者手术切除的肝癌组织经切碎处理后直接植入裸鼠肝脏,从而构建了癌症组织肝脏原位移植的动物模型。随后,对裸鼠进行Sorafenib分子靶向药灌胃治疗,实验结果表明该患者标本中的HCC细胞对Sorafenib敏感,表明该患者可能对Sorafenib敏感,术后有可能通过服用Sorafenib预防复发与疾病进展。通过对其行为评分和诊疗过程进行追踪分析,发现该患者入院确诊时行为评分较差,因此先行射波刀和TACE降阶梯后方接受外科手术切除。现已有明确报道,射频消融、TACE或射波刀等局部消融策略结合Sorafenib治疗能够显著延长患者生存期,提高患者生存质量[9-10,14]。本研究结果与这些报道一致,这提示局部消融的物理性治疗策略有可能改变患者HCC细胞的生物学行为或特性,增加其对Sorafenib的敏感性。但另一方面,射波刀和TACE等也有可能改变HCC病灶的生物学行为,使其对Sorafenib敏感或易于复发,而HCC降阶梯治疗后的复发风险也值得警惕[11,15]。
本研究建立了一种新型Sorafenib治疗HCC的临床药敏检测方法,利用免疫缺陷小鼠建立HCC肝脏原位肿瘤模型,行口服灌胃给药治疗后能够明确观察到Sorafenib对HCC原位病灶的抗肿瘤活性。该方法具有自身独特的优势:①在建立细胞系过程中,HCC细胞的性状或生物学行为会发生变化,可能难以反映HCC临床治疗的实际情况。在研究中我们也发现,利用HCC较为常见的细胞系HepG2先建立皮下肿瘤模型,再将肿瘤组织微块接种于免疫缺陷小鼠肝脏获得的HCC模型与HCC手术切除标本建立的HCC原位肿瘤模型相比,其B超检测结果差异明显:用HepG2细胞系建立的HCC原位肿瘤模型为B超探查复杂回声的HCC病灶(图1),而利用手术切除标本建立的HCC原位肿瘤为典型的低回声病灶(图3A)。HCC临床影像探查已明确证实,HCC以B超探查低回声病灶最为常见,而混杂回升和高回升病灶较为少见,这也从一个方面证实了本研究方法的优势。②恶性程度较高的HCC标本获得的肿瘤病灶具有明确的侵袭特性,能够造成不同肝叶的黏连和侵袭。本研究利用HCC患者手术切除标本建立免疫缺陷小鼠肝脏原位肿瘤模型,这一模型不仅可用于预测HCC相关抗肿瘤药物的敏感性,也可能对判别HCC的恶性程度和预后预测提供参考。本研究不仅具有重要的科研价值,也有助于为HCC临床分子靶向治疗提供有价值的药物敏感性预测信息。
综上,我们获得了相关研究模型,在未来研究中将对方法进行优化:①HCC肿瘤自身特性较为疏松,临床HCC手术切除标本质地较软,这给原位肿瘤建模带来一定影响;②受限于各种原因,能够获得的肿瘤标本受限,难以获得很大量标本,同时标本中仅极少部分性状较好,因此难以接种更多实验动物;③与HCC临床诊疗不同(现已发展出系统的HCC患者对症支持治疗策略),研究过程中实验动物易因虚弱而死亡,因此开发和建立相关支持疗法或手段亦有重要意义。
[1]Wang F S,Fan J G,Zhang Z,et al.The global bur⁃den of liver disease:the major impact of China[J].Hepatology,2014,60(6):2099-2108.
[2]Jia H,Yang Q,Wang T,et al.Rhamnetin induces sensitization of hepatocellular carcinoma cells to a small molecular kinase inhibitor or chemotherapeutic agents[J].Biochim BiophysActa,2016,1860(7):1417-1430.
[3]Abou-Alfa G K,Puig O,Daniele B,et al.Random⁃ized phaseⅡplacebo controlled study of codrituzumab in previously treated patients with advanced hepatocel⁃lular carcinoma[J].J Hepatol,2016,65(2):289-295.
[4]Cheng A L,Thongprasert S,Lim H Y,et al.Random⁃ized,open-labelphase 2 study comparing frontline dovitinib versus sorafenib in patients with advanced hepatocellular carcinoma[J]. Hepatology, 2016,64(3):774-784.
[5]Bitzer M,Horger M,Giannini E G,et al.Resminostat plus sorafenib as second-line therapy of advanced hepatocel⁃lular carcinoma[J].J The SHELTER study Hepatol,2016,65(2):280-288.
[6]Koeberle D,Dufour J F,Demeter G,et al.Sorafenib with or without everolimus in patients with advanced hepatocellular carcinoma(HCC):a randomized multi⁃center,multinational phaseⅡ trial(SAKK 77/08 and SASL 29)[J].Ann Oncol,2016,27(5):856-861.
[7]Ciuleanu T,Bazin I,Lungulescu D,et al.A random⁃ized,double-blind,placebo-controlled phaseⅡ study to assessthe efficacy and safety of mapatumumab with sorafenib in patients with advanced hepatocellu⁃lar carcinoma[J].Ann Oncol,2016,27(4):680-687.
[8]Cheng A L,Kang Y K,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific re⁃gion with advanced hepatocellular carcinoma:a phase III randomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1):25-34.
[9]Wang C,Lu Y,Wang H,et al.Transarterial chemoem⁃bolization with/without cryotherapy is associated with improved clinical outcomes of sorafenib for the treat⁃ment of advanced hepatocellular carcinoma[J].Exp Ther Med,2012,4(2):188-196.
[10]Yang Y,Lu Y,Wang C,et al.Cryotherapy is associat⁃ed with improved clinical outcomes of sorafenib for the treatment of advanced hepatocellular carcinoma[J].Exp Ther Med,2012,3(2):171-180.
[11]Zeng Z,Ren J,O'Neil M,et al.Impact of stem cell marker expression on recurrence of TACE-treated he⁃patocellular carcinoma post liver transplantation[J].BMC Cancer,2012,12:584.
[12]Wang C,Wang H,Yang W,et al.Multicenter random⁃ized controlled trial of percutaneous cryoablation ver⁃sus radiofrequency ablation in hepatocellular carcinoma[J].Hepatology,2015,1(5):1579-1590.
[13]Shi Y,Zhai B.A recent advance in image-guided lo⁃coregional therapy for hepatocellular carcinoma[J].Gas⁃trointest Tumors,2016,3(2):90-102.
[14]颜芳,黄成成,路富民,等.癌痛的分子机理研究进展[J].生物技术通讯,2016,27(5):711-715.
[15]楼敏,白文林,常秀娟,等.上皮细胞黏附分子在肝动脉化疗栓塞中的表达改变及其功能[J].传染病信息,2016,29(4):209-212.
Establishment of a Novelin vivoSensitivity-Testing Model for HCC Molecular Targeted Therapy
SUN Hui-Wei1,CHAI Yan-Tao1,ZHAO Shuang1,WANG Zhi-Jie1,XIE Hui2,HONG Zhi-Xian3,FENG Fan1*,HOU Jun1*
a.Research Center for Clinical and Translational Medicine;b.Center of Interventional Radiology for Oncology;c.Department of Hepatobiliary Surgery;the 302nd Hospital of Chinese PLA,Beijing 100039,China
Objective:To establish a novelin vivosensitivity-testing model for hepatocellular carcinoma(HCC)molecular targeted therapy.Methods:The clinical specimens from HCC patients were seeded in the liver tissues of BALB/c nude mice.After 4~6 weeks,thein situcancer nests were confirmed by a B-mode ultrasonography test.Sorafenib were given via oral gavage administration(2 mg/kg per two days),and physiological saline was used as the solvent control.After 18 days treatment,the results were shown by anatomic or pathological analysis.Re⁃sults:Sorafenib significantly inhibited thein situgrowth of HCC in nude mice.Conclusion:This work successful⁃ly establishes a novelin vivosensitivity-testing model for HCC molecular targeted therapy.
hepatocellular carcinoma;molecular targeted therapy;immunodeficient animal;in situtumor growth;drug-sensitivity test
R730.5
A
1009-0002(2017)05-0671-05
10.3969/j.issn.1009-
*Co-corresponding authors,FENG Fan,E-mail:fengfanbio@126.com;HOU Jun,E-mail:houj302@163.com
2017-03-08
解放军第三〇二医院院长创新基金(YNKT2014039)
孙慧伟(1988- ),学士,实验师,(E-mail)mugoutaiji@163.com
冯帆,(E-mail)fengfanbio@126.com;侯俊,(E-mail)houj302@163.com

