非酒精性脂肪性肝病细胞模型中自噬与脂质代谢的相互调节
闫 蓉, 牛春燕, 于 璐, 田 宇
(1 西安医学院第一附属医院 a.消化内科; b.检验科, 西安 710077; 2 河南省人民医院 内分泌科, 郑州 450003)
非酒精性脂肪性肝病细胞模型中自噬与脂质代谢的相互调节
闫 蓉1a, 牛春燕1a, 于 璐2, 田 宇1b
(1 西安医学院第一附属医院 a.消化内科; b.检验科, 西安 710077; 2 河南省人民医院 内分泌科, 郑州 450003)
目的探讨非酒精性脂肪性肝病(NAFLD)中自噬与脂质代谢的相互作用。方法体外人肝细胞培养(脂肪变性)制备NAFLD细胞模型,雷帕霉素诱导细胞自噬,3-甲基腺嘌呤抑制细胞自噬,MTT比色法测定细胞活力,ELISA法检测各组细胞TG、ALT、AST、LDH、GGT、Alb水平,IF法检测 LC3-Ⅱ的定位与分布,Western Blot 检测LC3-Ⅱ/LC3-Ⅰ比值。计量资料多组间比较采用方差分析,进一步两两比较采用SNK-q检验。结果诱导自噬组的吸光度值和细胞活率与脂肪变组比较,明显下降(HL-7702细胞q值分别为4.160、4.110,SK-HEP-1细胞q值分别为4.407、4.032;P值均<0.05)。脂肪变组TG、ALT、AST、LDH、GGT、Alb水平与对照组相比,明显升高(HL-7702细胞q值分别为5.316、3.730、4.013、6.967、6.192、5.531,SK-HEP-1细胞q值分别为4.963、3.603、4.774、7.479、6.319、5.193;P值均<0.05)。诱导自噬组TG、ALT、AST、LDH、GGT、Alb水平与脂肪变组相比,明显降低(HL-7702细胞q值分别为4.978、3.695、3.960、5.130、4.695、3.192,SK-HEP-1细胞q值分别为3.846、5.575、4.184、5.019、4.203、3.049;P值均<0.05)。LC3-Ⅱ在各组肝细胞中的标记值,诱导自噬组最高(HL-7702细胞为90.1%,SK-HEP-1细胞为80.0%),其次是脂肪变组(HL-7702细胞为47.2%,SK-HEP-1细胞为48.4%)及抑制自噬组(HL-7702细胞为30.2%,SK-HEP-1细胞为45.5%)。诱导自噬组LC3-Ⅱ/LC3-Ⅰ比值与脂肪变组相比,明显升高(HL-7702细胞q值为6.786,SK-HEP-1细胞q值为5.926;P值均<0.05)。结论自噬的上调有利于促进肝脏脂肪的清除,而下调则促进脂质的聚积。
脂肪肝; 自噬; 脂类代谢
近年来,非酒精性脂肪性肝病(NAFLD)患病率逐年增加,已成为全球重要的公共健康问题[1]。NAFLD的发病机制至今尚未完全明确,较为普遍接受的“二次打击学说”认为,初次打击为脂质聚积导致肝脏脂肪变及胰岛素抵抗,通过外周脂解增加(脂质过多)和高胰岛素血症引起肝细胞脂肪堆积、脂肪变,二次打击主要指氧化应激和脂质过氧化及细胞因子、线粒体功能异常等,导致肝细胞损伤、炎症、纤维化[2]。最近的研究[3-4]表明,自噬除了降解肝细胞内过多或损伤的细胞器和蛋白质外,还介导肝细胞内脂肪的代谢和分解,介导脂滴内贮存脂质的降解,提示自噬在NAFLD的发生、发展中具有重要病理生理意义。本实验通过对体外人肝细胞培养(脂肪变性)制备NAFLD模型,观察自噬的生物学特性,探讨NAFLD中自噬与脂质代谢的相互作用和可能的机制,为将来NAFLD治疗领域的分子靶向治疗相关研究奠定基础。
1 材料与方法
1.1 材料 HL-7702细胞和SK-HEP-1细胞株(西安东澳生物科技有限公司),10%脂肪乳注射液(四川科伦药业股份有限公司),雷帕霉素(Selleck,S1039),3-甲基腺嘌呤(3-MA)(Selleck,S2767),LC3B (D11) XP®Rabbit mAb(CST,3868S),Anti-PKC epsilon 抗体(Abcam,ab124806),油红O染色液(南京建成科技有限公司,D027),科研人甘油三酯(TG)ELISA 试剂盒(上海酶联生物科技有限公司,ml026468),科研人ALT检测试剂盒(上海酶联生物科技有限公司,ml027133),科研人AST检测试剂盒(上海酶联生物科技有限公司,ml024056),科研人乳酸脱氢酶(LDH)检测试剂盒(上海酶联生物科技有限公司,ml024518),科研人GGT检测试剂盒(上海酶联生物科技有限公司,ml027457),科研人Alb检测试剂盒(上海酶联生物科技有限公司,ml025061)。倒置荧光显微镜(OLYMPUS),冷冻离心机(Eppendorf),电热恒温培养箱(天津泰斯特仪器有限公司),Mini-PROTEAN®Casting stand(Bio-Rad),Power PacTMHC 高电流电泳仪(Bio-Rad),Mini-PROTEAN®电泳槽(Bio-Rad),Mini Trans-Blot®转印槽(Bio-Rad),iMarkTM酶标仪(Bio-Rad)。
1.2 方法
1.2.1 细胞培养及模型建立 将从液氮中取出的HL-7702细胞和SK-HEP-1细胞在37 ℃水浴锅中快速融化后接种于10 cm皿中,培养基分别是RPMI1640+10%FBS和MEM+10%FBS。将 10 cm皿中细胞废液弃除,用PBS清洗1次,滴加8滴胰酶,消化30 s左右,加入完全培养基终止消化,用1 ml的枪吹打细胞,收集细胞液于15 ml离心管中,1000 r/min离心5 min;离心后弃上清,加入新的完全培养基,轻柔吹打细胞,制备单细胞悬液;按1∶2的接种比例将细胞悬液接种于10 cm皿中,在CO2孵箱中培养。HL-7702、SK-HEP-1细胞分别用2%脂肪乳培养 48 h后,用油红O染色肝细胞出现红色脂滴,即为建模成功。另将普通培养的2种细胞株设为对照。
1.2.2 肝细胞自噬的调节 人肝HL-7702、SK-HEP-1脂肪变细胞传代培养至对数生长期后,诱导自噬组加入雷帕霉素(100 nmol/L)培养48 h;抑制自噬组加入3-MA(4.5 mg/L)培养24 h。
1.2.3 细胞活力与功能评价
1.2.3.1 油红O染色 分别取对数生长期HL-7702、SK-HEP-1细胞,以5×104/孔的密度接种于放玻片的24孔板上,细胞培养至密度达到 60%~70%时,模型组加入 2%脂肪乳(10%脂肪乳注射液稀释5倍),对照组加入不含脂肪乳的培养基。放入孵箱培养48 h后,取出培养板,PBS洗3次,用4%多聚甲醛固定30 min,PBS洗3次,油红O染液室温染色30 min,37 ℃左右蒸馏水洗30 s至背景透明,再用复染剂室温染色3 min,蒸馏水洗30~60 s,用水性封片剂封片,显微镜下观察细胞内的脂滴。
1.2.3.2 MTT比色法测定细胞活力 将 T25培养瓶中的废液全部吸弃,消化后重悬细胞;吸取10 μl细胞悬液,用血球计数板按照3×104/ml计数,接种到96孔板中,每孔100 μl,在 CO2孵箱中过夜培养。接种细胞后第2天,更换培养基,模型组加入2%脂肪乳(10%脂肪乳注射液稀释5倍),对照组加入不含脂肪乳的培养基,置于37 ℃、5% CO2培养箱中48 h。每孔加20 μl MTT溶液(5 mg/ml),继续培养4 h。去上清液,每孔加入150 μl二甲亚砜,置摇床低速振荡10 min,全自动酶联免疫检测仪490 nm测吸光度值。
1.2.3.3 ELISA检测 分别取对数生长期HL-7702、SK-HEP-1细胞,以5×105/孔的密度接种于6孔板上,细胞培养至密度达到60%~70%时,模型组加入2%脂肪乳(10%脂肪乳注射液稀释5倍);对照组加入不含脂肪乳的培养基;放入孵箱培养48 h后,收集各组细胞,用冰的PBS清洗细胞3次,每孔加1 ml PBS后,收集细胞悬液至EP管中,1000 r/min,离心10 min,弃上清液,留细胞沉淀,用PBS调整至1×106个/ml。反复冻融3次裂解细胞,4 ℃、3000 r/min,离心20 min,收集上清后,于-80 ℃保存备用。按ELISA试剂盒操作说明检测其中TG、ALT、AST、LDH、GGT、Alb水平。
1.2.4 肝细胞自噬相关蛋白在人肝细胞及脂肪变人肝细胞中活性状态的检测
1.2.4.1 IF法检测自噬相关蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)Ⅱ 培养好的细胞经4%多聚甲醛室温固定30 min。PBS洗3次,每次5 min。0.3% TritonX-100室温通透15 min。PBS洗3次,每次5 min。一抗孵育:用10%山羊血清将一抗LC3-Ⅱ(1∶100)稀释,4 ℃孵育过夜。第2天吸去一抗,PBS洗3次,每次5 min。滴加二抗工作液[用 2%山羊血清荧光二抗Alexa Fluor 594 donkey-rabbit (1∶400)](稀释到工作时的浓度),37 ℃避光孵育30 min。吸去二抗,用PBS洗 3次,每次5 min。滴加VECTASHIELD®+DAPI封片并染细胞核。立即用倒置荧光显微镜拍照,蓝色代表细胞核,红色荧光代表LC3-Ⅱ。观察LC3-Ⅱ的定位和分布。采用双盲法在光镜下随机选择20个肝细胞/片,记数肝细胞的阳性细胞及细胞总数,LC3-Ⅱ在肝细胞中的标记值为阳性细胞数/细胞总数×100%。
1.2.4.2 Western Blot检测自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ 收集各组细胞,用冰的PBS清洗细胞3次,每个孔加1 ml PBS后,收集细胞悬液至EP管中,1000 r/min,离心10 min,弃上清液,留细胞沉淀,加入预冷的细胞裂解液裂解细胞,用移液枪反复吹打数次。将裂解好的细胞转移入预冷的离心管中,冰浴10 min,以使细胞充分裂解。在4 ℃条件下,12 000 r/min离心10 min。将上清转移至预冷的离心管中。用BCA蛋白定量试剂盒对提取的蛋白进行检测。检测后将蛋白样品分装成小份,-80 ℃贮存备用。取各组蛋白样品30 μg,加入相当于蛋白样品1/4体积的5×蛋白上样缓冲液,沸水浴中煮5 min,然后进行SDS-PAGE分离蛋白。采用湿转法,将蛋白质转移至偏氟乙烯(polyvinylidence difluoride,PVDF)膜上。转膜结束后,将PVDF膜放在丽春红染色液中染色2~5 min,观察蛋白转移效果。标记出PVDF膜的右上角,将PVDF膜转移至含有5% BSA的TBST封闭液中,室温封闭1.5 h。按1∶800稀释抗体LC3B,按1∶500稀释抗体β-Actin于封闭液中,将PVDF膜放入皿中,加入一抗的稀释液,4 ℃过夜。次日,用TBST洗膜10 min×4次。按1∶10 000稀释辣根过氧化物酶标记的羊抗兔IgG(LC3B)于封闭液中,按1∶10 000稀释辣根过氧化物酶标记的羊抗鼠IgG(β-Actin)于封闭液中,将PVDF膜放入含稀释二抗的皿中,脱色摇床孵育1 h。孵育结束后,用TBST洗膜10 min×3次。暗室中,用滤纸轻轻将膜上的液体吸干,在增强化学发光反应混合液中反应2~3 min,压片显影。
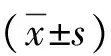
2 结果
2.1 油红O染色结果 对照组HL-7702细胞和SK-HEP-1细胞生长为不规则或卵圆形,胞质无明显红染或淡染,脂肪变组细胞胞质广泛染色,为红色脂滴,大而多(图1)。
2.2 MTT比色结果 对照组、脂肪变组HL-7702细胞及SK-HEP-1细胞生长良好,吸光度值和细胞活率组间比较,差异均无统计学意义(P值均>0.05)。诱导自噬组HL-7702及SK-HEP-1细胞的吸光度值和细胞活率与脂肪变组比较,明显下降(P值均<0.05)。抑制自噬组HL-7702及SK-HEP-1细胞的吸光度值和细胞活率与脂肪变组比较,差异均无统计学意义(P值均>0.05)(表1,2)。
对照组


脂肪变组


图1对照组和脂肪变组HL-7702细胞和SK-HEP-1细胞内脂滴油红O染色结果(×400) a、b:HL-7702;c、d:SK-HEP-1
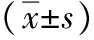
表1 各组HL-7702细胞吸光度值和细胞活率
注:与脂肪变组比较,1)q值分别为4.160、4.110,P<0.05
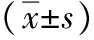
表2 各组SK-HEP-1细胞吸光度值和细胞活率
注:与脂肪变组比较,1)q值分别为4.070、4.032,P<0.05
2.3 ELISA检测结果 脂肪变组HL-7702及SK-HEP-1细胞TG、ALT、AST、LDH、GGT、Alb水平与对照组相比,明显升高(P值均<0.05)。诱导自噬组HL-7702及SK-HEP-1细胞TG、ALT、AST、LDH、GGT、Alb水平与脂肪变组相比,明显降低(P值均<0.05)。抑制自噬组HL-7702及SK-HEP-1细胞TG、ALT、AST、LDH、GGT、Alb水平与脂肪变组比较,差异均无统计学意义(P值均>0.05)(表3,4)。
2.4 IF法检测LC3-Ⅱ LC3-Ⅱ在各组细胞的定位及分布见图2。LC3-Ⅱ在各组肝细胞中的标记值,诱导自噬组最高,其次是脂肪变组及抑制自噬组。脂肪变组HL-7702及SK-HEP-1细胞LC3-Ⅱ标记值与对照组相比,明显升高(P值均<0.05)。诱导自噬组HL-7702及SK-HEP-1细胞LC3-Ⅱ标记值与脂肪变组相比,明显升高(P值均<0.05)。抑制
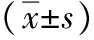
表3 各组HL-7702细胞ELISA检测结果
注:与对照组比较,1)q值分别为5.316、3.730、4.013、6.967、6.192、5.531,P<0.05;与脂肪变组比较,2)q值分别为4.978、3.695、3.960、5.130、4.695、3.192,P<0.05
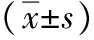
表4 各组SK-HEP-1细胞ELISA检测结果
注:与对照组比较,1)q值分别为4.963、3.603、4.774、7.479、6.319、5.193,P<0.05;与脂肪变组比较,2)q值分别为3.846、5.575、4.184、5.019、4.203、3.049,P<0.05

图2 LC3-Ⅱ在各组细胞的定位及分布
自噬组HL-7702及SK-HEP-1细胞LC3-Ⅱ标记值与脂肪变组相比,差异无统计学意义(P值均>0.05)(表5)。

表5 LC3-Ⅱ在各组肝细胞中的标记值
注:与对照组比较,1)q值分别为7.318、7.424,P<0.05;与脂肪变组比较,2)q值分别为8.486、8.609,P<0.05
2.5 Western Blot检测LC3-Ⅱ/LC3-Ⅰ比值 LC3-Ⅱ/LC3-Ⅰ比值中诱导自噬组最高,其次是脂肪变组、对照组及抑制自噬组。脂肪变组HL-7702及SK-HEP-1细胞LC3-Ⅱ/LC3-Ⅰ比值与对照组相比,差异无统计学意义(P值均>0.05)。诱导自噬组HL-7702细胞及SK-HEP-1细胞LC3-Ⅱ/LC3-Ⅰ比值与脂肪变组相比,明显升高(P值均<0.05)。抑制自噬组HL-7702细胞及SK-HEP-1细胞LC3-Ⅱ/LC3-Ⅰ比值与脂肪变组相比,无显著性差异(P值均>0.05)(图3,表6)。

图3 Western Blot分析中各组LC3蛋白表达水平

组别HL-7702细胞SK-HEP-1细胞对照组0.023±00050.443±0007脂肪变组0.030±00080.587±0006诱导自噬组0.772±00201)1.146±00301)抑制自噬组0.014±00020.317±0010F值3.4624.581P值0.0430.034
注:与脂肪变组比较,1)q值分别为6.786、5.926,P<0.05
3 讨论
自噬是指一些需降解的蛋白质和细胞器等胞浆成分被包裹,并最终运送至溶酶体降解的过程,自噬性降解产生的氨基酸和其他一些小分子物质可被再利用或产生能量。现已明确,自噬的主要功能之一实际上是在细胞受到应激性的死亡威胁时保持细胞的存活,这是真核细胞维持稳态、实现更新的一种重要的进化保守机制[4]。参与自噬的信号调节机制非常复杂,主要有:(1)营养信号调节,最主要的2个通路为,哺乳动物雷帕霉素靶蛋白复合体1通路,Ras/cAMP依赖的蛋白激酶途径通路;(2)胰岛素/生长因子通路;(3)能量响应;(4)应激响应(包括内质网应激、缺氧、氧应激、病原体感染)。参与自噬的基因主要有Atg家族的31种基因、Beclin Ⅰ、LC3 Ⅰ/Ⅱ等。在自噬整个过程中,关键分子是位于启动阶段的Ⅲ型磷脂酰肌醇-3-激酶和TOR/mTOR激酶。Ⅲ型磷脂酰肌醇-3-激酶通过磷酸化脂酰肌醇来募集胞浆中含FYVE或PX结构域的蛋白质,用于自噬体膜的形成。3-MA通过抑制该激酶,可有效抑制自噬活性[5]。mTOR通过调控核糖体蛋白质S6的活性而发挥抑制细胞自噬活性的作用[6],mTOR的特异性抑制剂雷帕霉素可抑制mTOR通路,活化细胞自噬。本实验中,各组细胞经MTT比色法测定细胞活力,3-MA抑制自噬组的吸光度值和细胞活率与脂肪变组比较无显著性差异(P>0.05)。雷帕霉素诱导自噬组的吸光度值和细胞活率与脂肪变组比较明显下降(P<0.05),考虑与自噬导致细胞活力下降有关。
除维持生理状态下机体的稳态功能外,越来越多的研究[7]表明自噬与肿瘤发生、神经退化性疾病、心肌病、克罗恩病、脂肪肝、2型糖尿病以及衰老有关,并且具有抵御细胞内病原、抗原递呈的功能。本实验中,诱导自噬组中反映脂质沉积及肝细胞损伤的指标,TG、ALT、AST、LDH、GGT、Alb与脂肪变组相比,明显降低(P<0.05)。抑制自噬组TG、ALT、AST、LDH、GGT、Alb与脂肪变组相比,无显著性差异(P>0.05)。考虑与自噬参与脂质代谢有关,自噬的上调有利于促进肝脏脂肪的清除,而下调则促进脂质的聚积[9-10]。另外,自噬还可减轻非酒精性脂肪性肝炎状态下的内质网应激和肝细胞损伤、改善胰岛素抵抗[11-12]。
自噬过程由一系列自噬相关蛋白(Atg蛋白)介导完成,这些蛋白质在自噬体形成的不同阶段发挥作用。LC3是自噬体膜上的标记蛋白。细胞内存在2种形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成LC3-Ⅰ,LC3-Ⅰ散在分布于细胞浆内。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺偶联形成 LC3-Ⅱ并定位于自噬体内膜和外膜。与其他一些定位于自噬性结构膜上的Atg蛋白不同(仅在自噬过程的某一阶段发挥作用),LC3-Ⅱ始终稳定地保留在自噬体膜上直到与溶酶体融合,因此被用来作为自噬体的标记,且LC3-Ⅱ的水平在某种程度上反映了自噬体的数量[13]。本实验中采用IF法检测LC3-Ⅱ。LC3-Ⅱ在各组肝细胞中的标记值诱导自噬组最高,其次是脂肪变组及抑制自噬组。诱导自噬组LC3-Ⅱ标记值与脂肪变组相比,明显升高(P<0.05),提示雷帕霉素可以显著激活细胞自噬,增加自噬体数量。脂肪变组LC3-Ⅱ标记值与对照组相比,明显升高(P<0.05),提示脂肪变组细胞自噬体数量增加,考虑与脂肪变导致细胞应激有关。
自噬发生后,通过Western Blot可以检测到2个条带的蛋白质,尽管 LC3-Ⅱ与磷脂酰乙醇胺结合后实际分子质量大于LC3-Ⅰ,由于其疏水性较强,在聚丙烯酰胺凝胶中的泳动速度要快于 LC3-Ⅰ。由于在自噬时细胞内LC3蛋白总的表达水平其实并无上调,仅仅是一部分LC3-Ⅰ转变成了LC3-Ⅱ,自噬时应表现为LC3-Ⅰ的减少和LC3-Ⅱ的增加,通过LC3-Ⅱ/LC3-Ⅰ或者LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)即可反映自噬水平[14]。本实验中,LC3-Ⅱ/LC3-Ⅰ比值中诱导自噬组最高,其次是脂肪变组及抑制自噬组。诱导自噬组HL-7702细胞及SK-HEP-1细胞LC3-Ⅱ/LC3-Ⅰ比值与脂肪变组相比,明显升高(P<0.05)。提示与IF法检测LC3-Ⅱ相比,采用Western Blot法检测LC3-Ⅱ/LC3-Ⅰ比值更能反映细胞真实的自噬水平。
自噬在NAFLD发生发展中的作用近年来受到越来越多的关注,但NAFLD背景下自噬与脂质代谢之间的作用机制尚未明确。本课题研究的结果初步显示,自噬的上调有利于促进肝脏脂肪的清除,而下调则促进脂质的聚积;自噬还可减轻非酒精性脂肪性肝炎状态下的肝细胞损伤。因此,肝细胞自噬活性的调控有望成为治疗NAFLD的新靶点。
[1] CHANG BX, ZOU ZS, LI BS, et al. 2015 The Japanese Society of Gastroenterology of Evidence-based clinical practice guidelines for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis
[J]. J Clin Hepatol, 2015, 31(7): 1027-1030. (in Chinese)
常彬霞, 邹正升, 李宝森, 等. 2015年日本胃肠病学会非酒精性脂肪肝病/非酒精性脂肪肝炎的循证医学临床治疗指南[J]. 临床肝胆病杂志, 2015, 31(7): 1027-1030.
[2] MESHKANI R, ADELI K. Hepatic insulin resistance, metabolic syndrome and cardiovascular disease[J]. Clin Biochem, 2009, 42(6): 1331-1346.
[3] GREEN DR, LEVINE B. To be or not to be? How selective autophagy and cell death govern death cell fate[J]. Cell, 2014, 157(1): 65-75.
[4] MARTINEZ-LOPEZ N, SINGH R. Autophagy and lipid droplets in the liver[J]. Annu Rev Nutr, 2015, 35: 215-237.
[5] ESKELINEN EL, SAFTIG P. Autophagy: a lysosomal degradation pathway with a central role in health and disease[J]. Biochim Biophys Acta, 2009, 1793(4): 664-673.
[6] HIROSAKO K, IMASATO H, HIROTA Y, et al. 3-Methyladenine specifically inhibits retrograde transport of cation-independent mannose 6-phosphate/insulin-like growth factor II receptor from the early endosome to the TGN[J]. Biochem Biophys Res Commun, 2004, 316(3): 845-852.
[7] ROSENFELDT MT, RYAN KM.The multiple roles of autophagy in cancer[J]. Carcinoqenesis, 2011, 32(7): 955-963.
[8] MIJALJICA D, PRESCOTT M, DEVENISH RJ. Autophagy in disease[J]. Methods Mol Biol, 2010, 648: 79-92.
[9] CZAJA MJ. Autophagy in health and disease. 2. Regulation of lipid metabolism and storage by autophagy: pathophysiological implications[J]. Am J Physiol Cell Physiol, 2010, 298(5): c973-c978.
[10] MARTINEZ-VICENTE M, TALLOCZY Z, WONG E, et al. Cargo recognition failure is responsible for inefficient autophagy in Huntington′s disease[J]. Nat Neurosci, 2010, 13(5): 567-576.
[11] YOSHIZAKI T, KUSUNOKI C, KONDO M, et al. Autophagy regulates inflammation in adipocytes[J]. Biochem Biophys Res Commun, 2012, 417(1): 352-357.
[12] CHRISTIAN P, SACCO J, ADELI K. Autophagy: emerging roles in lipid homeostasis and metabolic control[J]. Biochim Biophys Acta, 2013, 1831(4): 819-824.
[13] KIMURA S, FUJITA N, NODA T, et al. Monitoring autophagy inmammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452: 1-12.
[14] KADOWAKI M, KARIM MR. Cytosolic LC3 ratio as a quantitative index of macroautophagy[J]. Methods Enzymol, 2009, 452: 199-213.
Interactionbetweenautophagyandlipidmetabolismincellmodelsofnonalcoholicfattyliverdisease
YANRong,NIUChunyan,YULu,etal.
(DepartmentofGastroenterology,TheFirstAffiliatedHospitalofXi′anMedicalCollege,Xi′an710077,China)
ObjectiveTo investigate the interaction between autophagy and lipid metabolism in nonalcoholic fatty liver disease (NAFLD).MethodsHuman hepatocytes (steatosis) were cultured in vitro to establish a cell model of NAFLD. Rapamycin was used to induce autophagy and 3-methyladenine was used to inhibit autophagy. MTT colorimetry was used to measure cell viability. ELISA was used to measure the levels of triglyceride (TG), alanine aminotransferase (ALT), aspartate aminotransferase (AST), lactate dehydrogenase (LDH), gamma-glutamyl transpeptidase (GGT), and albumin (Alb). IF method was used to determine the location and distribution of LC3-II. Western blot was used to measure LC3-II/LC3-I ratio. An analysis of variance was used for comparison of continuous data between groups, and the SNK-qtest was used for further comparison between two groups.ResultsCompared with the steatosis group, the induced autophagy group had significant reductions in absorbance and cell viability (HL-7702 cells:q=4.160 and 4.110,P<0.05; SK-HEP-1 cells:q=4.407 and 4.032,P<0.05). Compared with the control group, the steatosis group had significant increases in the levels of TG, ALT, AST, LDH, GGT, and Alb (HL-7702 cells:q=5.316, 3.730, 4.013, 6.967, 6.192, and 5.531,P<0.05; SK-HEP-1 cells:q=4.963, 3.603, 4.774, 7.479, 6.319, and 5.193,P<0.05). Compared with the steatosis group, the induced autophagy group had significant reductions in the levels of TG, ALT, AST, LDH, GGT, and Alb (HL-7702 cells:q=4.978, 3.695, 3.960, 5.130, 4.695, and 3.192,P<0.05; SK-HEP-1 cells:q=3.846, 5.575, 4.184, 5.019, 4.203, 3.049,P<0.05). The induced autophagy group had the highest percentage of LC3-II-positive HL-7702 cells (90.1%) and LC3-II-positive SK-HEP-1 cells (80.0%), followed by the steatosis group (47.2% LC3-II-positive HL-7702 cells and 48.4% LC3-II-positive SK-HEP-1 cells) and the autophagy inhibition group (30.2% LC3-II-positive HL-7702 cells and 45.5% LC3-II-positive SK-HEP-1 cells). The induced autophagy group had a significant increase in LC3-II/IC3-I ratio compared with the steatosis group (HL-7702 cells:q=6.786,P<0.05; SK-HEP-1 cells:q=5.926,P<0.05).ConclusionUpregulation of autophagy can promote the elimination of liver fat, while downregulation of autophagy can promote lipid accumulation.
fatty liver; autophagy; lipid metabolism
R575.5
A
1001-5256(2017)10-1981-06
10.3969/j.issn.1001-5256.2017.10.027
2017-06-30;
2017-07-27。
陕西省教育厅科研基金(2013JK0788)
闫蓉(1983-),女,主治医师,主要从事脂肪肝及胃肠动力性疾病研究。
牛春燕,电子信箱:nchy69@163.com。
引证本文:YAN R, NIU CY, YU L, et al. Interaction between autophagy and lipid metabolism in cell models of nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2017, 33(10): 1981-1986. (in Chinese)
闫蓉, 牛春燕, 于璐, 等. 非酒精性脂肪性肝病细胞模型中自噬与脂质代谢的相互调节[J]. 临床肝胆病杂志, 2017, 33(10): 1981-1986.
(本文编辑:朱 晶)

